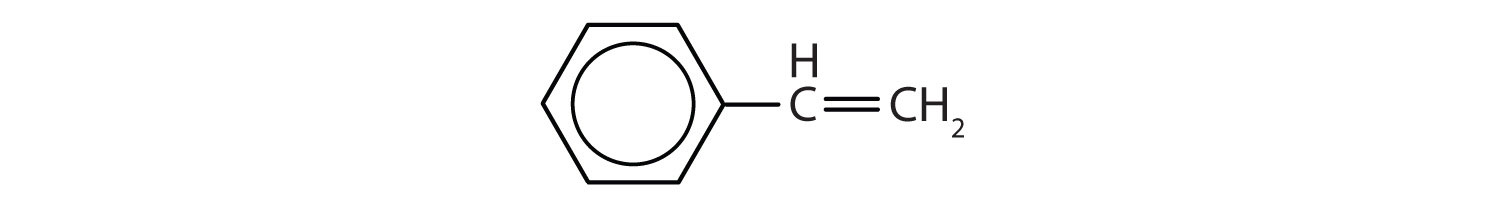
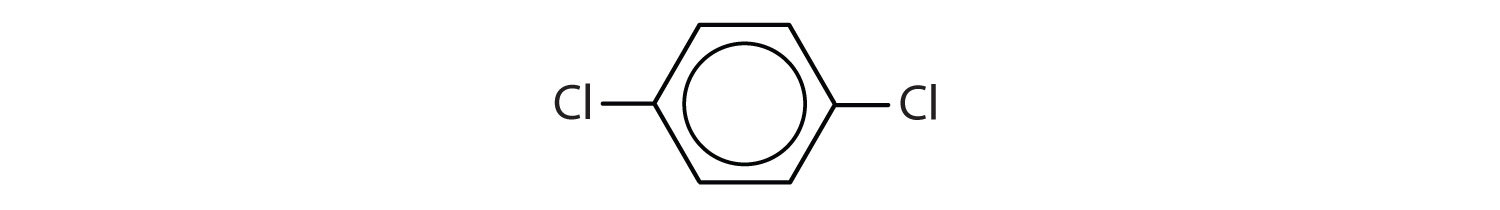
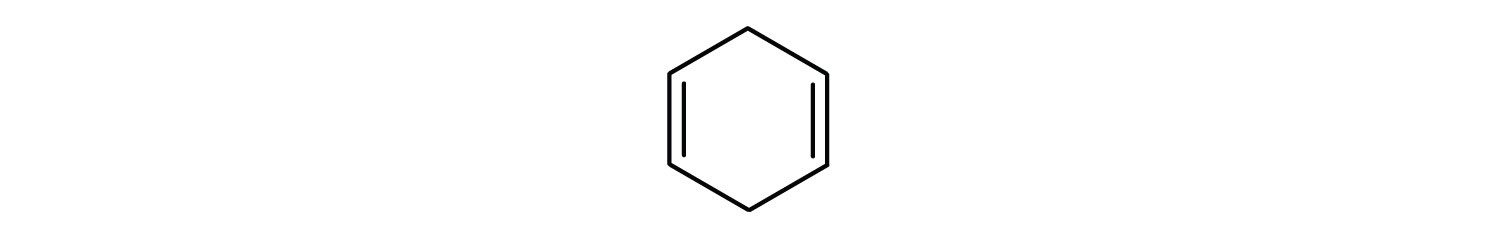
Aromatiska kolväten definieras genom att de har en 6-bindig ringstruktur med alternerande dubbelbindningar (Fig 8.2).
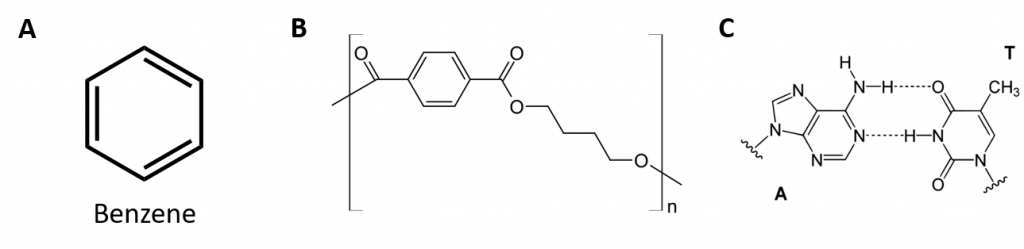
Figur 8.2: Aromatiska kolväten. Aromatiska kolväten innehåller den 6-meddelade bensenringstrukturen (A) som kännetecknas av alternerande dubbelbindningar. Ultradur, PBT är en plastpolymer som innehåller en aromatisk funktionell grupp. Den repeterande monomeren i Ultradur visas i (B). Ultradur finns i duschmunstycken, tandborstborstar, plasthöljen för fiberoptiska kablar och i yttre och inre komponenter i bilar. Biologiskt viktiga molekyler, t.ex. desoxyribonukleinsyra, DNA (C) innehåller också aromatiska ringstrukturer.
Därmed har de formler som kan ritas som cykliska alkener, vilket gör dem omättade. På grund av den cykliska strukturen är dock egenskaperna hos aromatiska ringar i allmänhet helt annorlunda, och de beter sig inte som typiska alkener. Aromatiska föreningar ligger till grund för många läkemedel, antiseptiska medel, sprängämnen, lösningsmedel och plaster (t.ex. polyestrar och polystyren).
De två enklaste omättade föreningarna – eten (ethen) och acetylen (etyne) – användes en gång i tiden som bedövningsmedel och introducerades inom medicinen 1924. Man upptäckte dock att acetylen bildar explosiva blandningar med luft, så den medicinska användningen övergavs 1925. Etylen ansågs vara säkrare, men även det var inblandat i många dödliga bränder och explosioner under anestesi. Trots detta förblev det ett viktigt bedövningsmedel fram till 1960-talet, då det ersattes av icke brännbara bedövningsmedel som halotan (CHBrClCF3).
- (Tillbaka till början)
- 8.1 Översikt över alkener och alkiner
- (Tillbaka till början)
- 8.2 Egenskaper hos alkener
- Närmare betraktat: Miljöinformation
- Konceptgenomgångsövningar
- Svar
- Nyckeluppfattning
- Övningar
- Svar
- Konceptgenomgångsövningar
- Svar
- Nyckeluppfattning
- 8.3 Alkyner
- Note
- Övningar för begreppsgenomgång
- Key Takeaway
- Övningar
- (Tillbaka till början)
- 8.4 Aromatiska föreningar: Benzen
- Note
- Till din hälsa: Bensen och oss
- Konceptgenomgångsövningar
- Att känna igen aromatiska föreningar
- Färdighetsövning
- Nyckelgrepp
- (Tillbaka till början)
- Polycykliska aromatiska kolväten
- Till din hälsa: Polycykliska aromatiska kolväten och cancer
- Biologiskt viktiga föreningar med bensenringar
- Note
- 8.5 Geometriska isomerer
- Klicka här för att se Kahn Academys videohandledning om alkenens struktur.
- Cis-Trans-nomenklatur
- Klicka här för en Kahn Academy Video Tutorial on Cis/Trans Isomerization
- Till din hälsa
- Klicka här för en videohandledning från Kahn Academy om mättade, omättade och transfetter
- Nyckelfaktorer för att bestämma Cis/Trans-isomerisering
- Arbetat exempel
- Färdighetsuppgift
- Övningar för genomgång av begrepp
- Svar
- Key Takeaway
- (Tillbaka till början)
- E-Z Nomenklatur
- Klicka här för en videohandledning från Kahn Academy om E/Z-isomerisering.
- (Tillbaka till början)
(Tillbaka till början)
8.1 Översikt över alkener och alkiner
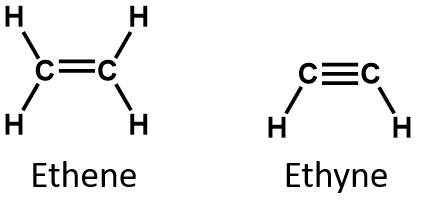
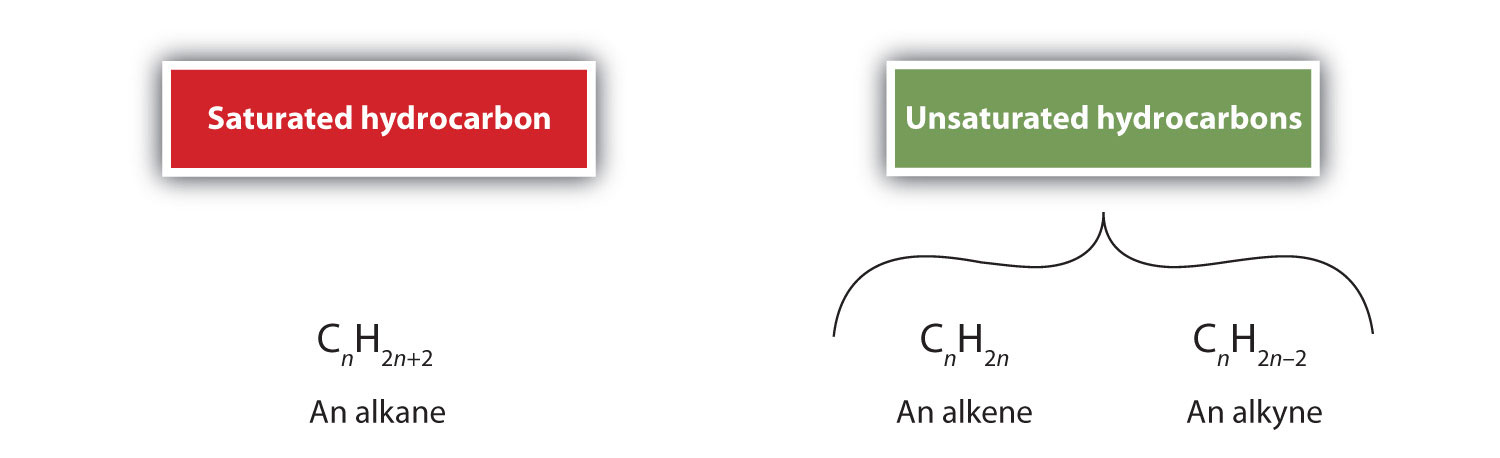
Enligt definitionen är alkener kolväten med en eller flera kol-kol-dubbelbindningar (R2C=CR2), medan alkiner är kolväten med en eller flera kol-kol trippelbindningar (R-C≡C-R). Tillsammans kallas de för omättade kolväten, som definieras som kolväten med en eller flera multipla (dubbel- eller trippel)bindningar mellan kolatomer. Till följd av dubbel- eller trippelbindningarnas karaktär har alkener och alkyner färre väteatomer än jämförbara alkaner med samma antal kolatomer. Matematiskt kan detta anges med följande allmänna formler:
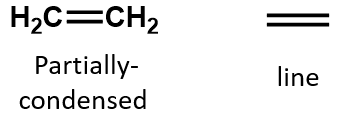
I en alken delas dubbelbindningen av de två kolatomerna och involverar inte väteatomerna, även om den kondenserade formeln inte gör detta uppenbart, dvs. den kondenserade formeln för eten är CH2CH2. Det är ännu svårare att urskilja en molekyls dubbel- eller trippelbindningar utifrån molekylformlerna. Observera att molekylformeln för eten är C2H4, medan molekylformeln för etan är C2H2. Tills du blir mer förtrogen med den organiska kemins språk är det därför ofta mest användbart att rita upp linjestrukturer eller delvis kondenserade strukturer, som visas nedan:
(Tillbaka till början)
8.2 Egenskaper hos alkener
Alkénernas fysikaliska egenskaper liknar de som gäller för alkaner. Tabell 8.1 visar att kokpunkterna för raksträngade alkener ökar med ökande molarmassa, precis som för alkaner. För molekyler med samma antal kolatomer och samma allmänna form skiljer sig kokpunkterna vanligen bara lite, precis som vi skulle förvänta oss för ämnen vars molarmassa skiljer sig med endast 2 u (motsvarande två väteatomer). Liksom andra kolväten är alkenerna olösliga i vatten men lösliga i organiska lösningsmedel.
Några representativa alkener – deras namn, strukturer och fysikaliska egenskaper – anges i tabell 8.1.
Tabell 8.1 Fysikaliska egenskaper hos några utvalda alkener
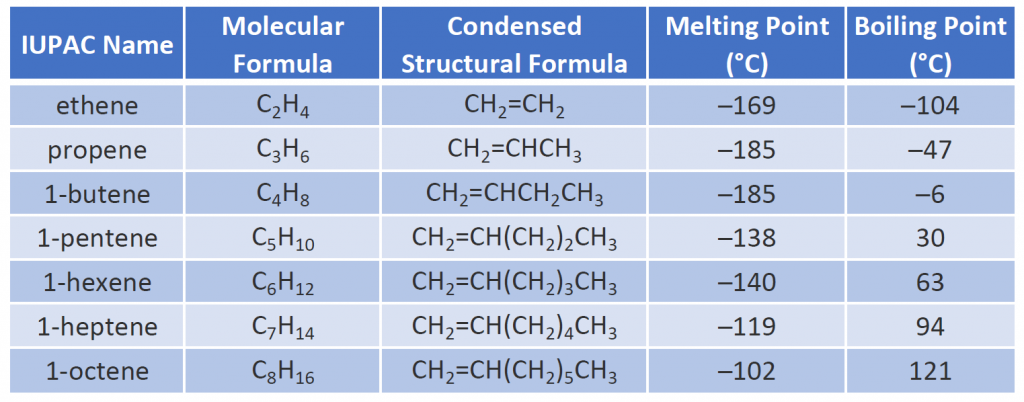
De två första alkenerna i tabell 8.1 -eten och propen, kallas oftast för sina vanliga namn – eten respektive propylen. Etylen är en viktig kommersiell kemikalie. Den amerikanska kemiska industrin producerar cirka 25 miljarder kilo eten årligen, vilket är mer än någon annan syntetisk organisk kemikalie. Mer än hälften av denna etylen går till tillverkning av polyeten, en av de mest kända plasterna. Propylen är också en viktig industrikemikalie. Det omvandlas till plast, isopropylalkohol och en rad andra produkter.
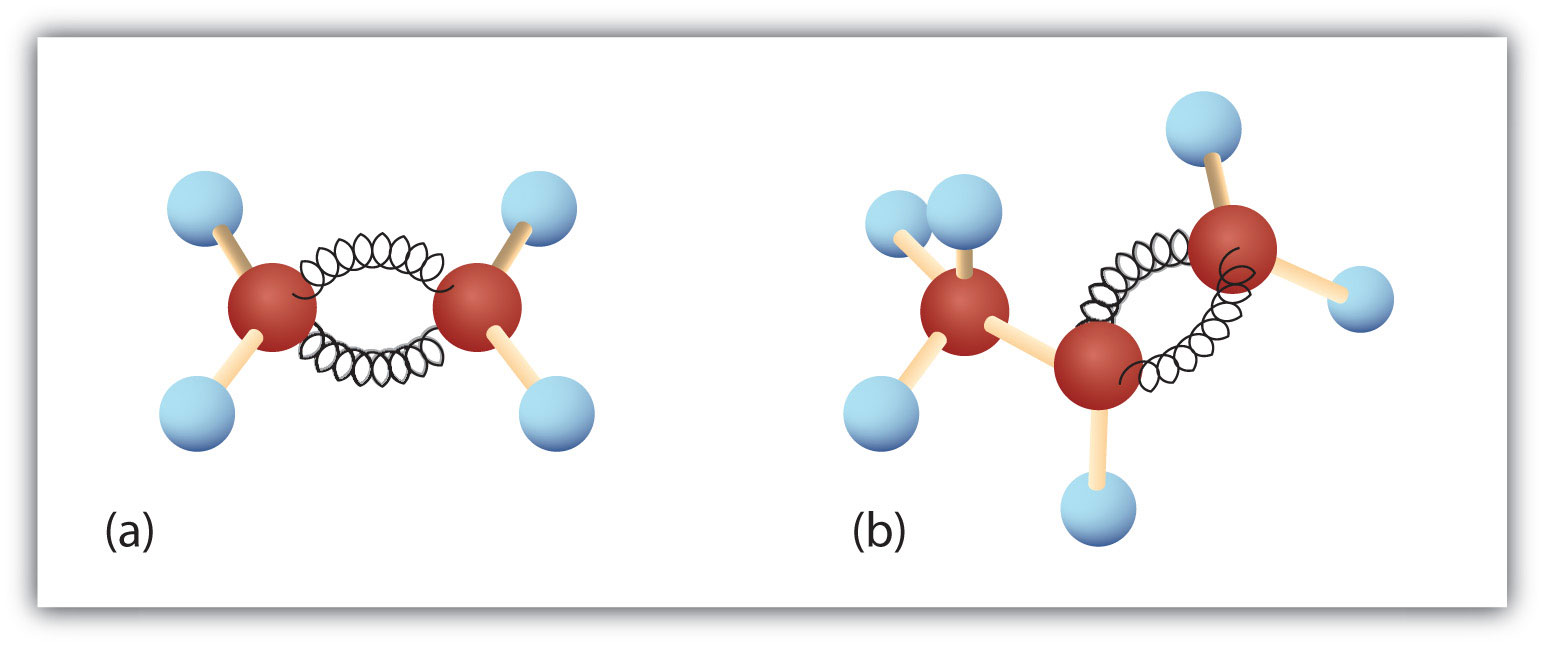
Figur 8.3. Eten och propen. Boll- och fjädermodellerna av eten/eten (a) och propen/propen (b) visar deras respektive former, särskilt bindningsvinklarna.
Närmare betraktat: Miljöinformation
Alkener förekommer i stor utsträckning i naturen. Mognande frukter och grönsaker avger etylen, vilket utlöser ytterligare mognad. Fruktförädlare tillför artificiellt etylen för att påskynda mognadsprocessen; exponering för så lite som 0,1 mg etylen under 24 timmar kan mogna 1 kg tomater. Tyvärr kopierar denna process inte exakt mognadsprocessen, och tomater som plockas gröna och behandlas på detta sätt smakar inte mycket som vinmogna tomater färska från trädgården.
Andra alkener som förekommer i naturen är bland annat 1-octen, en beståndsdel i citronolja, och oktadecen (C18H36) som finns i fisklever. Diener (två dubbelbindningar) och polyener (tre eller fler dubbelbindningar) är också vanliga. Butadien (CH2=CHCHCH=CH2) finns i kaffe. Lykopen och karotenerna är isomeriska polyener (C40H56) som ger de attraktiva röda, orange och gula färgerna på vattenmeloner, tomater, morötter och andra frukter och grönsaker. Vitamin A, som är viktigt för en god syn, kommer från en karoten. Världen skulle vara en mycket mindre färgstark plats utan alkener.

Figur 8.4 Tomaternas klarröda färg beror på lykopen.
Foto från : © Thinkstock; Lycopenstruktur från: Jeff Dahl
Konceptgenomgångsövningar
-
Beskriv kortfattat de fysikaliska egenskaperna hos alkener. Hur är dessa egenskaper jämfört med egenskaperna hos alkaner?
-
Och ordna följande alkener i ordning efter stigande kokpunkt utan att konsultera tabeller:

Svar
-
Alkener har fysikaliska egenskaper (låg kokpunkt, olösliga i vatten) som liknar dem hos motsvarande alkaner.
-
ethen <propen < 1-buten < 1-hexen
Nyckeluppfattning
- Alkenernas fysikaliska egenskaper liknar i hög grad de fysikaliska egenskaperna hos alkanexemplarerna: deras kokpunkter ökar med ökande molarmassa och de är olösliga i vatten.
Övningar
-
Förutsäg utan att hänvisa till en tabell eller annan referens vilken medlem i varje par som har den högre kokpunkten.
- 1-penten eller 1-buten
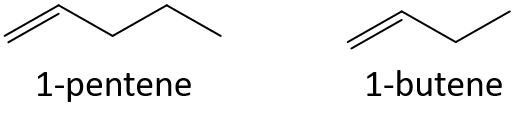
- 3-heptene eller 3-nonen
- 1-penten eller 1-buten
-
Vilket är ett bra lösningsmedel för cyklohexen? pentan eller vatten?
Svar
-
- 1-penten
- 3-nonen
Konceptgenomgångsövningar
-
Hitta kortfattat de viktiga skillnaderna mellan ett mättat kolväte och ett omättat kolväte.
-
Hitta kortfattat de viktiga skillnaderna mellan en alken och en alkan.
-
Klassificera varje förening som mättad eller omättad. Identifiera varje förening som en alkan, en alken eller en alkan.
-
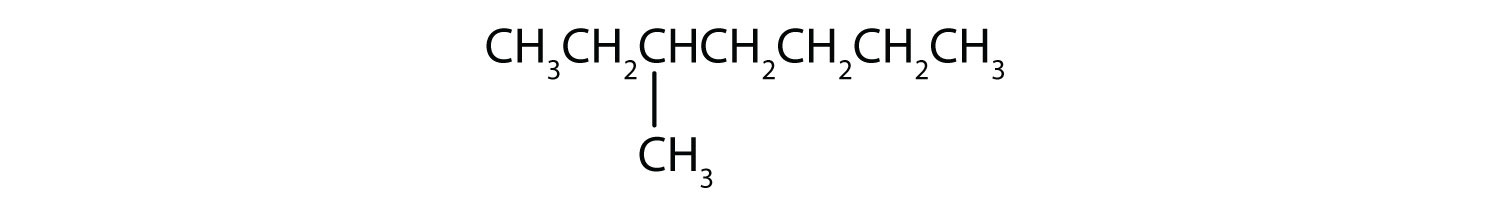
- CH3CH2C≡CCH3
-

-
Svar
-
Omättade kolväten har dubbel- eller trippelbindningar och är ganska reaktiva; Mättade kolväten har endast enkla bindningar och är ganska oreaktiva.
-
En alken har en dubbelbindning; en alkan har endast enkelbindningar.
-
- mättad; alkan
- omättad; alkan
- omättad; alkan
- omättad; alken
Nyckeluppfattning
- Alkener är kolväten som har en kol-till-kol dubbelbindning.
8.3 Alkyner
Den enklaste alkynen – ett kolväte med kol-till-kol trippelbindning – har molekylformeln C2H2 och är känd under sitt vanliga namn acetylen (fig 8.5). Dess struktur är H-C≡C-H.
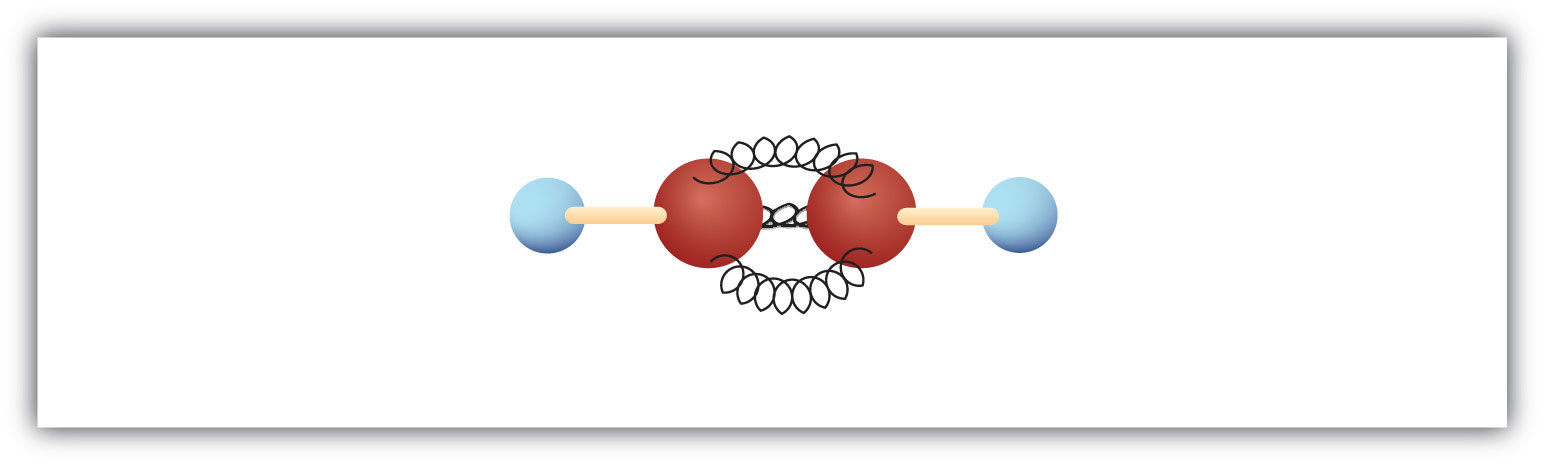
Figur 8.5 Kul- och fjädermodell för acetylen. Acetylen (etyn) är den enklaste medlemmen i alkynfamiljen.
Note
Acetylen används i oxyacetylenbrännare för att skära och svetsa metaller. Flamman från en sådan brännare kan vara mycket het. Det mesta acetylen omvandlas dock till kemiska mellanprodukter som används för att tillverka vinyl- och akrylplaster, fibrer, hartser och en mängd andra produkter.
Alkyner liknar alkener i både fysikaliska och kemiska egenskaper. Alkyner genomgår till exempel många av de typiska additionsreaktionerna för alkener. IUPAC-namnen (International Union of Pure and Applied Chemistry) för alkyner är parallella med namnen på alkener, förutom att familjeändelsen är -yne i stället för -ene. IUPAC-namnet för acetylen är etyn. Namnen på andra alkyner illustreras i följande övningar.
Övningar för begreppsgenomgång
-
Hitta kortfattat upp de viktiga skillnaderna mellan en alken och en alkyn. Hur liknar de varandra?
-
Alkenen (CH3)2CHCHCH2CH=CH2 heter 4-metyl-1-penten. Vad heter (CH3)2CHCHCH2C≡CH?
-
Var alkyner cis-trans isomeriska? Förklara.
Svar
-
Alkener har dubbelbindningar; alkyner har trippelbindningar. Båda genomgår additionsreaktioner.
-
4-metyl-1-pentyne
-
Nej; en trippelbunden kolatom kan bilda endast en annan bindning. Den skulle behöva ha två grupper knutna till sig för att visa cis-trans isomeri.
Key Takeaway
- Alkyner är kolväten med trippelbindningar från kol till kol och egenskaper som påminner mycket om de som alkener har.
Övningar
-
Rita strukturen för varje förening.
- acetylen
- 3-metyl-1-hexyne
-
Rita strukturen för varje förening.
- 4-metyl-2-hexyne
- 3-octyne
-
Nämn varje alkin.
- CH3CH3CH2CH2CH2C≡CH
- CH3CH3CH2CH2CH2C≡CCH3
Svar
-
- H-C≡C-H
-
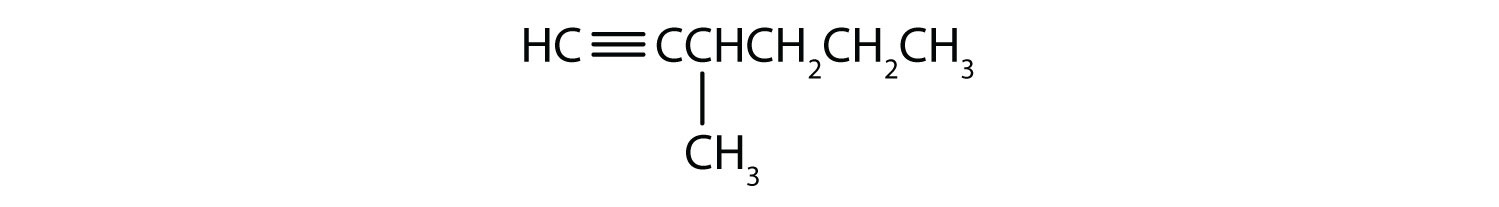
-
- 1-pentyne
- 2-hexyne
(Tillbaka till början)
8.4 Aromatiska föreningar: Benzen
Nästan betraktar vi en klass av kolväten med molekylformler som liknar dem för omättade kolväten, men som till skillnad från alkenerna inte lätt genomgår additionsreaktioner. Dessa föreningar utgör en särskild klass som kallas aromatiska kolväten. Aromatiska kolväten är föreningar som innehåller en bensenringstruktur Den enklaste aromatiska föreningen är bensen (C6H6) och den är av stor kommersiell betydelse, men den har också anmärkningsvärda skadliga hälsoeffekter (se ”Till din hälsa: bensen och vi”).
Formeln C6H6 tycks indikera att bensen har en hög grad av omättnad. (Hexan, det mättade kolväte med sex kolatomer har formeln C6H14 – åtta fler väteatomer än bensen). Trots den till synes låga mättnadsgraden är bensen dock ganska oreaktiv. Detta beror på den resonansstruktur som bildas av den aromatiska ringens alternerande dubbelbindningsstruktur.

Note
Bensen är en vätska som luktar som bensin, kokar vid 80°C och fryser vid 5,5°C. Det är det aromatiska kolväte som produceras i den största volymen. Den användes tidigare för att avkoffeinera kaffe och var en viktig komponent i många konsumentprodukter, t.ex. färgborttagningsmedel, gummicement och fläckborttagningsmedel för kemtvättar i hemmet. Det togs bort från många produktformuleringar på 1950-talet, men andra fortsatte att använda bensen i produkter fram till 1970-talet då det förknippades med dödsfall i leukemi. Bensen är fortfarande viktig inom industrin som en prekursor vid tillverkningen av plast (t.ex. styrofoam och nylon), läkemedel, tvättmedel, syntetiskt gummi, bekämpningsmedel och färgämnen. Det används som lösningsmedel för bl.a. rengöring och underhåll av tryckutrustning och för lim, t.ex. för lim som används för att fästa sulor på skor. Bensen är en naturlig beståndsdel i petroleumprodukter, men eftersom det är ett känt cancerframkallande ämne är dess användning som tillsats i bensin numera begränsad.
Till din hälsa: Bensen och oss
Det mesta av den bensen som används kommersiellt kommer från petroleum. Det används som utgångsmaterial vid tillverkning av tvättmedel, läkemedel, färgämnen, insektsbekämpningsmedel och plaster. Bensen, som en gång i tiden användes i stor utsträckning som ett organiskt lösningsmedel, är nu känd för att ha både kort- och långtidstoxiska effekter. Inandning av stora koncentrationer kan orsaka illamående och till och med dödsfall på grund av andnings- eller hjärtsvikt, medan upprepad exponering leder till en progressiv sjukdom där benmärgens förmåga att bilda nya blodkroppar så småningom förstörs. Detta resulterar i ett tillstånd som kallas aplastisk anemi, där antalet både röda och vita blodkroppar minskar.
Konceptgenomgångsövningar
-
Hur skiljer sig de typiska reaktionerna för bensen från de för alkenerna?
-
Beskriv kortfattat bindningarna i bensen.
-
Vad betyder cirkeln i kemistens representation av bensen?
Svar
-
Bensen är ganska oreaktiv mot additionsreaktioner jämfört med en alken.
-
Valenceelektronerna delas lika mycket av alla sex kolatomer (det vill säga elektronerna är delokaliserade).
-
De sex elektronerna delas lika mycket av alla sex kolatomer.
Att känna igen aromatiska föreningar
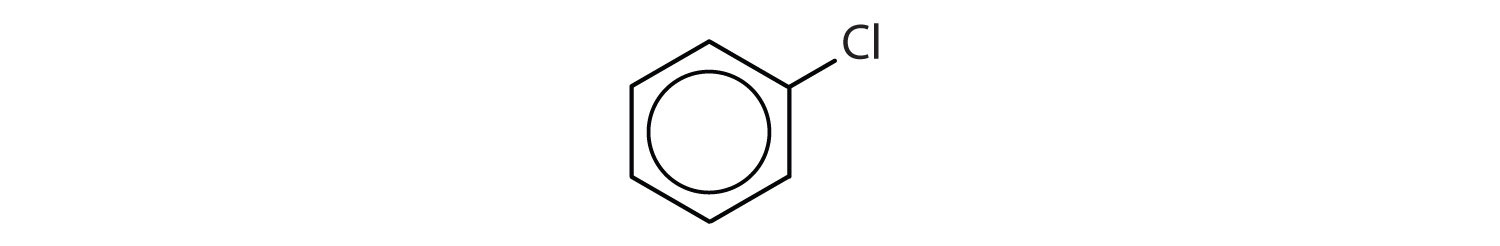
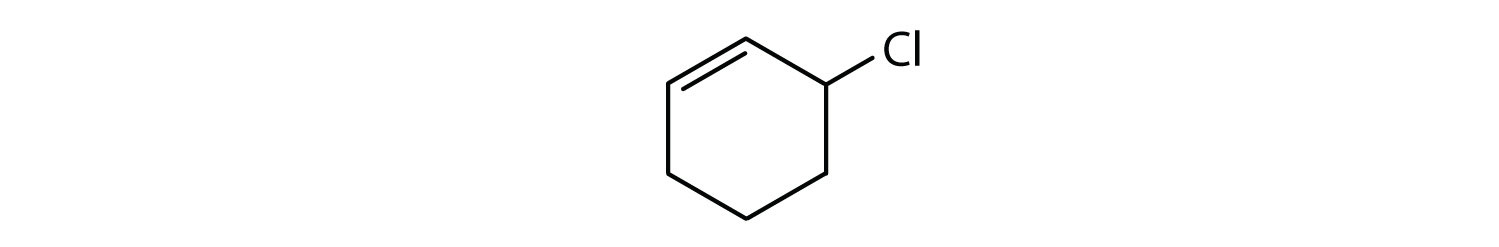
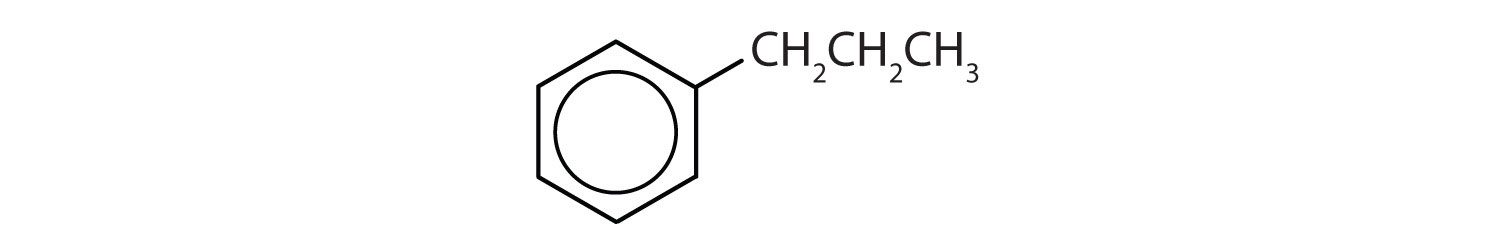
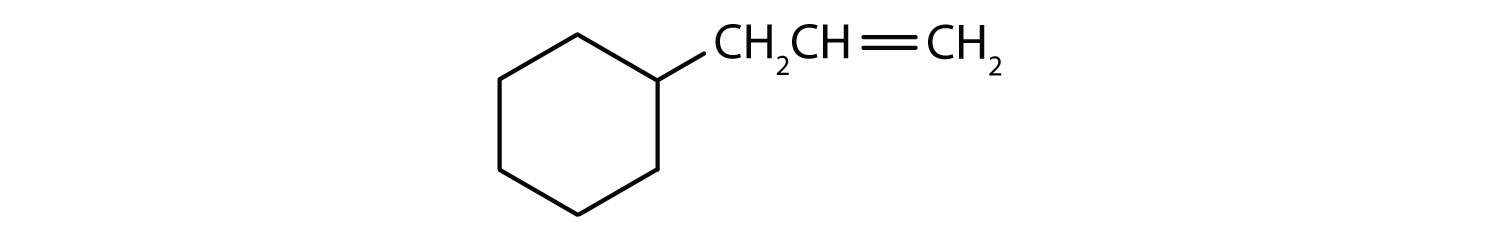
Vilka föreningar är aromatiska?
Lösning
- Förbindelsen har en bensenring (med en kloratomsubstitut för en av väteatomerna); Den är aromatisk.
- Förbindelsen är cyklisk, men har ingen bensenring; den är inte aromatisk.
- Förbindelsen har en bensenring (med en propylgrupp som ersätter en av väteatomerna); den är aromatisk.
- Förbindelsen är cyklisk, men den har ingen bensenring; den är inte aromatisk.
Färdighetsövning
Vilka föreningar är aromatiska?
I I IUPAC-systemet (International Union of Pure and Applied Chemistry) kallas aromatiska kolväten som derivat av bensen. Fem exempel visas nedan. I dessa strukturer spelar det ingen roll om den enda substituenten skrivs på toppen, sidan eller botten av ringen: en hexagon är symmetrisk och därför är alla positioner likvärdiga.
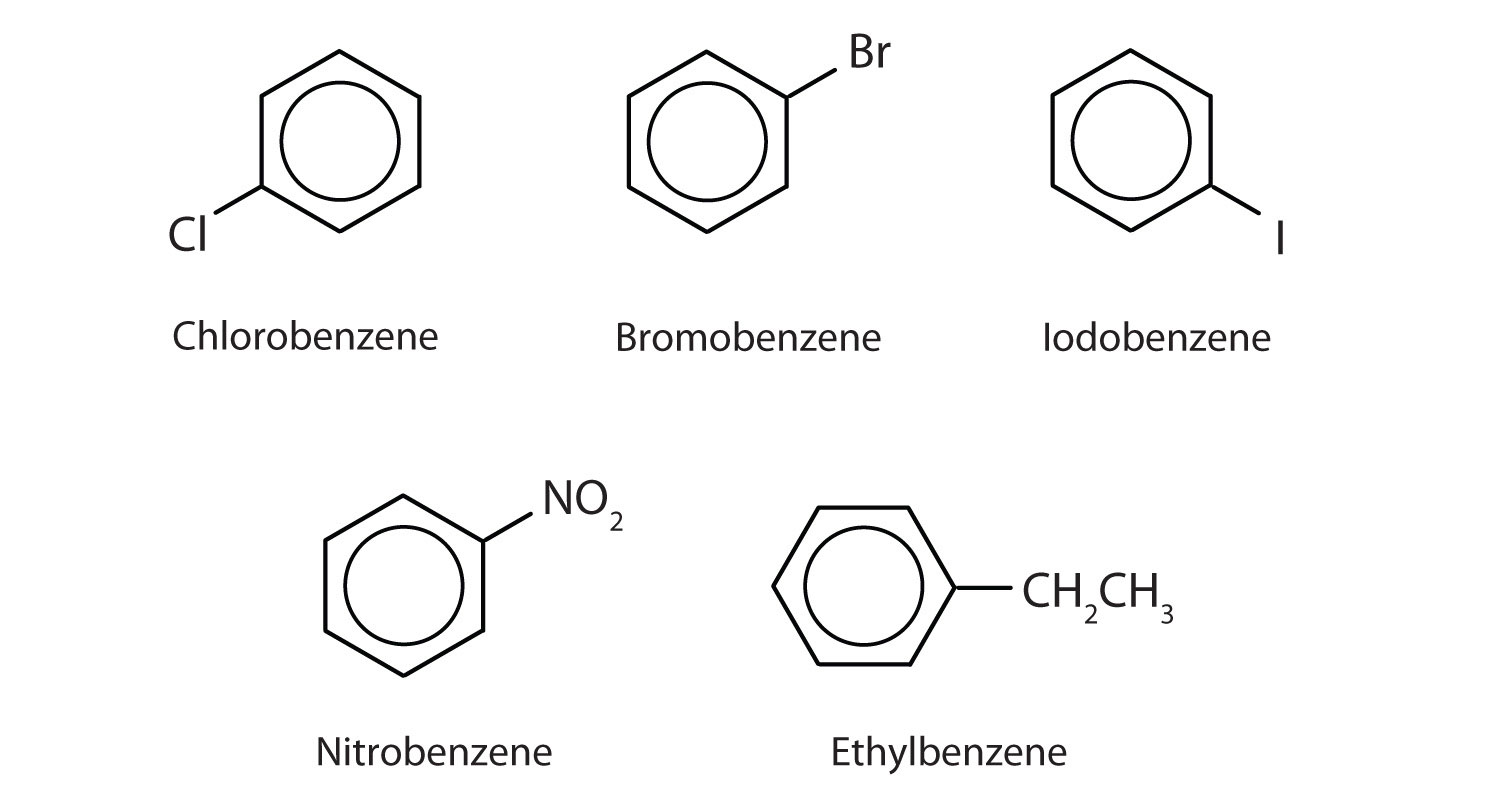
Dessa föreningar benämns på sedvanligt sätt där den grupp som ersätter en väteatom benämns som en substituentgrupp: Cl för klor, Br för bromo, I för jod, NO2 för nitro och CH3CH2 för etyl.
Och även om vissa föreningar uteslutande hänvisas till IUPAC-namn, anges vissa oftare med vanliga namn, vilket anges nedan.
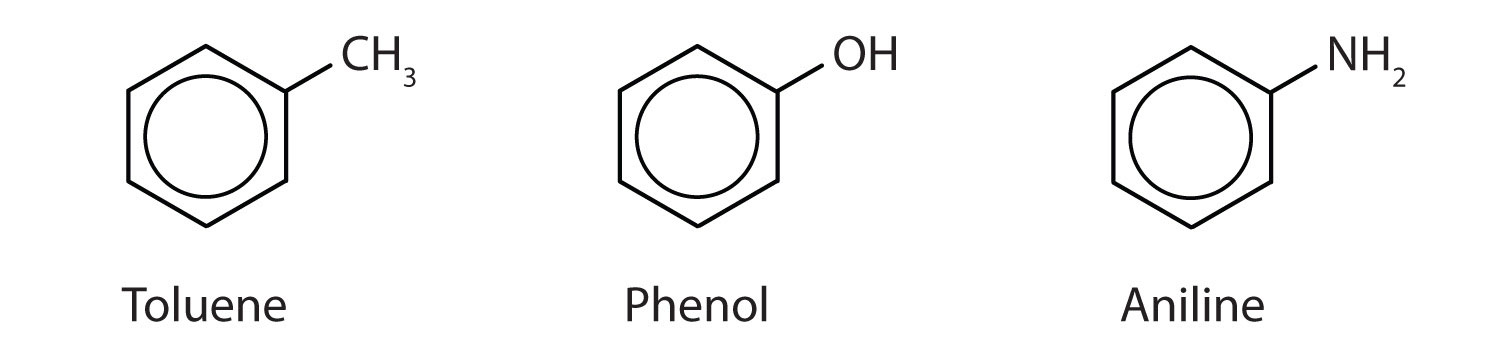
-
Nyckelgrepp
- Aromatiska kolväten tycks vara omättade, men de har en speciell typ av bindningar och genomgår inte additionsreaktioner.
(Tillbaka till början)
Polycykliska aromatiska kolväten
En del vanliga aromatiska kolväten består av fusionerade bensenringar – ringar som har en gemensam sida. Dessa föreningar kallas polycykliska aromatiska kolväten (PAH)Ett aromatiskt kolväte som består av kondenserade bensenringar som delar en gemensam sida..
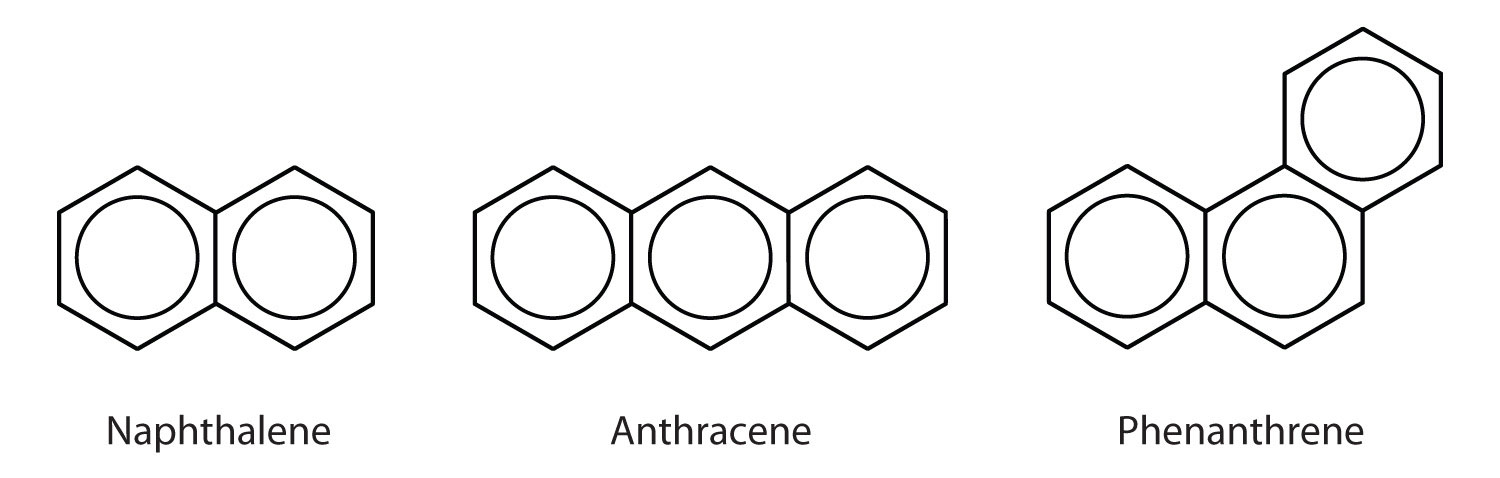
De tre exemplen som visas här är färglösa, kristallina fasta ämnen som i allmänhet erhålls från stenkolstjära. Naftalen har en stickande lukt och används i malpåse. Antracen används vid tillverkning av vissa färgämnen. Steroider, inklusive kolesterol och hormonerna östrogen och testosteron, innehåller fenantrenstrukturen.
Till din hälsa: Polycykliska aromatiska kolväten och cancer
Den intensiva upphettning som krävs för att destillera stenkolstjära leder till att PAH:er bildas. I många år har det varit känt att arbetare i stenkolstjäreraffinaderier är mottagliga för en typ av hudcancer som kallas tjärcancer. Undersökningar har visat att ett antal PAH:er är cancerframkallande. En av de mest aktiva cancerframkallande föreningarna, bensopyren, förekommer i stenkolstjära och har också isolerats från cigarettrök, marijuanarök, bilavgaser och kolgrillade biffar. Man uppskattar att mer än 1 000 ton bensopyren släpps ut i luften över USA varje år. Det krävs endast några milligram bensopyren per kilo kroppsvikt för att framkalla cancer hos försöksdjur.
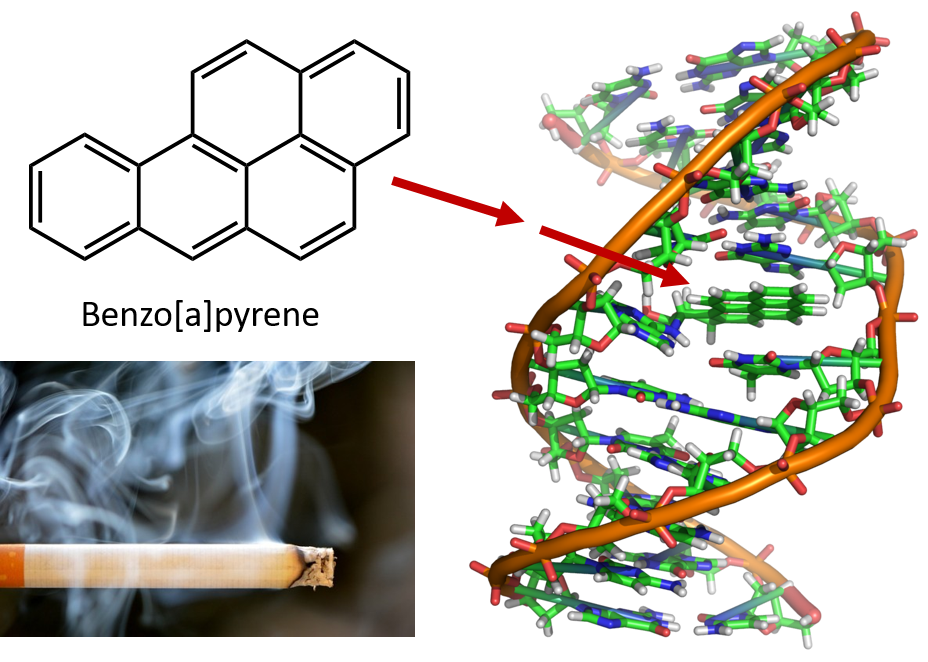
Figur 8.6 Bensopyren är ett polycykliskt aromatiskt kolväte som produceras som en biprodukt i stenkolstjära, cigarett- och marijuanarök och i kolgrillade biffar. Bensopyren metaboliseras för att producera biologiskt aktiva föreningar som kan bilda fysiska addukter på DNA-molekyler. Dessa addukter kan orsaka genetiska mutationer som orsakar cancer.
Foto av cigarettrök
Biologiskt viktiga föreningar med bensenringar
Substanser som innehåller bensenringen är vanliga i både djur och växter, även om de är vanligare i de senare. Växter kan syntetisera bensenringen från koldioxid, vatten och oorganiska material. Djur kan inte syntetisera den, men de är beroende av vissa aromatiska föreningar för sin överlevnad och måste därför få dem från födan. Fenylalanin, tyrosin och tryptofan (essentiella aminosyror) och vitaminerna K, B2 (riboflavin) och B9 (folsyra) innehåller alla bensenringen. Många viktiga läkemedel, varav några visas i tabell 8.2, har också en bensenring.
Note
Här har vi hittills endast studerat aromatiska föreningar med kolhaltiga ringar. Många cykliska föreningar har dock ett annat element än kolatomer i ringen. Organiska ringstrukturer som innehåller en annan atom än kol kallas heterocykliska föreningar…, Heterocykliska aromatiska föreningar har också unika och medicinskt relevanta egenskaper.
Tabell 8.2 Några läkemedel som innehåller en bensenring
| Namn | Struktur |
|---|---|
| aspirin |
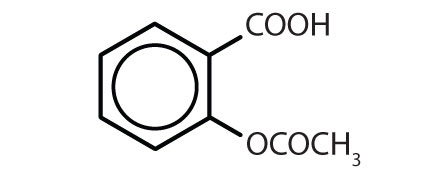 |
| acetaminofen |
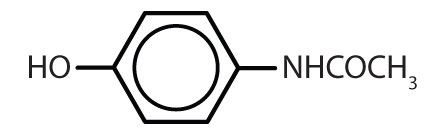 |
| ibuprofen |
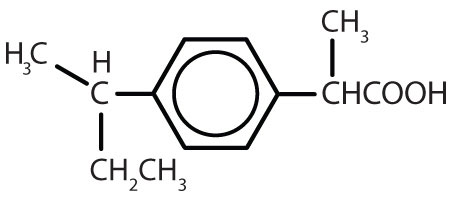 |
| amfetamin |
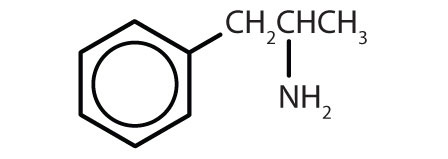 |
| sulfanilamid |
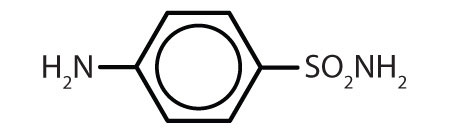 |
8.5 Geometriska isomerer
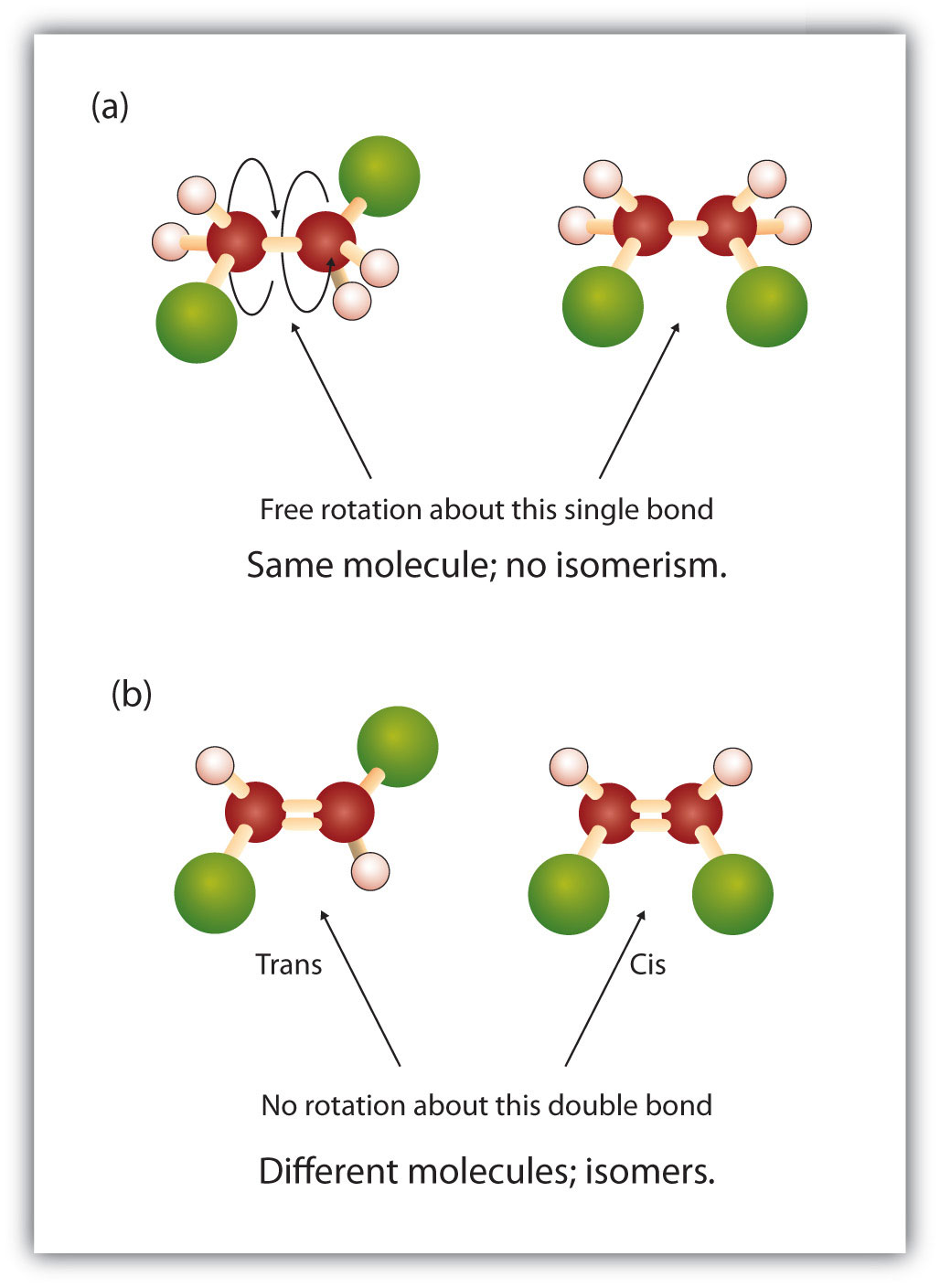
Inom alkanstrukturen finns det fri rotation kring kol-till-kol-monobindningarna (C-C). I alkenernas struktur krävs däremot att kolatomerna bildar en dubbelbindning. Dubbelbindningar mellan grundämnen skapas med hjälp av p-orbitalskal (även kallade pi-orbitaler). Dessa orbitalskal är formade som hantlar i stället för de cirkulära orbitaler som används i enkelbindningar. Detta förhindrar kolatomernas fria rotation runt dubbelbindningen, eftersom det skulle leda till att dubbelbindningen bryts under rotationen (figur 8.7). En enkelbindning är således analog med två brädor som spikas ihop med en spik. Brädorna är fria att rotera runt den enda spiken. En dubbelbindning, å andra sidan, är analogt med två brädor som spikas ihop med två spikar. I det första fallet kan man vrida brädorna, medan man i det andra fallet inte kan vrida dem.

Figur 8.7 Bildandet av dubbelbindningar kräver användning av pi-bindningar. För att molekyler ska kunna bilda dubbelbindningar måste elektroner dela överlappande pi-orbitaler mellan de två atomerna. Detta kräver att de hantelformade pi-orbitalerna (visas till vänster) förblir i en fast konformation under dubbelbindningsbildningen. Detta gör det möjligt att bilda elektronorbitaler som kan delas av båda atomerna (visas till höger). Rotation runt dubbelbindningen skulle leda till att pi-orbitalerna blir felriktade, vilket bryter dubbelbindningen.
Diagrammet kommer från: JoJanderivative work – Vladsinger (talk)
Den fasta och rigida karaktären hos dubbelbindningen skapar möjligheten till ett ytterligare chiralt centrum, och därmed potentialen för stereoisomerer. Nya stereoisomerer bildas om var och en av de kolväten som är inblandade i dubbelbindningen har två olika atomer eller grupper som är knutna till den. Titta till exempel på de två klorerade kolvätena i figur 8.8. I den övre figuren visas den halogenerade alkanen. Rotation runt denna kol-kol-bindning är möjlig och resulterar inte i olika isomerkonformationer. I den nedre figuren har den halogenerade alken en begränsad rotation runt dubbelbindningen. Observera också att varje kol som ingår i dubbelbindningen också är knutet till två olika atomer (ett väte och ett klor). Denna molekyl kan alltså bilda två stereoisomerer: en som har de två kloratomer på samma sida av dubbelbindningen och en där kloratomerna sitter på motsatta sidor av dubbelbindningen.
Figur 8.8 Alken dubbelbindningar kan bilda geometriska isomerer. (a) Visar den fria rotationen runt en kol-kol enkelbindning i alkanstrukturen. (b) Visar den fasta positionen för kol-kol-dubbelbindningen som leder till geometiska (rumsliga) isomerer.
Klicka här för att se Kahn Academys videohandledning om alkenens struktur.
För det här avsnittet berör vi inte namngivningen som också ingår i den här videohandledningen.(Observera: Allt innehåll från Khan Academy är tillgängligt gratis med CC-BY-NC-SA-licensiering på www.khanacademy.org )
Cis-Trans-nomenklatur
Namngivningssystemet cis-trans kan användas för att särskilja enkla isomerer, där varje kol i dubbelbindningen har en uppsättning identiska grupper knutna till sig. Till exempel i figur 8.8b har varje kol som ingår i dubbelbindningen ett klor knutet till sig, och har även väte knutet till sig. Systemet cis och trans identifierar om identiska grupper finns på samma sida (cis) av dubbelbindningen eller om de finns på motsatt sida (trans) av dubbelbindningen. Om väteatomerna till exempel befinner sig på motsatt sida av dubbelbindningen sägs bindningen vara i trans-konformation. Om vätegrupperna befinner sig på samma sida av dubbelbindningen sägs bindningen vara i cis-konformation. Observera att man också kan säga att om båda klorgrupperna befinner sig på motsatt sida av dubbelbindningen är molekylen i transkonformationen eller om de befinner sig på samma sida av dubbelbindningen är molekylen i cis-konformationen.
För att avgöra om en molekyl är cis eller trans är det bra att rita en streckad linje ner i mitten av dubbelbindningen och sedan ringa in de identiska grupperna, som visas i figur 8.9. Båda molekylerna som visas i figur 8.9 har namnet 1,2-dikloroethen. Beteckningen cis och trans definierar alltså bara stereokemin runt dubbelbindningen, den ändrar inte molekylens övergripande identitet. Cis- och trans-isomerer har dock ofta olika fysikaliska och kemiska egenskaper, på grund av bindningarnas fasta natur i rummet.
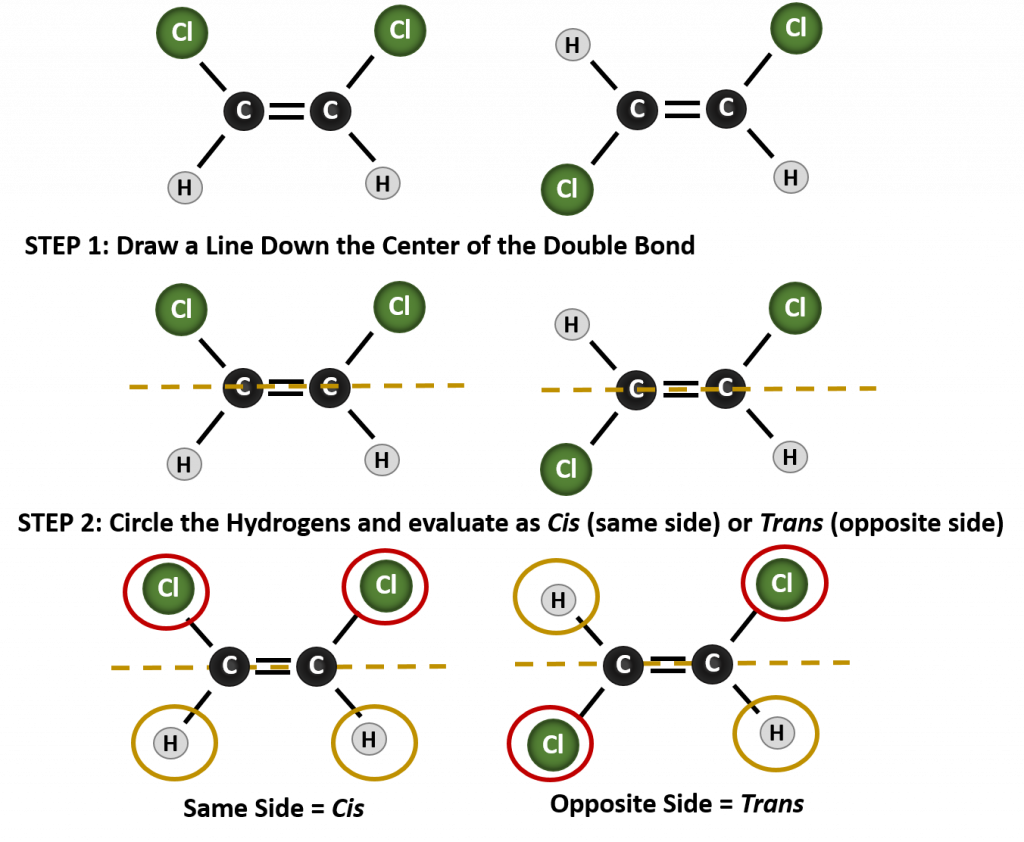
Figur 8.9 En guide för att bestämma cis- eller transkonformiteter.
Klicka här för en Kahn Academy Video Tutorial on Cis/Trans Isomerization
(Observera: Allt Khan Academy-innehåll är tillgängligt gratis med CC-BY-NC-SA-licensiering på www.khanacademy.org )
Cis-trans-isomeri förekommer även i cykliska föreningar. I ringstrukturer kan grupperna inte rotera runt någon av ringens kol-kol-bindningar. Därför kan grupperna antingen befinna sig på samma sida av ringen (cis) eller på motsatta sidor av ringen (trans). För våra syften här representerar vi alla cykloalkaner som plana strukturer, och vi anger gruppernas positioner, antingen ovanför eller under ringens plan.

Till din hälsa
Den kanske vanligaste platsen där du kommer att höra hänvisningar till cis-trans-konformationer i det vardagliga livet är i snabbköpet eller på din läkarmottagning. Det har att göra med vår konsumtion av kostfetter. Olämplig eller överdriven konsumtion av kostfetter har kopplats till många hälsostörningar, till exempel diabetes och ateroskleros och kranskärlssjukdomar. Så vad är skillnaderna mellan mättade och omättade fetter och vad är transfetter och varför är de ett sådant hälsoproblem?

Figur 8.10 Vanliga källor till kostfetter.
Foto från: TyMaHe
Den vanligaste formen av kostfetter och den viktigaste beståndsdelen av kroppsfett hos människor och andra djur är triglyceriderna (TAG). TAGs, som visas i figur 8.10, är uppbyggda av en molekyl glycerol och tre molekyler fettsyror som är sammanlänkade med en esterbindning. I det här avsnittet kommer vi att fokusera på strukturen hos de långa fettsyrastjärtarna, som kan bestå av alkan- eller alkenstrukturer. Kapitel 10 kommer att fokusera mer på bildandet av esterbindningarna.

Figur 8.11. Exempel på en triglyceridstruktur (TAG). Lägg märke till att varje triglycerid har tre långkedjiga fettsyror som sträcker sig från glycerolryggen. Varje fettsyra kan ha olika grader av mättnad och omättnad.
Struktur anpassad från: Wolfgang Schaefer
Fetter som är helt mättade kommer endast att ha fettsyror med långkedjiga alkansvansar. De sägs vara ”mättade” med väteatomer. Mättade fetter är vanliga i den amerikanska kosten och finns i rött kött, mejeriprodukter som mjölk, ost och smör, kokosolja och finns i många bakverk. Mättade fetter är vanligtvis fasta ämnen vid rumstemperatur. Detta beror på att de långkedjiga alkanerna kan stapla sig på varandra med fler intermolekylära London-dispersationskrafter. Detta ger mättade fetter högre smältpunkt och kokpunkt än de omättade fetter som finns i många vegetabiliska oljor.
De flesta omättade fetter som finns i naturen är i cis-konformationen, vilket visas i figur 8.11. Observera att de fettsyror som visas i figur 8.11 är ritade för enkelhetens skull, så att de är lätta att titta på och inte tar för mycket plats på pappret, men de skrivna bindningsvinklarna skildrar inte på ett adekvat sätt den verkliga rumsliga orienteringen av molekylerna. När fettsyrorna från TAG som visas i figur 8.11 ritas med korrekta bindningsvinklar är det lätt att se att cis-dubbelbindningar orsakar böjningar i alkenkedjan (figur 8.12).
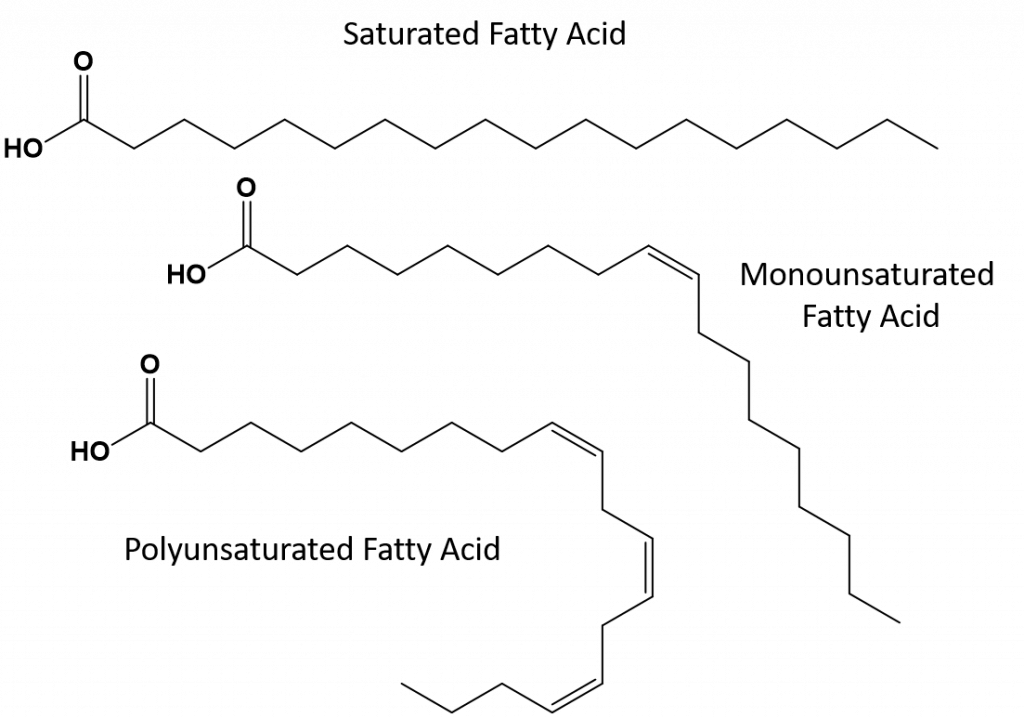
Figur 8.12 Cis-dubbelbindningar orsakar böjningar i fettsyrans struktur
Därmed kan enkelomättade och fleromättade fetter inte stapla sig lika lätt och har inte lika många intermolekylära attraktionskrafter jämfört med mättade fetter. Därför har de lägre smält- och kokpunkter och tenderar att vara flytande vid rumstemperatur. Det har visat sig att en minskning eller ersättning av mättade fetter med enkel- och fleromättade fetter i kosten bidrar till att sänka nivåerna av kolesterolformen LDL (low-density-lipoprotein), som är en riskfaktor för kranskärlssjukdom.
Transfetter innehåller däremot dubbelbindningar som befinner sig i transkonformationen. Fettsyrornas form är således linjär, i likhet med mättade fetter. Transfetter har också liknande smält- och kokpunkter jämfört med mättade fetter. Till skillnad från mättade fetter är transfetter dock inte vanligt förekommande i naturen och har negativa hälsoeffekter. Transfetter uppstår främst som en biprodukt vid livsmedelsförädling (främst hydreringsprocessen för att skapa margariner och shortening) eller vid matlagning, särskilt vid fritering. Faktum är att många snabbmatsrestauranger använder transfetter i sin friteringsprocess, eftersom transfetter kan användas många gånger innan de behöver bytas ut. Konsumtion av transfetter höjer LDL-kolesterolnivåerna i kroppen (det dåliga kolesterolet som förknippas med kranskärlssjukdomar) och tenderar att sänka HDL-kolesterolet (kolesterolet med hög densitet) (det goda kolesterolet i kroppen). Konsumtion av transfetter ökar risken för hjärtsjukdomar och stroke samt för utveckling av typ II-diabetes. Risken är så starkt korrelerad att många länder har förbjudit användningen av transfetter, bland annat Norge, Sverige, Österrike och Schweiz. I USA har Food and Drug Administration (FDA) nyligen antagit en åtgärd för att fasa ut användningen av transfetter i livsmedel senast 2018. Denna åtgärd beräknas förhindra 20 000 hjärtinfarkter och 7 000 dödsfall per år.
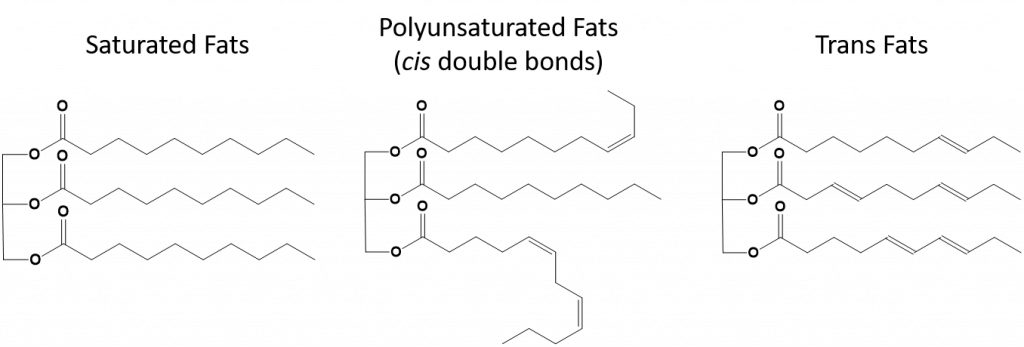
Figur 8.13 Strukturella skillnader mellan mättade, fleromättade och transfetter.
Klicka här för en videohandledning från Kahn Academy om mättade, omättade och transfetter
(Obs: Allt innehåll från Khan Academy är tillgängligt gratis med CC-BY-NC-SA-licensiering på www.khanacademy.org )
Nyckelfaktorer för att bestämma Cis/Trans-isomerisering
- Förbindelsen måste innehålla en dubbel- eller trippelbindning, eller ha en ringstruktur som inte tillåter fri rotation runt kol-kol-bindningen.
- Förbindelsen måste ha två icke-identiska grupper knutna till varje kol som ingår i kol-kol dubbel- eller trippelbindningen.
Arbetat exempel
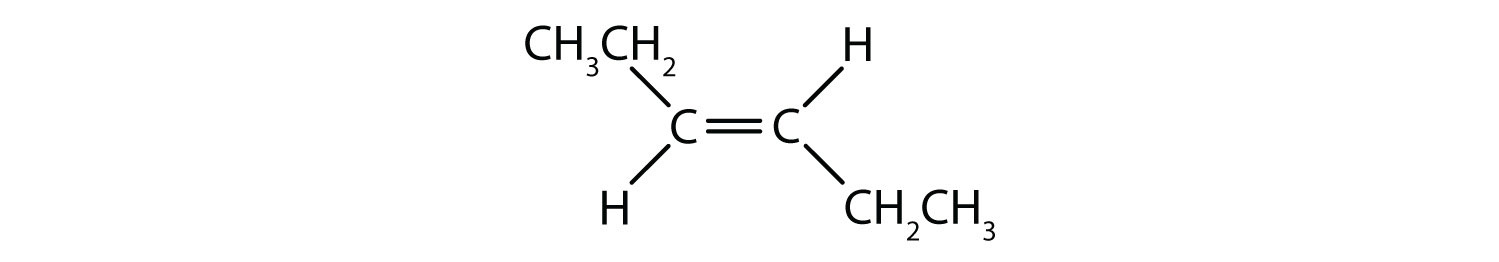
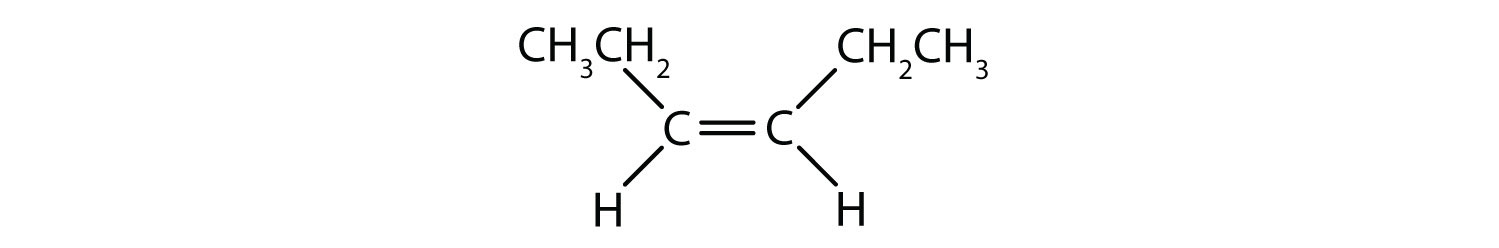
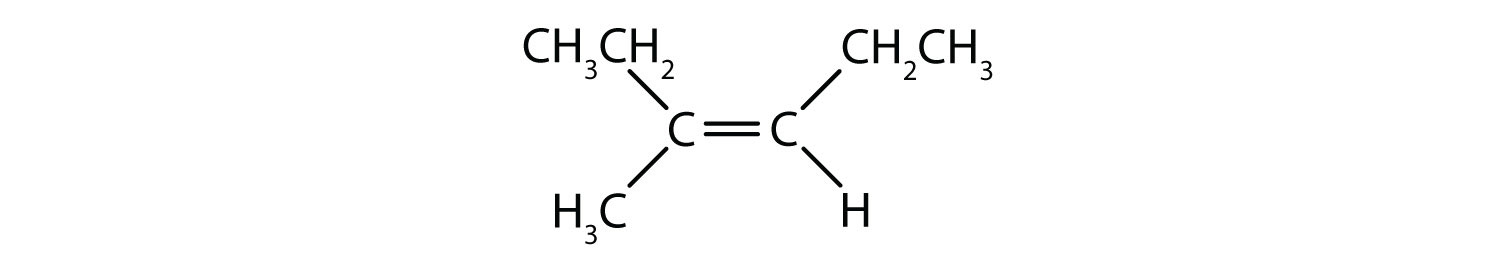
Vilka föreningar kan existera som cis-trans (geometriska) isomerer? Rita dem.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CHCH2CH3
Lösning
Alla fyra strukturerna har en dubbelbindning och uppfyller därmed regel 1 för cis-trans-isomeri.
-
Denna förening uppfyller regel 2; den har två icke-identiska grupper på varje kolatom (H och Cl på den ena och H och Br på den andra). Den existerar som både cis- och transisomerer:

- Denna förening har två väteatomer på en av sina dubbelbundna kolatomer; den uppfyller inte regel 2 och existerar inte som cis- och transisomerer.

- Denna förening har två metyl-(CH3)-grupper på en av sina dubbelbundna kolatomer. Den uppfyller inte regel 2 och existerar inte som cis- och transisomerer.

-
Denna förening uppfyller regel 2; den har två icke-identiska grupper på varje kolatom och existerar som både cis- och transisomerer:

Färdighetsuppgift
-
Vilka föreningar kan existera som cis-transisomerer? Rita dem.
- CH2=CH2CH2CH2CH3
- CH3CH=CH2CH2CH3
- CH3CH2CH=CH2CH3
-
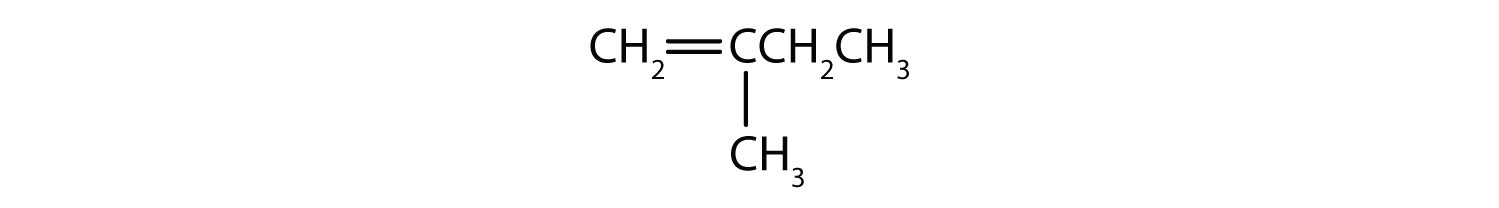
-
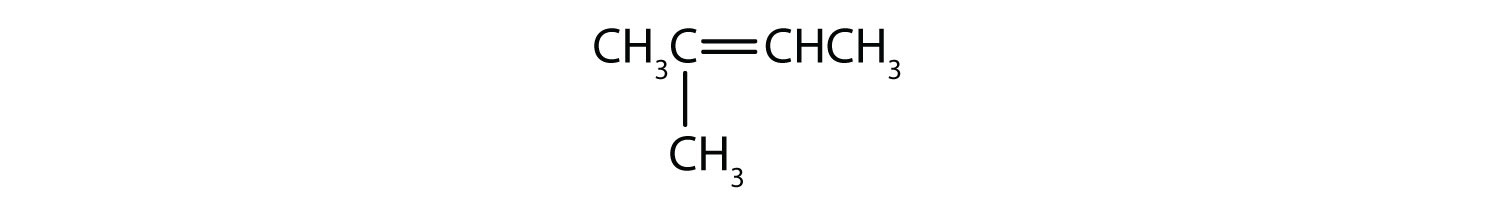
Övningar för genomgång av begrepp
-
Vad är cis-trans (geometriska) isomerer? Vilka två typer av föreningar kan uppvisa cis-trans-isomeri?
-
Klassificera varje förening som en cis-isomer, en trans-isomer eller ingendera.
-
Svar
-
Cis-trans-isomerer är föreningar som har olika konfigurationer (grupper som permanent befinner sig på olika ställen i rummet) på grund av förekomsten av en styv struktur i deras molekyl. Alkener och cykliska föreningar kan uppvisa cis-trans-isomeri.
-
- trans
- cis
- cis
- neither
Key Takeaway
- Cis-trans (geometrisk) isomeri föreligger när det finns en begränsad rotation i en molekyl och det finns två olika grupper på varje kolatom som är involverad i den kemiska bindningen.
(Tillbaka till början)
E-Z Nomenklatur
Situationen blir mer komplicerad när det finns 4 olika grupper knutna till kolatomerna som är involverade i bildandet av dubbelbindningen. Nomenklatursystemet cis-trans kan inte användas i detta fall, eftersom det inte finns någon hänvisning till vilka grupper som beskrivs av nomenklaturen. I molekylen nedan kan man till exempel säga att kloret är trans till bromgruppen eller att kloret är cis till metylgruppen (CH3). Att helt enkelt skriva cis eller trans i det här fallet avgränsar alltså inte tydligt gruppernas rumsliga orientering i förhållande till dubbelbindningen.
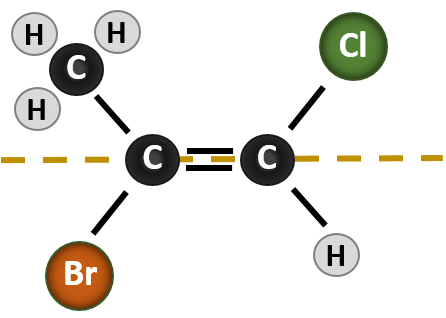
För att benämna de olika stereoisomerer som bildas i den här situationen krävs kunskap om prioritetsreglerna. Minns du från kapitel 5 att i prioritetssystemet Cahn-Ingold-Prelog (CIP) prioriteras de grupper som är knutna till det chirala kolet utifrån deras atomnummer (Z). Atomer med högre atomnummer (fler protoner) ges högre prioritet (dvs. S > P > O > N > C > H). För detta nomenklatursystem används beteckningarna (Z) och (E) i stället för cis/trans-systemet. (E) kommer från det tyska ordet entgegen, eller motsatt. När de högre prioriterade grupperna befinner sig på motsatt sida av dubbelbindningen sägs bindningen således vara i (E)-konformationen. (Z), å andra sidan, kommer från det tyska ordet zusammen, dvs. tillsammans. När de högprioriterade grupperna befinner sig på samma sida av dubbelbindningen sägs bindningen vara i (Z)-konformationen. Figur 8.14 visar de steg som används för att tilldela (E)- eller (Z)-konformationer för en molekyl.
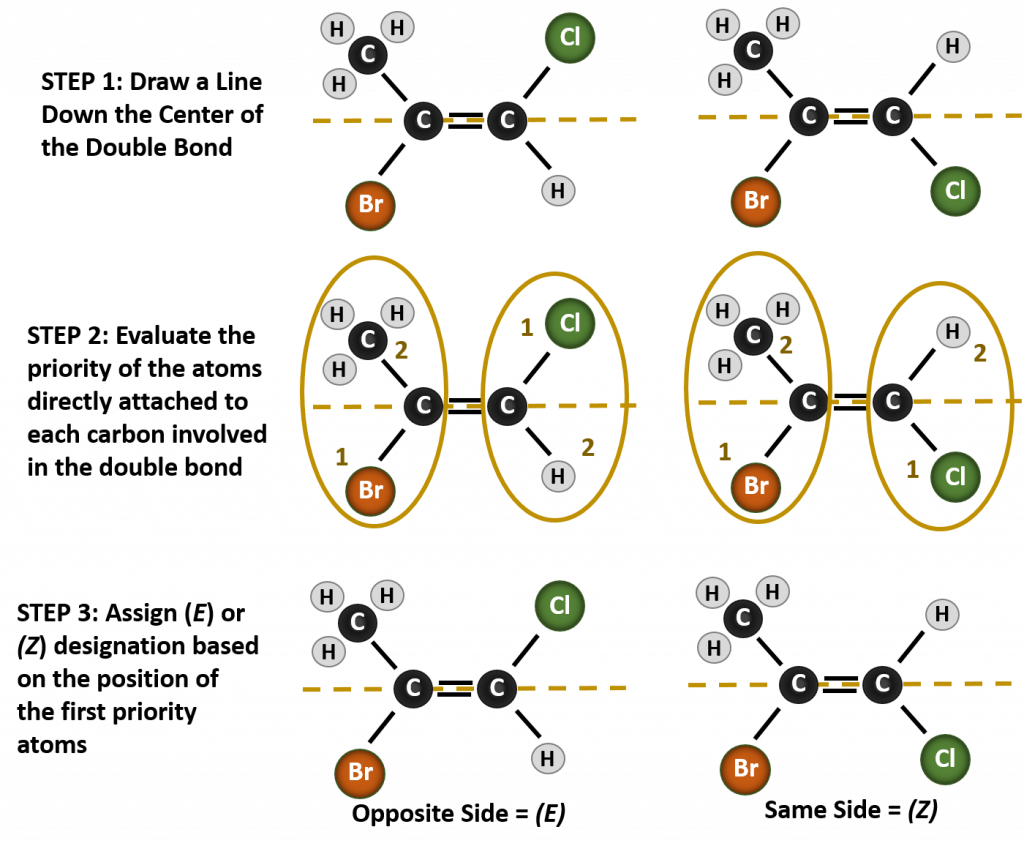
Figur 8.14 Steg som används för att tilldela (E)- och (Z)-konformationer.
Klicka här för en videohandledning från Kahn Academy om E/Z-isomerisering.
(Observera: Allt innehåll från Khan Academy är tillgängligt gratis med CC-BY-NC-SA-licensiering på www.khanacademy.org )