Gli idrocarburi aromatici sono definiti dall’avere strutture ad anello di 6 membri con doppi legami alternati (Fig 8.2).
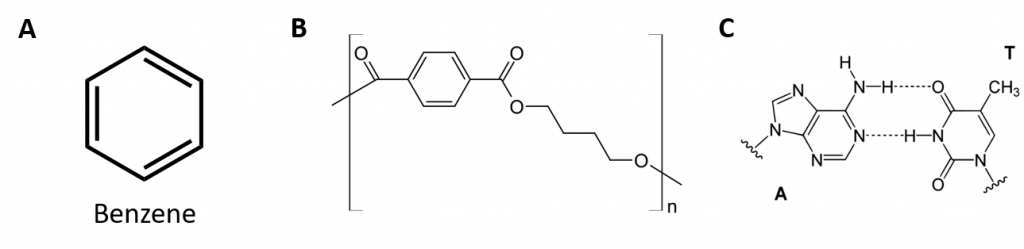
Figura 8.2: Idrocarburi aromatici. Gli idrocarburi aromatici contengono la struttura ad anello di benzene a 6 membri (A) che è caratterizzata da doppi legami alternati. Ultradur, PBT è un polimero plastico che contiene un gruppo funzionale aromatico. Il monomero ripetuto di Ultradur è mostrato in (B). L’Ultradur si trova nei soffioni della doccia, nelle setole degli spazzolini da denti, negli alloggiamenti di plastica per i cavi a fibre ottiche e nei componenti esterni e interni delle automobili. Molecole biologicamente importanti, come l’acido desossiribonucleico, il DNA (C) contengono anche strutture ad anello aromatico.
Quindi, hanno formule che possono essere disegnate come alcheni ciclici, rendendoli insaturi. Tuttavia, a causa della struttura ciclica, le proprietà degli anelli aromatici sono generalmente molto diverse, e non si comportano come i tipici alcheni. I composti aromatici servono come base per molti farmaci, antisettici, esplosivi, solventi e plastiche (per esempio, poliesteri e polistirene).
I due composti insaturi più semplici – etilene (etene) e acetilene (etilene) – erano una volta usati come anestetici e furono introdotti nel campo medico nel 1924. Tuttavia, fu scoperto che l’acetilene forma miscele esplosive con l’aria, così il suo uso medico fu abbandonato nel 1925. Si pensava che l’etilene fosse più sicuro, ma anch’esso fu implicato in numerosi incendi ed esplosioni letali durante l’anestesia. Anche così, rimase un importante anestetico fino agli anni ’60, quando fu sostituito da anestetici non infiammabili come l’alotano (CHBrClCF3).
- (Back to the Top)
- 8.1 Panoramica su alcheni e alchine
- (Torna in alto)
- 8.2 Proprietà degli alcheni
- Guardando più da vicino: Nota ambientale
- Esercizi di revisione del concetto
- Risposte
- Key Takeaway
- Esercizi
- Risposta
- Esercizi di ripasso dei concetti
- Risposte
- Presa di coscienza
- 8.3 Alceni
- Nota
- Esercizi di ripasso dei concetti
- Key Takeaway
- Esercizi
- (Back to the Top)
- 8.4 Composti aromatici: Benzene
- Nota
- alla tua salute: Benzene e Noi
- Esercizi di revisione del concetto
- Riconoscere i composti aromatici
- Esercizio di costruzione delle abilità
- Presa di coscienza
- (Back to the Top)
- Idrocarburi aromatici policiclici
- Alla tua salute: Idrocarburi Policiclici Aromatici e Cancro
- Composti biologicamente importanti con anelli di benzene
- Nota
- 8.5 Isomeri geometrici
- Clicca qui per un video tutorial di Kahn Academy sulla struttura degli alcheni.
- Nomenclatura cis-trans
- Clicca qui per un video tutorial di Kahn Academy sull’isomerizzazione Cis/Trans
- Alla tua salute
- Clicca qui per un video tutorial di Kahn Academy sui grassi saturi, insaturi e trans
- Fattori chiave per determinare l’isomerizzazione Cis/Trans
- Esempio lavorato
- Esercizio di costruzione delle abilità
- Esercizi di ripasso dei concetti
- Risposte
- Key Takeaway
- (Back to the Top)
- Nomenclatura E-Z
- Clicca qui per un video tutorial di Kahn Academy sull’isomerizzazione E/Z.
- (Torna all’inizio)
(Back to the Top)
8.1 Panoramica su alcheni e alchine
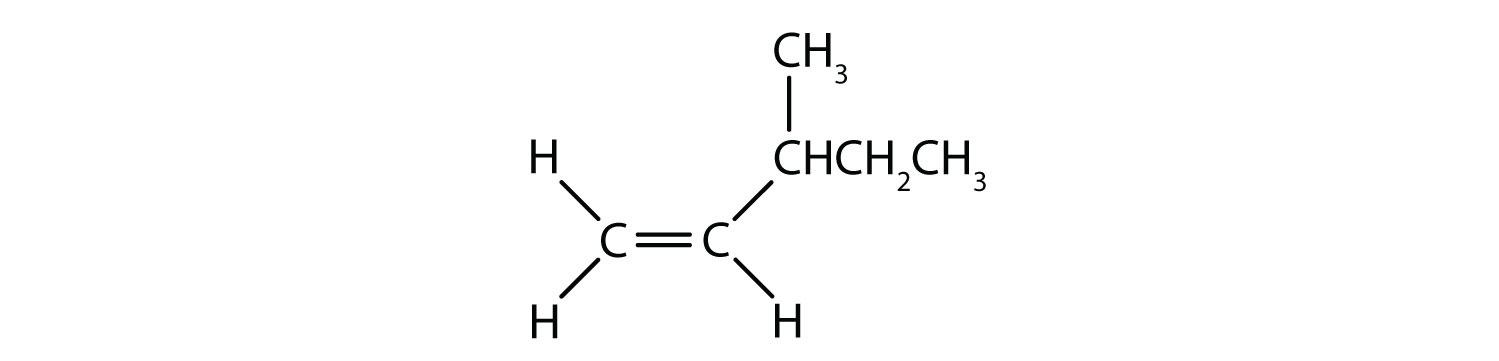
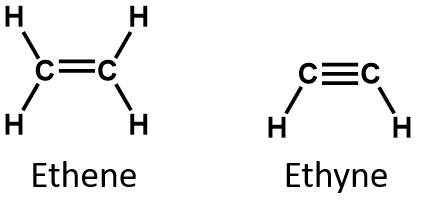
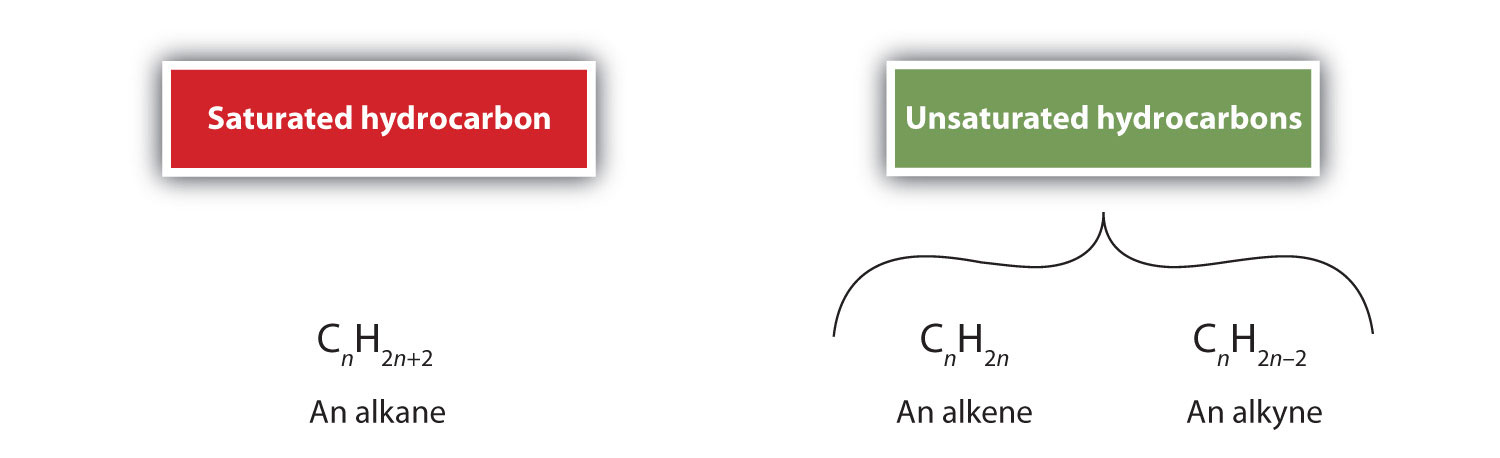
Per definizione, gli alcheni sono idrocarburi con uno o più doppi legami carbonio-carbonio (R2C=CR2), mentre gli alchini sono idrocarburi con uno o più tripli legami carbonio-carbonio (R-C≡C-R). Collettivamente, sono chiamati idrocarburi insaturi, che sono definiti come idrocarburi che hanno uno o più legami multipli (doppi o tripli) tra gli atomi di carbonio. Come risultato della natura del doppio o triplo legame, gli alcheni e gli alchini hanno meno atomi di idrogeno di alcani comparabili con lo stesso numero di atomi di carbonio. Matematicamente, questo può essere indicato dalle seguenti formule generali:
In un alchene, il doppio legame è condiviso dai due atomi di carbonio e non coinvolge gli atomi di idrogeno, anche se la formula condensata non rende questo punto ovvio, cioè la formula condensata per l’etene è CH2CH2. La natura di doppio o triplo legame di una molecola è ancora più difficile da discernere dalle formule molecolari. Si noti che la formula molecolare dell’etene è C2H4, mentre quella dell’etina è C2H2. Quindi, fino a quando non si acquisisce maggiore familiarità con il linguaggio della chimica organica, è spesso più utile disegnare strutture in linea o parzialmente condensate, come mostrato qui sotto:
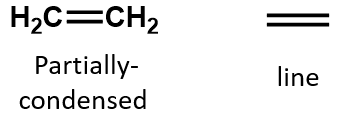
(Torna in alto)
8.2 Proprietà degli alcheni
Le proprietà fisiche degli alcheni sono simili a quelle degli alcani. La tabella 8.1 mostra che i punti di ebollizione degli alcheni a catena lineare aumentano con l’aumentare della massa molare, proprio come per gli alcani. Per molecole con lo stesso numero di atomi di carbonio e la stessa forma generale, i punti di ebollizione di solito differiscono solo leggermente, proprio come ci aspetteremmo per sostanze la cui massa molare differisce solo di 2 u (equivalente a due atomi di idrogeno). Come altri idrocarburi, gli alcheni sono insolubili in acqua ma solubili in solventi organici.
Alcuni alcheni rappresentativi – i loro nomi, strutture e proprietà fisiche – sono dati nella tabella 8.1.
Tabella 8.1 Proprietà fisiche di alcuni alcheni selezionati
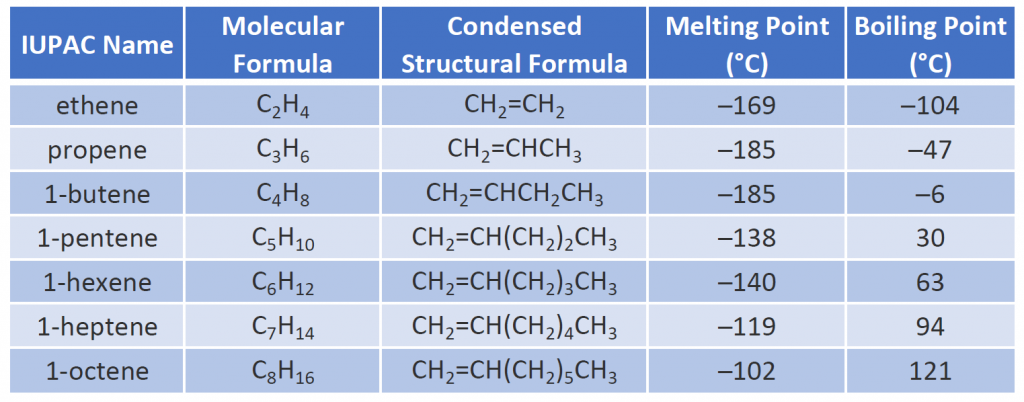
I primi due alcheni della tabella 8.1, l’etene e il propene, sono più spesso chiamati con i loro nomi comuni, rispettivamente etilene e propilene. L’etilene è un importante prodotto chimico commerciale. L’industria chimica statunitense produce circa 25 miliardi di chilogrammi di etilene all’anno, più di qualsiasi altro prodotto chimico organico sintetico. Più della metà di questo etilene va nella fabbricazione del polietilene, una delle plastiche più familiari. Anche il propilene è un importante prodotto chimico industriale. Viene convertito in plastica, alcool isopropilico e una varietà di altri prodotti.
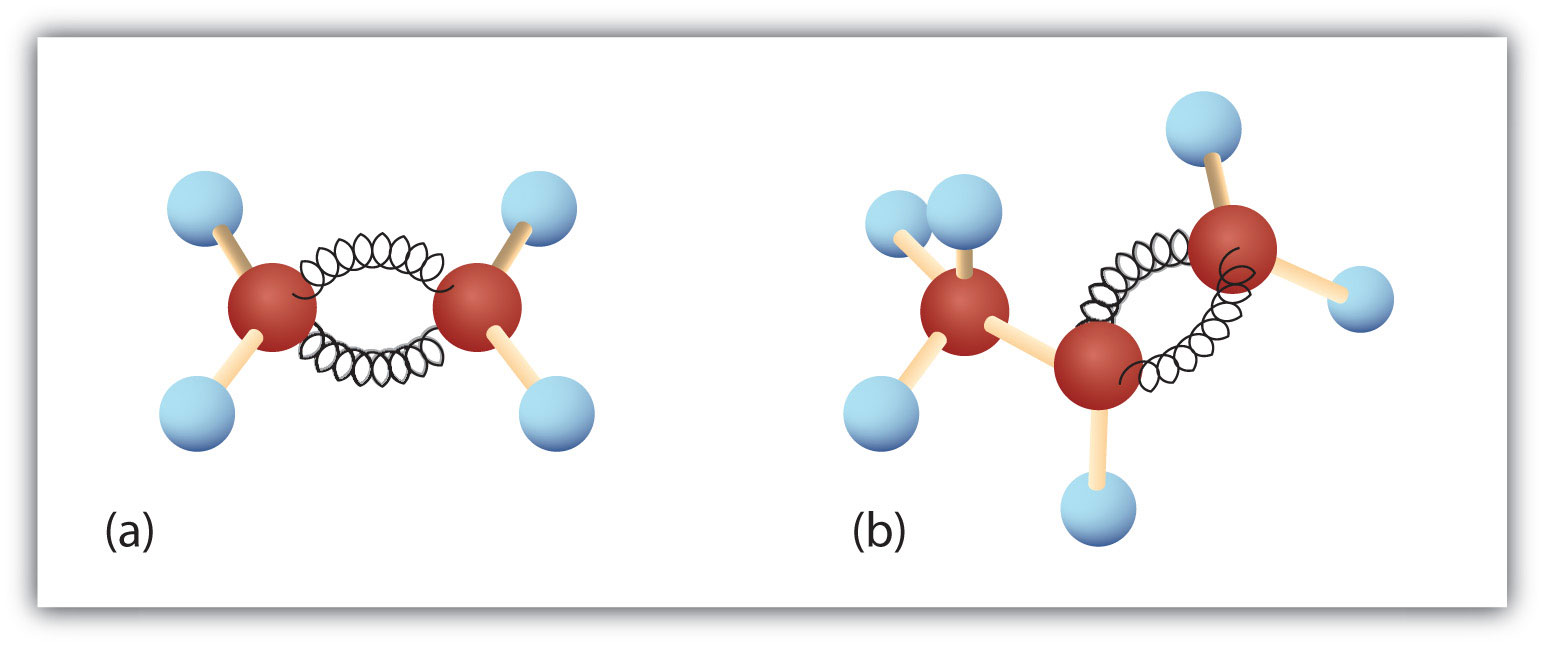
Figura 8.3. Etilene e Propene. I modelli palla-e-molla di etene/etilene (a) e propene/propilene (b) mostrano le loro rispettive forme, specialmente gli angoli di legame.
Guardando più da vicino: Nota ambientale
Gli alcheni si trovano ampiamente in natura. La frutta e la verdura che maturano emettono etilene, che innesca un’ulteriore maturazione. I trasformatori di frutta introducono artificialmente l’etilene per accelerare il processo di maturazione; l’esposizione a soli 0,1 mg di etilene per 24 ore può far maturare 1 kg di pomodori. Sfortunatamente, questo processo non duplica esattamente il processo di maturazione, e i pomodori raccolti verdi e trattati in questo modo non hanno un sapore molto simile a quello dei pomodori appena maturati dal giardino.
Altri alcheni che si trovano in natura includono l’1-octene, un costituente dell’olio di limone, e l’ottadecene (C18H36) che si trova nel fegato di pesce. Dieni (due doppi legami) e polieni (tre o più doppi legami) sono anche comuni. Il butadiene (CH2=CHCH=CH2) si trova nel caffè. Il licopene e i caroteni sono polieni isomerici (C40H56) che danno gli attraenti colori rosso, arancione e giallo a cocomeri, pomodori, carote e altri frutti e verdure. La vitamina A, essenziale per una buona visione, deriva da un carotene. Il mondo sarebbe un posto molto meno colorato senza alcheni.

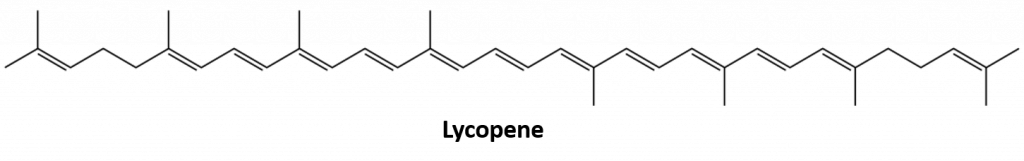
Figura 8.4 Il colore rosso vivo dei pomodori è dovuto al licopene.
Foto da: © Thinkstock; Struttura del licopene da: Jeff Dahl
Esercizi di revisione del concetto
-
Descrivi brevemente le proprietà fisiche degli alcheni. Come si confrontano queste proprietà con quelle degli alcani?
-
Senza consultare le tabelle, disponi i seguenti alcheni in ordine di punto di ebollizione crescente:

Risposte
-
Gli alcheni hanno proprietà fisiche (bassi punti di ebollizione, insolubili in acqua) abbastanza simili a quelle dei loro corrispondenti alcani.
-
Etene < propene < 1-butene < 1-esene
Key Takeaway
- Le proprietà fisiche degli alcheni sono molto simili a quelle degli alcani: i loro punti di ebollizione aumentano all’aumentare della massa molare, e sono insolubili in acqua.
Esercizi
-
Senza fare riferimento ad una tabella o altro riferimento, prevedere quale membro di ogni coppia ha il punto di ebollizione più alto.
- 1-pentene o 1-butene
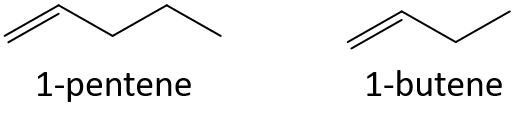
- 3-eptene o 3-nonene
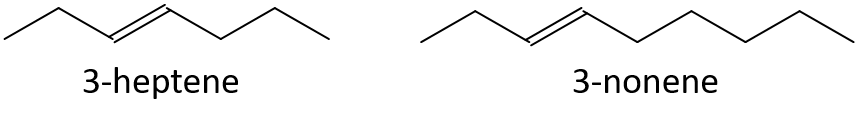
- 1-pentene o 1-butene
-
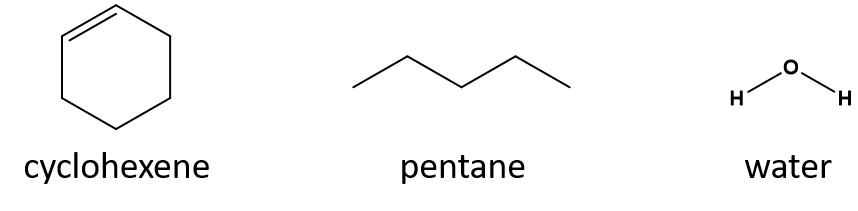
Qual è un buon solvente per il cicloesene? pentano o acqua?
Risposta
-
- 1-pentene
- 3-nonene
Esercizi di ripasso dei concetti
-
Individuare brevemente le distinzioni importanti tra un idrocarburo saturo e uno insaturo.
-
Individuare brevemente le distinzioni importanti tra un alchene e un alcano.
-
Classificare ogni composto come saturo o insaturo. Identificare ciascuno come un alcano, un alchene o un alchene.
-
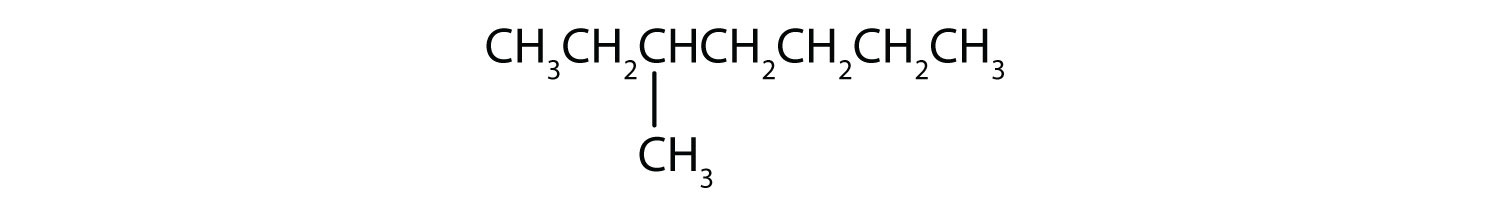
- CH3CH2C≡CCH3
-

-
Risposte
-
Gli idrocarburi insaturi hanno legami doppi o tripli e sono abbastanza reattivi; gli idrocarburi saturi hanno solo legami singoli e sono piuttosto poco reattivi.
-
Un alchene ha un doppio legame; un alcano ha solo legami singoli.
-
- saturo; alcano
- insaturo; alchene
- insaturo; alchene
Presa di coscienza
- Gli alcheni sono idrocarburi con un doppio legame carbonio-carbonio.
8.3 Alceni
Il più semplice alchene – un idrocarburo con triplo legame carbonio-carbonio – ha la formula molecolare C2H2 ed è conosciuto con il suo nome comune – acetilene (Fig 8.5). La sua struttura è H-C≡C-H.
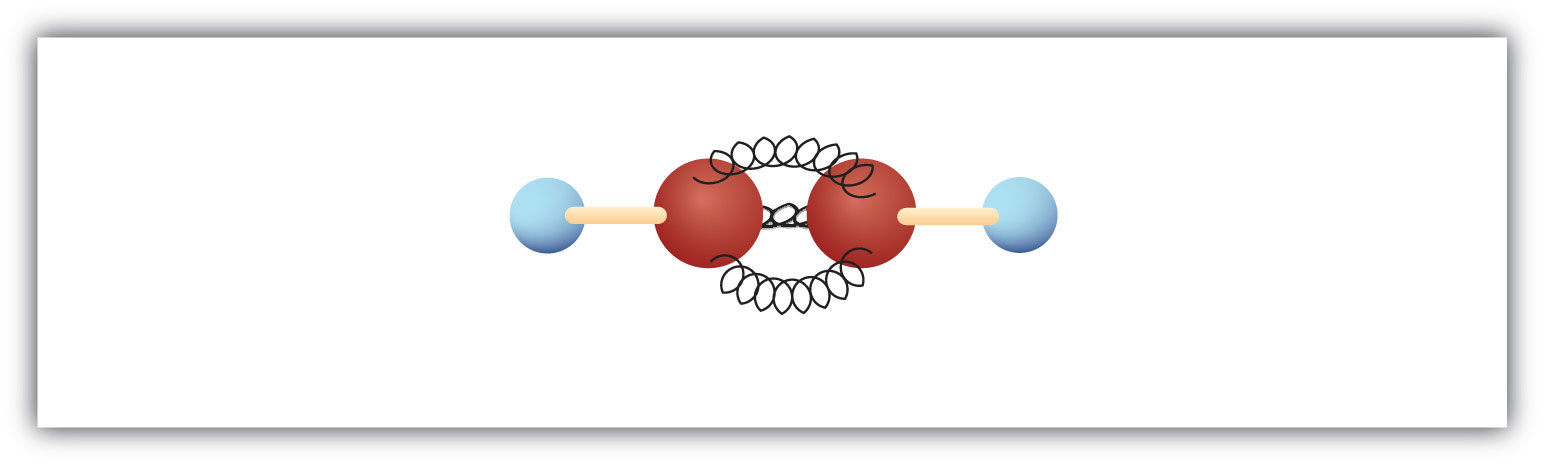
Figura 8.5 Modello a sfera dell’acetilene. L’acetilene (etilene) è il membro più semplice della famiglia degli alcheni.
Nota
L’acetilene è usato in torce ossiacetileniche per tagliare e saldare metalli. La fiamma di tale torcia può essere molto calda. La maggior parte dell’acetilene, tuttavia, è convertito in intermedi chimici che sono usati per fare plastiche viniliche e acriliche, fibre, resine e una varietà di altri prodotti.
Gli alchini sono simili agli alcheni in entrambe le proprietà fisiche e chimiche. Per esempio, gli alchini subiscono molte delle reazioni di addizione tipiche degli alcheni. I nomi dell’Unione Internazionale di Chimica Pura e Applicata (IUPAC) per gli alchini sono paralleli a quelli degli alcheni, eccetto che la terminazione della famiglia è -yne piuttosto che -ene. Il nome IUPAC per l’acetilene è ethyne. I nomi di altri alchini sono illustrati nei seguenti esercizi.
Esercizi di ripasso dei concetti
-
Individuare brevemente le differenze importanti tra un alchene e un alchene. Come sono simili?
-
L’alchene (CH3)2CHCHCH2CH=CH2 è chiamato 4-metil-1-pentene. Qual è il nome di (CH3)2CHCH2C≡CH?
-
Gli alchini mostrano isomerismo cis-trans? Spiegare.
Risposte
-
Gli alcheni hanno doppi legami; gli alchini hanno tripli legami. Entrambi subiscono reazioni di addizione.
-
4-methyl-1-pentyne
-
No; un atomo di carbonio con triplo legame può formare solo un altro legame. Dovrebbe avere due gruppi attaccati per mostrare l’isomerismo cis-trans.
Key Takeaway
- Gli alchini sono idrocarburi con tripli legami carbonio-carbonio e proprietà molto simili a quelle degli alcheni.
Esercizi
-
Disegna la struttura di ogni composto.
- acetilene
- 3-metil-1-esilene
-
Disegna la struttura di ogni composto.
- 4-metil-2-esilene
- 3-octina
-
Nominare ogni alchina.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Risposte
-
- H-C≡C-H
-
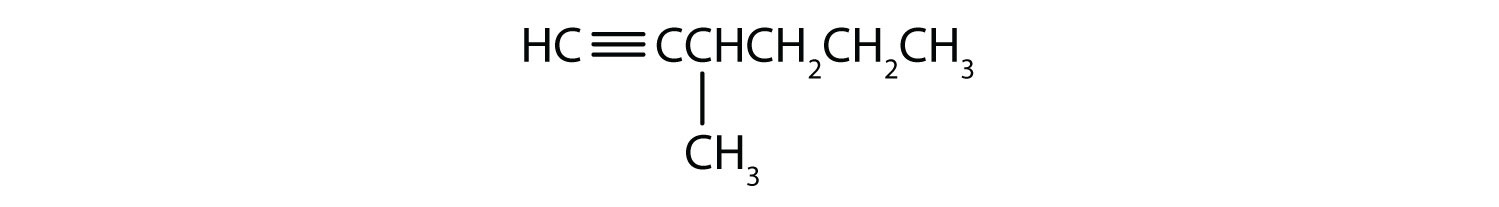
-
- 1-pentyne
- 2-hexyne
(Back to the Top)
8.4 Composti aromatici: Benzene
Prossimo consideriamo una classe di idrocarburi con formule molecolari come quelle degli idrocarburi insaturi, ma che, a differenza degli alcheni, non subiscono facilmente reazioni di addizione. Questi composti comprendono una classe distinta, chiamata idrocarburi aromatici. Gli idrocarburi aromatici sono composti che contengono una struttura ad anello di benzene.Il composto aromatico più semplice è il benzene (C6H6) ed è di grande importanza commerciale, ma ha anche notevoli effetti deleteri sulla salute (vedi “Alla tua salute: il benzene e noi”).
La formula C6H6 sembra indicare che il benzene ha un alto grado di insaturazione. (L’esano, l’idrocarburo saturo con sei atomi di carbonio ha la formula C6H14-otto atomi di idrogeno in più del benzene). Tuttavia, nonostante l’apparente basso livello di saturazione, il benzene è piuttosto poco reattivo. Ciò è dovuto alla struttura di risonanza formata dalla struttura a doppio legame alternato dell’anello aromatico.

Nota
Il benzene è un liquido che odora di benzina, bolle a 80°C e congela a 5,5°C. È l’idrocarburo aromatico prodotto in maggior volume. In passato veniva usato per decaffeinare il caffè ed era un componente significativo di molti prodotti di consumo, come gli sverniciatori, i cementi di gomma e gli smacchiatori per il lavaggio a secco. È stato rimosso da molte formulazioni di prodotti negli anni ’50, ma altri hanno continuato a usare il benzene nei prodotti fino agli anni ’70, quando è stato associato a morti per leucemia. Il benzene è ancora importante nell’industria come precursore nella produzione di plastica (come Styrofoam e nylon), farmaci, detergenti, gomma sintetica, pesticidi e coloranti. È usato come solvente per cose come la pulizia e la manutenzione delle attrezzature di stampa e per gli adesivi come quelli usati per attaccare le suole alle scarpe. Il benzene è un costituente naturale dei prodotti petroliferi, ma poiché è un noto cancerogeno, il suo uso come additivo nella benzina è ora limitato.
alla tua salute: Benzene e Noi
La maggior parte del benzene usato commercialmente proviene dal petrolio. Viene impiegato come materiale di partenza per la produzione di detergenti, farmaci, coloranti, insetticidi e plastica. Una volta ampiamente usato come solvente organico, il benzene è ora noto per avere effetti tossici sia a breve che a lungo termine. L’inalazione di grandi concentrazioni può causare nausea e persino la morte per insufficienza respiratoria o cardiaca, mentre l’esposizione ripetuta porta a una malattia progressiva in cui la capacità del midollo osseo di produrre nuove cellule del sangue viene alla fine distrutta. Questo si traduce in una condizione chiamata anemia aplastica, in cui c’è una diminuzione del numero di globuli rossi e bianchi.
Esercizi di revisione del concetto
-
In che modo le reazioni tipiche del benzene differiscono da quelle degli alcheni?
-
Descrivi brevemente il legame nel benzene.
-
Cosa significa il cerchio nella rappresentazione chimica del benzene?
Risposte
-
Il benzene è piuttosto poco reattivo verso le reazioni di addizione rispetto ad un alchene.
-
Gli elettroni di valenza sono condivisi equamente da tutti i sei atomi di carbonio (cioè, gli elettroni sono delocalizzati).
-
I sei elettroni sono condivisi equamente da tutti e sei gli atomi di carbonio.
Riconoscere i composti aromatici
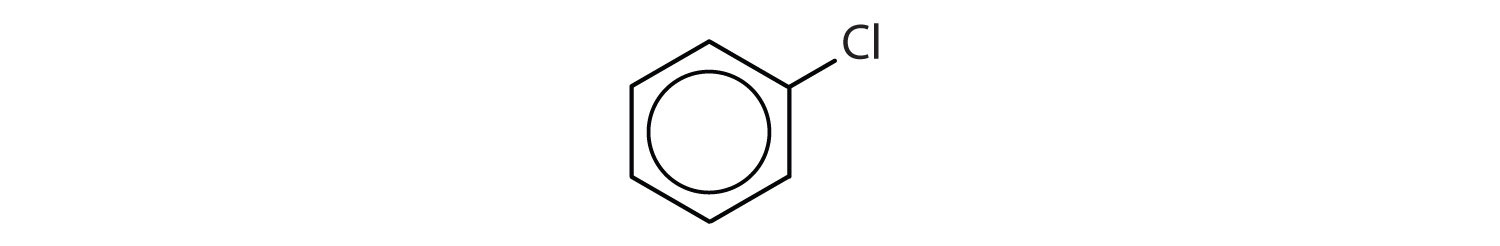
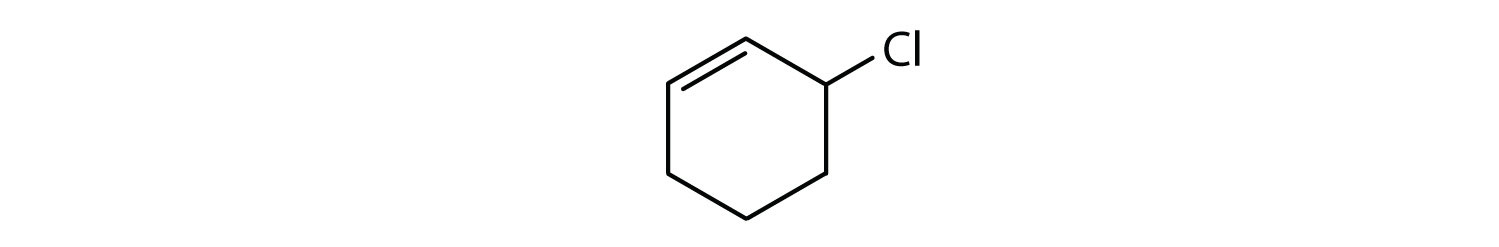
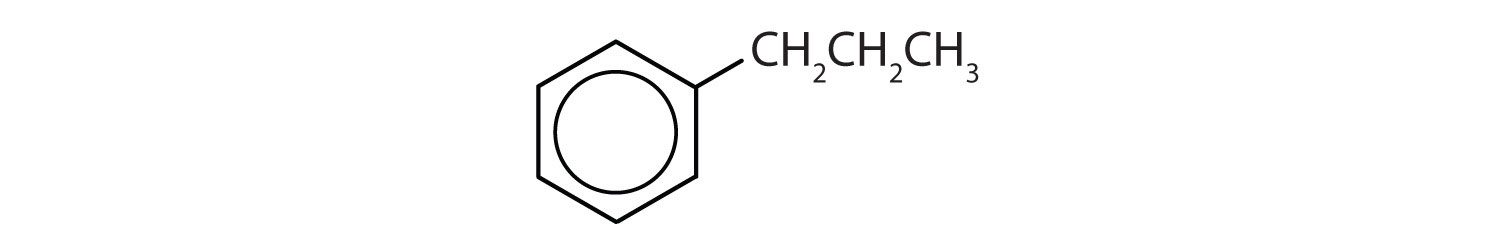
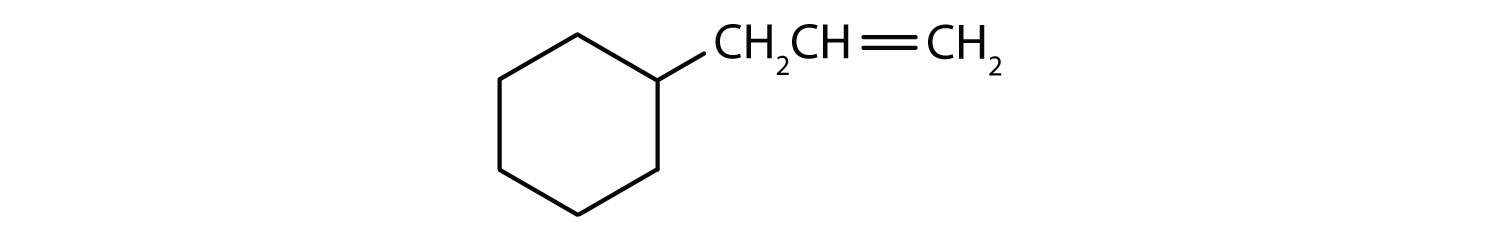
Quali composti sono aromatici?
Soluzione
- Il composto ha un anello benzenico (con un atomo di cloro sostituito ad uno degli atomi di idrogeno); è aromatico.
- Il composto è ciclico, ma non ha un anello benzenico; non è aromatico.
- Il composto ha un anello benzenico (con un gruppo propilico sostituito ad uno degli atomi di idrogeno); è aromatico.
- Il composto è ciclico, ma non ha un anello benzenico; non è aromatico.
Esercizio di costruzione delle abilità
Quali composti sono aromatici?
-
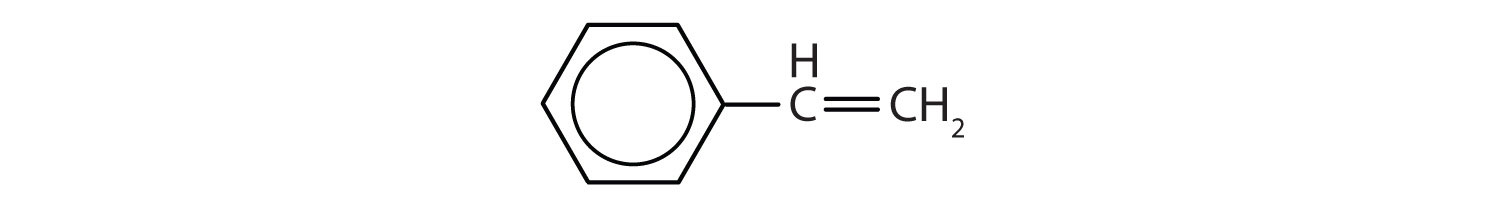
-
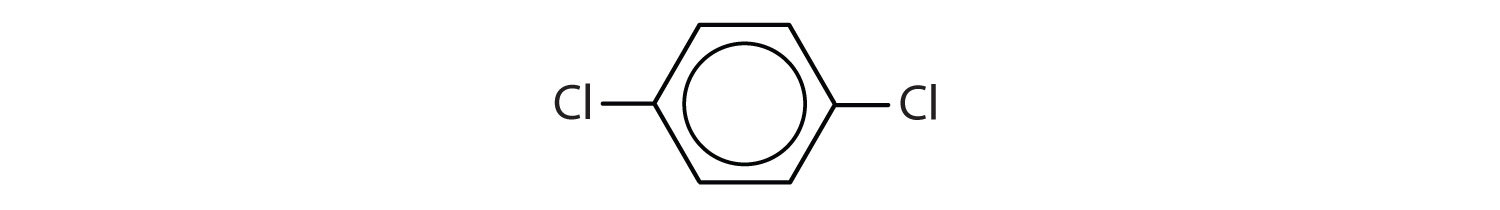
Nel sistema dell’Unione internazionale di chimica pura e applicata (IUPAC), gli idrocarburi aromatici sono chiamati come derivati del benzene. Cinque esempi sono mostrati qui sotto. In queste strutture, è irrilevante se il singolo sostituente è scritto nella parte superiore, laterale o inferiore dell’anello: un esagono è simmetrico, e quindi tutte le posizioni sono equivalenti.
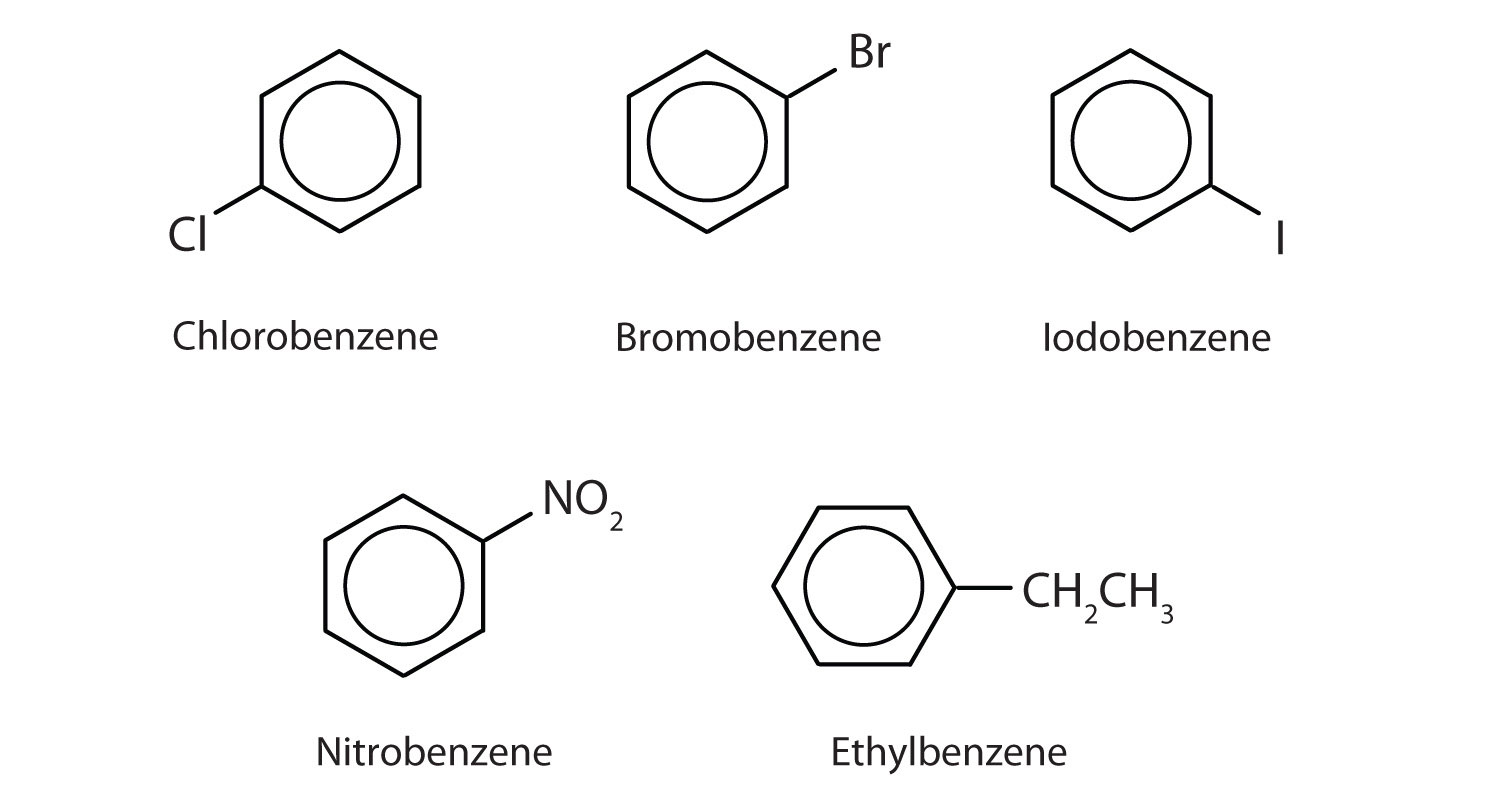
Questi composti sono nominati nel solito modo con il gruppo che sostituisce un atomo di idrogeno nominato come un gruppo sostituente: Cl come cloro, Br come bromo, I come iodo, NO2 come nitro, e CH3CH2 come etile.
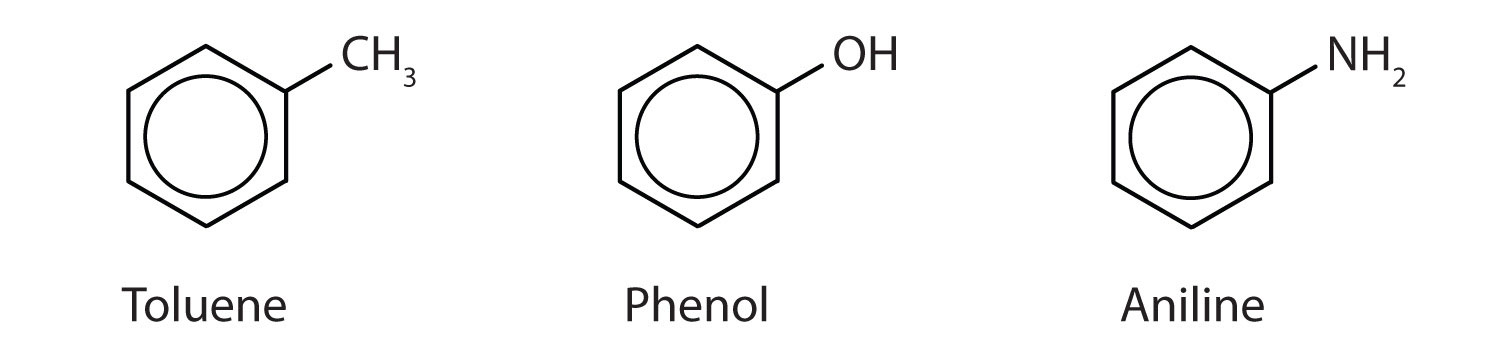
Anche se alcuni composti sono indicati esclusivamente con nomi IUPAC, alcuni sono più frequentemente indicati con nomi comuni, come è indicato di seguito.
Presa di coscienza
- Gli idrocarburi aromatici sembrano essere insaturi, ma hanno un tipo speciale di legame e non subiscono reazioni di addizione.
-
(Back to the Top)
Idrocarburi aromatici policiclici
Alcuni idrocarburi aromatici comuni consistono in anelli benzenici fusi che condividono un lato comune. Questi composti sono chiamati idrocarburi aromatici policiclici (IPA)Un idrocarburo aromatico costituito da anelli di benzene fusi che condividono un lato comune..
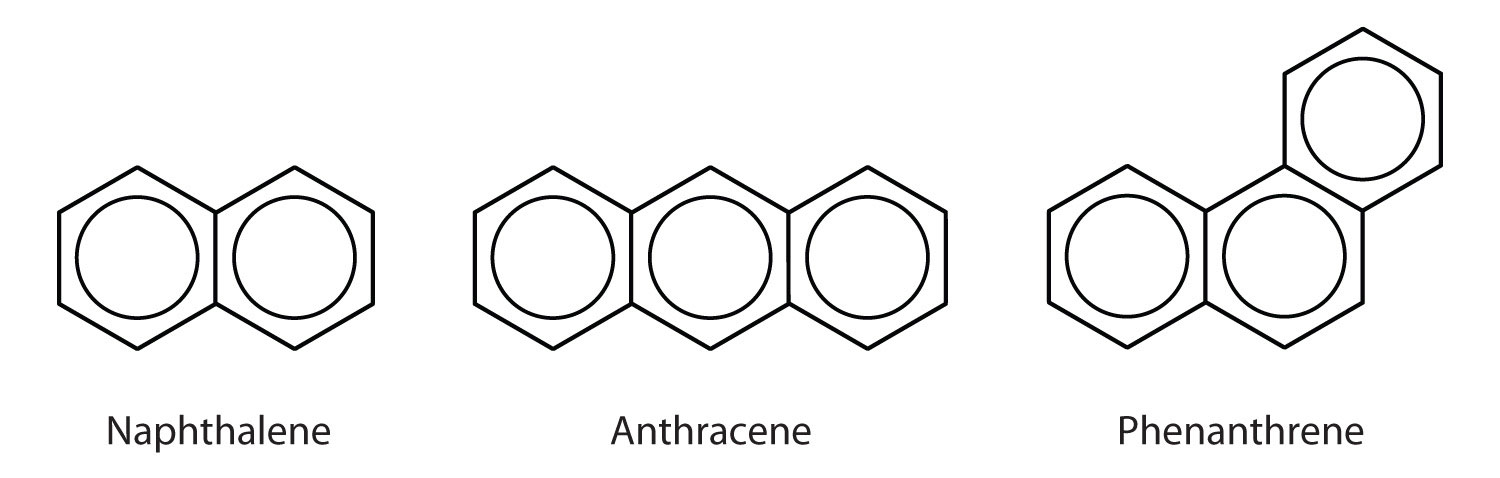
I tre esempi mostrati qui sono incolori, solidi cristallini generalmente ottenuti dal catrame di carbone. Il naftalene ha un odore pungente ed è usato nelle palline antitarme. L’antracene è usato nella fabbricazione di alcuni coloranti. Gli steroidi, compreso il colesterolo e gli ormoni, estrogeni e testosterone, contengono la struttura del fenantrene.
Alla tua salute: Idrocarburi Policiclici Aromatici e Cancro
L’intenso riscaldamento necessario per distillare il catrame di carbone provoca la formazione di IPA. Da molti anni si sa che i lavoratori delle raffinerie di catrame di carbone sono suscettibili a un tipo di cancro della pelle noto come cancro del catrame. Le indagini hanno dimostrato che un certo numero di IPA sono cancerogeni. Uno dei composti cancerogeni più attivi, il benzopirene, si trova nel catrame di carbone ed è stato isolato anche dal fumo di sigaretta, dal fumo di marijuana, dai gas di scarico delle automobili e dalle bistecche cotte al carbone. Si stima che più di 1.000 tonnellate di benzopirene siano emesse nell’aria degli Stati Uniti ogni anno. Solo pochi milligrammi di benzopirene per chilogrammo di peso corporeo sono necessari per indurre il cancro negli animali da esperimento.
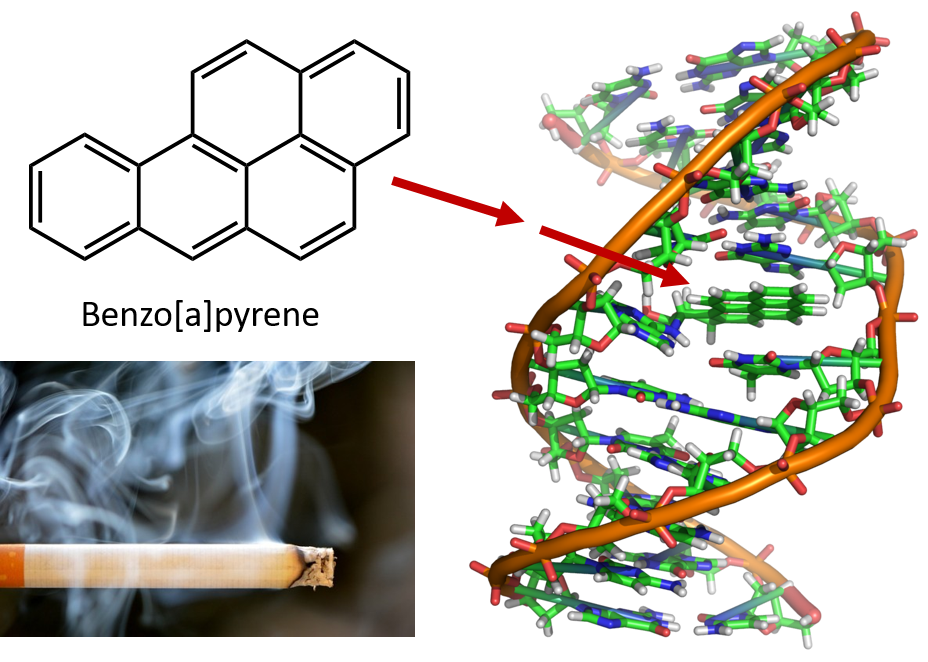
Figura 8.6 Il benzopirene è un idrocarburo aromatico policiclico prodotto come sottoprodotto nel catrame di carbone, nel fumo di sigarette e marijuana, e nelle bistecche alla brace. Il benzopirene viene metabolizzato per produrre composti biologicamente attivi che possono formare addotti fisici sulle molecole di DNA. Questi addotti possono causare mutazioni genetiche che causano il cancro.
Foto di fumo di sigaretta
Composti biologicamente importanti con anelli di benzene
Sostanze contenenti l’anello di benzene sono comuni sia negli animali che nelle piante, sebbene siano più abbondanti in queste ultime. Le piante possono sintetizzare l’anello benzenico da anidride carbonica, acqua e materiali inorganici. Gli animali non possono sintetizzarlo, ma dipendono da certi composti aromatici per la sopravvivenza e quindi devono ottenerli dal cibo. Fenilalanina, tirosina e triptofano (aminoacidi essenziali) e le vitamine K, B2 (riboflavina) e B9 (acido folico) contengono tutti l’anello benzenico. Molti farmaci importanti, alcuni dei quali sono mostrati nella tabella 8.2, presentano anche un anello benzenico.
Nota
Finora abbiamo studiato solo i composti aromatici con anelli contenenti carbonio. Tuttavia, molti composti ciclici hanno un elemento diverso dagli atomi di carbonio nell’anello. Le strutture organiche ad anello che contengono un atomo diverso dal carbonio sono chiamate composti eterociclici, I composti aromatici eterociclici hanno anche proprietà uniche e rilevanti dal punto di vista medico.
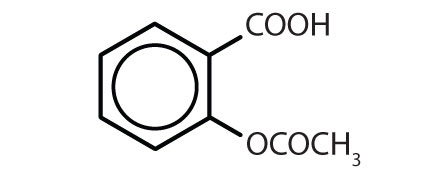
Tabella 8.2 Alcuni farmaci che contengono un anello di benzene
| Nome | Struttura |
|---|---|
| aspirina |
 |
| acetaminofene |
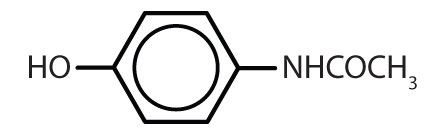 |
| ibuprofene |
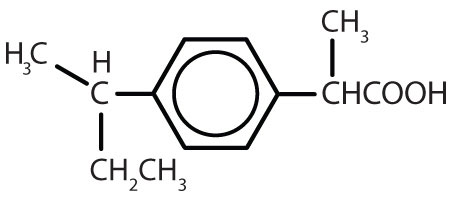 |
| amphetamine |
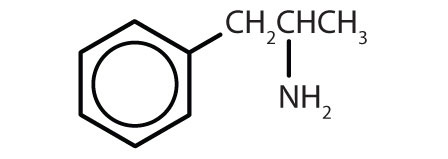 |
| sulfanilamide |
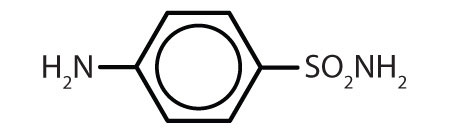 |
8.5 Isomeri geometrici
Nella struttura degli alcani c’è una rotazione libera intorno ai singoli legami carbonio-carbonio (C-C). Al contrario, la struttura degli alcheni richiede che gli atomi di carbonio formino un doppio legame. I doppi legami tra elementi sono creati usando gusci di orbitali p (chiamati anche orbitali pi). Questi gusci orbitali hanno la forma di manubri piuttosto che gli orbitali circolari usati nei legami singoli. Questo impedisce la libera rotazione degli atomi di carbonio intorno al doppio legame, poiché causerebbe la rottura del doppio legame durante la rotazione (Figura 8.7). Quindi, un legame singolo è analogo a due tavole inchiodate insieme con un solo chiodo. Le tavole sono libere di girare intorno al singolo chiodo. Un doppio legame, d’altra parte, è analogo a due tavole inchiodate insieme con due chiodi. Nel primo caso si possono torcere le tavole, mentre nel secondo caso non si possono torcere.

Figura 8.7 La formazione di doppi legami richiede l’uso di legami pi. Affinché le molecole creino doppi legami, gli elettroni devono condividere pi-orbitali sovrapposti tra i due atomi. Questo richiede che i pi-orbitali a forma di manubrio (mostrati a sinistra) rimangano in una conformazione fissa durante la formazione del doppio legame. Questo permette la formazione di orbitali elettronici che possono essere condivisi da entrambi gli atomi (mostrati a destra). La rotazione intorno al doppio legame causerebbe il disallineamento degli orbitali pi, rompendo il doppio legame.
Diagramma fornito da: JoJanderivative work – Vladsinger (talk)
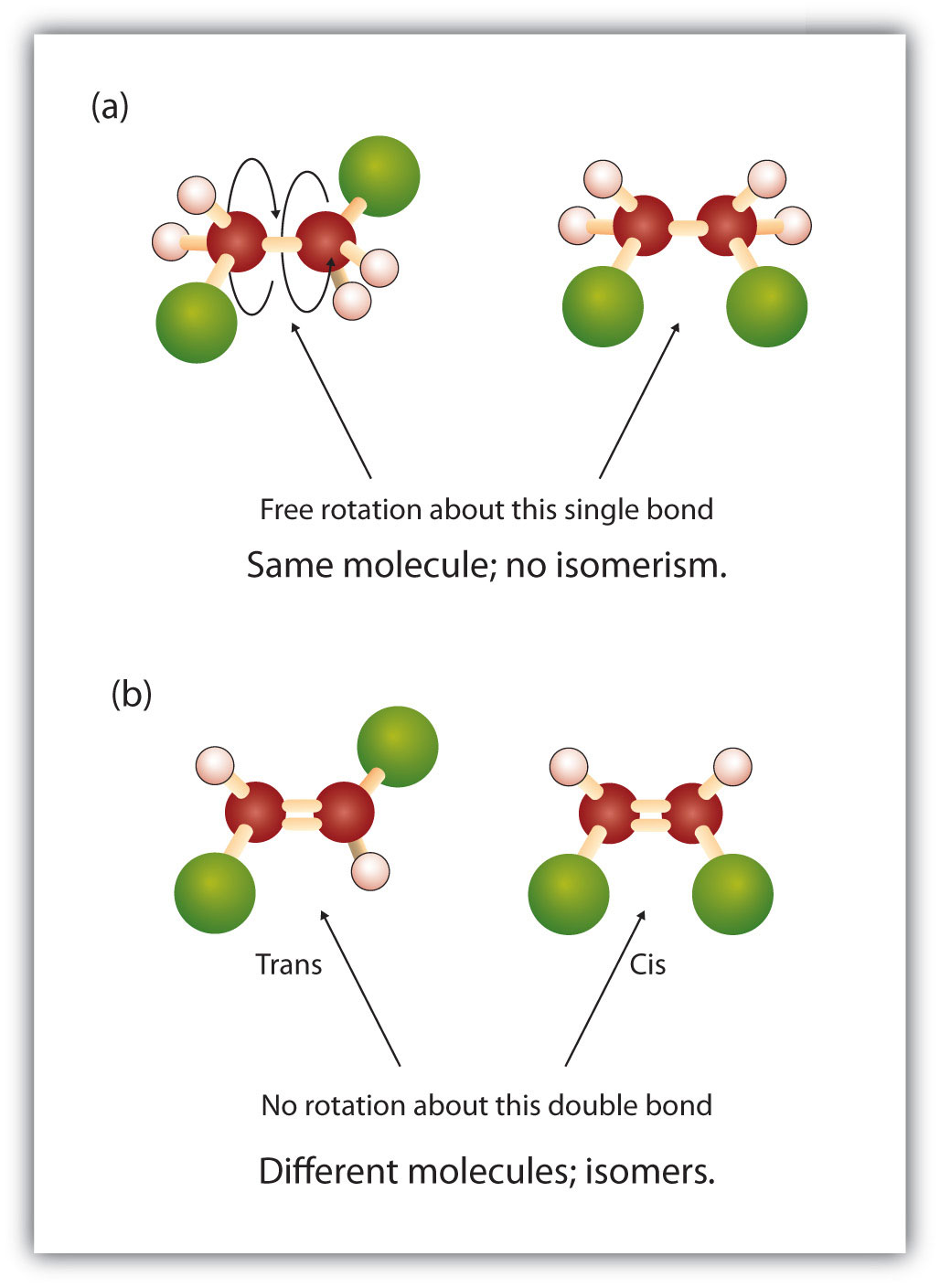
La natura fissa e rigida del doppio legame crea la possibilità di un ulteriore centro chirale, e quindi, il potenziale per gli stereoisomeri. Nuovi stereoisomeri si formano se ciascuno dei carboni coinvolti nel doppio legame ha due diversi atomi o gruppi attaccati ad esso. Per esempio, guardate i due idrocarburi clorurati nella figura 8.8. Nella figura superiore, è mostrato l’alcano alogenato. La rotazione intorno a questo legame carbonio-carbonio è possibile e non risulta in diverse conformazioni isomeriche. Nella figura inferiore, l’alcano alogenato ha una rotazione limitata intorno al doppio legame. Si noti anche che ogni carbonio coinvolto nel doppio legame è anche attaccato a due atomi diversi (un idrogeno e un cloro). Così, questa molecola può formare due stereoisomeri: uno che ha i due atomi di cloro sullo stesso lato del doppio legame, e l’altro dove i clorini risiedono su lati opposti del doppio legame.
Figura 8.8 I doppi legami alchenici possono formare isomeri geometrici. (a) Mostra la rotazione libera intorno a un singolo legame carbonio-carbonio nella struttura dell’alcano. (b) Mostra la posizione fissa del doppio legame carbonio-carbonio che porta agli isomeri geometrici (spaziali).
Clicca qui per un video tutorial di Kahn Academy sulla struttura degli alcheni.
Per questa sezione, non ci occupiamo della denominazione che è anche inclusa in questo video tutorial.(Nota: Tutti i contenuti di Khan Academy sono disponibili gratuitamente con licenza CC-BY-NC-SA su www.khanacademy.org )
Nomenclatura cis-trans
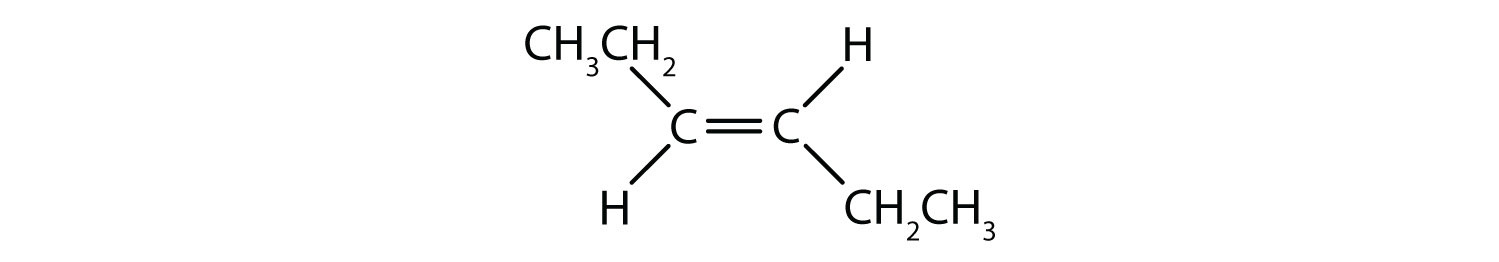
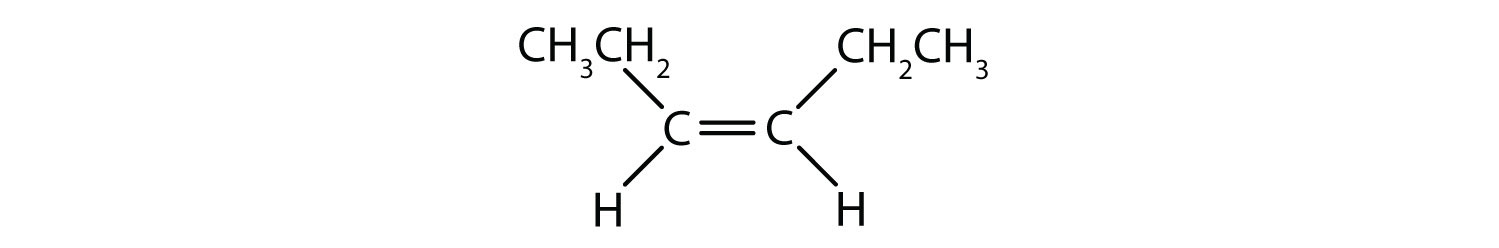
Il sistema di denominazione cis-trans può essere usato per distinguere isomeri semplici, dove ogni carbonio del doppio legame ha una serie di gruppi identici attaccati ad esso. Per esempio, nella figura 8.8b, ogni carbonio coinvolto nel doppio legame, ha un cloro attaccato ad esso, e ha anche un idrogeno attaccato ad esso. Il sistema cis e trans, identifica se i gruppi identici sono sullo stesso lato (cis) del doppio legame o se sono sul lato opposto (trans) del doppio legame. Per esempio, se gli atomi di idrogeno sono sul lato opposto del doppio legame, si dice che il legame è in conformazione trans. Quando i gruppi di idrogeno sono sullo stesso lato del doppio legame, il legame si dice che è in conformazione cis. Notate che si potrebbe anche dire che se entrambi i gruppi di cloro sono sul lato opposto del doppio legame, la molecola è in conformazione trans o se sono sullo stesso lato del doppio legame, la molecola è in conformazione cis.
Per determinare se una molecola è cis o trans, è utile tracciare una linea tratteggiata lungo il centro del doppio legame e poi cerchiare i gruppi identici, come mostrato in figura 8.9. Entrambe le molecole mostrate in figura 8.9, sono denominate 1,2-dicloroetilene. Così, la designazione cis e trans, definisce solo la stereochimica intorno al doppio legame, non cambia l’identità generale della molecola. Tuttavia, gli isomeri cis e trans hanno spesso proprietà fisiche e chimiche diverse, a causa della natura fissa dei legami nello spazio.
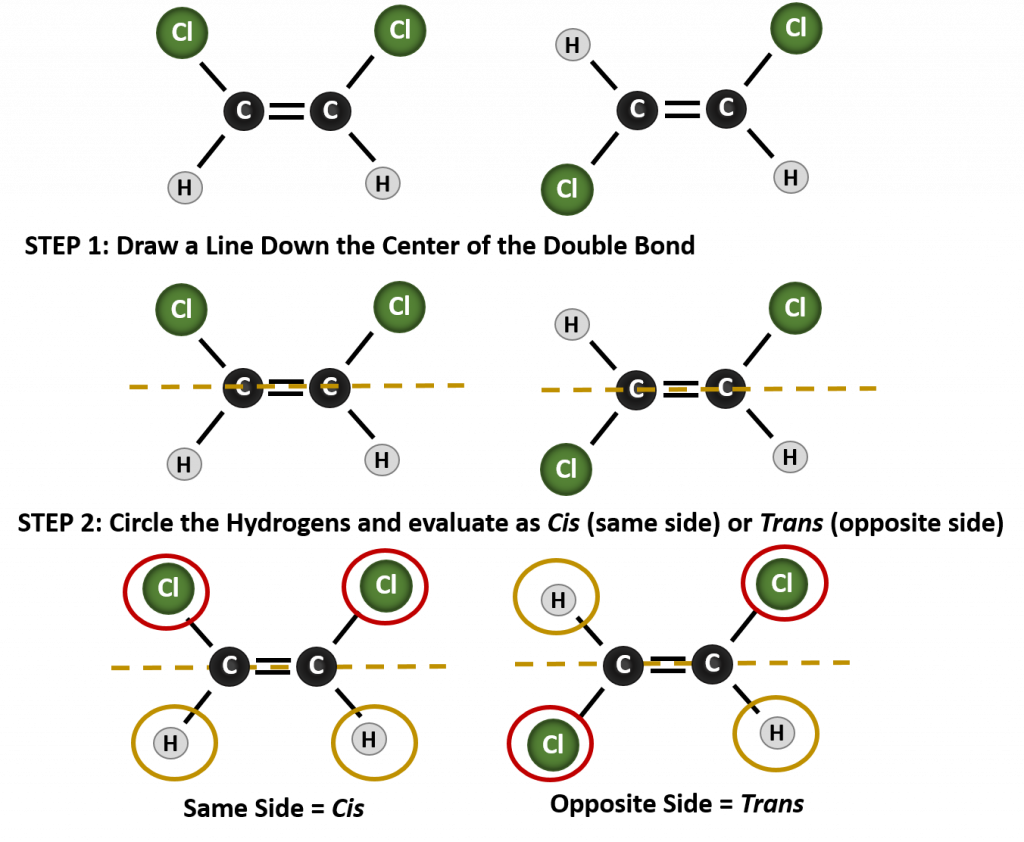
Figura 8.9 Una guida per determinare le conformazioni cis o trans.
Clicca qui per un video tutorial di Kahn Academy sull’isomerizzazione Cis/Trans
(Nota: Tutti i contenuti di Khan Academy sono disponibili gratuitamente con licenza CC-BY-NC-SA su www.khanacademy.org )
L’isomerismo Cis-trans si verifica anche nei composti ciclici. Nelle strutture ad anello, i gruppi non sono in grado di ruotare su nessuno dei legami carbonio-carbonio dell’anello. Pertanto, i gruppi possono trovarsi sullo stesso lato dell’anello (cis) o su lati opposti dell’anello (trans). Per i nostri scopi qui, rappresentiamo tutti i cicloalcani come strutture planari, e indichiamo le posizioni dei gruppi, sia sopra che sotto il piano dell’anello.

Alla tua salute
Possibilmente il posto più comune in cui sentirete riferimento alle conformazioni cis-trans nella vita quotidiana è al supermercato o nello studio del vostro medico. Si riferisce al nostro consumo di grassi alimentari. Il consumo inappropriato o eccessivo di grassi alimentari è stato collegato a molti disturbi di salute, come il diabete e l’aterosclerosi, e le malattie coronariche. Quindi, quali sono le differenze tra i grassi saturi e insaturi e quali sono i grassi trans e perché sono così preoccupanti per la salute?

Figura 8.10 Fonti comuni di grassi alimentari.
Foto da: TyMaHe
La forma più comune di grassi alimentari e il principale costituente del grasso corporeo negli esseri umani e in altri animali sono i trigliceridi (TAG). I TAG, come mostrato in figura 8.10, sono costruiti da una molecola di glicerolo e tre molecole di acidi grassi che sono legati insieme da un legame estere. In questa sezione, ci concentreremo sulla struttura delle lunghe code degli acidi grassi, che possono essere composte da strutture alcano o alcheno. Il capitolo 10 si concentrerà maggiormente sulla formazione dei legami esteri.

Figura 8.11. Esempio di struttura di un trigliceride (TAG). Si noti che ogni trigliceride ha tre acidi grassi a catena lunga che si estendono dalla spina dorsale del glicerolo. Ogni acido grasso può avere diversi gradi di saturazione e insaturazione.
Struttura adattata da: Wolfgang Schaefer
I grassi che sono completamente saturi avranno solo acidi grassi con code di alcani a catena lunga. Si dice che sono “saturi” di atomi di idrogeno. I grassi saturi sono comuni nella dieta americana e si trovano nella carne rossa, nei prodotti caseari come il latte, il formaggio e il burro, nell’olio di cocco e si trovano in molti prodotti da forno. I grassi saturi sono tipicamente solidi a temperatura ambiente. Questo perché gli alcani a catena lunga possono impilarsi insieme avendo più forze di dispersione intermolecolari di Londra. Questo dà ai grassi saturi punti di fusione e di ebollizione più alti rispetto ai grassi insaturi che si trovano in molti oli vegetali.
La maggior parte dei grassi insaturi che si trovano in natura sono nella conformazione cis, come mostrato nella Figura 8.11. Notate che gli acidi grassi mostrati nella figura 8.11 sono disegnati per comodità, in modo che siano facili da guardare e non occupino troppo spazio sulla carta, ma gli angoli di legame scritti non rappresentano adeguatamente il vero orientamento spaziale delle molecole. Quando gli acidi grassi del TAG mostrato in figura 8.11 sono disegnati con angoli di legame corretti, è facile vedere che i legami cis-doppi causano curve nella catena alchenica (Fig. 8.12).
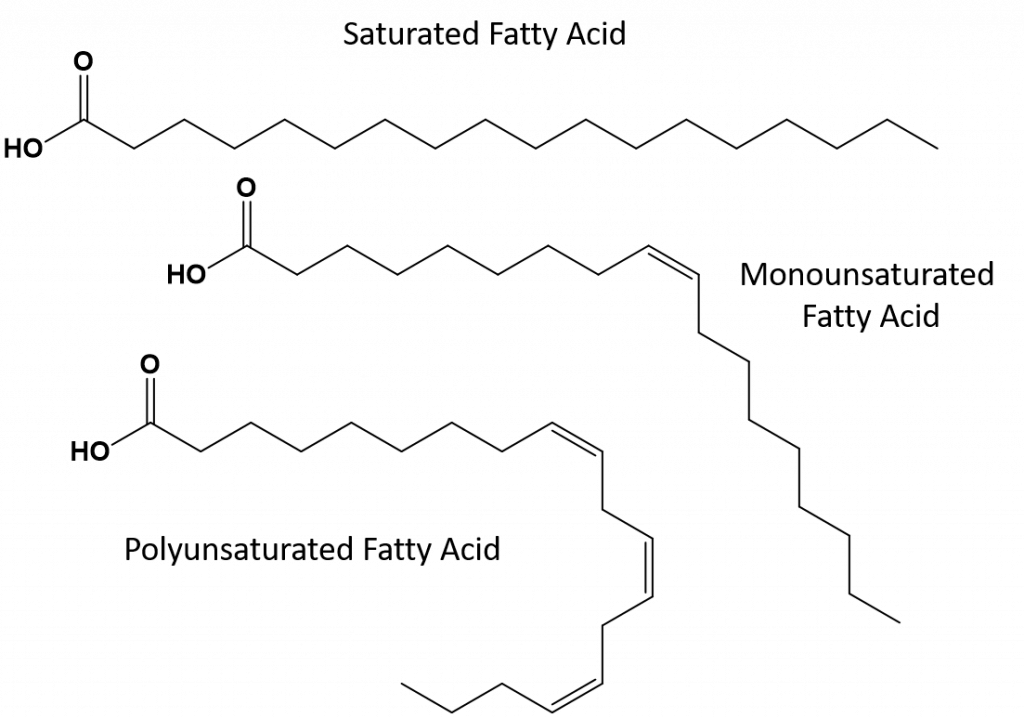
Figura 8.12 I doppi legami Cis causano curve nella struttura degli acidi grassi
Quindi, i grassi monoinsaturi e polinsaturi non possono impilarsi insieme così facilmente e non hanno così tante forze attrattive intermolecolari rispetto ai grassi saturi. Di conseguenza, hanno punti di fusione e di ebollizione più bassi e tendono ad essere liquidi a temperatura ambiente. È stato dimostrato che la riduzione o la sostituzione dei grassi saturi con grassi mono- e polinsaturi nella dieta, aiuta a ridurre i livelli della forma di colesterolo a bassa densità (LDL), che è un fattore di rischio per le malattie coronariche.
I grassi trans, d’altra parte, contengono doppi legami che sono nella conformazione trans. Così, la forma degli acidi grassi è lineare, simile ai grassi saturi. I grassi trans hanno anche punti di fusione e di ebollizione simili a quelli dei grassi saturi. Tuttavia, a differenza dei grassi saturi, i grassi trans non si trovano comunemente in natura e hanno un impatto negativo sulla salute. I grassi trans si presentano principalmente come un sottoprodotto nella lavorazione degli alimenti (principalmente il processo di idrogenazione per creare margarine e accorciamenti) o durante la cottura, specialmente la frittura. Infatti, molti fast food usano i grassi trans nel loro processo di frittura, poiché i grassi trans possono essere usati molte volte prima di dover essere sostituiti. Il consumo di grassi trans aumenta i livelli di colesterolo LDL nel corpo (il colesterolo cattivo che è associato alle malattie coronariche) e tende ad abbassare il colesterolo lipoproteico ad alta densità (HDL) (il colesterolo buono nel corpo). Il consumo di grassi trans aumenta il rischio di malattie cardiache e ictus, e di sviluppo del diabete di tipo II. Il rischio è stato così altamente correlato che molti paesi hanno vietato l’uso di grassi trans, tra cui Norvegia, Svezia, Austria e Svizzera. Negli Stati Uniti, la Food and Drug Administration (FDA) ha recentemente approvato una misura per eliminare gradualmente l’uso di grassi trans negli alimenti entro il 2018. Si stima che questa misura possa prevenire 20.000 attacchi di cuore e 7.000 morti all’anno.
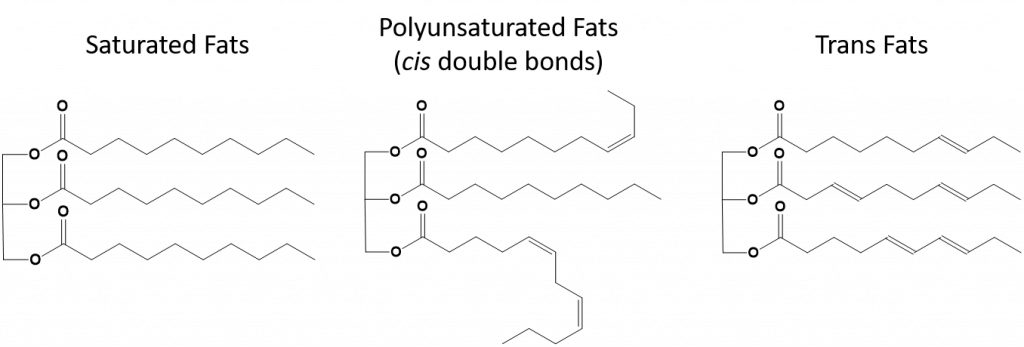
Figura 8.13 Differenze strutturali nei grassi saturi, polinsaturi e trans.
Clicca qui per un video tutorial di Kahn Academy sui grassi saturi, insaturi e trans
(Nota: Tutti i contenuti di Khan Academy sono disponibili gratuitamente con licenza CC-BY-NC-SA su www.khanacademy.org )
Fattori chiave per determinare l’isomerizzazione Cis/Trans
- Il composto deve contenere un doppio o triplo legame, o avere una struttura ad anello che non permette la libera rotazione attorno al legame carbonio-carbonio.
- Il composto deve avere due gruppi non identici attaccati ad ogni carbonio coinvolto nel doppio o triplo legame carbonio-carbonio.
Esempio lavorato
Quali composti possono esistere come isomeri cis-trans (geometrici)? Disegnali.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CH2CH3
Soluzione
Tutte e quattro le strutture hanno un doppio legame e quindi soddisfano la regola 1 dell’isomerismo cis-trans.
-
Questo composto soddisfa la regola 2; ha due gruppi non identici su ogni atomo di carbonio (H e Cl su uno e H e Br sull’altro). Esiste come isomero sia cis che trans:

- Questo composto ha due atomi di idrogeno su uno dei suoi atomi di carbonio doppiamente legati; non rispetta la regola 2 e non esiste come isomero cis e trans.

- Questo composto ha due gruppi metilici (CH3) su uno dei suoi atomi di carbonio doppiamente legati. Non rispetta la regola 2 e non esiste come isomero cis e trans.

-
Questo composto soddisfa la regola 2; ha due gruppi non identici su ogni atomo di carbonio ed esiste come isomero cis e trans:

Esercizio di costruzione delle abilità
-
Quali composti possono esistere come isomeri cis-trans? Disegnali.
- CH2=CH2CH2CH3
- CH3CH=CH2CH3
- CH3CH2CH=CH2CH3
-
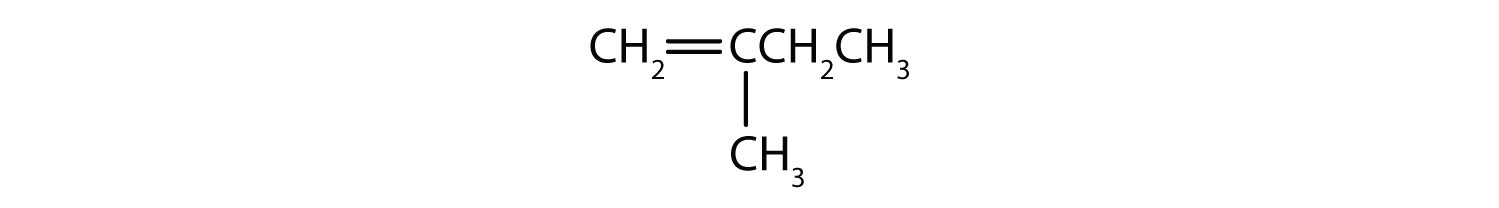
-
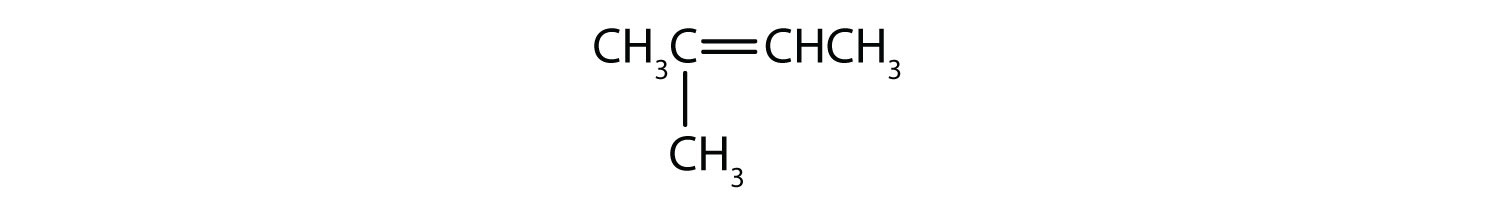
Esercizi di ripasso dei concetti
-
Cosa sono gli isomeri cis-trans (geometrici)? Quali due tipi di composti possono mostrare un isomerismo cis-trans?
-
Classifica ogni composto come un isomero cis, un isomero trans, o nessuno dei due.
-
Risposte
-
Cis-Gli isomeri trans sono composti che hanno configurazioni diverse (gruppi permanentemente in posti diversi nello spazio) a causa della presenza di una struttura rigida nella loro molecola. Gli alcheni e i composti ciclici possono mostrare un isomerismo cis-trans.
-
- trans
- cis
- cis
- né
Key Takeaway
- Cis-trans (geometrico) isomerismo esiste quando c’è una rotazione limitata in una molecola e ci sono due gruppi diversi su ogni atomo di carbonio coinvolto nel legame chimico.
(Back to the Top)
Nomenclatura E-Z
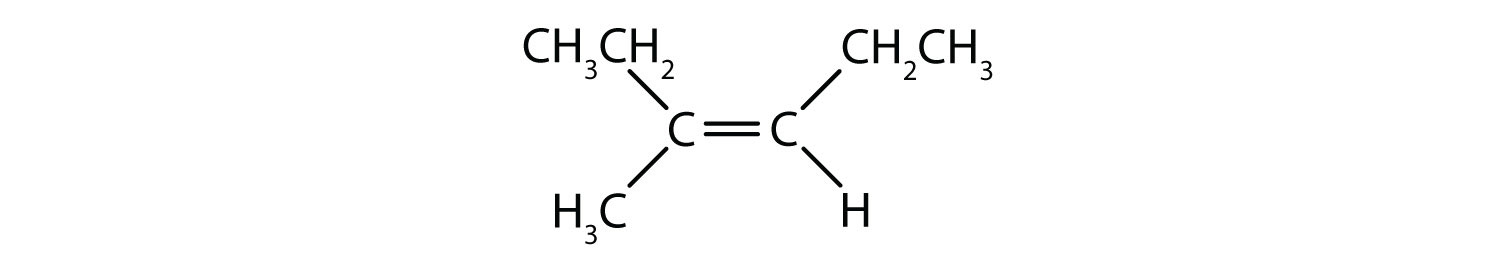
La situazione diventa più complessa quando ci sono 4 gruppi diversi attaccati agli atomi di carbonio coinvolti nella formazione del doppio legame. Il sistema di denominazione cis-trans non può essere usato in questo caso, perché non c’è alcun riferimento a quali gruppi sono descritti dalla nomenclatura. Per esempio, nella molecola qui sotto, si potrebbe dire che il cloro è trans al gruppo del bromo, o si potrebbe dire che il cloro è cis al gruppo del metile (CH3). Quindi, scrivere semplicemente cis o trans in questo caso non delinea chiaramente l’orientamento spaziale dei gruppi in relazione al doppio legame.
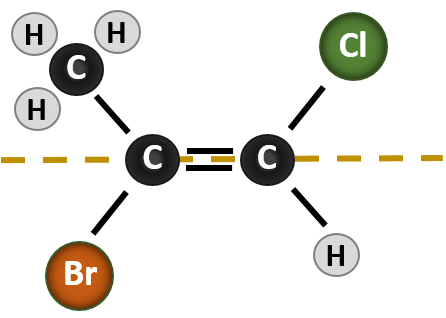
Nominare i diversi stereoisomeri formati in questa situazione, richiede la conoscenza delle regole di priorità. Ricordiamo dal capitolo 5 che nel sistema di priorità Cahn-Ingold-Prelog (CIP), i gruppi che sono attaccati al carbonio chirale hanno la priorità in base al loro numero atomico (Z). Gli atomi con un numero atomico più alto (più protoni) hanno una priorità maggiore (cioè S > P > O > N > C > H). Per questo sistema di nomenclatura si usano le denominazioni (Z) e (E) invece del sistema cis/trans. (E) deriva dalla parola tedesca entgegen, o opposto. Così, quando i gruppi a più alta priorità sono sul lato opposto del doppio legame, si dice che il legame è nella conformazione (E). (Z), d’altra parte, deriva dalla parola tedesca zusammen, o insieme. Così, quando i gruppi a più alta priorità sono sullo stesso lato del doppio legame, si dice che il legame è in conformazione (Z). La figura 8.14 mostra i passi utilizzati per assegnare le conformazioni (E) o (Z) di una molecola.
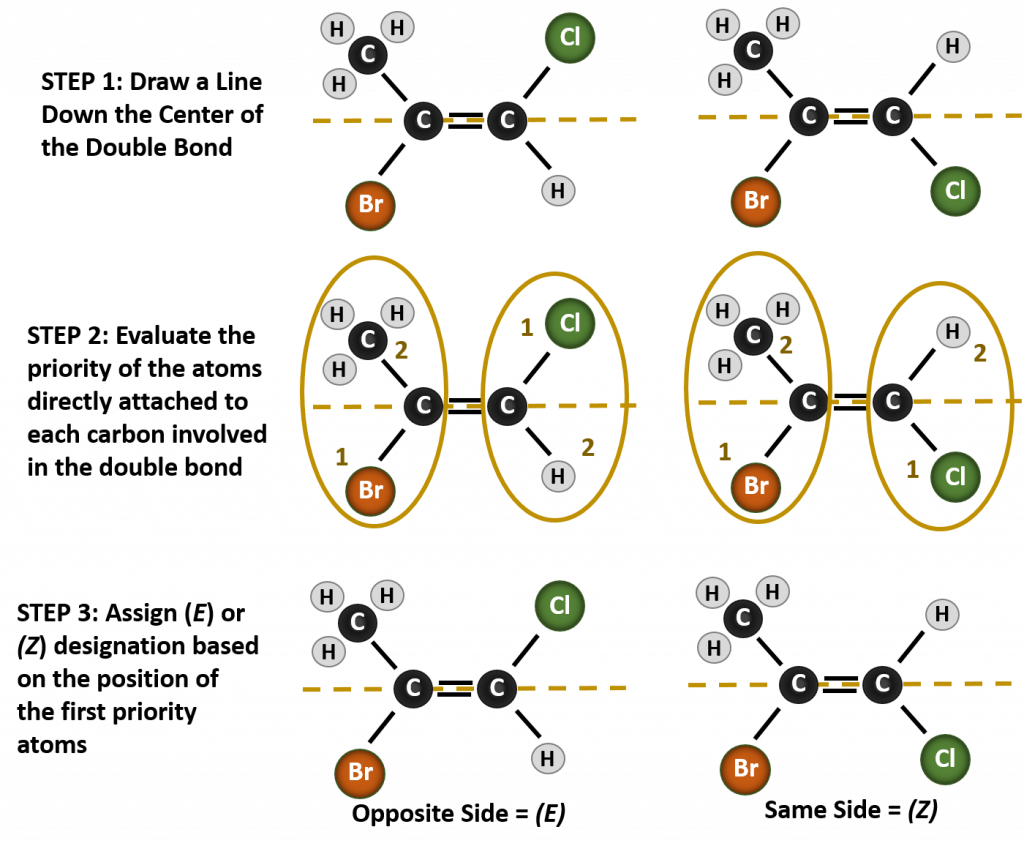
Figura 8.14 Passi utilizzati per assegnare le conformazioni (E) e (Z).
Clicca qui per un video tutorial di Kahn Academy sull’isomerizzazione E/Z.
(Nota: Tutti i contenuti di Khan Academy sono disponibili gratuitamente con licenza CC-BY-NC-SA su www.khanacademy.org )