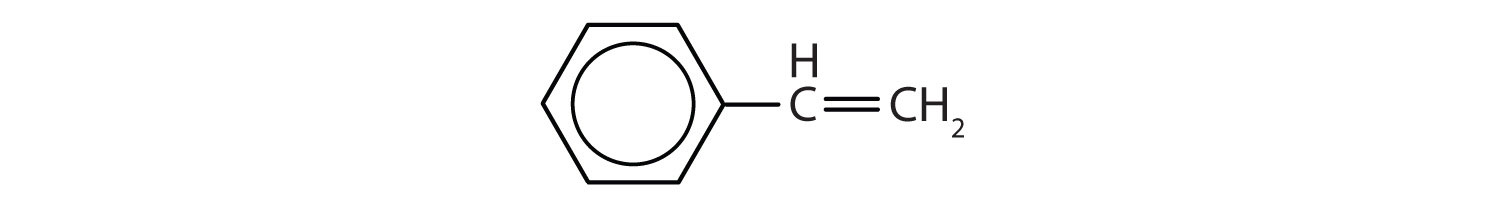
Aromatiske carbonhydrider er defineret ved at have seks-ledede ringstrukturer med vekslende dobbeltbindinger (fig. 8.2).
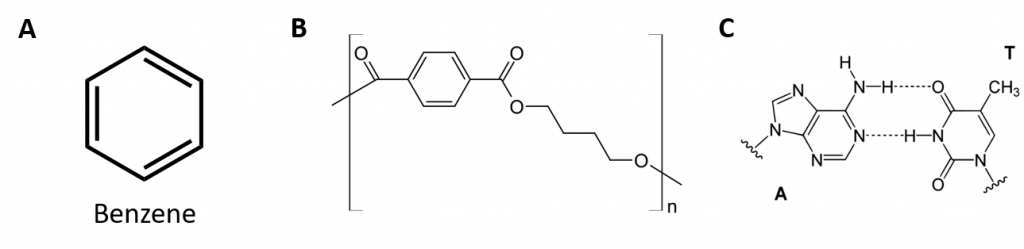
Figur 8.2: Aromatiske carbonhydrider. Aromatiske kulbrinter indeholder den 6-gliedrede benzenringstruktur (A), der er karakteriseret ved vekslende dobbeltbindinger. Ultradur, PBT er en plastpolymer, der indeholder en aromatisk funktionel gruppe. Den gentagende monomer i Ultradur er vist i (B). Ultradur kan findes i brusehoveder, tandbørstehår, plasthuse til fiberoptiske kabler og i ydre og indre komponenter i biler. Biologisk vigtige molekyler, såsom desoxyribonukleinsyre, DNA (C), indeholder også aromatiske ringstrukturer.
Som følge heraf har de formler, der kan tegnes som cykliske alkener, hvilket gør dem umættede. På grund af den cykliske struktur er de aromatiske ringers egenskaber imidlertid generelt helt anderledes, og de opfører sig ikke som typiske alkener. Aromatiske forbindelser tjener som grundlag for mange lægemidler, antiseptiske midler, sprængstoffer, opløsningsmidler og plast (f.eks. polyestere og polystyren).
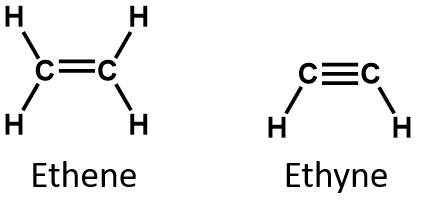
De to enkleste umættede forbindelser – ethylen (ethen) og acetylen (ethen) – blev engang brugt som bedøvelsesmidler og blev introduceret på det medicinske område i 1924. Det blev imidlertid opdaget, at acetylen danner eksplosive blandinger med luft, så den medicinske anvendelse blev opgivet i 1925. Ethylen blev anset for at være mere sikkert, men det var også involveret i adskillige dødelige brande og eksplosioner under anæstesi. Alligevel forblev det et vigtigt anæstetikum indtil 1960’erne, hvor det blev erstattet af ikke-brændbare anæstetika som halothan (CHBrClCF3).
- (Tilbage til toppen)
- 8.1 Oversigt over alkener og alkyne
- (Tilbage til toppen)
- 8.2 Alkenernes egenskaber
- Nærmere kigget: Miljøbemærkning
- Begrebsgennemgang Øvelser
- Svar
- Key Takeaway
- Opgaver
- Svar
- Begrebsgennemgang øvelser
- Svar
- Key Takeaway
- 8.3 Alkyner
- Note
- Begrebsgennemgang øvelser
- Nøgleopfattelse
- Opgaver
- (Tilbage til toppen)
- 8.4 Aromatiske forbindelser: Benzen
- Note
- Til dit helbred: Benzen og os
- Concept Review Exercises
- Rekognoscering af aromatiske forbindelser
- Skill-Building Exercise
- Key Takeaway
- (Tilbage til toppen)
- Polycykliske aromatiske kulbrinter
- Til dit helbred: Polycykliske aromatiske kulbrinter og kræft
- Biologisk vigtige forbindelser med benzenringe
- Note
- 8.5 Geometriske isomerer
- Klik her for at se en Kahn Academy-video-vejledning om alkenstruktur.
- Cis-Trans-nomenklatur
- Klik her for en Kahn Academy-videovejledning om Cis/Trans-isomerisering
- Til dit helbred
- Klik her for at få en Kahn Academy-videovejledning om mættede-, umættede- og transfedtstoffer
- Nøglefaktorer til bestemmelse af Cis/Trans-isomerisering
- Arbejdet eksempel
- Skill-Building Exercise
- Begrebsgennemgang øvelser
- Svar
- Key Takeaway
- (Tilbage til toppen)
- E-Z Nomenklatur
- Klik her for at få en Kahn Academy-videovejledning om E/Z-isomerisering.
- (Tilbage til toppen)
(Tilbage til toppen)
8.1 Oversigt over alkener og alkyne
På definition er alkener kulbrinter med en eller flere kulstof-kulstof-dobbeltbindinger (R2C=CR2), mens alkyner er kulbrinter med en eller flere kulstof-kulstof-dobbeltbindinger (R-C≡C-R). Tilsammen kaldes de umættede kulbrinter, som defineres som kulbrinter med en eller flere flerbindinger (dobbelt- eller trippelbindinger) mellem kulstofatomer. Som følge af dobbelt- eller trippelbindingernes karakter har alkener og alkyner færre hydrogenatomer end sammenlignelige alkaner med det samme antal kulstofatomer. Matematisk kan dette angives ved følgende generelle formler:
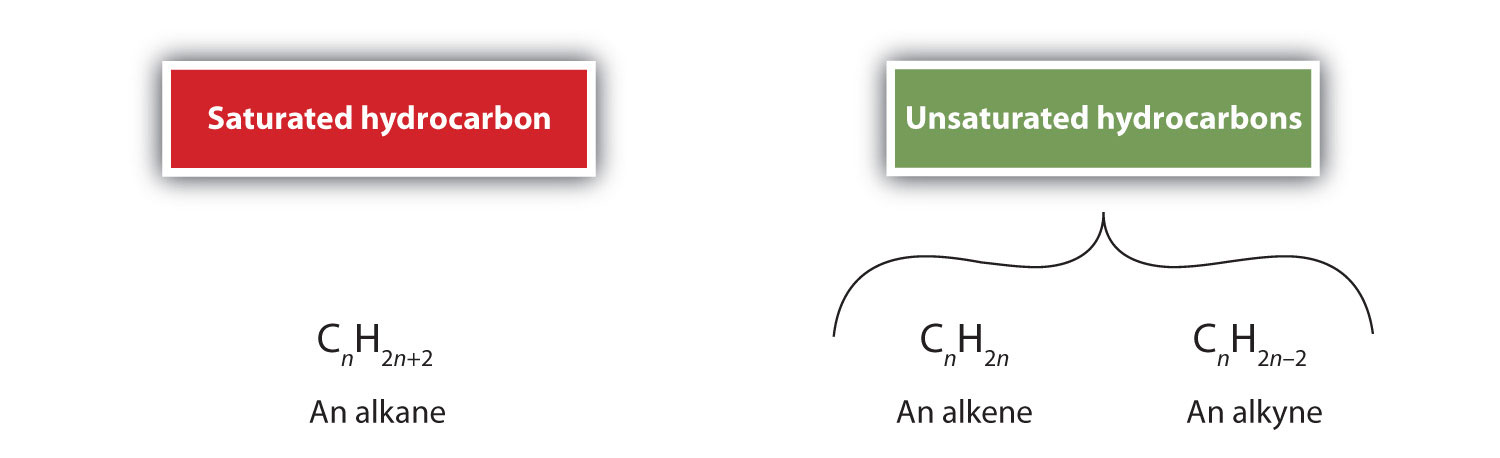
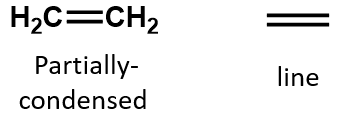
I en alken deles dobbeltbindingen af de to kulstofatomer og involverer ikke hydrogenatomerne, selv om den kondenserede formel ikke gør dette punkt tydeligt, dvs. den kondenserede formel for ethen er CH2CH2. Det er endnu vanskeligere at afgøre, om et molekyle er dobbelt- eller trippelbundet eller ej, ud fra molekylformlerne. Bemærk, at molekylformlen for ethen er C2H4, mens den for ethen er C2H2. Indtil du bliver mere fortrolig med den organiske kemis sprog, er det derfor ofte mest nyttigt at tegne linjestrukturer eller delvist kondenserede strukturer op, som vist nedenfor:
(Tilbage til toppen)
8.2 Alkenernes egenskaber
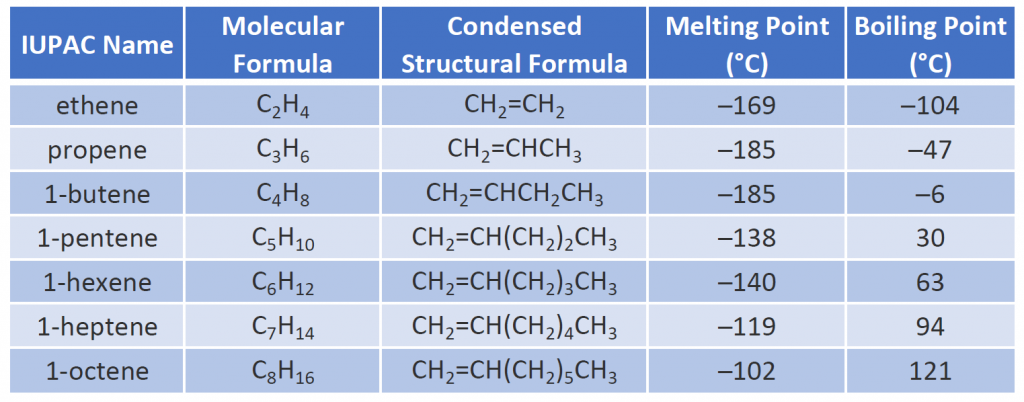
Alkenernes fysiske egenskaber svarer til alkanernes egenskaber. Tabel 8.1 viser, at kogepunkterne for retkædede alkener stiger med stigende molarmasse, ligesom for alkanerne. For molekyler med samme antal kulstofatomer og samme generelle form afviger kogepunkterne normalt kun lidt fra hinanden, ligesom vi ville forvente for stoffer, hvis molarmasse kun adskiller sig med 2 u (svarende til to brintatomer). Ligesom andre kulbrinter er alkenerne uopløselige i vand, men opløselige i organiske opløsningsmidler.
Nogle repræsentative alkener – deres navne, strukturer og fysiske egenskaber – er angivet i tabel 8.1.
Tabel 8.1 Fysiske egenskaber for nogle udvalgte alkener
De to første alkener i tabel 8.1 -ethen og propen, kaldes oftest ved deres almindelige navne – henholdsvis ethylen og propylen. Ethylen er et vigtigt kommercielt kemikalie. Den amerikanske kemiske industri producerer ca. 25 mia. kg ethylen årligt, hvilket er mere end noget andet syntetisk organisk kemikalie. Mere end halvdelen af dette ethylen går til fremstilling af polyethylen, en af de mest kendte plasttyper. Propylen er også et vigtigt industrikemikalie. Det omdannes til plast, isopropylalkohol og en række andre produkter.
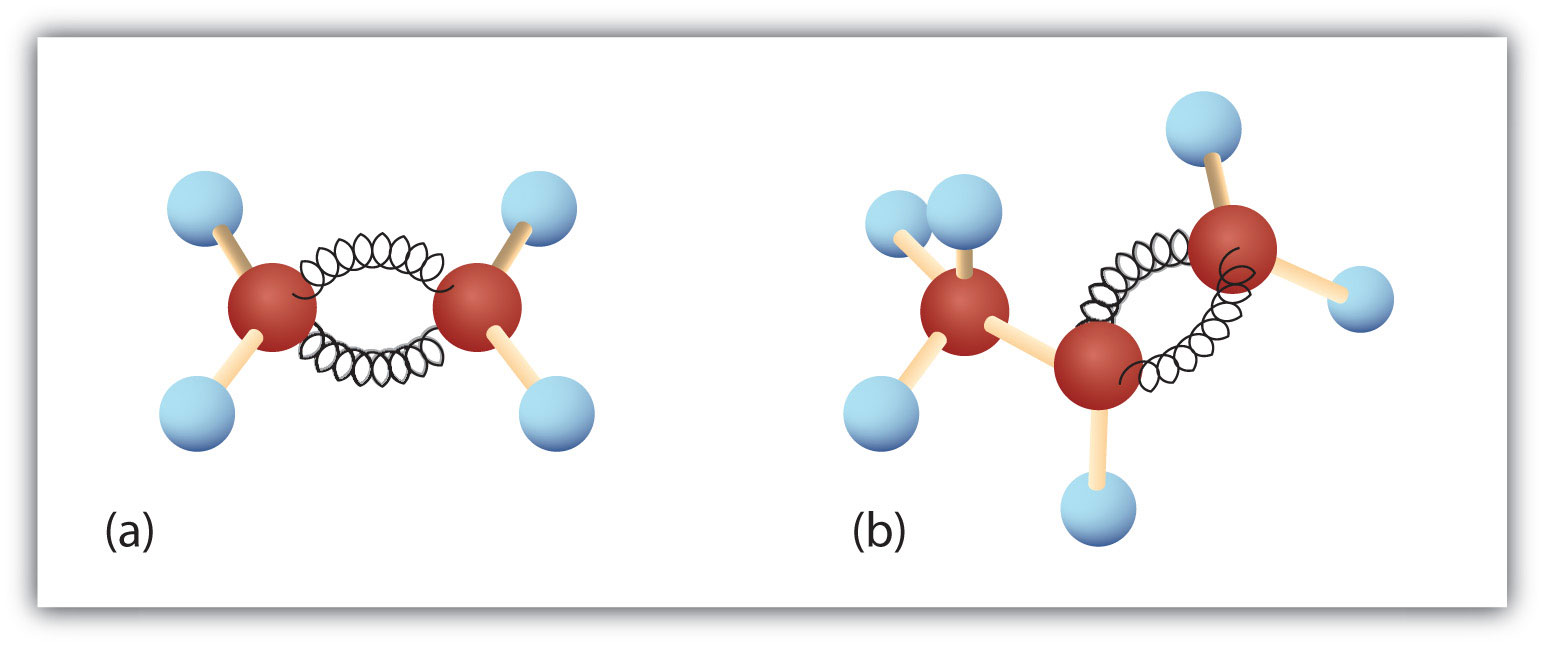
Figur 8.3. Ethen og propen. Kugle- og fjedermodellerne af ethen/ethylen (a) og propen/propylen (b) viser deres respektive former, især bindingsvinklerne.
Nærmere kigget: Miljøbemærkning
Alkener forekommer i stor udstrækning i naturen. Modnende frugter og grøntsager afgiver ethylen, som udløser yderligere modning. Frugtforarbejdningsvirksomheder tilfører kunstigt ethylen for at fremskynde modningsprocessen; udsættelse for så lidt som 0,1 mg ethylen i 24 timer kan modne 1 kg tomater. Desværre er denne proces ikke nøjagtigt en kopi af modningsprocessen, og tomater, der er plukket grønne og behandlet på denne måde, smager ikke meget som vinmodne tomater frisk fra haven.
Andre alkener, der forekommer i naturen, omfatter 1-octen, en bestanddel af citronolie, og octadecen (C18H36), der findes i fiskelever. Diener (to dobbeltbindinger) og polyener (tre eller flere dobbeltbindinger) er også almindelige. Butadien (CH2=CHCHCHCH=CH2) findes i kaffe. Lycopen og carotenerne er isomere polyener (C40H56), som giver vandmeloner, tomater, gulerødder og andre frugter og grøntsager deres flotte røde, orange og gule farver. A-vitamin, der er vigtigt for et godt syn, stammer fra et caroten. Verden ville være et langt mindre farverigt sted uden alkener.

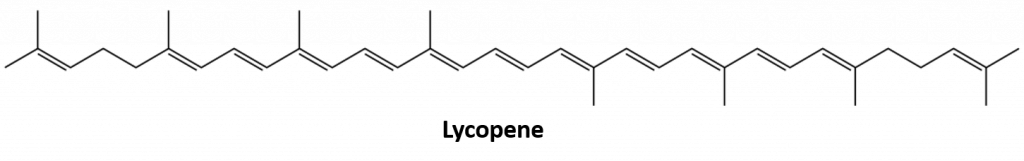
Figur 8.4 Den knaldrøde farve i tomater skyldes lycopen.
Foto fra : © Thinkstock; Lycopenstruktur fra: Jeff Dahl
Begrebsgennemgang Øvelser
-
Beskriv kort de fysiske egenskaber ved alkener. Hvordan kan disse egenskaber sammenlignes med alkanernes egenskaber?
-
Og ordnér følgende alkener i rækkefølge efter stigende kogepunkt uden at konsultere tabeller:

Svar
-
Alkener har fysiske egenskaber (lavt kogepunkt, uopløselige i vand), som minder meget om de tilsvarende alkaners egenskaber.
-
ethen <propen < 1-buten < 1-hexen
Key Takeaway
- Alkenernes fysiske egenskaber minder meget om alkanernes: deres kogepunkt stiger med stigende molarmasse, og de er uopløselige i vand.
Opgaver
-
Forudsig uden at henvise til en tabel eller anden reference, hvilket medlem af hvert par der har det højeste kogepunkt.
- 1-penten eller 1-buten
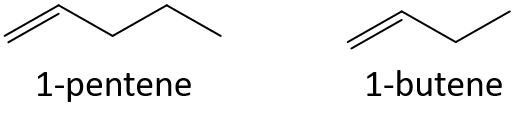
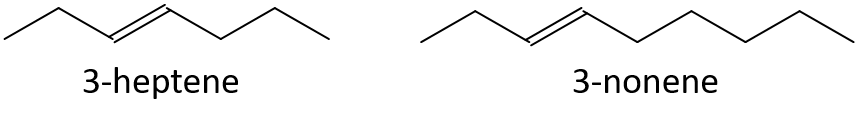
- 3-hepten eller 3-nonen
-
Hvilket er et godt opløsningsmiddel for cyclohexen? pentan eller vand? 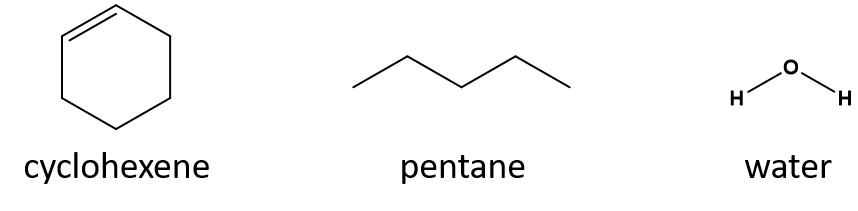
Forudsig uden at henvise til en tabel eller anden reference, hvilket medlem af hvert par der har det højeste kogepunkt.
- 1-penten eller 1-buten

- 3-hepten eller 3-nonen

Hvilket er et godt opløsningsmiddel for cyclohexen? pentan eller vand? 
Svar
-
- 1-penten
- 3-nonen
Begrebsgennemgang øvelser
-
Oplys kort de vigtige sondringer mellem et mættet kulbrinte og et umættet kulbrinte.
-
Gør kort rede for de vigtige sondringer mellem et alken og en alkan.
-
Klassificer hver forbindelse som mættet eller umættet. Identificer hver af dem som en alkan, et alken eller et alkyn.
-
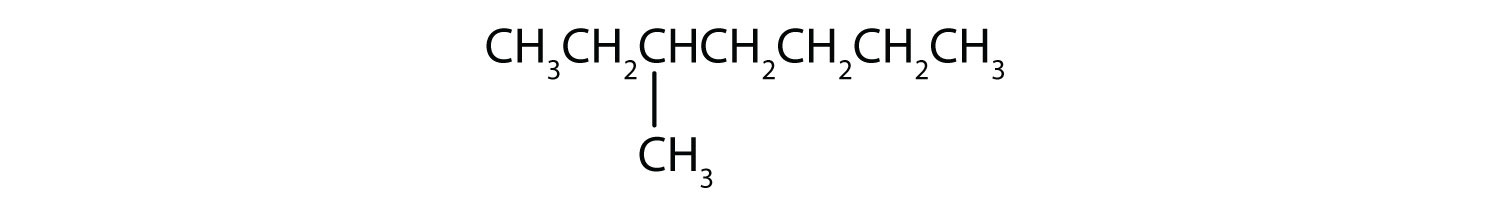
- CH3CH2C≡CCH3
-

-
Svar
-
Umættede carbonhydrider har dobbelt- eller trippelbindinger og er ret reaktive; mættede carbonhydrider har kun enkeltbindinger og er ret ureaktive.
-
En alken har en dobbeltbinding; en alkan har kun enkeltbindinger.
-
- mættet; alkan
- umættet; alkyn
- umættet; alken
Key Takeaway
- Alkener er carbonhydrider med en kulstof-til-kulstof-dobbeltbinding.
8.3 Alkyner
Den enkleste alkyn – et kulbrinte med kulstof-kulstof-dobbeltbinding – har molekylformlen C2H2 og er kendt under sit almindelige navn acetylen (fig. 8.5). Dens struktur er H-C≡C-H.
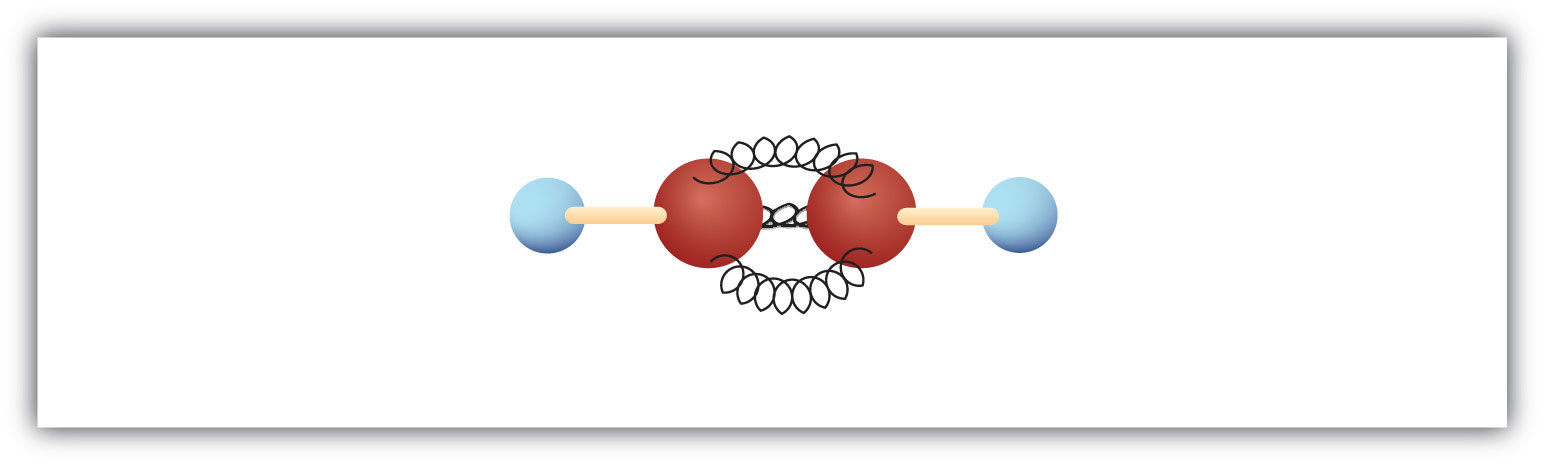
Figur 8.5 Kugle- og fjedermodel af acetylen. Acetylen (ethylen) er det enkleste medlem af alkynefamilien.
Note
Acetylen anvendes i oxyacetylenbrændere til skæring og svejsning af metaller. Flammen fra en sådan fakkel kan være meget varm. Det meste acetylen omdannes imidlertid til kemiske mellemprodukter, der bruges til at fremstille vinyl- og akrylplast, fibre, harpiks og en række andre produkter.
Alkyner ligner alkener i både fysiske og kemiske egenskaber. For eksempel gennemgår alkyner mange af de typiske additionsreaktioner, som alkener gennemgår. IUPAC-navnene (International Union of Pure and Applied Chemistry) for alkyner svarer til navnene for alkener, bortset fra at familieendelsen er -yne i stedet for -ene. IUPAC-navnet for acetylen er ethyn. Navnene på andre alkyner er illustreret i de følgende øvelser.
Begrebsgennemgang øvelser
-
Oplys kort de vigtige forskelle mellem et alken og et alkyn. Hvordan ligner de hinanden?
-
Alkenet (CH3)2CHCHCH2CHCH=CH2 hedder 4-methyl-1-penten. Hvad er navnet på (CH3)2CHCHCH2CH2C≡CH?
-
Viser alkyner cis-trans isomeri? Forklar.
Svar
-
Alkener har dobbeltbindinger; alkyner har trippelbindinger. Begge undergår additionsreaktioner.
-
4-methyl-1-pentyn
-
Nej; et tredobbelt bundet kulstofatom kan kun danne én anden binding. Der skulle være to grupper knyttet til det for at vise cis-trans-isomeri.
Nøgleopfattelse
- Alkyner er kulbrinter med kulstof-til-kulstof-dobbeltbindinger og egenskaber, der minder meget om alkenernes.
Opgaver
-
Tegn strukturen for hver forbindelse.
- acetylen
- 3-methyl-1-hexyne
-
Tegn strukturen for hver forbindelse.
- 4-methyl-2-hexyne
- 3-octyn
-
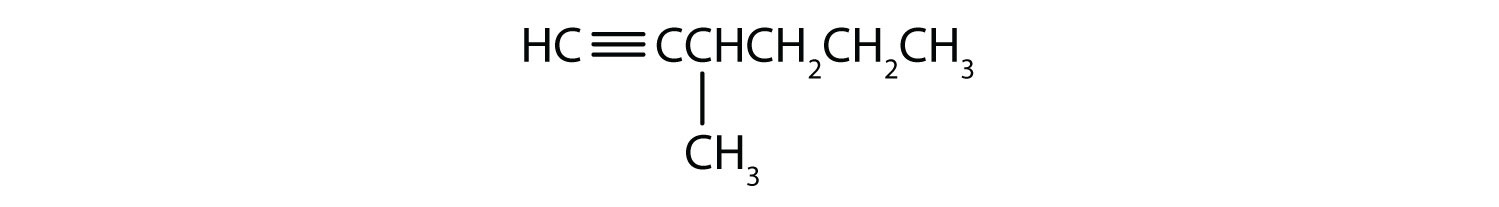
Nævn hvert alkyn.
- CH3CH3CH2CH2CH2C≡CH
- CH3CH3CH2CH2CH2C≡CCH3
Svar
-
- H-C≡C-H
-
-
- 1-pentyne
- 2-hexyne
(Tilbage til toppen)
8.4 Aromatiske forbindelser: Benzen
Næst betragter vi en klasse af carbonhydrider med molekylformler som dem for umættede carbonhydrider, men som i modsætning til alkenerne ikke let undergår additionsreaktioner. Disse forbindelser udgør en særskilt klasse, kaldet aromatiske carbonhydrider. Aromatiske kulbrinter er forbindelser, der indeholder en benzenringstruktur. den enkleste aromatiske forbindelse er benzen (C6H6), og den er af stor kommerciel betydning, men den har også bemærkelsesværdige skadelige virkninger på sundheden (se “For dit helbred: Benzen og os”).
formlen C6H6 synes at indikere, at benzen har en høj grad af umætning. (Hexan, det mættede carbonhydrid med seks kulstofatomer, har formlen C6H14 – otte flere hydrogenatomer end benzen). På trods af den tilsyneladende lave mætningsgrad er benzen dog ret ureaktiv. Dette skyldes den resonansstruktur, der dannes af den aromatiske rings vekslende dobbeltbindingsstruktur.

Note
Benzen er en væske, der lugter som benzin, koger ved 80 °C og fryser ved 5,5 °C. Det er det aromatiske kulbrinte, der produceres i den største mængde. Det blev tidligere brugt til koffeinfri kaffe og var en væsentlig bestanddel af mange forbrugerprodukter, f.eks. malingfjerner, gummicementer og pletfjernere til kemisk rensning i hjemmet. Det blev fjernet fra mange produktformuleringer i 1950’erne, men andre fortsatte med at bruge benzen i produkter indtil 1970’erne, hvor det blev sat i forbindelse med leukæmiedødsfald. Benzen er stadig vigtigt i industrien som en forløber i produktionen af plastik (f.eks. styropor og nylon), lægemidler, rengøringsmidler, syntetisk gummi, pesticider og farvestoffer. Det anvendes som opløsningsmiddel til f.eks. rengøring og vedligeholdelse af trykkeriudstyr og til klæbemidler, f.eks. til at fastgøre såler på sko. Benzen er en naturlig bestanddel af olieprodukter, men da det er et kendt kræftfremkaldende stof, er dets anvendelse som tilsætningsstof i benzin nu begrænset.
Til dit helbred: Benzen og os
Det meste af det benzen, der anvendes kommercielt, kommer fra olie. Det anvendes som udgangsmateriale til fremstilling af rengøringsmidler, lægemidler, farvestoffer, insektbekæmpelsesmidler og plast. Benzen, der engang blev anvendt i vid udstrækning som et organisk opløsningsmiddel, er nu kendt for at have både kort- og langtidstoksiske virkninger. Indånding af store koncentrationer kan forårsage kvalme og endog døden som følge af åndedræts- eller hjertesvigt, mens gentagen eksponering fører til en progressiv sygdom, hvor knoglemarvens evne til at danne nye blodceller til sidst ødelægges. Dette resulterer i en tilstand kaldet aplastisk anæmi, hvor der er et fald i antallet af både de røde og hvide blodlegemer.
Concept Review Exercises
-
Hvordan adskiller de typiske reaktioner for benzen sig fra alkenerne?
-
Beskriv kortfattet bindingerne i benzen.
-
Hvad betyder cirklen i kemikerens fremstilling af benzen?
Svar
-
Benzen er ret ureaktiv over for additionsreaktioner sammenlignet med en alken.
-
Valenceelektroner deles ligeligt af alle seks kulstofatomer (dvs. elektronerne er delokaliserede).
-
De seks elektroner deles ligeligt af alle seks kulstofatomer.
Rekognoscering af aromatiske forbindelser
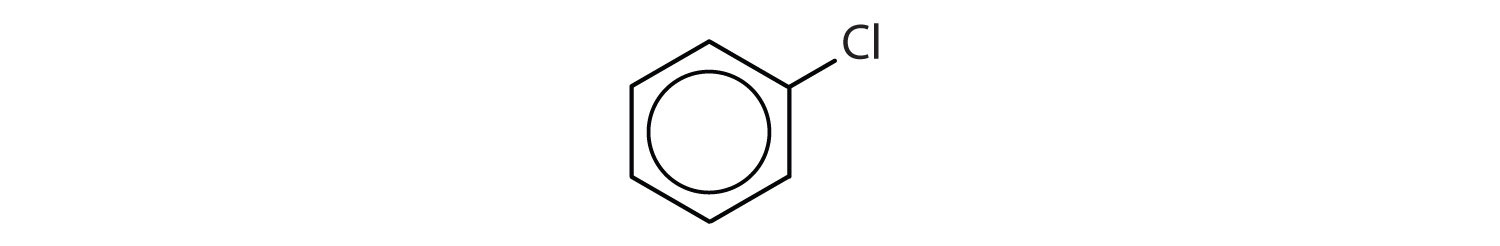
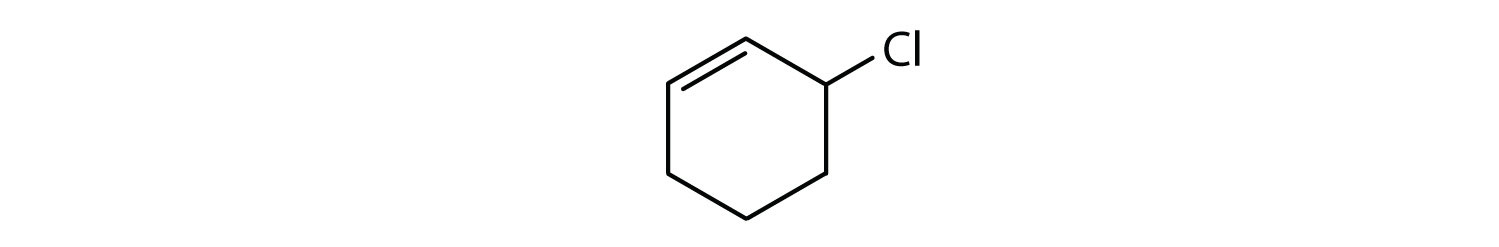
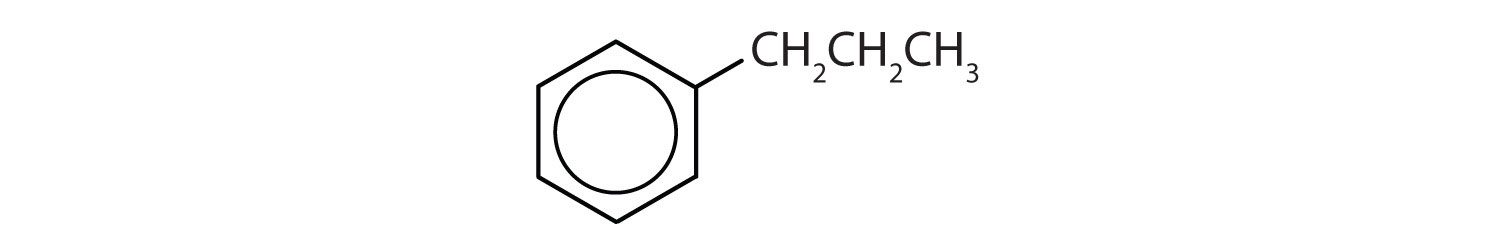
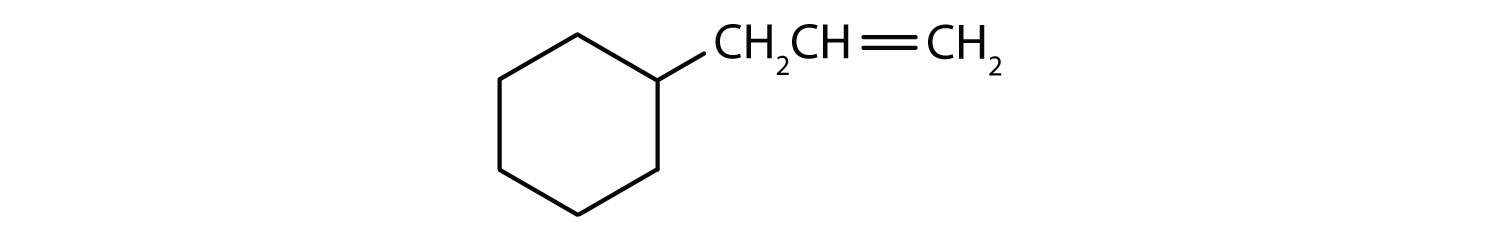
Hvilke forbindelser er aromatiske?
Løsning
- Forbindelsen har en benzenring (med et kloratom substitueret i stedet for et af hydrogenatomerne); den er aromatisk.
- Forbindelsen er cyklisk, men den har ikke en benzenring; den er ikke aromatisk.
- Forbindelsen har en benzenring (med en propylgruppe substitueret i stedet for et af hydrogenatomerne); den er aromatisk.
- Forbindelsen er cyklisk, men den har ikke en benzenring; den er ikke aromatisk.
Skill-Building Exercise
Hvilke forbindelser er aromatiske?
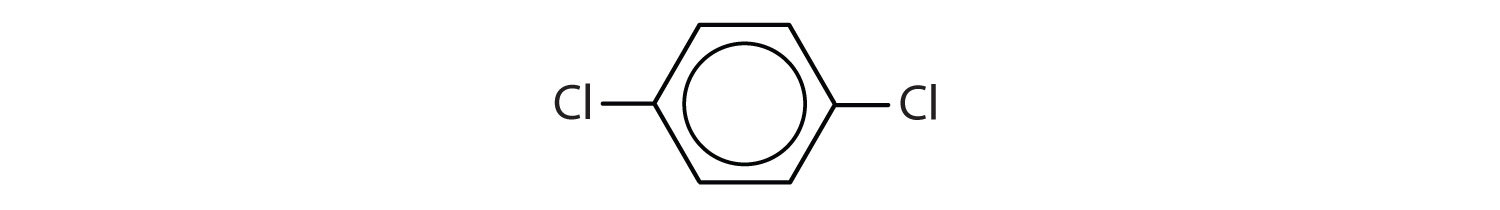
I International Union of Pure and Applied Chemistry (IUPAC) systemet benævnes aromatiske carbonhydrider som derivater af benzen. Fem eksempler er vist nedenfor. I disse strukturer er det ligegyldigt, om den enkelte substituent er skrevet i toppen, siden eller bunden af ringen: en sekskant er symmetrisk, og derfor er alle positioner ækvivalente.
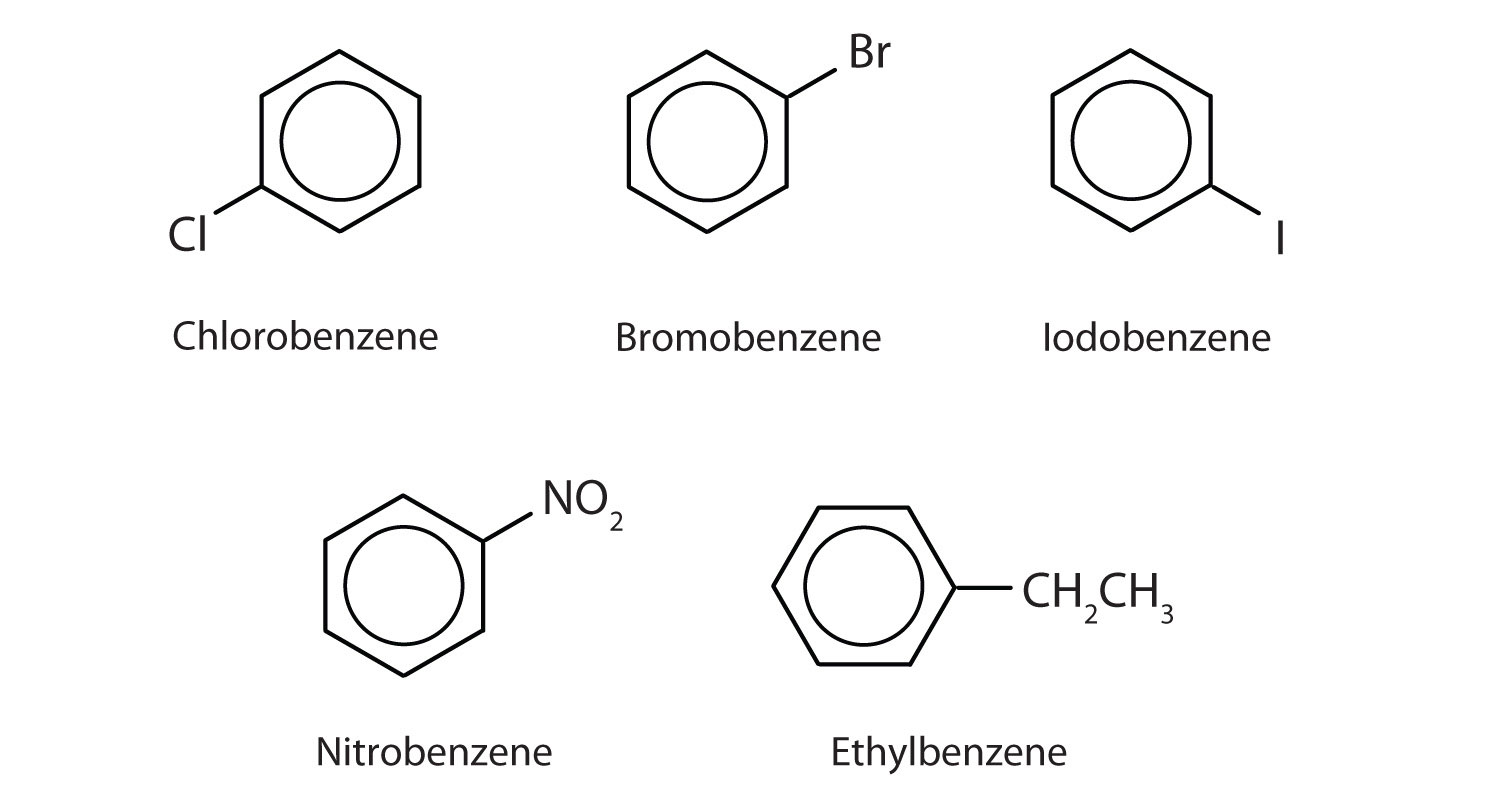
Disse forbindelser navngives på den sædvanlige måde, hvor den gruppe, der erstatter et hydrogenatom, navngives som en substituentgruppe: Cl som klor, Br som bromo, I som iodo, NO2 som nitro og CH3CH2 som ethyl.
Og selv om nogle forbindelser udelukkende benævnes ved IUPAC-navne, benævnes nogle hyppigere ved almindelige navne, som det fremgår nedenfor.
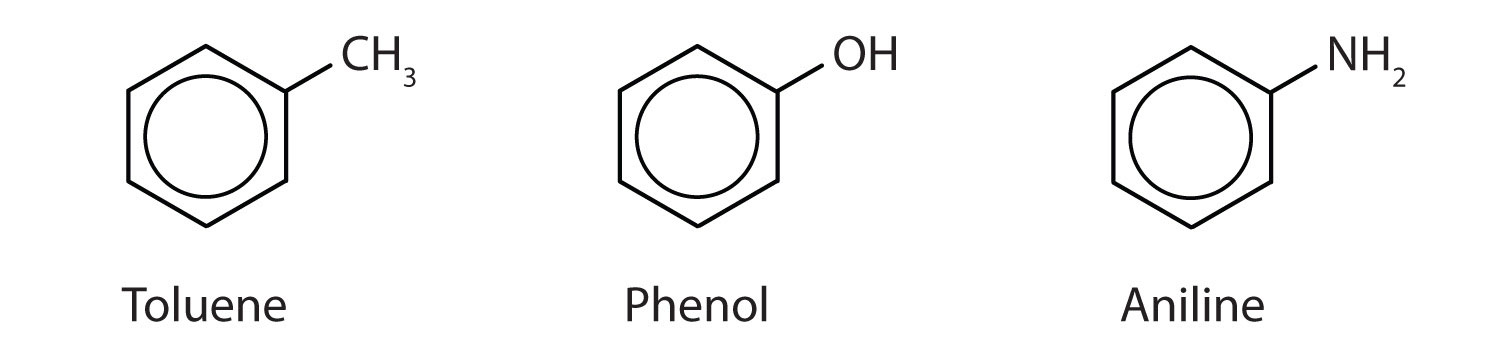
-
Key Takeaway
- Aromatiske kulbrinter ser ud til at være umættede, men de har en særlig type bindinger og undergår ikke additionsreaktioner.
(Tilbage til toppen)
Polycykliske aromatiske kulbrinter
En del almindelige aromatiske kulbrinter består af sammensmeltede benzenringe – ringe, der har en fælles side. Disse forbindelser kaldes polycykliske aromatiske kulbrinter (PAH’er)Et aromatisk kulbrinte bestående af kondenserede benzenringe, der deler en fælles side..
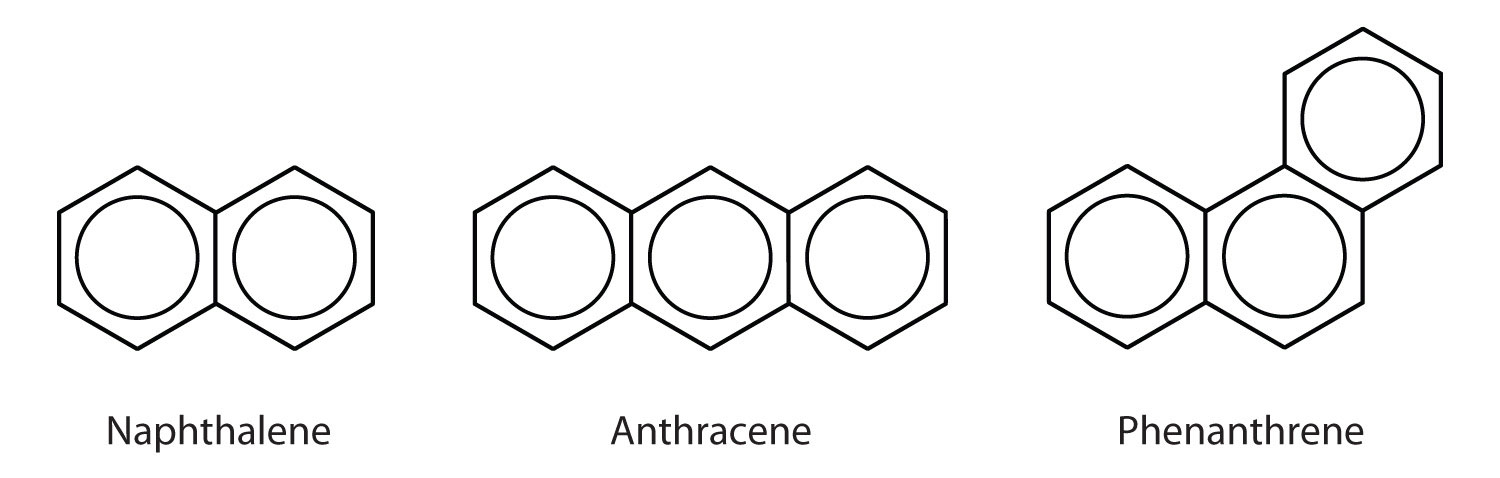
De tre eksempler, der er vist her, er farveløse, krystallinske faste stoffer, der almindeligvis fremstilles af stenkulstjære. Naphthalen har en skarp lugt og anvendes i mølkugler. Antracen anvendes til fremstilling af visse farvestoffer. Steroider, herunder kolesterol og hormonerne østrogen og testosteron, indeholder phenanthrenstrukturen.
Til dit helbred: Polycykliske aromatiske kulbrinter og kræft
Den intense opvarmning, der er nødvendig for at destillere stenkulstjære, resulterer i dannelsen af PAH’er. Det har i mange år været kendt, at arbejdere på stenkulstjære-raffinaderier er modtagelige for en type hudkræft, der kaldes tjærekræft. Undersøgelser har vist, at en række PAH’er er kræftfremkaldende. En af de mest aktive kræftfremkaldende forbindelser, benzopyren, forekommer i stenkulstjære og er også blevet isoleret fra cigaretrøg, marihuanarøg, biludstødningsgasser og kulgrillede bøffer. Det anslås, at der hvert år udledes mere end 1 000 t benzopyren i luften over USA. Der kræves kun få milligram benzopyren pr. kg kropsvægt for at fremkalde kræft hos forsøgsdyr.
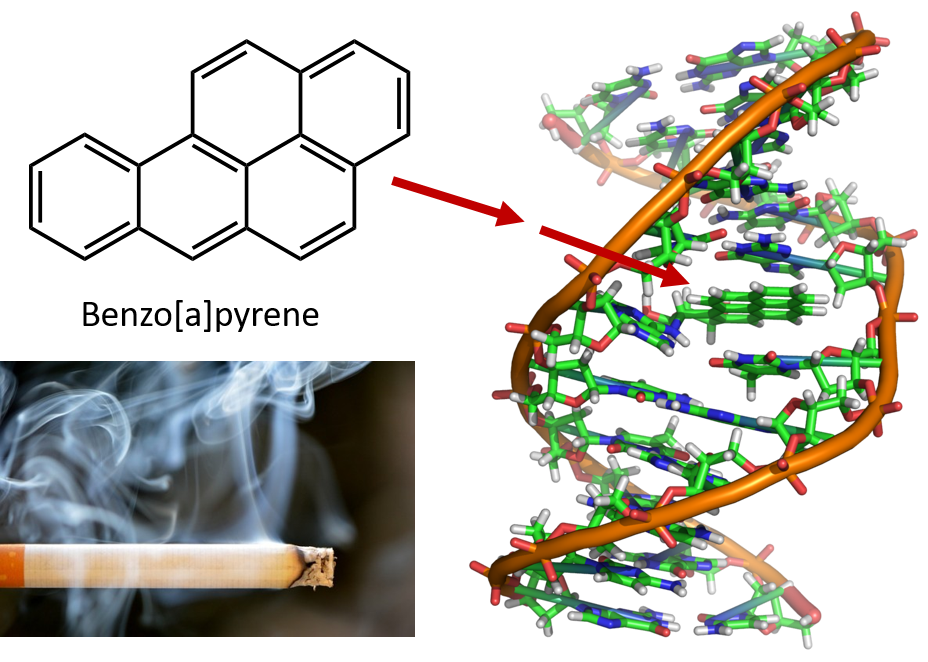
Figur 8.6 Benzopyren er et polycyklisk aromatisk kulbrinte, der produceres som et biprodukt i stenkulstjære, cigaret- og marihuanarøg og i bøffer fra forkullede bøffer. Benzopyren metaboliseres til biologisk aktive forbindelser, der kan danne fysiske addukter på DNA-molekyler. Disse addukter kan forårsage genetiske mutationer, der kan forårsage kræft.
Foto af cigaretrøg
Biologisk vigtige forbindelser med benzenringe
Stoffer, der indeholder benzenringen, er almindelige i både dyr og planter, selv om de er mere hyppige i sidstnævnte. Planter kan syntetisere benzenringen fra kuldioxid, vand og uorganiske materialer. Dyr kan ikke syntetisere den, men de er afhængige af visse aromatiske forbindelser for at overleve og må derfor få dem fra føden. Phenylalanin, tyrosin og tryptofan (essentielle aminosyrer) og vitaminerne K, B2 (riboflavin) og B9 (folinsyre) indeholder alle benzenringen. Mange vigtige lægemidler, hvoraf nogle få er vist i tabel 8.2, har også en benzenring.
Note
Så vidt vi har undersøgt kun aromatiske forbindelser med kulstofholdige ringe. Mange cykliske forbindelser har imidlertid et andet grundstof end kulstofatomer i ringen. Organiske ringstrukturer, der indeholder et andet atom end kulstof, kaldes heterocykliske forbindelser.., Heterocykliske aromatiske forbindelser har også unikke og medicinsk relevante egenskaber.
Tabel 8.2 Nogle lægemidler, der indeholder en benzenring
| Navn | Struktur |
|---|---|
| aspirin |
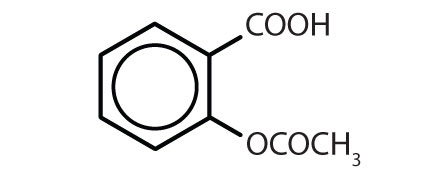 |
| acetaminophen |
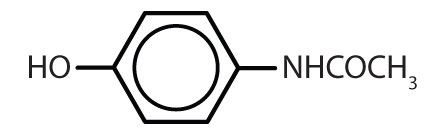 |
| ibuprofen |
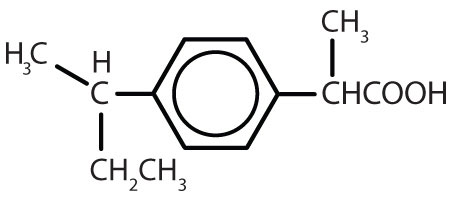 |
| amfetamin |
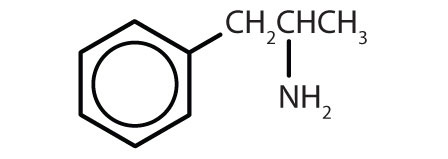 |
| sulfanilamid |
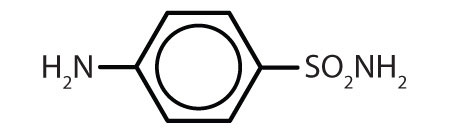 |
8.5 Geometriske isomerer
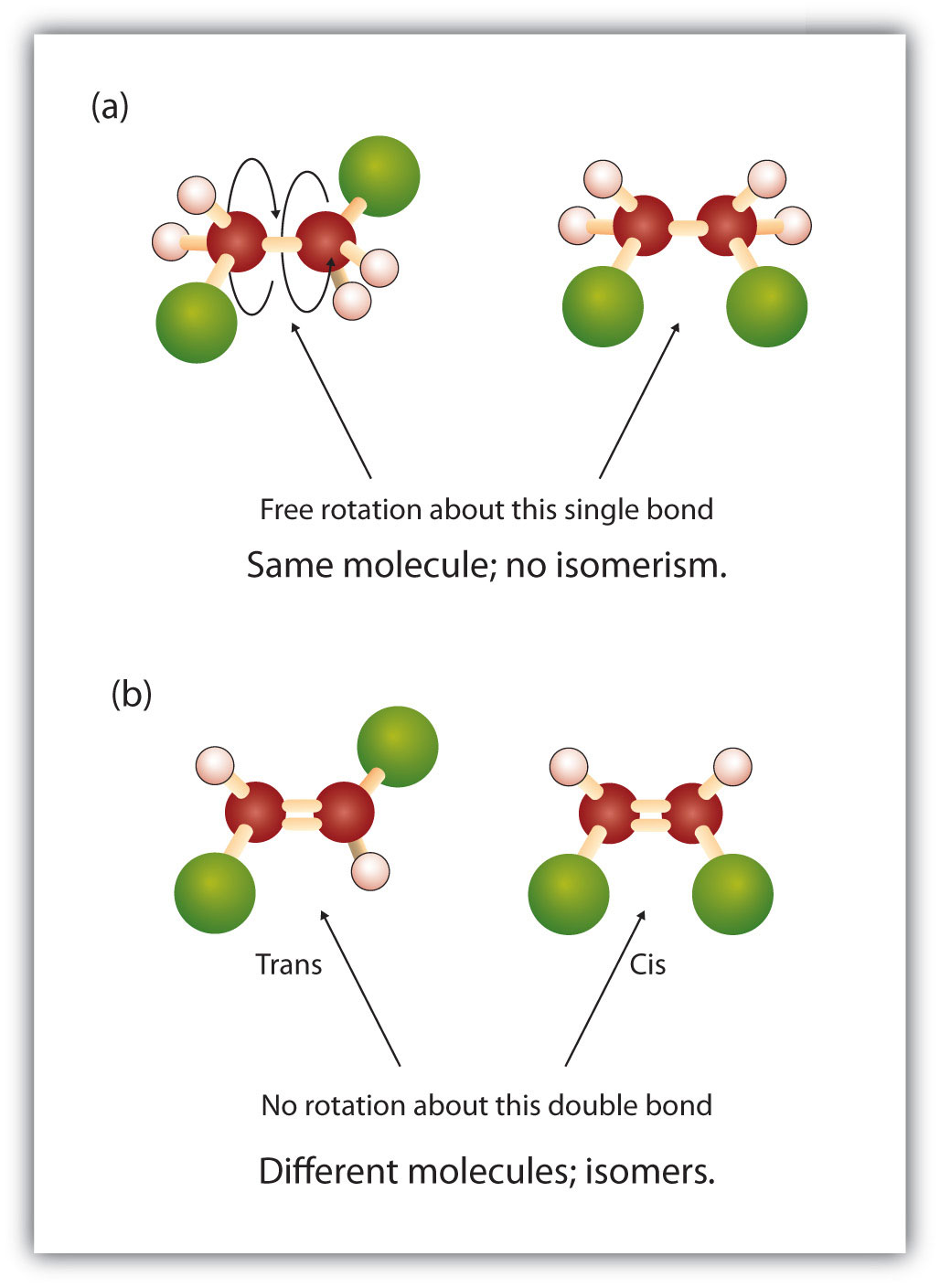
Indenfor alkanstrukturen er der fri rotation om kulstof-til-kulstof enkeltbindingerne (C-C). I modsætning hertil kræver alkenernes struktur, at kulstofatomerne danner en dobbeltbinding. Dobbeltbindinger mellem grundstoffer dannes ved hjælp af p-orbitalskaller (også kaldet pi-orbitaler). Disse orbitalskaller er formet som dumbbells i stedet for de cirkulære orbitaler, der anvendes i enkeltbindinger. Dette forhindrer kulstofatomerne i at rotere frit omkring dobbeltbindingen, da det ville få dobbeltbindingen til at bryde under rotationen (figur 8.7). En enkeltbinding svarer således til to brædder, der er sømmet sammen med ét søm. Brædderne kan frit dreje rundt om det enkelte søm. En dobbeltbinding svarer derimod til to brædder, der er sømmet sammen med to søm. I det første tilfælde kan man vride brædderne, mens man i det andet tilfælde ikke kan vride dem.

Figur 8.7 Dannelsen af dobbeltbindinger kræver brug af pi-bindinger. For at molekyler kan danne dobbeltbindinger, skal elektronerne dele overlappende pi-orbitaler mellem de to atomer. Dette kræver, at de dumbel-formede pi-orbitaler (vist til venstre) forbliver i en fast konformation under dobbeltbindingsdannelsen. Dette giver mulighed for dannelse af elektronorbitaler, som kan deles af begge atomer (vist til højre). Rotation omkring dobbeltbindingen ville medføre, at pi-orbitalerne ville blive forskudt, hvorved dobbeltbindingen ville blive brudt.
Diagrammet stammer fra: JoJanderivative work – Vladsinger (talk)
Den faste og stive karakter af dobbeltbindingen skaber mulighed for et ekstra chiralt center og dermed potentiale for stereoisomerer. Nye stereoisomerer dannes, hvis hvert af de kulbrinter, der er involveret i dobbeltbindingen, har to forskellige atomer eller grupper knyttet til sig. Se f.eks. på de to klorerede carbonhydrider i figur 8.8. I den øverste figur er den halogenerede alkan vist. Rotation omkring denne kulstof-kulstofbinding er mulig og resulterer ikke i forskellige isomerkonformiteter. I det nederste diagram har den halogenerede alken begrænset rotation omkring dobbeltbindingen. Bemærk også, at hvert kulstof, der er involveret i dobbeltbindingen, også er knyttet til to forskellige atomer (et hydrogen og et klor). Dette molekyle kan således danne to stereoisomerer: en, hvor de to kloratomer sidder på samme side af dobbeltbindingen, og en, hvor kloratomerne sidder på modsatte sider af dobbeltbindingen.
Figur 8.8 Alken-dobbeltbindinger kan danne geometriske isomerer. (a) Viser den frie rotation omkring en kulstof-kulstof enkeltbinding i alkanstrukturen. (b) Viser den faste position af kulstof-kulstof-dobbeltbindingen, der fører til geometiske (rumlige) isomerer.
Klik her for at se en Kahn Academy-video-vejledning om alkenstruktur.
I dette afsnit beskæftiger vi os ikke med navngivningen, som også er med i denne video-vejledning.(Bemærk: Alt Khan Academy-indhold er gratis tilgængeligt med CC-BY-NC-SA-licensering på www.khanacademy.org )
Cis-Trans-nomenklatur
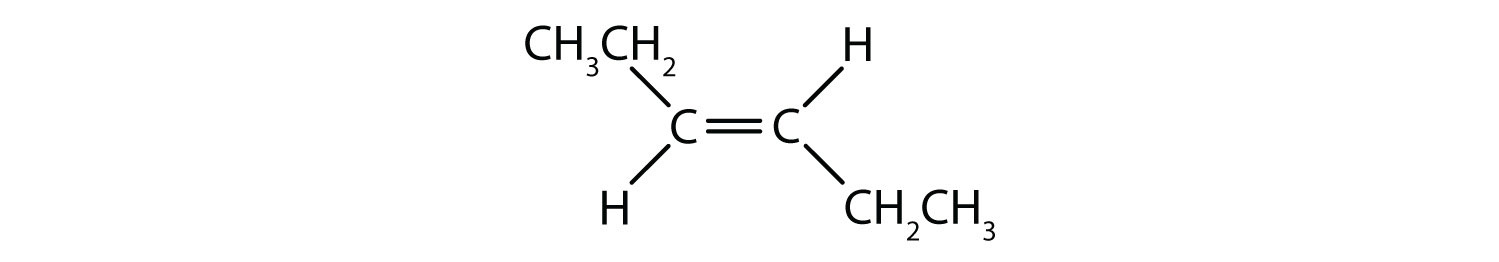
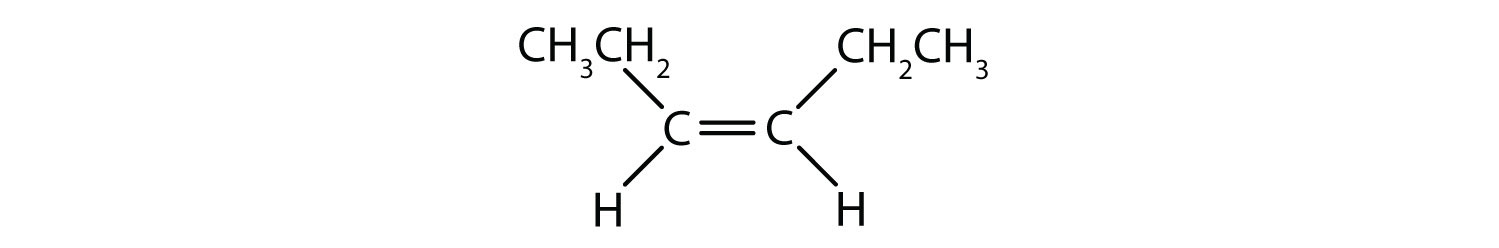
Det cis-trans-nomenklatursystem kan bruges til at skelne simple isomerer, hvor hvert kulstof i dobbeltbindingen har et sæt identiske grupper knyttet til sig. For eksempel i figur 8.8b har hvert kulstof, der er involveret i dobbeltbindingen, et klor knyttet til sig, og har også hydrogen knyttet til sig. cis- og trans-systemet identificerer, om identiske grupper er på samme side (cis) af dobbeltbindingen, eller om de er på den modsatte side (trans) af dobbeltbindingen. Hvis f.eks. hydrogenatomerne befinder sig på den modsatte side af dobbeltbindingen, siges bindingen at være i trans-konformation. Når hydrogengrupperne er på den samme side af dobbeltbindingen, siges bindingen at være i cis-konformation. Bemærk, at man også kan sige, at hvis begge klorgrupper er på den modsatte side af dobbeltbindingen, er molekylet i trans-konformationen, eller hvis de er på samme side af dobbeltbindingen, er molekylet i cis-konformationen.
For at afgøre, om et molekyle er cis eller trans, er det nyttigt at tegne en stiplet linje ned langs midten af dobbeltbindingen og derefter indramme de identiske grupper, som vist i figur 8.9. Begge de molekyler, der er vist i figur 8.9, har navnet 1,2-dichlorethen. Således definerer cis- og trans-betegnelsen kun stereokemien omkring dobbeltbindingen, men den ændrer ikke molekylets overordnede identitet. Imidlertid har cis- og trans-isomerer ofte forskellige fysiske og kemiske egenskaber på grund af bindelsernes faste karakter i rummet.
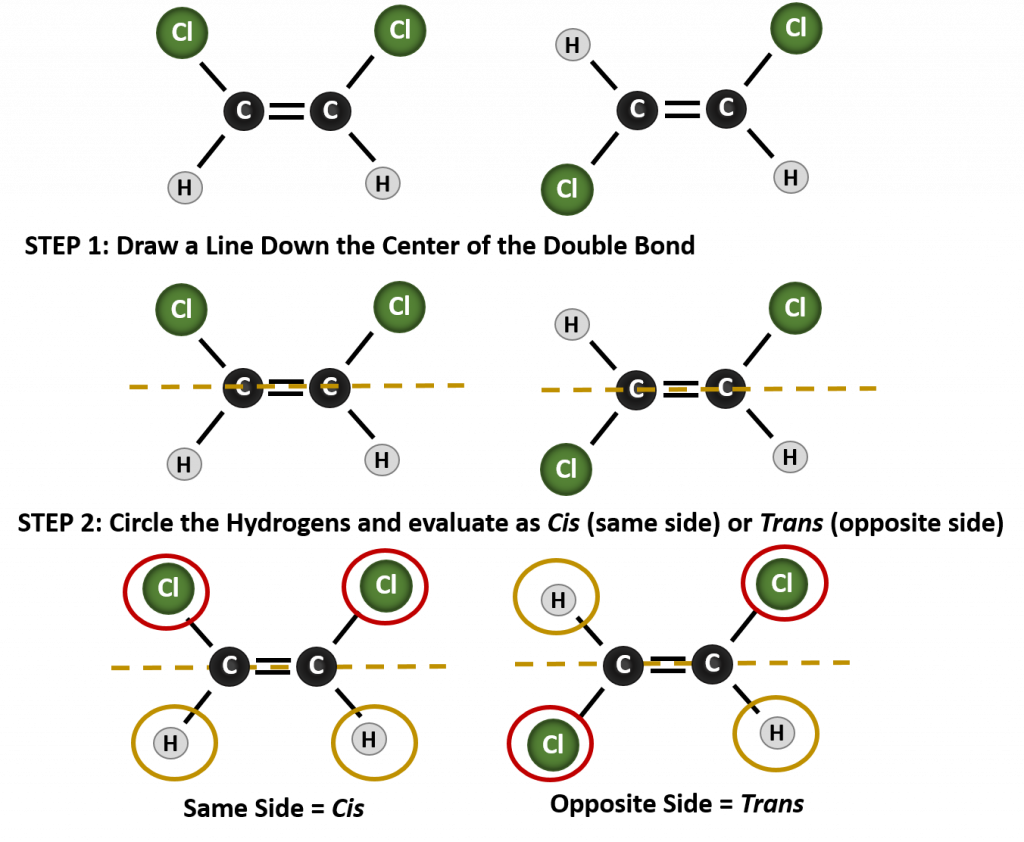
Figur 8.9 En vejledning til bestemmelse af cis- eller trans-konformiteter.
Klik her for en Kahn Academy-videovejledning om Cis/Trans-isomerisering
(Bemærk: Alt Khan Academy-indhold er gratis tilgængeligt med CC-BY-NC-SA-licensering på www.khanacademy.org )
Cis-trans-isomeri forekommer også i cykliske forbindelser. I ringstrukturer er grupper ikke i stand til at rotere om nogen af ringens kulstof-kulstofbindinger. Derfor kan grupper enten være på den samme side af ringen (cis) eller på modsatte sider af ringen (trans). Til vores formål her fremstiller vi alle cycloalkaner som plane strukturer, og vi angiver gruppernes positioner enten over eller under ringens plan.

Til dit helbred
Det mest almindelige sted, hvor du i dagligdagen vil høre henvisning til cis-trans-konformationer, er i supermarkedet eller hos din læge. Det drejer sig om vores forbrug af fedtstoffer i kosten. Uhensigtsmæssigt eller overdrevent forbrug af fedtstoffer i kosten er blevet sat i forbindelse med mange sundhedsmæssige lidelser som f.eks. diabetes og åreforkalkning og koronar hjertesygdom. Så hvad er forskellene mellem mættede og umættede fedtstoffer, og hvad er transfedtstoffer, og hvorfor er de så problematiske for sundheden?

Figur 8.10 Almindelige kilder til kostfedt.
Foto fra: TyMaHe
Den mest almindelige form for kostfedt og den vigtigste bestanddel af kropsfedt hos mennesker og andre dyr er triglyceriderne (TAG’er). TAG’er, som vist i figur 8.10, er opbygget af et molekyle glycerol og tre molekyler fedtsyrer, der er bundet sammen af en esterbinding. I dette afsnit vil vi fokusere på strukturen af de lange fedtsyrehaler, som kan være sammensat af alkan- eller alkenstrukturer. I kapitel 10 vil der blive fokuseret mere på dannelsen af esterbindingerne.

Figur 8.11. Eksempel på en struktur af et triglycerid (TAG). Bemærk, at hvert triglycerid har tre langkædede fedtsyrer, der strækker sig fra glycerolryggen. Hver fedtsyre kan have forskellige grader af mætning og umætning.
Struktur tilpasset fra: Wolfgang Schaefer
Fedtsyrer, der er fuldt mættede, vil kun have fedtsyrer med langkædede alkanhaler. De siges at være “mættede” med hydrogenatomer. Mættede fedtstoffer er almindelige i den amerikanske kost og findes i rødt kød, mejeriprodukter som mælk, ost og smør, kokosolie, og findes i mange bagværk. Mættede fedtstoffer er typisk faste stoffer ved stuetemperatur. Det skyldes, at de langkædede alkaner kan stakke sig sammen og have flere intermolekylære London-dispersionskræfter. Dette giver mættede fedtstoffer højere smeltepunkter og kogepunkter end de umættede fedtstoffer, der findes i mange vegetabilske olier.
De fleste af de umættede fedtstoffer, der findes i naturen, er i cis-konformationen, som vist i figur 8.11. Bemærk, at de fedtsyrer, der er vist i figur 8.11, er tegnet for nemheds skyld, så de er lette at se på og ikke fylder for meget på papiret, men de skrevne bindingsvinkler giver ikke et fyldestgørende billede af molekylernes virkelige rumlige orientering. Når fedtsyrerne fra TAG’et i figur 8.11 er tegnet med korrekte bindingsvinkler, er det let at se, at cis-dobbeltbindinger forårsager bøjninger i alkenkæden (fig. 8.12).
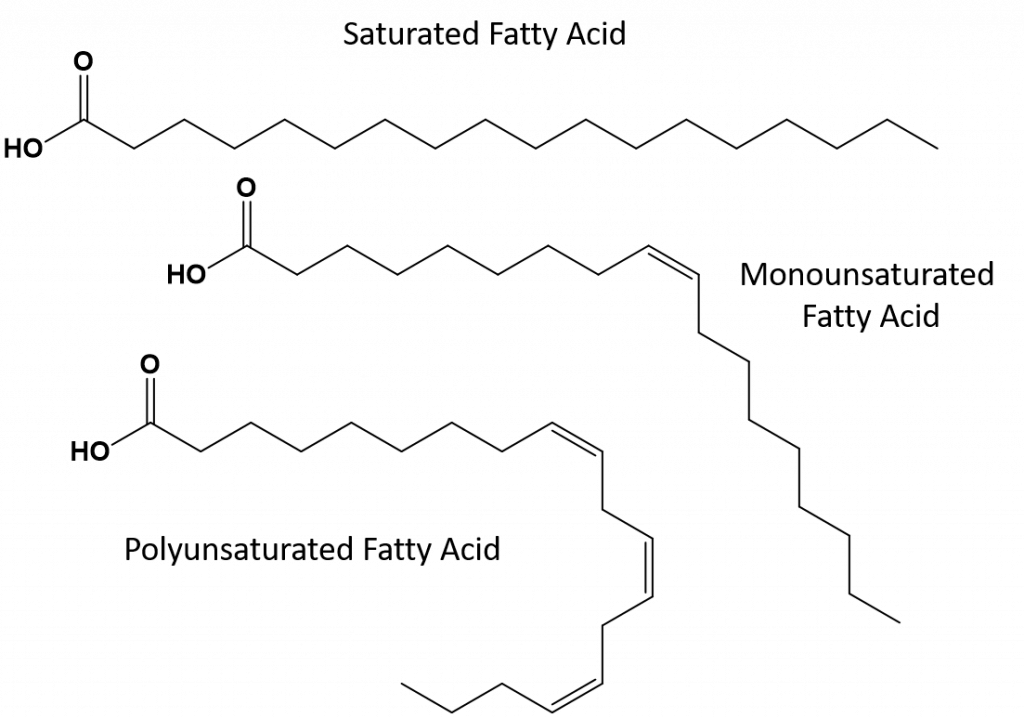
Figur 8.12 Cis-dobbeltbindinger forårsager bøjninger i fedtsyrestrukturen
Så kan enkeltumættede og flerumættede fedtstoffer ikke så let stables sammen og har ikke så mange intermolekylære tiltrækningskræfter sammenlignet med mættede fedtstoffer. Som følge heraf har de lavere smeltepunkter og kogepunkter og har en tendens til at være flydende ved stuetemperatur. Det har vist sig, at en reduktion eller udskiftning af mættede fedtstoffer med mono- og flerumættede fedtstoffer i kosten bidrager til at reducere niveauet af kolesterol i form af low-density-lipoprotein (LDL), som er en risikofaktor for koronar hjertesygdom.
Trans-fedtstoffer indeholder derimod dobbeltbindinger, der er i trans-konformation. Fedtsyrernes form er således lineær, svarende til mættede fedtstoffer. Transfedtstoffer har også lignende smelte- og kogepunkter sammenlignet med mættede fedtstoffer. I modsætning til mættede fedtstoffer er transfedtstoffer dog ikke almindeligt forekommende i naturen og har negative sundhedsvirkninger. Transfedtstoffer opstår hovedsagelig som et biprodukt i forbindelse med fødevareforarbejdning (især hydrogeneringsprocessen til fremstilling af margarine og shortening) eller under madlavning, især friture. Faktisk bruger mange fastfoodrestauranter transfedt i deres friturestegningsproces, da transfedt kan bruges mange gange, før det er nødvendigt at udskifte det. Forbruget af transfedt øger LDL-kolesterolniveauet i kroppen (det dårlige kolesterol, der er forbundet med koronar hjertesygdom) og har en tendens til at sænke HDL-kolesterol (det gode kolesterol i kroppen). Indtagelse af transfedt øger risikoen for hjertesygdomme og slagtilfælde og for udvikling af type II-diabetes. Risikoen har været så stærkt korreleret, at mange lande har forbudt brugen af transfedtstoffer, herunder Norge, Sverige, Østrig og Schweiz. I USA har Food and Drug Administration (FDA) for nylig vedtaget en foranstaltning, der skal udfase brugen af transfedt i fødevarer inden 2018. Denne foranstaltning anslås at kunne forhindre 20.000 hjerteanfald og 7.000 dødsfald om året.
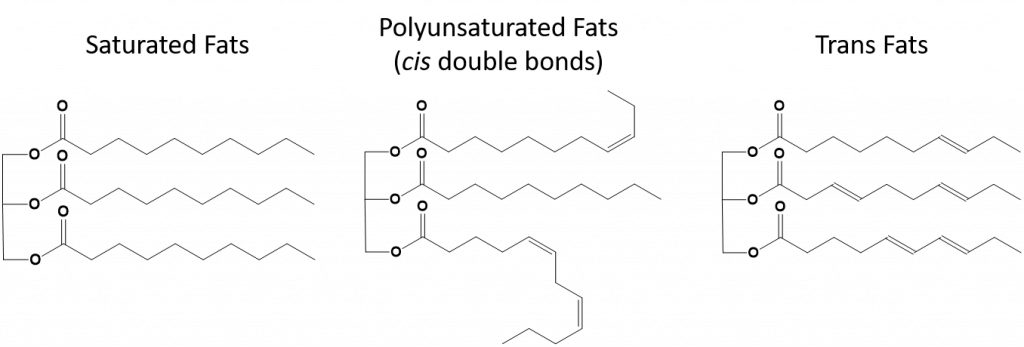
Figur 8.13 Strukturelle forskelle i mættede, flerumættede og transfedtsyrer.
Klik her for at få en Kahn Academy-videovejledning om mættede-, umættede- og transfedtstoffer
(Bemærk: Alt Khan Academy-indhold er gratis tilgængeligt under CC-BY-NC-SA-licensering på www.khanacademy.org )
Nøglefaktorer til bestemmelse af Cis/Trans-isomerisering
- Forbindelsen skal indeholde en dobbelt- eller trippelbinding eller have en ringstruktur, der ikke tillader fri rotation omkring kulstof-kulstof-bindingen.
- Forbindelsen skal have to ikke-identiske grupper knyttet til hvert kulstof, der er involveret i kulstof-kulstof-dobbelt- eller trippelbindingen.
Arbejdet eksempel
Hvilke forbindelser kan eksistere som cis-trans (geometriske) isomerer? Tegn dem.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CHCH2CH3
Løsning
Alle fire strukturer har en dobbeltbinding og opfylder dermed regel 1 for cis-trans-isomeri.
-
Denne forbindelse opfylder regel 2; den har to ikke-identiske grupper på hvert kulstofatom (H og Cl på det ene og H og Br på det andet). Den findes både som cis- og transisomere:

- Denne forbindelse har to hydrogenatomer på et af sine dobbeltbundne kulstofatomer; den opfylder ikke regel 2 og findes ikke som cis- og transisomere.

- Denne forbindelse har to methyl (CH3)-grupper på et af sine dobbeltbundne kulstofatomer. Den opfylder ikke regel 2 og findes ikke som cis- og transisomere.

-
Denne forbindelse opfylder regel 2; den har to ikke-identiske grupper på hvert kulstofatom og eksisterer som både cis- og trans-isomere:

Skill-Building Exercise
-
Hvilke forbindelser kan eksistere som cis-trans-isomere? Tegn dem.
- CH2=CH2CH2CH2CH3
- CH3CH=CH2CH2CH3
- CH3CH2CH=CH2CH2CH3
-
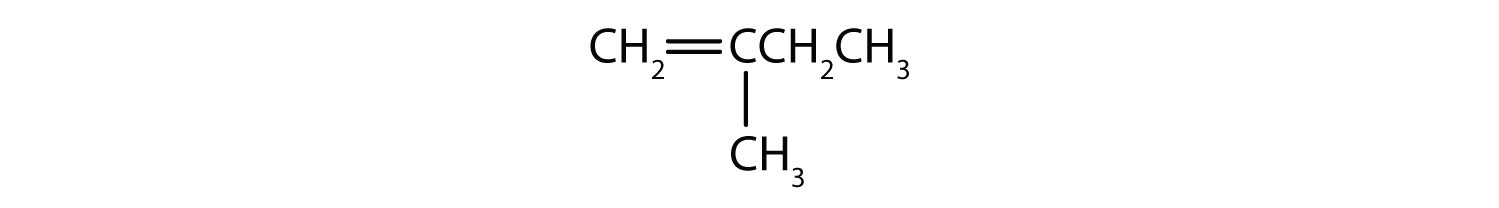
-
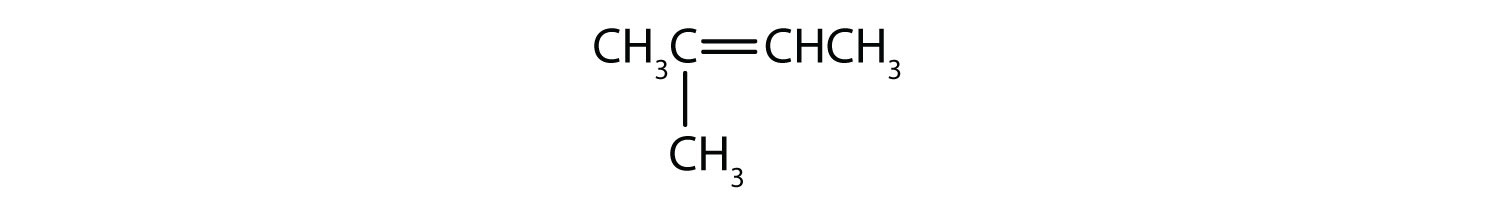
Begrebsgennemgang øvelser
-
Hvad er cis-trans (geometriske) isomerer? Hvilke to typer forbindelser kan udvise cis-trans-isomeri?
-
Klassificer hver forbindelse som en cis-isomer, en trans-isomer eller ingen af delene.
-
Svar
-
Cis-trans-isomerer er forbindelser, der har forskellige konfigurationer (grupper permanent på forskellige steder i rummet) på grund af tilstedeværelsen af en stiv struktur i deres molekyle. Alkener og cykliske forbindelser kan udvise cis-trans-isomeri.
-
- trans
- cis
- cis
- neither
Key Takeaway
- Cis-trans- (geometrisk) isomeri eksisterer, når der er begrænset rotation i et molekyle, og der er to forskellige grupper på hvert kulstofatom, der er involveret i den kemiske binding.
(Tilbage til toppen)
E-Z Nomenklatur
Situationen bliver mere kompleks, når der er 4 forskellige grupper knyttet til de kulstofatomer, der er involveret i dannelsen af dobbeltbindingen. Navnesystemet cis-trans kan ikke anvendes i dette tilfælde, fordi der ikke er nogen henvisning til, hvilke grupper der beskrives af nomenklaturen. I molekylet nedenfor kan man f.eks. sige, at kloren er trans til bromholdig, eller man kan sige, at kloren er cis til methylgruppen (CH3). Hvis man i dette tilfælde blot skriver cis eller trans, er gruppernes rumlige orientering i forhold til dobbeltbindingen således ikke klart afgrænset.
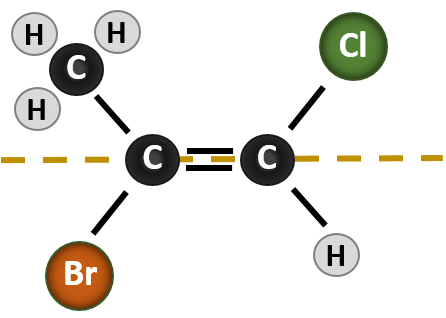
Nævnelse af de forskellige stereoisomerer, der dannes i denne situation, kræver kendskab til prioritetsreglerne. Husk fra kapitel 5, at i Cahn-Ingold-Prelog (CIP)-prioritetssystemet prioriteres de grupper, der er knyttet til det chirale kulstof, på grundlag af deres atomnummer (Z). Atomer med højere atomnummer (flere protoner) får højere prioritet (dvs. S > P > P > O > N > C > H). I dette nomenklatursystem anvendes betegnelserne (Z) og (E) i stedet for cis/trans-systemet. (E) kommer af det tyske ord entgegen, dvs. modsat. Når de højere prioriterede grupper således befinder sig på den modsatte side af dobbeltbindingen, siges bindingen at være i (E)-konformationen. (Z) kommer derimod fra det tyske ord zusammen, som betyder sammen. Når de højest prioriterede grupper er på samme side af dobbeltbindingen, siges bindingen således at være i (Z)-konformationen. Figur 8.14 viser de trin, der anvendes til at tildele (E)- eller (Z)-konformiteterne for et molekyle.
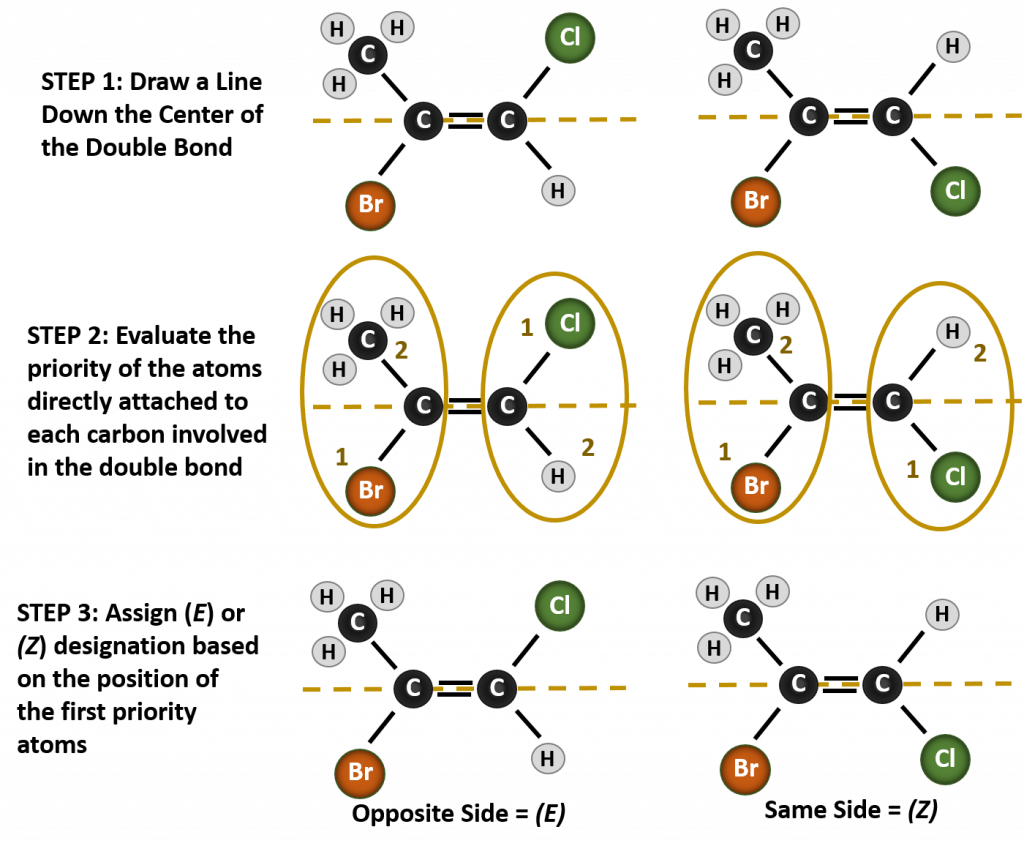
Figur 8.14 Trin, der anvendes til at tildele (E)- og (Z)-konformiteterne.
Klik her for at få en Kahn Academy-videovejledning om E/Z-isomerisering.
(Bemærk: Alt Khan Academy-indhold er gratis tilgængeligt med CC-BY-NC-SA-licensering på www.khanacademy.org )