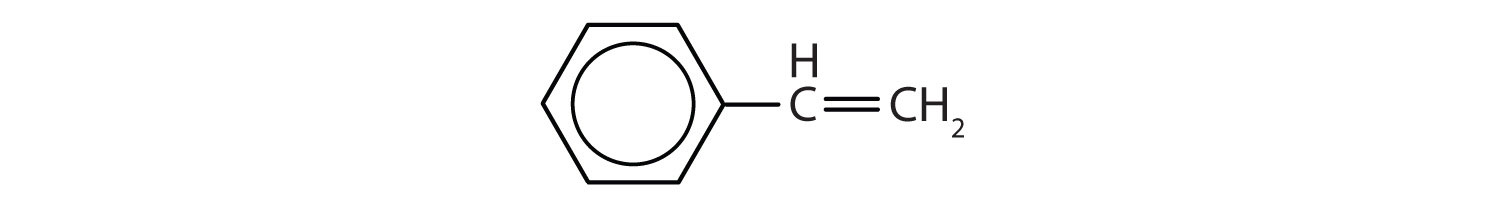
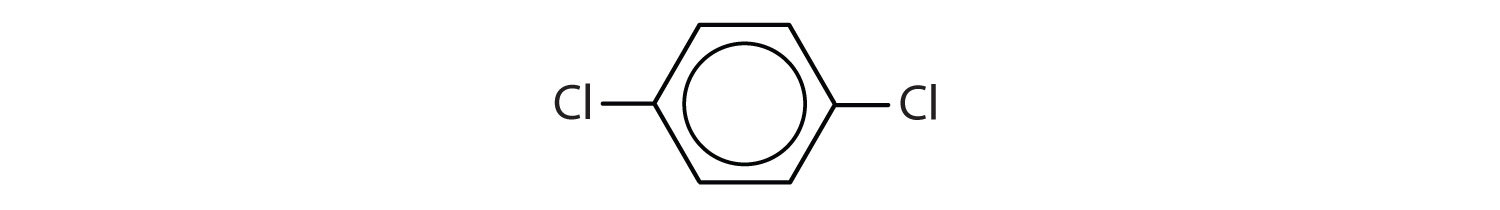
Aromatické uhlovodíky jsou definovány tím, že mají strukturu 6členného kruhu se střídavými dvojnými vazbami (obr. 8.2).
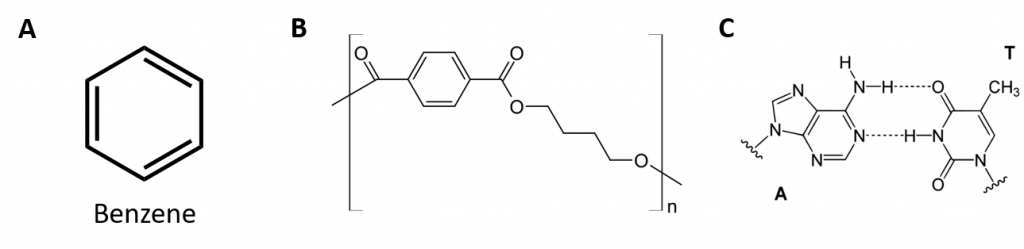
Obrázek 8.2: Aromatické uhlovodíky. Aromatické uhlovodíky obsahují šestičlennou strukturu benzenového kruhu (A), která se vyznačuje střídavými dvojnými vazbami. Ultradur, PBT je plastový polymer, který obsahuje aromatickou funkční skupinu. Opakující se monomer Ultraduru je znázorněn v (B). Ultradur lze nalézt ve sprchových hlavicích, štětinách zubních kartáčků, plastových pouzdrech pro kabely z optických vláken a v součástech exteriéru a interiéru automobilů. Biologicky důležité molekuly, jako je deoxyribonukleová kyselina, DNA (C), také obsahují aromatické kruhové struktury.
Také mají vzorce, které lze nakreslit jako cyklické alkeny, takže jsou nenasycené. Vzhledem k cyklické struktuře jsou však vlastnosti aromatických kruhů obecně zcela odlišné a nechovají se jako typické alkeny. Aromatické sloučeniny slouží jako základ mnoha léčiv, antiseptik, výbušnin, rozpouštědel a plastů (např. polyesterů a polystyrenu).
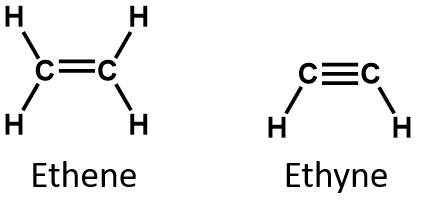
Dvě nejjednodušší nenasycené sloučeniny – ethen (ethen) a acetylen (ethen) – se kdysi používaly jako anestetika a v roce 1924 byly zavedeny do lékařství. Bylo však zjištěno, že acetylen tvoří se vzduchem výbušné směsi, a proto se od jeho použití v lékařství v roce 1925 upustilo. Etylen byl považován za bezpečnější, ale i on se podílel na četných smrtelných požárech a explozích během anestezie. Přesto zůstal důležitým anestetikem až do 60. let 20. století, kdy byl nahrazen nehořlavými anestetiky, například halotanem (CHBrClCF3).
- (Zpět na začátek)
- 8.1 Přehled alkenů a alkynů
- (Zpět na začátek)
- 8.2 Vlastnosti alkenů
- Pohled zblízka: Poznámka k životnímu prostředí
- Cvičení na přehled pojmů
- Odpovědi
- Klíčové poznatky
- Cvičení
- Odpověď
- Cvičení na přehled pojmů
- Odpovědi
- Klíčový závěr
- 8.3 Alkyny
- Poznámka
- Cvičení na přehled pojmů
- Klíčový závěr
- Cvičení
- (Zpět na začátek)
- 8.4 Aromatické sloučeniny: Benzen
- Poznámka
- Poznámka
- Pro vaše zdraví:
- Cvičení na přehled pojmů
- Rozpoznávání aromatických sloučenin
- Dovednostní cvičení
- Klíčové poznatky
- (Zpět na začátek)
- Polycyklické aromatické uhlovodíky
- Pro vaše zdraví:
- Biologicky významné sloučeniny s benzenovými kruhy
- Poznámka
- 8.5 Geometrické izomery
- Klikněte sem pro videonávod Kahnovy akademie o struktuře alkenů.
- Cis-Trans pojmenování
- Klikněte sem pro videonávod Khan Academy na téma Cis/Trans izomerizace
- K vašemu zdraví
- Klikněte sem pro videonávod Kahnovy akademie o nasycených, nenasycených a trans-tucích
- Klíčové faktory pro určení Cis/Trans izomerizace
- Pracovní příklad
- Cvičení na procvičení dovedností
- Cvičení na přehled pojmů
- Odpovědi
- Klíčové poznatky
- (Zpět na začátek)
- E-Z názvosloví
- Klikněte sem pro videonávod Khan Academy na téma E/Z izomerizace.
- (Zpět na začátek)
(Zpět na začátek)
8.1 Přehled alkenů a alkynů
Podle definice jsou alkeny uhlovodíky s jednou nebo více dvojnými vazbami uhlík-uhlík (R2C=CR2), zatímco alkyny jsou uhlovodíky s jednou nebo více trojnými vazbami uhlík-uhlík (R-C≡C-R). Souhrnně se nazývají nenasycené uhlovodíky, které jsou definovány jako uhlovodíky s jednou nebo více násobnými (dvojnými nebo trojnými) vazbami mezi atomy uhlíku. V důsledku povahy dvojné nebo trojné vazby mají alkeny a alkyny méně atomů vodíku než srovnatelné alkany se stejným počtem atomů uhlíku. Matematicky to lze vyjádřit následujícími obecnými vzorci:
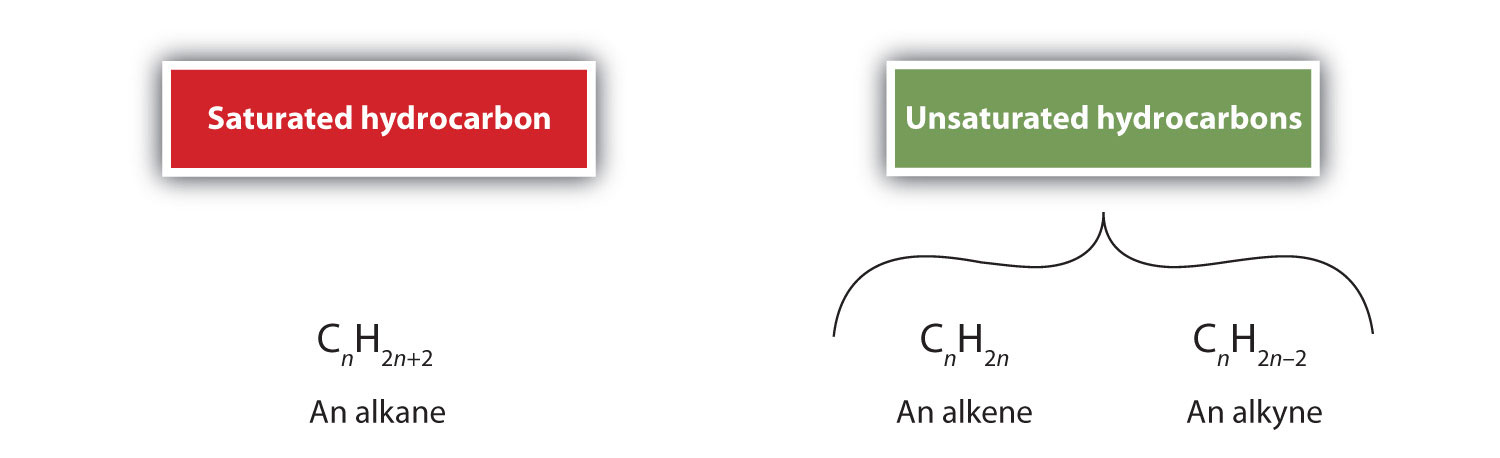
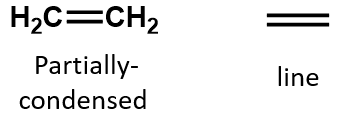
U alkenů je dvojná vazba společná pro dva atomy uhlíku a nezahrnuje atomy vodíku, i když z kondenzovaného vzorce to není zřejmé, tj. kondenzovaný vzorec pro ethen je CH2CH2. Z molekulových vzorců je ještě obtížnější rozpoznat povahu dvojné nebo trojné vazby v molekule. Všimněte si, že molekulový vzorec ethenu je C2H4, zatímco vzorec ethynu je C2H2. Dokud se tedy lépe neseznámíte s jazykem organické chemie, je často nejužitečnější kreslit čárové nebo částečně kondenzované struktury, jak je uvedeno níže:
(Zpět na začátek)
8.2 Vlastnosti alkenů
Fyzikální vlastnosti alkenů jsou podobné jako u alkanů. Tabulka 8.1 ukazuje, že teploty varu alkenů s přímým řetězcem rostou s rostoucí molární hmotností, stejně jako u alkanů. U molekul se stejným počtem atomů uhlíku a stejným obecným tvarem se teploty varu obvykle liší jen nepatrně, stejně jako bychom očekávali u látek, jejichž molární hmotnost se liší pouze o 2 u (což odpovídá dvěma atomům vodíku). Stejně jako ostatní uhlovodíky jsou alkeny nerozpustné ve vodě, ale rozpustné v organických rozpouštědlech.
Někteří zástupci alkenů – jejich názvy, struktura a fyzikální vlastnosti – jsou uvedeny v tabulce 8.1.
Tabulka 8.1 Fyzikální vlastnosti některých vybraných alkenů
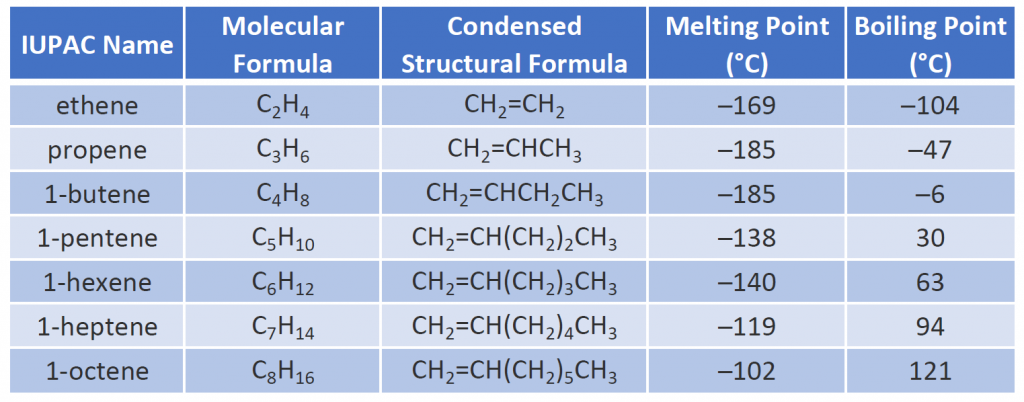
První dva alkeny v tabulce 8.1 -ethen a propen, se nejčastěji nazývají svými běžnými názvy – ethen, resp. propylen. Etylen je hlavní komerční chemickou látkou. Americký chemický průmysl vyrábí ročně přibližně 25 miliard kilogramů ethylenu, což je více než u jakékoli jiné syntetické organické chemikálie. Více než polovina tohoto ethylenu jde na výrobu polyethylenu, jednoho z nejznámějších plastů. Propylen je rovněž důležitou průmyslovou chemikálií. Přeměňuje se na plasty, isopropylalkohol a řadu dalších výrobků.
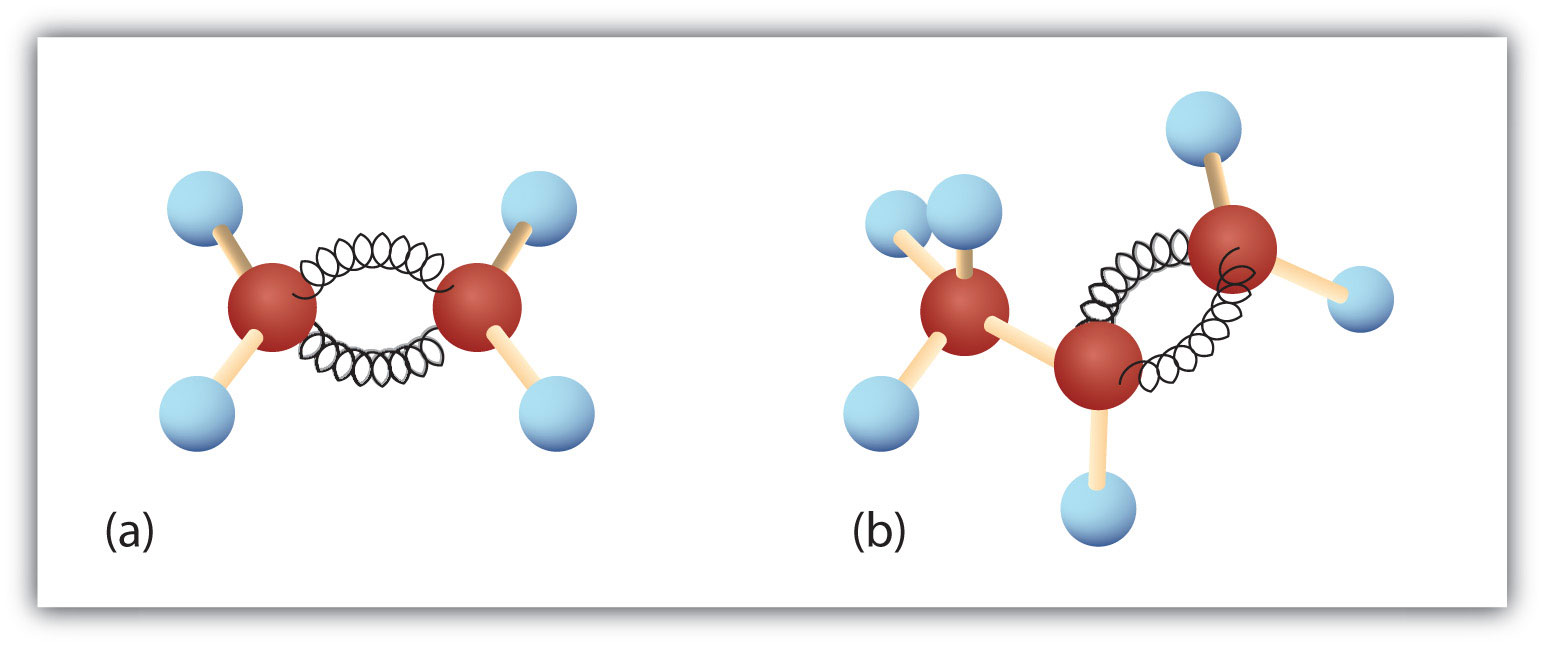
Obrázek 8.3. Ethen a propen. Kuličkové modely ethen/ethylen (a) a propen/propylen (b) ukazují jejich příslušné tvary, zejména vazebné úhly.
Pohled zblízka: Poznámka k životnímu prostředí
Alkeny se v přírodě vyskytují ve velkém množství. Zrající ovoce a zelenina vylučují etylen, který vyvolává další zrání. Zpracovatelé ovoce uměle vnášejí etylen, aby urychlili proces zrání; působením pouhých 0,1 mg etylenu po dobu 24 hodin může dozrát 1 kg rajčat. Bohužel tento proces přesně nekopíruje proces zrání a rajčata sklizená zelená a takto ošetřená nechutnají jako rajčata čerstvě dozrálá ve vinné révě ze zahrady.
Mezi další alkeny, které se vyskytují v přírodě, patří 1-okten, složka citronového oleje, a oktadecen (C18H36), který se nachází v rybích játrech. Běžně se vyskytují také dieny (dvě dvojné vazby) a polyeny (tři a více dvojných vazeb). Butadien (CH2=CHCH=CH2) se nachází v kávě. Lykopen a karoteny jsou izomerní polyeny (C40H56), které dodávají atraktivní červenou, oranžovou a žlutou barvu melounům, rajčatům, mrkvi a dalšímu ovoci a zelenině. Vitamin A, nezbytný pro dobrý zrak, je odvozen od karotenu. Bez alkenů by byl svět mnohem méně barevný.

Obr. 8.4 Jasně červená barva rajčat je způsobena lykopenem.
Foto z : © Thinkstock; struktura lykopenu od: Jeff Dahl
Cvičení na přehled pojmů
-
Krátce popište fyzikální vlastnosti alkenů. Jak se tyto vlastnosti liší od vlastností alkanů?
-
Bez nahlížení do tabulek seřaďte následující alkeny podle rostoucí teploty varu:

Odpovědi
-
Alkeny mají fyzikální vlastnosti (nízké teploty varu, nerozpustnost ve vodě) dosti podobné vlastnostem odpovídajících alkanů.
-
ethene < propene < 1-butene < 1-hexene
Klíčové poznatky
- Fyzikální vlastnosti alkenů jsou velmi podobné vlastnostem alkanů: jejich bod varu se zvyšuje s rostoucí molární hmotností a jsou nerozpustné ve vodě.
Cvičení
-
Bez odkazu na tabulku nebo jiný odkaz předpovězte, který člen každé dvojice má vyšší bod varu.
- 1-penten nebo 1-buten
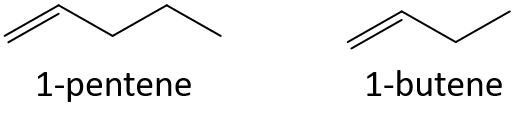
- 3-hepten nebo 3-nonen
- 1-penten nebo 1-buten
-
Které rozpouštědlo je vhodné pro cyklohexen – pentan nebo voda?
Odpověď
-
- 1-penten
- 3-?nonen
Cvičení na přehled pojmů
-
Uveďte stručně důležité rozdíly mezi nasyceným a nenasyceným uhlovodíkem.
-
Uveďte stručně důležité rozdíly mezi alkenem a alkanem.
-
Klasifikujte jednotlivé sloučeniny jako nasycené nebo nenasycené. Určete každou z nich jako alkan, alken nebo alkyn.
-
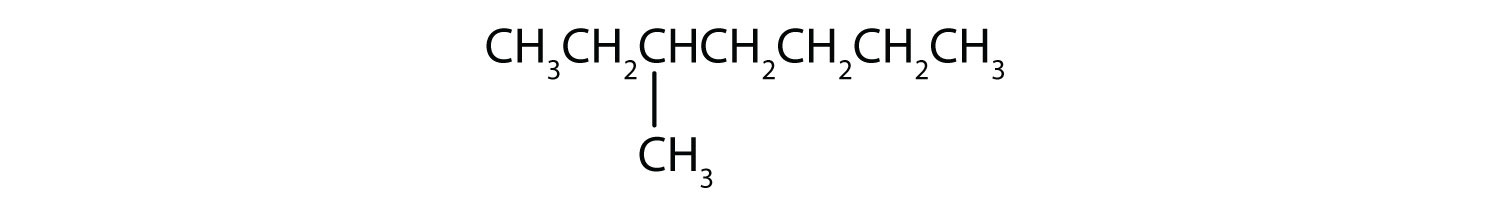
- CH3CH2C≡CCH3
-

-
.
Odpovědi
-
Nenasycené uhlovodíky mají dvojné nebo trojné vazby a jsou poměrně reaktivní; nasycené uhlovodíky mají pouze jednoduché vazby a jsou spíše nereaktivní.
-
Alken má dvojnou vazbu; alkan má pouze jednoduché vazby.
-
- nenasycený; alkan
- nenasycený; alkyn
- nenasycený; alken
Klíčový závěr
- Alkeny jsou uhlovodíky s dvojnou vazbou mezi uhlíky.
8.3 Alkyny
Nejjednodušší alkyn – uhlovodík s trojnou vazbou uhlík-uhlík – má molekulový vzorec C2H2 a je znám pod svým obecným názvem – acetylen (obr. 8.5). Jeho struktura je H-C≡C-H.
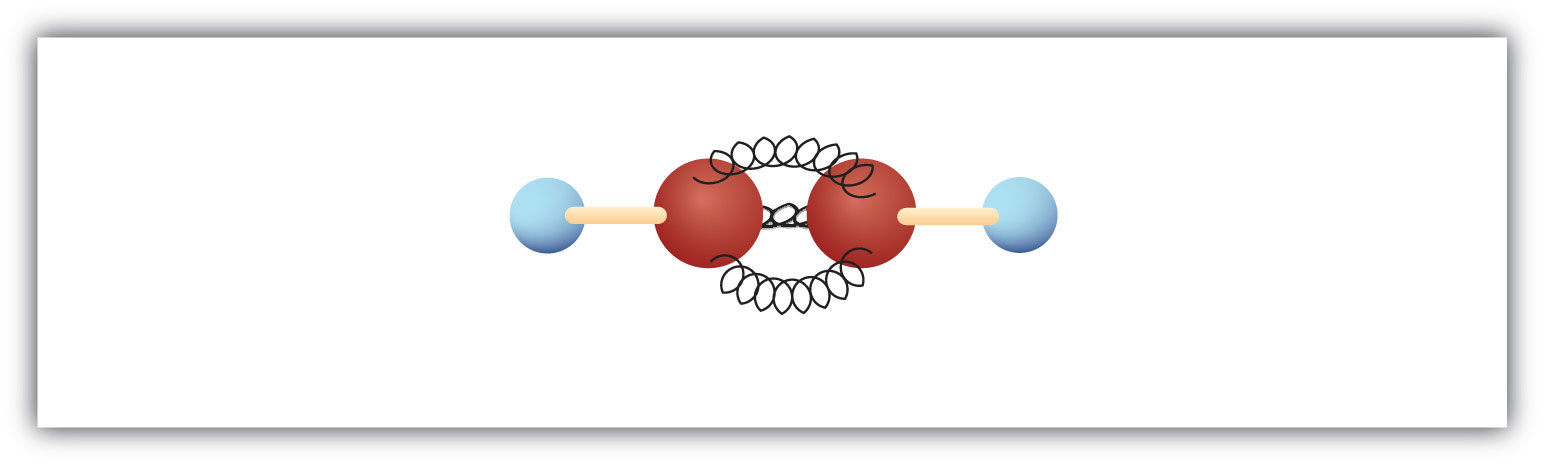
Obrázek 8.5 Kulový a pružinový model acetylenu. Acetylen (ethin) je nejjednodušším členem skupiny alkynů.
Poznámka
Acetylen se používá v kyslíkoacetylenových hořácích k řezání a svařování kovů. Plamen z takového hořáku může být velmi horký. Většina acetylenu se však přeměňuje na chemické meziprodukty, které se používají k výrobě vinylových a akrylových plastů, vláken, pryskyřic a řady dalších výrobků.
Alkeny jsou svými fyzikálními i chemickými vlastnostmi podobné alkenům. Alkyny například podléhají mnoha typickým adičním reakcím alkenů. Názvy alkynů podle Mezinárodní unie pro čistou a užitou chemii (IUPAC) jsou paralelní s názvy alkenů s tím rozdílem, že koncovka čeledi je -yn, nikoli -en. Název IUPAC pro acetylen je ethyne. Názvy dalších alkynů jsou znázorněny v následujících cvičeních.
Cvičení na přehled pojmů
-
Uveďte stručně důležité rozdíly mezi alkenem a alkynem. V čem jsou si podobné?
-
Alken (CH3)2CHCH2CH=CH2 se jmenuje 4-methyl-1-penten. Jak se jmenuje (CH3)2CHCH2C≡CH?“
-
Vykazují alkyny cis-trans izomerii? Vysvětlete.
Odpovědi
-
Alkeny mají dvojné vazby; alkyny mají trojné vazby. Oba podléhají adičním reakcím.
-
4-methyl-1-pentyn
-
Ne; atom uhlíku s trojnou vazbou může vytvořit pouze jednu další vazbu. Musel by mít připojeny dvě skupiny, aby se projevila cis-trans izomerie.
Klíčový závěr
- Alkiny jsou uhlovodíky s trojnou vazbou mezi uhlíky a vlastnostmi podobnými vlastnostem alkenů.
Cvičení
-
Nakreslete strukturu každé sloučeniny.
- acetylen
- 3-methyl-1-hexyn
-
Nakreslete strukturu každé sloučeniny.
- 4-methyl-2-hexyne
- 3-oktyne
-
Pojmenujte jednotlivé alkyny.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Odpovědi
-
- H-C≡C-H
-
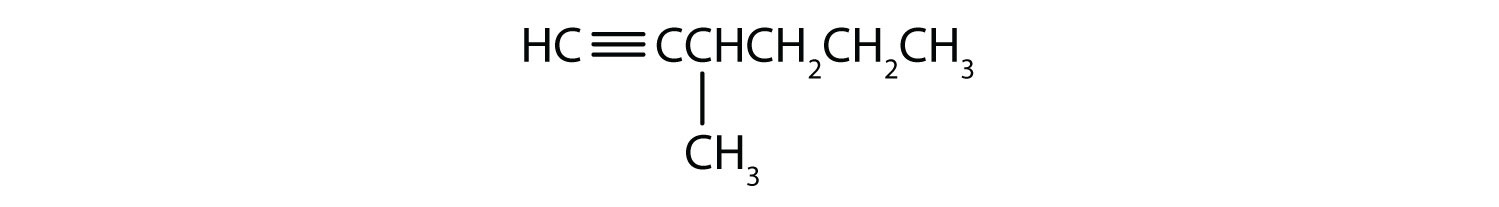
-
- 1-pentyne
- 2-hexyne
(Zpět na začátek)
8.4 Aromatické sloučeniny: Benzen
Následuje třída uhlovodíků s molekulovým vzorcem podobným vzorcům nenasycených uhlovodíků, které však na rozdíl od alkenů nepodléhají snadno adičním reakcím. Tyto sloučeniny tvoří samostatnou třídu, která se nazývá aromatické uhlovodíky. Aromatické uhlovodíky jsou sloučeniny, které obsahují strukturu benzenového kruhu. nejjednodušší aromatickou sloučeninou je benzen (C6H6) a má velký obchodní význam, ale také pozoruhodné škodlivé účinky na zdraví (viz „Pro vaše zdraví: Benzen a my“).
Vzorec C6H6 zřejmě naznačuje, že benzen má vysoký stupeň nenasycení. (Hexan, nasycený uhlovodík se šesti atomy uhlíku, má vzorec C6H14 – o osm atomů vodíku více než benzen). Navzdory zdánlivě nízkému stupni nasycení je však benzen poměrně málo reaktivní. Je to způsobeno rezonanční strukturou, která vzniká střídavou strukturou dvojných vazeb aromatického kruhu.

Poznámka
Benzen je kapalina, která voní po benzinu, vaří se při 80 °C a mrzne při 5,5 °C.
Poznámka
Benzen je kapalina, která voní po benzinu. Je to aromatický uhlovodík vyráběný v největším objemu. Dříve se používal k dekofeinizaci kávy a byl významnou složkou mnoha spotřebních výrobků, jako jsou odstraňovače nátěrů, gumárenské tmely a odstraňovače skvrn z domácího chemického čištění. Z mnoha složení výrobků byl odstraněn v 50. letech 20. století, ale v jiných výrobcích se benzen používal až do 70. let 20. století, kdy byl spojován s úmrtím na leukémii. Benzen je stále důležitý v průmyslu jako prekurzor při výrobě plastů (např. polystyrenu a nylonu), léků, detergentů, syntetického kaučuku, pesticidů a barviv. Používá se jako rozpouštědlo, například při čištění a údržbě tiskařských zařízení, a pro lepidla, například pro lepení podrážek bot. Benzen je přirozenou součástí ropných produktů, ale protože je známým karcinogenem, jeho použití jako přísady do benzinu je nyní omezeno.
Pro vaše zdraví:
Většina komerčně používaného benzenu pochází z ropy. Používá se jako výchozí surovina pro výrobu detergentů, léků, barviv, insekticidů a plastů. Kdysi se benzen hojně používal jako organické rozpouštědlo, dnes je známo, že má krátkodobé i dlouhodobé toxické účinky. Vdechování velkých koncentrací může způsobit nevolnost a dokonce smrt v důsledku selhání dýchání nebo srdce, zatímco opakovaná expozice vede k progresivnímu onemocnění, při kterém je nakonec zničena schopnost kostní dřeně vytvářet nové krvinky. Výsledkem je stav zvaný aplastická anémie, při kterém dochází k poklesu počtu červených i bílých krvinek.
Cvičení na přehled pojmů
-
Jak se liší typické reakce benzenu od reakcí alkenů?
-
Krátce popište vazbu v benzenu.
-
Co znamená kruh v chemickém zobrazení benzenu?
Odpovědi
-
Benzen je ve srovnání s alkenem poměrně málo reaktivní vůči adičním reakcím.
-
Valenční elektrony jsou rovnoměrně sdíleny všemi šesti atomy uhlíku (to znamená, že elektrony jsou delokalizované).
-
Šest elektronů je sdíleno rovným dílem všemi šesti atomy uhlíku.
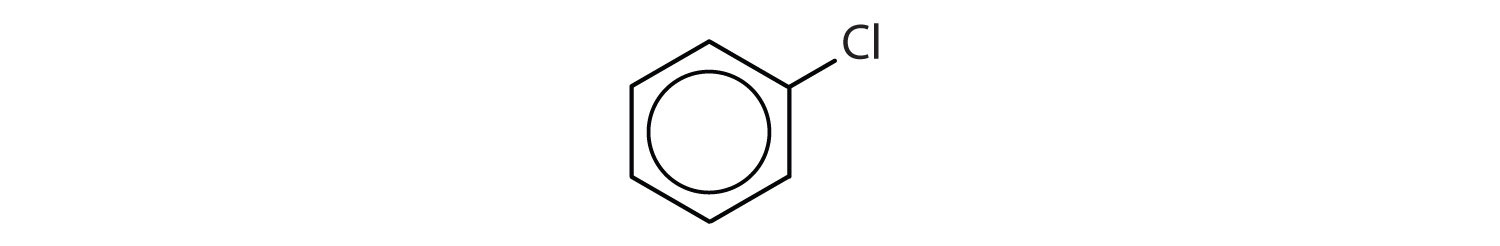
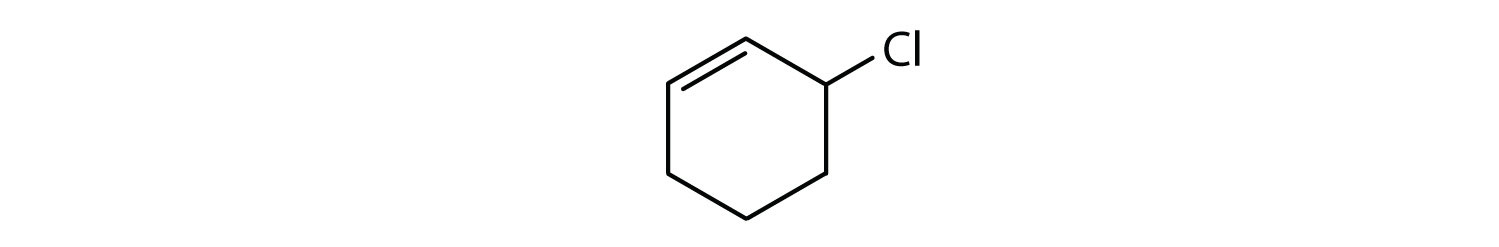
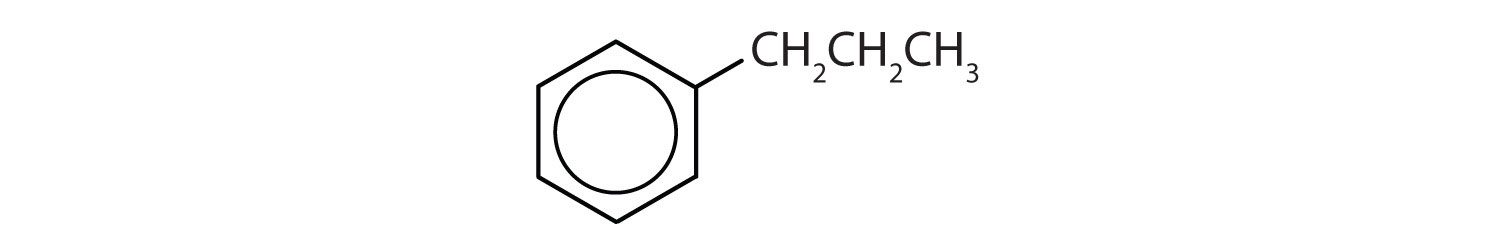
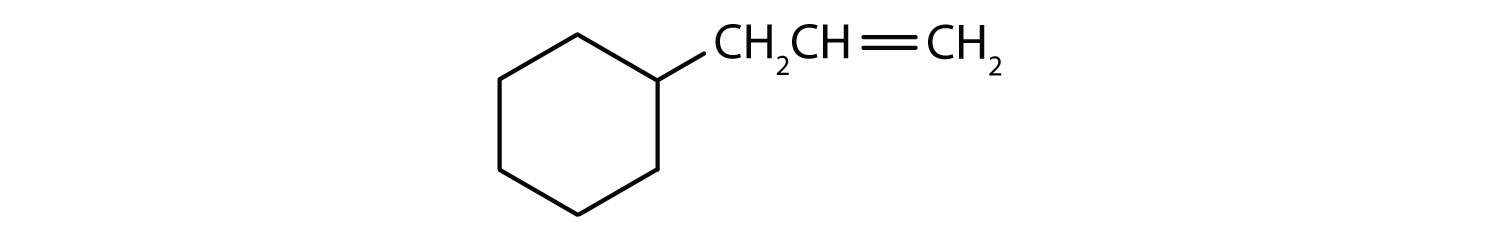
Které sloučeniny jsou aromatické?
Roztok
- Sloučenina má benzenový kruh (s atomem chloru nahrazeným jedním z atomů vodíku); je aromatická.
- Sloučenina je cyklická, ale nemá benzenový kruh; není aromatická.
- Sloučenina má benzenový kruh (s propylovou skupinou substituovanou za jeden z atomů vodíku); je aromatická.
- Sloučenina je cyklická, ale nemá benzenový kruh; není aromatická.
Dovednostní cvičení
Které sloučeniny jsou aromatické?
V systému Mezinárodní unie pro čistou a užitou chemii (IUPAC) se aromatické uhlovodíky označují jako deriváty benzenu. Níže je uvedeno pět příkladů. V těchto strukturách nezáleží na tom, zda je jediný substituent zapsán v horní, boční nebo spodní části kruhu: šestiúhelník je symetrický, a proto jsou všechny polohy ekvivalentní.
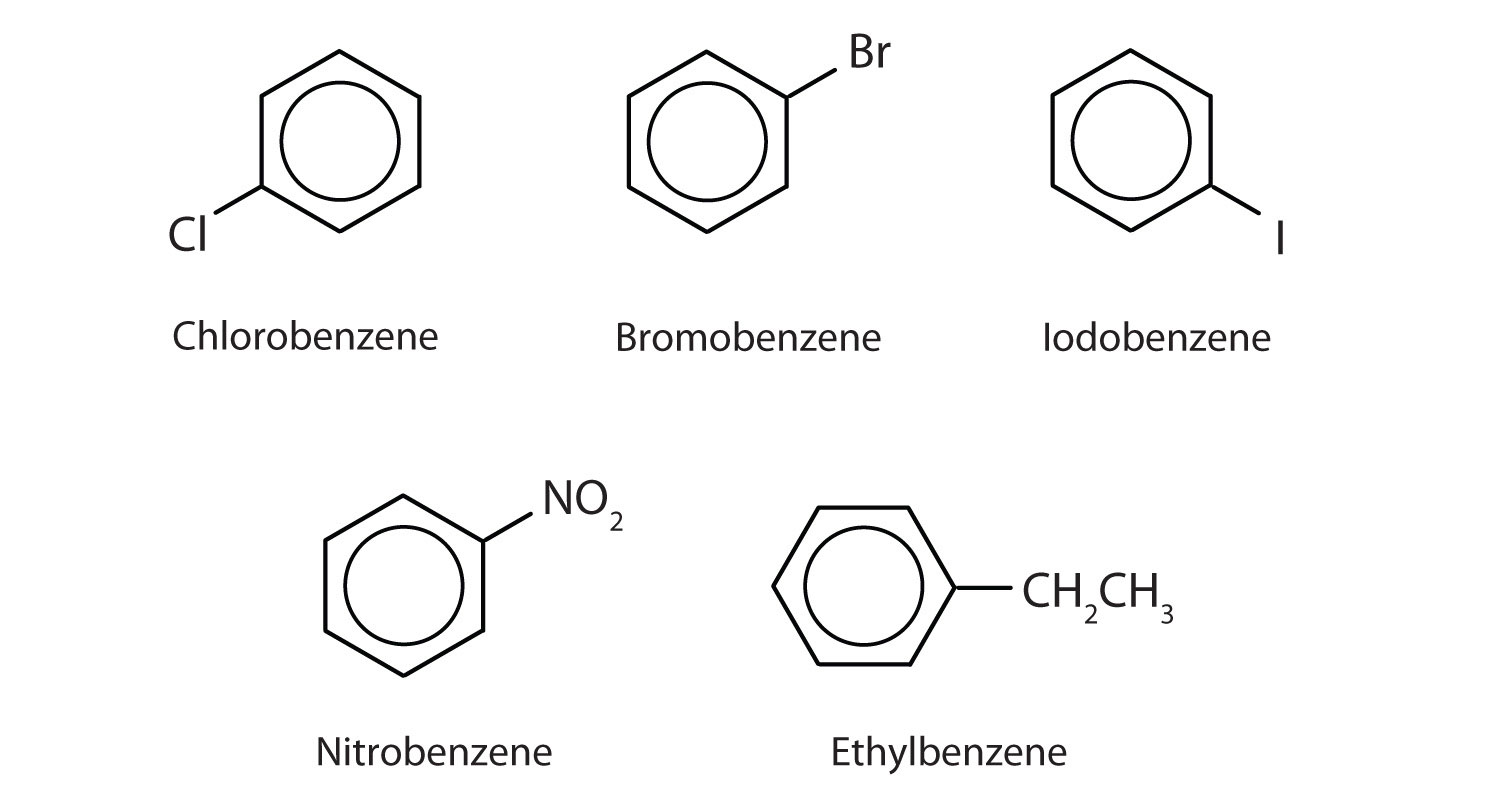
Tyto sloučeniny jsou pojmenovány obvyklým způsobem, přičemž skupina, která nahrazuje atom vodíku, je pojmenována jako substituční skupina: Cl jako chlor, Br jako brom, I jako jodo, NO2 jako nitro a CH3CH2 jako ethyl.
Ačkoli se některé sloučeniny označují výhradně názvy podle IUPAC, některé se častěji označují běžnými názvy, jak je uvedeno níže.
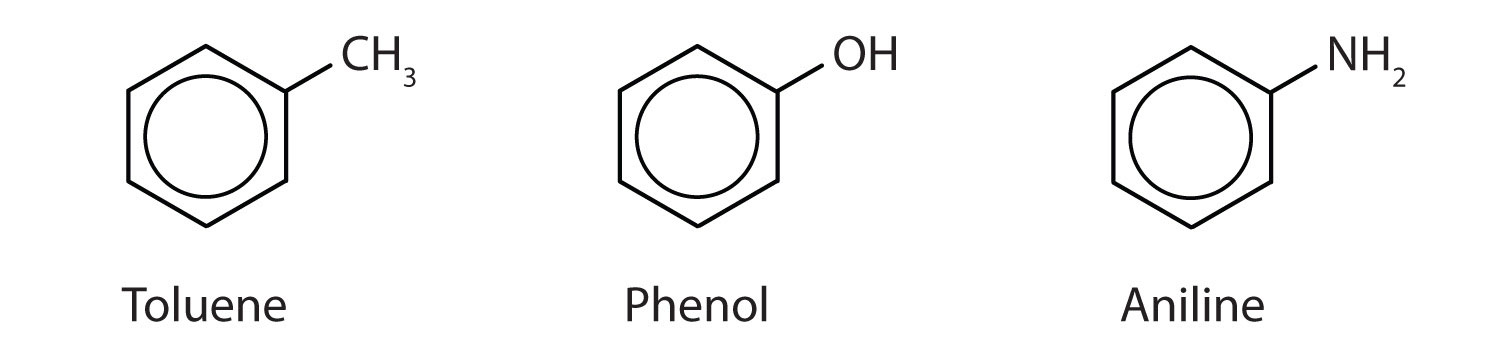
-
Klíčové poznatky
- Aromatické uhlovodíky se zdají být nenasycené, ale mají zvláštní typ vazby a nepodléhají adičním reakcím.
(Zpět na začátek)
Polycyklické aromatické uhlovodíky
Některé běžné aromatické uhlovodíky se skládají ze sloučených benzenových kruhů – prstenců, které mají společnou stranu. Tyto sloučeniny se nazývají polycyklické aromatické uhlovodíky (PAU)Aromatický uhlovodík sestávající ze sloučených benzenových kruhů, které mají společnou stranu
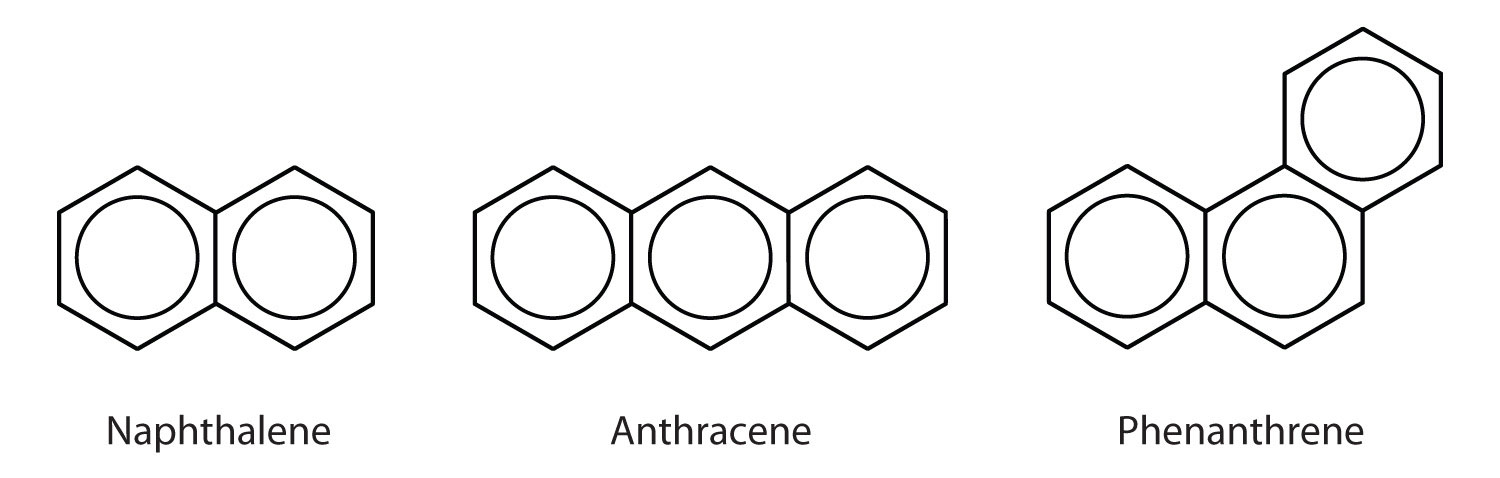
Tři uvedené příklady jsou bezbarvé krystalické pevné látky, které se obvykle získávají z uhelného dehtu. Naftalen má štiplavý zápach a používá se v naftalínových koulích. Antracen se používá při výrobě některých barviv. Steroidy, včetně cholesterolu a hormonů, estrogenu a testosteronu, obsahují fenantrenovou strukturu.
Pro vaše zdraví:
Intenzivní zahřívání potřebné k destilaci uhelného dehtu vede ke vzniku polycyklických aromatických uhlovodíků. Již mnoho let je známo, že pracovníci v rafineriích uhelného dehtu jsou náchylní k typu rakoviny kůže známé jako rakovina dehtu. Výzkumy prokázaly, že řada PAU je karcinogenní. Jedna z nejaktivnějších karcinogenních sloučenin, benzopyren, se vyskytuje v uhelném dehtu a byla také izolována z cigaretového kouře, marihuanového kouře, automobilových výfukových plynů a steaků pečených na dřevěném uhlí. Odhaduje se, že ročně se nad Spojenými státy uvolní do ovzduší více než 1 000 t benzopyrenu. K vyvolání rakoviny u pokusných zvířat je zapotřebí pouze několik miligramů benzopyrenu na kilogram tělesné hmotnosti.
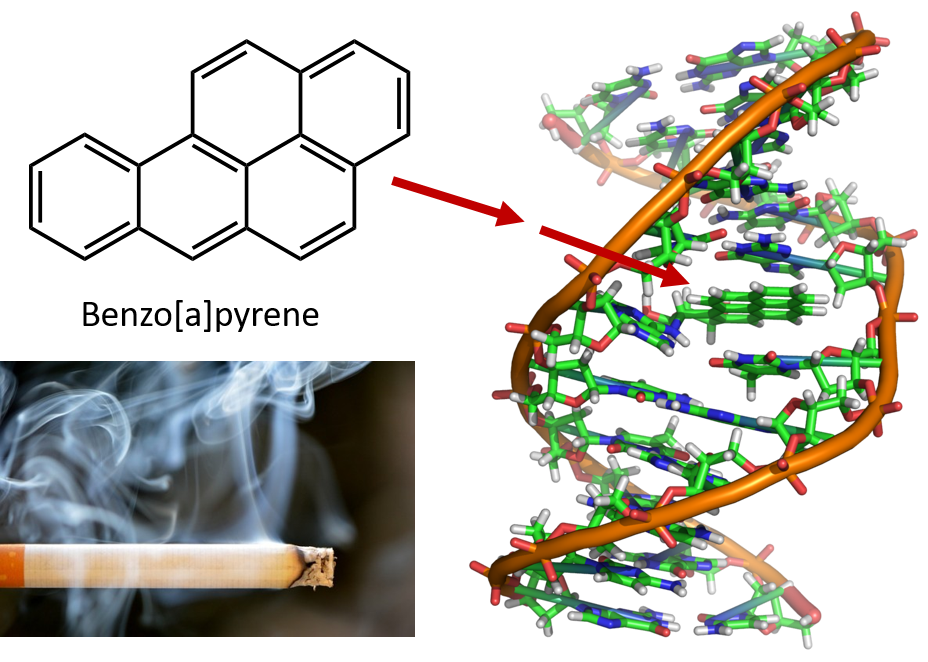
Obrázek 8.6 Benzopyren je polycyklický aromatický uhlovodík vznikající jako vedlejší produkt v uhelném dehtu, cigaretovém a marihuanovém kouři a ve steacích pečených na dřevěném uhlí. Benzopyren je metabolizován za vzniku biologicky aktivních sloučenin, které mohou vytvářet fyzikální adukty na molekulách DNA. Tyto adukty mohou způsobit genetické mutace, které způsobují rakovinu.
Foto cigaretového kouře
Biologicky významné sloučeniny s benzenovými kruhy
Látky obsahující benzenový kruh jsou běžné jak u živočichů, tak u rostlin, i když u rostlin jsou hojnější. Rostliny mohou benzenový kruh syntetizovat z oxidu uhličitého, vody a anorganických látek. Živočichové jej syntetizovat neumějí, ale jejich přežití závisí na určitých aromatických sloučeninách, a proto je musí získávat z potravy. Fenylalanin, tyrosin a tryptofan (esenciální aminokyseliny) a vitaminy K, B2 (riboflavin) a B9 (kyselina listová) obsahují benzenový kruh. Mnoho důležitých léčiv, z nichž několik je uvedeno v tabulce 8.2, také obsahuje benzenový kruh.
Poznámka
Dosud jsme studovali pouze aromatické sloučeniny s kruhy obsahujícími uhlík. Mnoho cyklických sloučenin však má v kruhu jiný prvek než atomy uhlíku. Organické kruhové struktury, které obsahují jiný atom než uhlík, se nazývají heterocyklické sloučeniny, Heterocyklické aromatické sloučeniny mají také jedinečné a lékařsky významné vlastnosti.
Tabulka 8.2 Některé léčivé látky, které obsahují benzenový kruh
| Název | Struktura |
|---|---|
| aspirin |
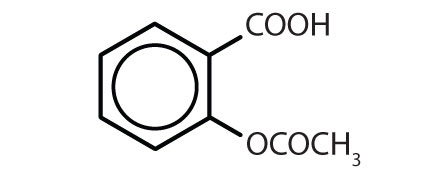 |
| acetaminofen |
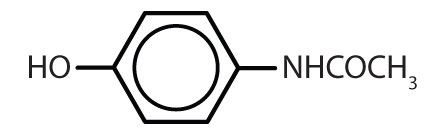 |
| ibuprofen |
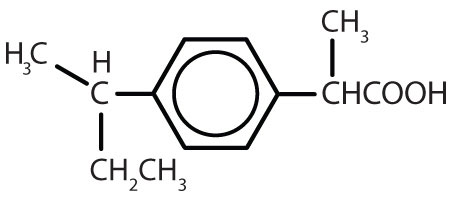 |
| amfetamin |
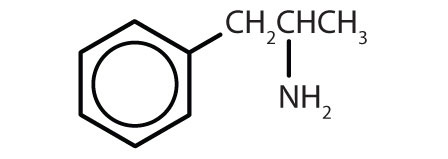 |
| sulfanilamid |
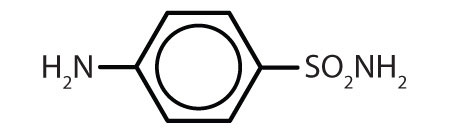 |
8.5 Geometrické izomery
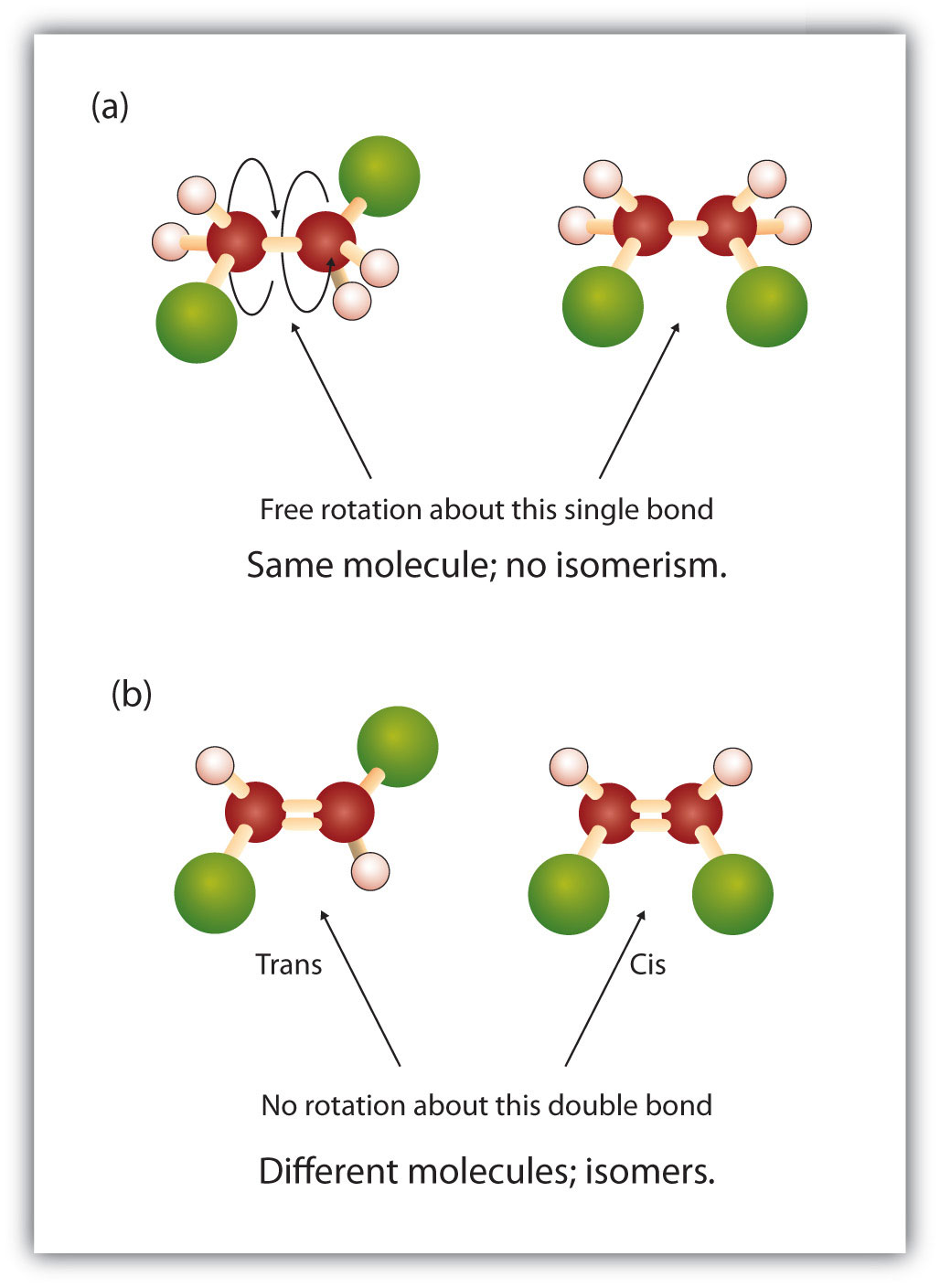
Ve struktuře alkanů dochází k volné rotaci kolem jednoduchých vazeb mezi uhlíky (C-C). Naproti tomu struktura alkenů vyžaduje, aby atomy uhlíku tvořily dvojnou vazbu. Dvojné vazby mezi prvky se vytvářejí pomocí p-orbitalových slupek (nazývaných také pi orbitaly). Tyto orbitální slupky mají spíše tvar činek než kruhových orbitalů používaných v jednoduchých vazbách. To zabraňuje volné rotaci atomů uhlíku kolem dvojné vazby, protože by při rotaci došlo k přerušení dvojné vazby (obrázek 8.7). Jednoduchá vazba je tedy analogická dvěma prknům přibitým k sobě jedním hřebíkem. Desky se mohou volně otáčet kolem jediného hřebíku. Dvojitá vazba je naproti tomu analogická dvěma prknům přibitým k sobě dvěma hřebíky. V prvním případě se prkna mohou otáčet, zatímco v druhém případě se otáčet nemohou.

Obrázek 8.7 Vznik dvojné vazby vyžaduje použití vazeb typu pí. Aby mohly molekuly vytvářet dvojné vazby, musí elektrony sdílet překrývající se pi-orbitaly mezi dvěma atomy. To vyžaduje, aby pi-orbitály ve tvaru činky (znázorněné vlevo) zůstaly během tvorby dvojné vazby v pevné konformaci. To umožňuje vznik elektronových orbitalů, které mohou být sdíleny oběma atomy (znázorněno vpravo). Rotace kolem dvojné vazby by způsobila nesprávné uspořádání orbitalů pí, čímž by se dvojná vazba porušila.
Diagram převzat z: JoJanderivative work – Vladsinger (diskuse)
Pevná a rigidní povaha dvojné vazby vytváří možnost vzniku dalšího chirálního centra, a tím i možnost vzniku stereoizomerů. Nové stereoizomery vznikají, pokud jsou na každý z uhlíků zapojených do dvojné vazby navázány dva různé atomy nebo skupiny. Podívejte se například na dva chlorované uhlovodíky na obrázku 8.8. Na horním obrázku je znázorněn halogenovaný alkan. Rotace kolem této vazby uhlík-uhlík je možná a nevede k různým konformacím izomerů. Na dolním obrázku má halogenovaný alken omezenou rotaci kolem dvojné vazby. Všimněte si také, že každý uhlík zapojený do dvojné vazby je také vázán na dva různé atomy (vodík a chlor). Tato molekula tedy může tvořit dva stereoizomery: jeden, který má oba atomy chloru na stejné straně dvojné vazby, a druhý, kde se chlory nacházejí na opačných stranách dvojné vazby.
Obrázek 8.8 Dvojná vazba alkenů může tvořit geometrické izomery. (a) Ukazuje volnou rotaci kolem jednoduché vazby uhlík-uhlík ve struktuře alkanů. (b) Ukazuje pevnou polohu dvojné vazby uhlík-uhlík, která vede ke vzniku geometických (prostorových) izomerů.
Pro tuto část se nebudeme zabývat pojmenováním, které je také součástí tohoto videonávodu.(Poznámka: Veškerý obsah Khan Academy je k dispozici zdarma s využitím licence CC-BY-NC-SA na adrese www.khanacademy.org )
Cis-Trans pojmenování
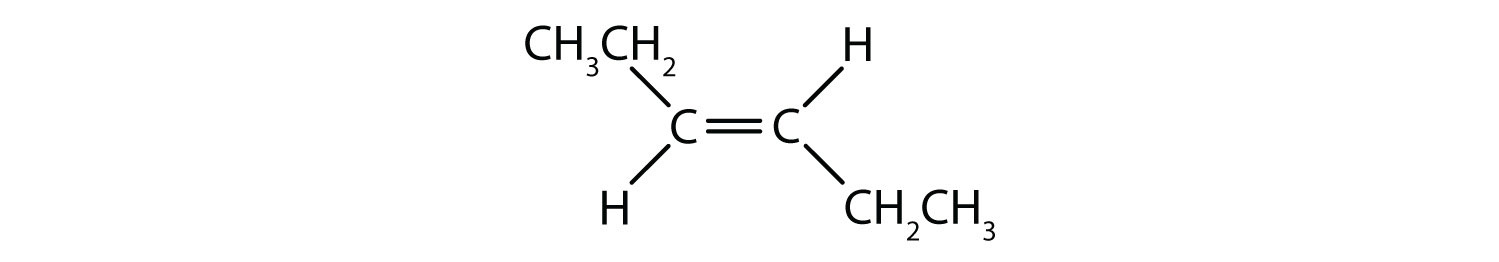
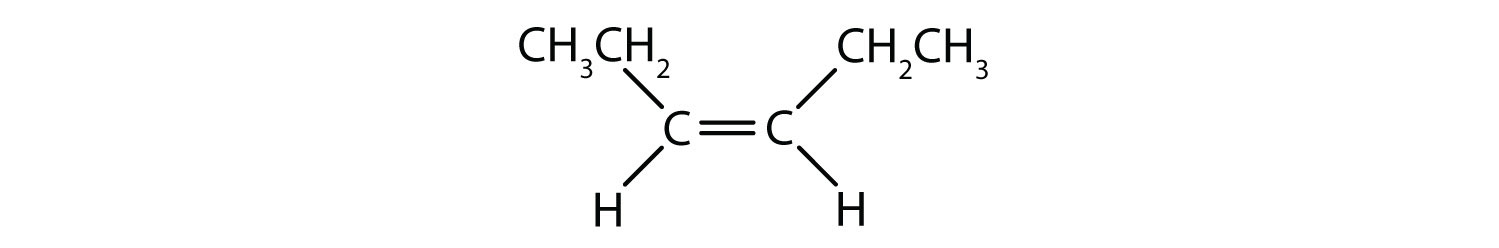
Systém cis-trans pojmenování lze použít k rozlišení jednoduchých izomerů, kde každý uhlík dvojné vazby má na sobě navázanou sadu identických skupin. Například na obrázku 8.8b má každý uhlík, který se účastní dvojné vazby, připojen chlor a také vodík. Systém cis a trans určuje, zda jsou identické skupiny na stejné straně (cis) dvojné vazby, nebo zda jsou na opačné straně (trans) dvojné vazby. Například pokud jsou atomy vodíku na opačné straně dvojné vazby, říká se, že vazba je v trans konformaci. Pokud jsou vodíkové skupiny na stejné straně dvojné vazby, říká se, že vazba je v cis konformaci. Všimněte si, že můžete také říci, že pokud jsou obě chlorové skupiny na opačné straně dvojné vazby, je molekula v trans konformaci, nebo pokud jsou na stejné straně dvojné vazby, je molekula v cis konformaci.
K určení, zda je molekula v konformaci cis nebo trans, je užitečné nakreslit přerušovanou čáru středem dvojné vazby a poté zakroužkovat shodné skupiny, jak je znázorněno na obrázku 8.9. V případě, že je molekula v konformaci cis nebo trans, je vhodné nakreslit přerušovanou čáru středem dvojné vazby. Obě molekuly znázorněné na obrázku 8.9 se jmenují 1,2-dichlorethen. Označení cis a trans tedy pouze definuje stereochemii kolem dvojné vazby, nemění celkovou identitu molekuly. Cis a trans izomery však mají často odlišné fyzikální a chemické vlastnosti, což je dáno pevnou povahou vazeb v prostoru.
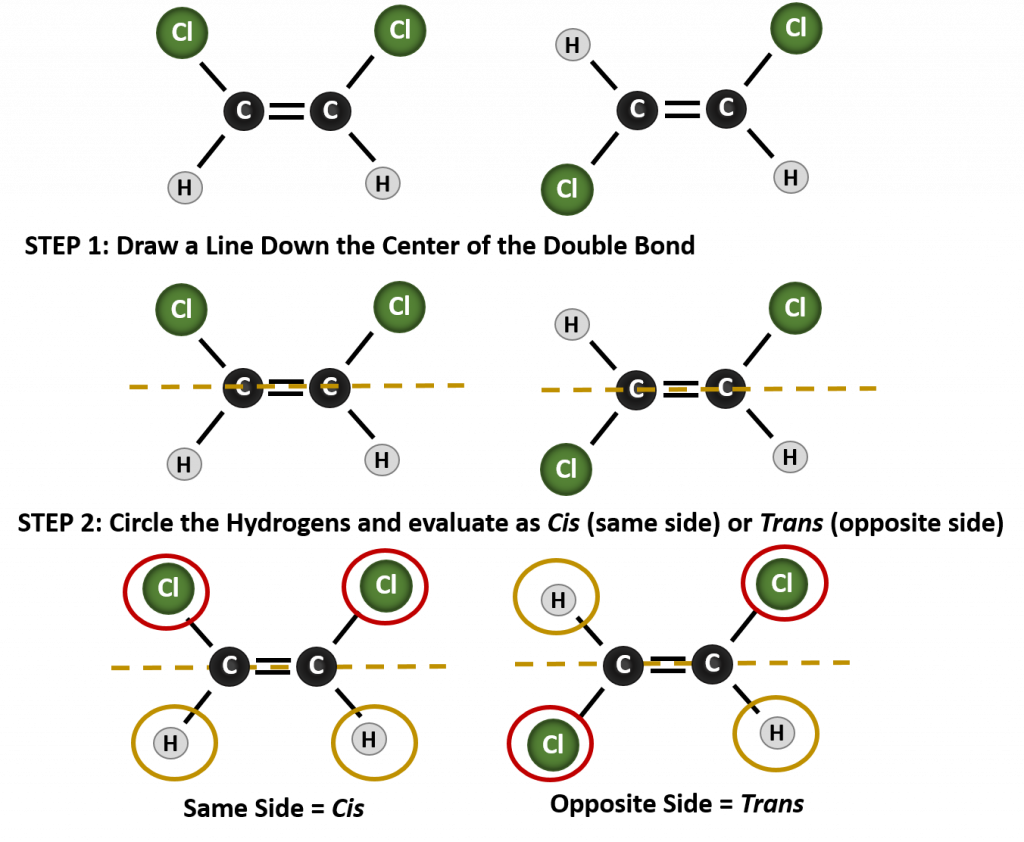
Obrázek 8.9 Průvodce určováním cis nebo trans konformací.
(Poznámka: Veškerý obsah Khan Academy je k dispozici zdarma s využitím licence CC-BY-NC-SA na adrese www.khanacademy.org )
Cis-trans izomerie se vyskytuje také v cyklických sloučeninách. V kruhových strukturách nemohou skupiny rotovat kolem žádné z vazeb uhlík-uhlík v kruhu. Proto mohou být skupiny buď na stejné straně kruhu (cis), nebo na opačných stranách kruhu (trans). Pro naše účely zde představujeme všechny cykloalkany jako planární struktury a polohy skupin uvádíme buď nad, nebo pod rovinou kruhu.

K vašemu zdraví
Pravděpodobně nejčastějším místem, kde v každodenním životě uslyšíte zmínku o cis-trans konformacích, je supermarket nebo ordinace vašeho lékaře. Týká se to naší spotřeby tuků ve stravě. Nevhodná nebo nadměrná konzumace tuků ve stravě je spojována s mnoha zdravotními poruchami, jako je cukrovka a ateroskleróza a ischemická choroba srdeční. Jaké jsou tedy rozdíly mezi nasycenými a nenasycenými tuky a co jsou to trans-tuky a proč jsou takovým zdravotním problémem?“

Obrázek 8.10 Běžné zdroje tuků v potravě.
Foto z: TyMaHe
Nejběžnější formou tuků v potravě a hlavní složkou tělesného tuku u lidí i jiných živočichů jsou triglyceridy (TAG). TAG, jak ukazuje obrázek 8.10, jsou tvořeny jednou molekulou glycerolu a třemi molekulami mastných kyselin, které jsou spojeny esterovou vazbou. V této části se zaměříme na strukturu dlouhých ocásků mastných kyselin, které mohou být složeny z alkanických nebo alkenických struktur. Kapitola 10 se více zaměří na tvorbu esterových vazeb.

Obrázek 8.11. Příklad struktury triglyceridu (TAG). Všimněte si, že každý triglycerid má tři mastné kyseliny s dlouhým řetězcem vycházející z glycerolové páteře. Každá mastná kyselina může mít různý stupeň nasycení a nenasycení.
Struktura převzata z: Wolfgang Schaefer
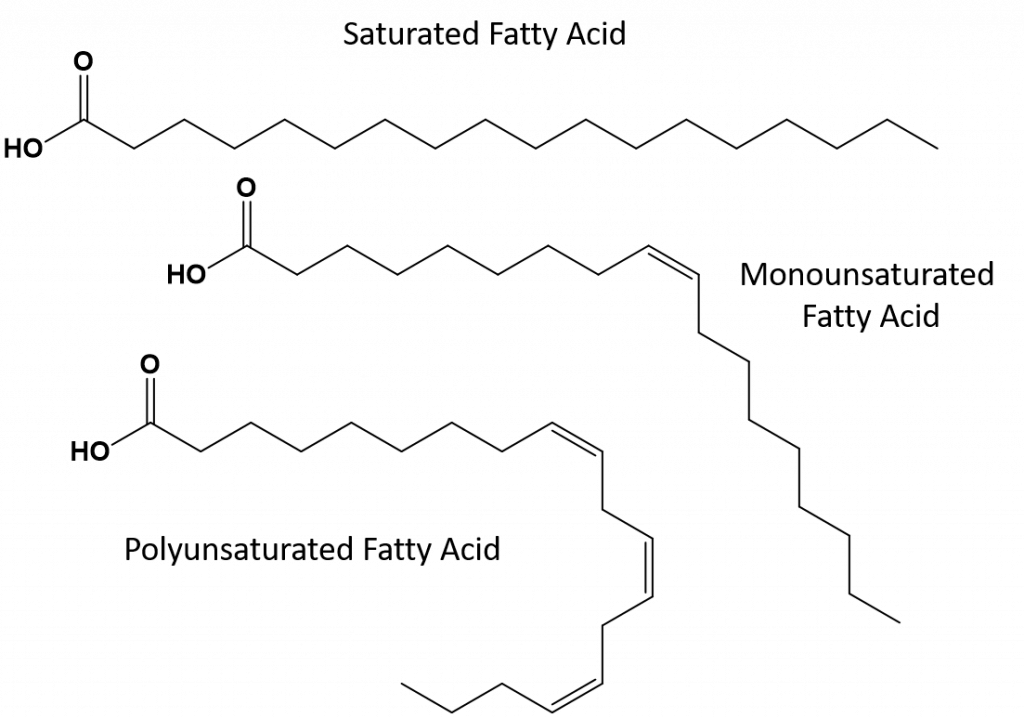
Tuky, které jsou plně nasycené, budou mít pouze mastné kyseliny s dlouhými alkanickými ocasy. Říká se, že jsou „nasycené“ atomy vodíku. Nasycené tuky jsou v americké stravě běžné a nacházejí se v červeném mase, mléčných výrobcích, jako je mléko, sýry a máslo, kokosovém oleji a jsou obsaženy v mnoha pekařských výrobcích. Nasycené tuky jsou při pokojové teplotě obvykle pevné. Je to proto, že alkany s dlouhým řetězcem se mohou skládat dohromady a mají více mezimolekulárních londýnských disperzních sil. Díky tomu mají nasycené tuky vyšší teploty tání a varu než nenasycené tuky obsažené v mnoha rostlinných olejích.
Většina nenasycených tuků vyskytujících se v přírodě je v cis-konformaci, jak je znázorněno na obrázku 8.11. Všimněte si, že mastné kyseliny zobrazené na obrázku 8.11 jsou nakresleny z pohodlnosti, aby se na ně dobře dívalo a nezabíraly příliš mnoho místa na papíře, ale zapsané vazebné úhly nezobrazují dostatečně skutečnou prostorovou orientaci molekul. Když jsou mastné kyseliny z TAG znázorněné na obrázku 8.11 nakresleny se správnými vazebnými úhly, je snadno vidět, že cis-dvojné vazby způsobují ohyby alkenového řetězce (obr. 8.12).
Obrázek 8: Mastné kyseliny z TAG znázorněné na obrázku 8.11.12 Cis-dvojné vazby způsobují ohyby ve struktuře mastných kyselin
Mononenasycené a polynenasycené tuky se proto nemohou tak snadno skládat na sebe a nemají tolik mezimolekulárních přitažlivých sil ve srovnání s nasycenými tuky. V důsledku toho mají nižší teploty tání a varu a při pokojové teplotě bývají kapalné. Bylo prokázáno, že snížení nebo nahrazení nasycených tuků mono- a polynenasycenými tuky ve stravě pomáhá snížit hladinu cholesterolu ve formě LDL (low-density-lipoprotein), který je rizikovým faktorem koronárních srdečních onemocnění.
Trans-tuky naopak obsahují dvojné vazby, které jsou v trans-konformaci. Tvar mastných kyselin je tedy lineární, podobně jako u nasycených tuků. Trans tuky mají také podobné teploty tání a varu ve srovnání s nasycenými tuky. Na rozdíl od nasycených tuků se však transmastné kyseliny v přírodě běžně nevyskytují a mají negativní vliv na zdraví. Transmastné kyseliny vznikají především jako vedlejší produkt při zpracování potravin (zejména při hydrogenaci, při níž vznikají margaríny a ztužené tuky) nebo při vaření, zejména při smažení ve fritéze. Mnoho provozoven rychlého občerstvení používá transmastné kyseliny při fritování, protože transmastné kyseliny mohou být použity mnohokrát, než je třeba je nahradit. Konzumace transmastných tuků zvyšuje hladinu LDL cholesterolu v těle (špatný cholesterol, který je spojován s ischemickou chorobou srdeční) a má tendenci snižovat hladinu lipoproteinů s vysokou hustotou (HDL) cholesterolu (dobrý cholesterol v těle). Konzumace transmastných kyselin zvyšuje riziko srdečních onemocnění a mrtvice a vzniku cukrovky II. typu. Riziko je natolik vysoké, že řada zemí, včetně Norska, Švédska, Rakouska a Švýcarska, používání transmastných kyselin zakázala. Ve Spojených státech amerických Úřad pro kontrolu potravin a léčiv (FDA) nedávno přijal opatření, které má do roku 2018 postupně ukončit používání transmastných kyselin v potravinách. Odhaduje se, že toto opatření zabrání 20 000 infarktů a 7 000 úmrtí ročně.
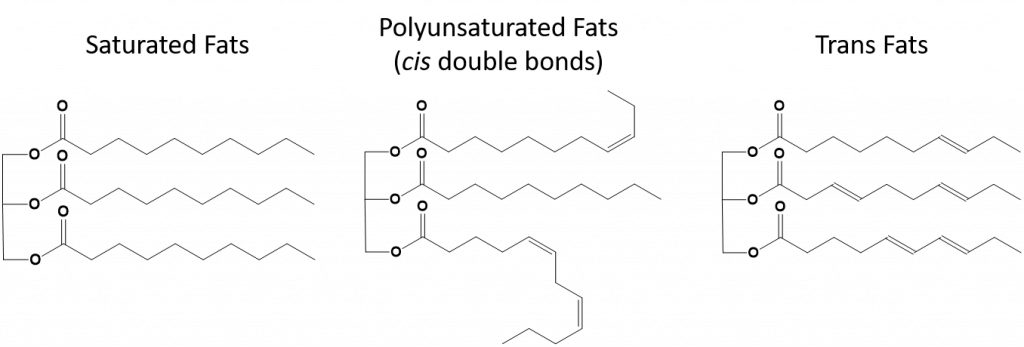
Obrázek 8.13 Strukturní rozdíly v nasycených, polynenasycených a trans tucích.
(Poznámka: Veškerý obsah Khanovy akademie je k dispozici zdarma s využitím licence CC-BY-NC-SA na adrese www.khanacademy.org )
Klíčové faktory pro určení Cis/Trans izomerizace
- Sloučenina musí obsahovat dvojnou nebo trojnou vazbu nebo mít kruhovou strukturu, která neumožní volnou rotaci kolem vazby uhlík-uhlík.
- Sloučenina musí mít ke každému uhlíku zapojenému do dvojné nebo trojné vazby uhlík-uhlík připojeny dvě neidentické skupiny.
Pracovní příklad
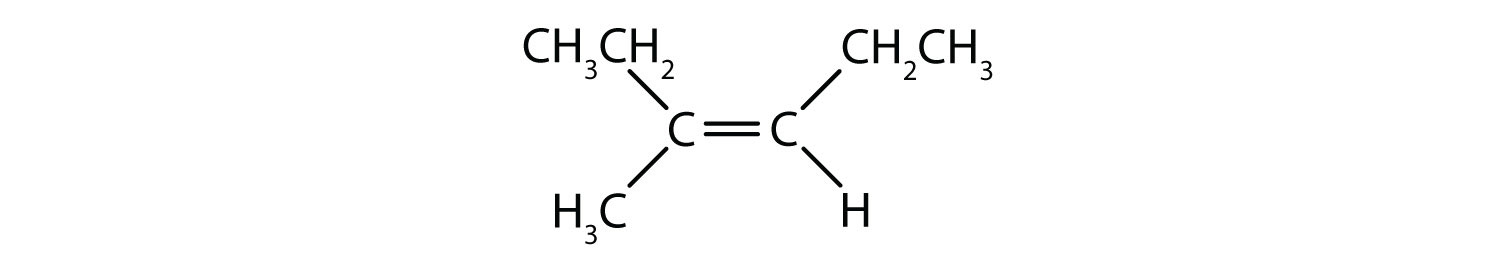
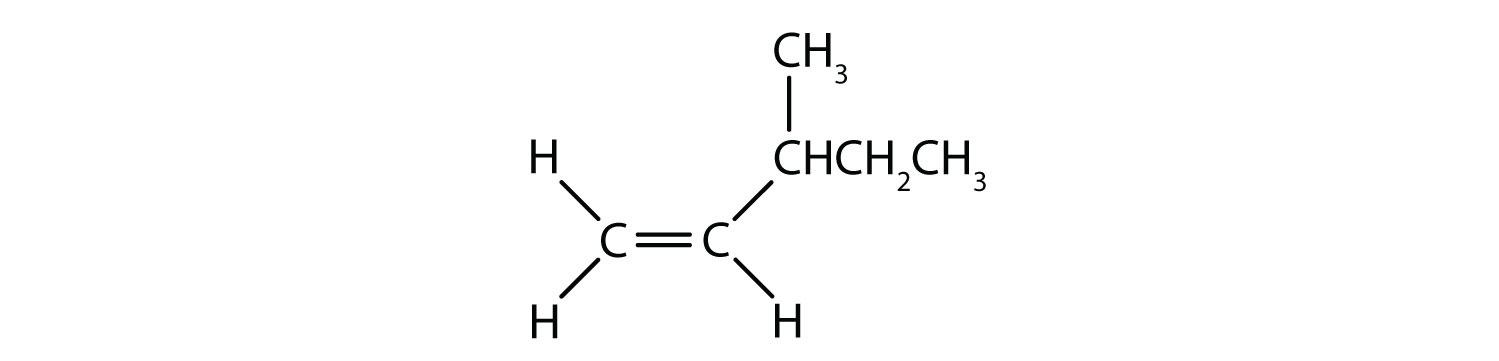
Které sloučeniny mohou existovat jako cis-trans (geometrické) izomery? Nakreslete je.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CH2CH3
- CH3CH=CH2CH3
Řešení
Všechny čtyři struktury mají dvojnou vazbu a splňují tak pravidlo 1 pro cis-trans izomerii.
-
Tato sloučenina splňuje pravidlo 2; má dvě neidentické skupiny na každém atomu uhlíku (H a Cl na jednom a H a Br na druhém). Existuje jako cis i trans izomery:

- Tato sloučenina má na jednom ze svých dvojně vázaných atomů uhlíku dva atomy vodíku; nesplňuje pravidlo 2 a neexistuje jako cis a trans izomery.

- Tato sloučenina má na jednom ze svých dvojně vázaných atomů uhlíku dvě methylové skupiny (CH3). Nevyhovuje pravidlu 2 a neexistuje jako cis a trans izomery.

-
Tato sloučenina splňuje pravidlo 2; má dvě neidentické skupiny na každém atomu uhlíku a existuje jako cis i trans izomery:

Cvičení na procvičení dovedností
-
Které sloučeniny mohou existovat jako cis-trans izomery? Nakreslete je.
- CH2=CH2CH2CH3
- CH3CH=CH2CH3
- CH3CH2CH=CH2CH3
-
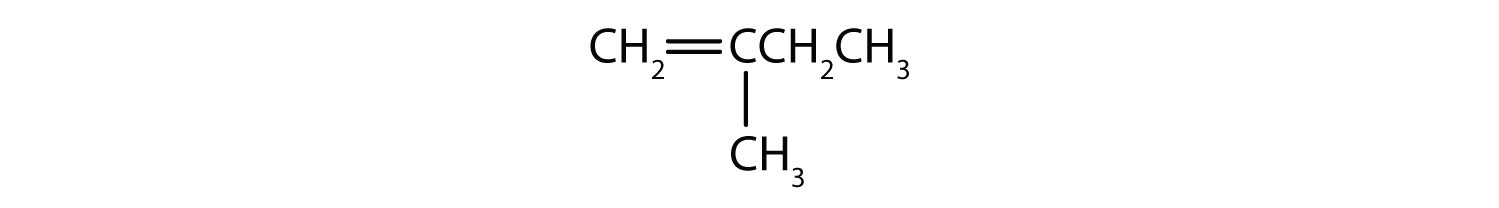
-
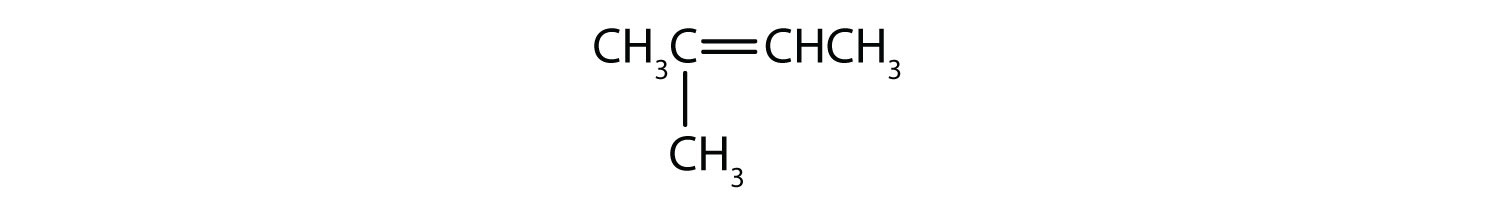
.
Cvičení na přehled pojmů
-
Co jsou cis-?trans (geometrické) izomery? Které dva typy sloučenin mohou vykazovat cis-trans izomerii
-
Klasifikujte každou sloučeninu jako cis izomer, trans izomer nebo ani jeden z nich.
-
Odpovědi
-
Cis.Trans izomery jsou sloučeniny, které mají různé konfigurace (skupiny trvale na různých místech v prostoru) díky přítomnosti pevné struktury v jejich molekule. Alkeny a cyklické sloučeniny mohou vykazovat cis-trans izomerii.
-
- trans
- cis
- cis
- neither
Klíčové poznatky
- Cis-.trans (geometrická) izomerie existuje, když je v molekule omezena rotace a na každém atomu uhlíku jsou dvě různé skupiny, které se podílejí na chemické vazbě.
(Zpět na začátek)
E-Z názvosloví
Složitější situace nastává, když jsou na atomech uhlíku připojeny 4 různé skupiny, které se podílejí na vzniku dvojné vazby. V tomto případě nelze použít systém pojmenování cis-trans, protože není uvedeno, které skupiny jsou pojmenováním popisovány. Například v níže uvedené molekule lze říci, že chlor je trans na bromovou skupinu, nebo lze říci, že chlor je cis na methylovou skupinu (CH3). Pouhé napsání cis nebo trans v tomto případě tedy jasně nevymezuje prostorovou orientaci skupin vzhledem k dvojné vazbě.
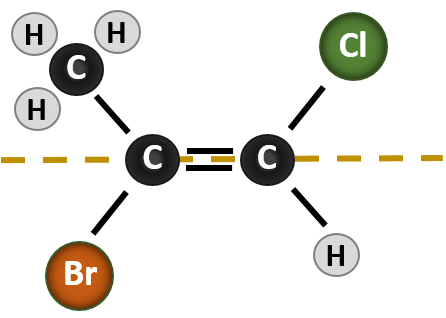
Pojmenování různých stereoizomerů, které v této situaci vznikají, vyžaduje znalost pravidel priority. Připomeňme si z kapitoly 5, že v Cahn-Ingold-Prelogově (CIP) systému priorit mají skupiny, které jsou připojeny k chirálnímu uhlíku, prioritu na základě svého atomového čísla (Z). Atomy s vyšším atomovým číslem (více protonů) mají vyšší prioritu (tj. S > P > O > N > C > H). Pro tento systém názvosloví se místo systému cis/trans používá označení (Z) a (E). (E) pochází z německého slova entgegen, tedy opačný. Pokud jsou tedy skupiny s vyšší prioritou na opačné straně dvojné vazby, říká se, že vazba je v konformaci (E). (Z) naopak pochází z německého slova zusammen, tedy společně. Pokud jsou tedy skupiny s vyšší prioritou na stejné straně dvojné vazby, říká se, že vazba je v konformaci (Z). Obrázek 8.14 ukazuje kroky používané při přiřazování (E) nebo (Z) konformací molekuly.
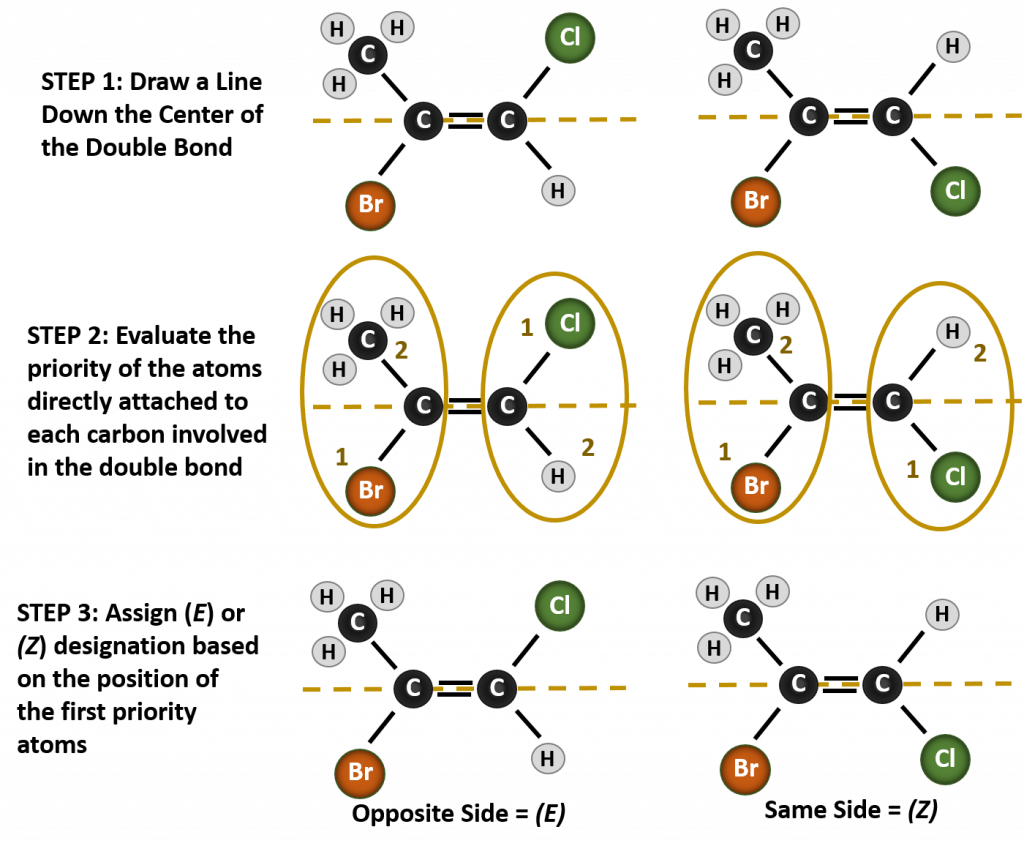
Obrázek 8.14 Kroky používané při přiřazování (E) a (Z) konformací.
(Poznámka: Veškerý obsah Khan Academy je k dispozici zdarma s využitím licence CC-BY-NC-SA na adrese www.khanacademy.org )
(Zpět na začátek)
.