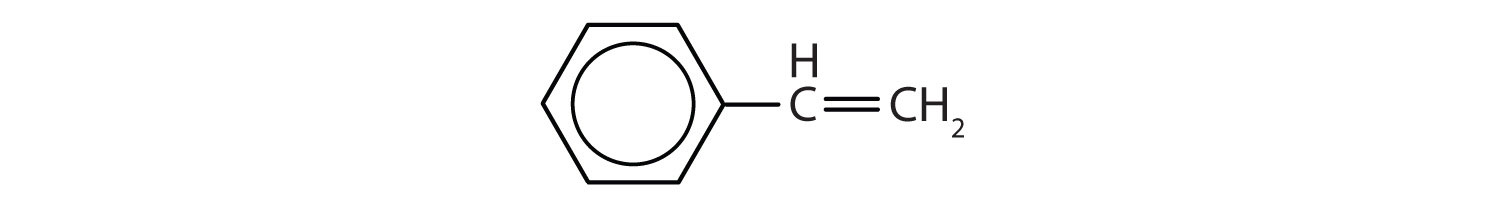
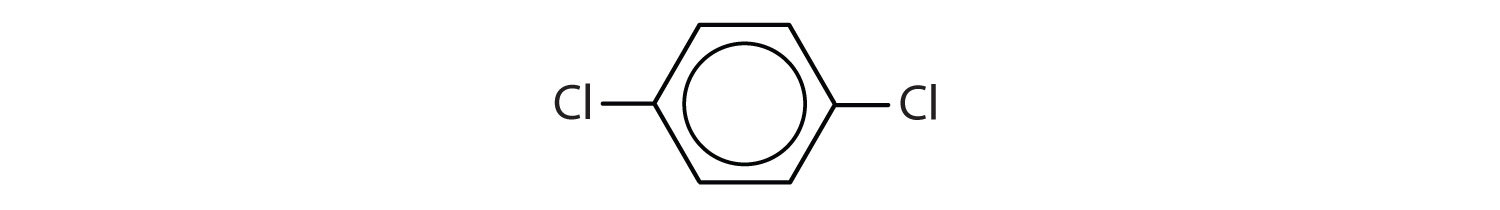
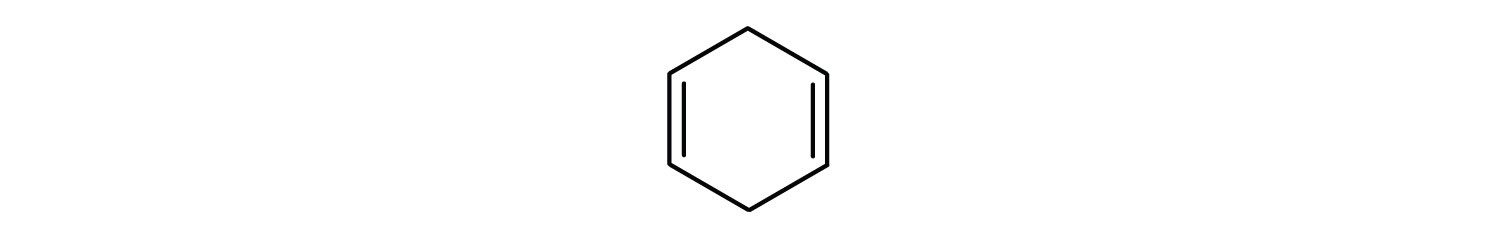
Les hydrocarbures aromatiques sont définis par le fait qu’ils ont des structures cycliques à 6 membres avec des doubles liaisons alternées (Fig 8.2).
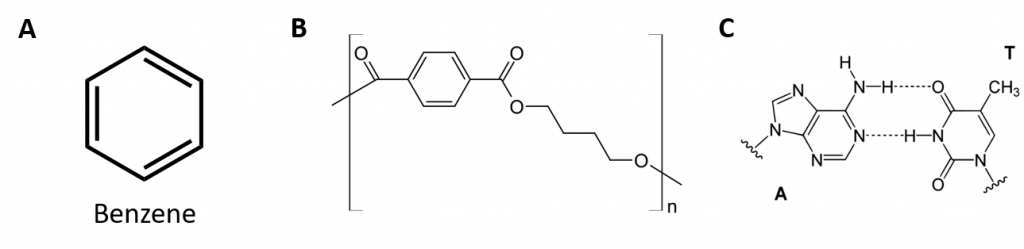
Figure 8.2 : Hydrocarbures aromatiques. Les hydrocarbures aromatiques contiennent la structure cyclique benzénique à 6 chaînons (A) qui est caractérisée par des doubles liaisons alternées. L’Ultradur, PBT est un polymère plastique qui contient un groupe fonctionnel aromatique. Le monomère répétitif de l’Ultradur est représenté en (B). On trouve l’Ultradur dans les pommeaux de douche, les poils de brosse à dents, les boîtiers en plastique pour les câbles à fibres optiques, ainsi que dans les composants extérieurs et intérieurs des automobiles. Des molécules importantes sur le plan biologique, comme l’acide désoxyribonucléique, l’ADN (C), contiennent également une structure cyclique aromatique.
Ils ont donc des formules qui peuvent être dessinées comme des alcènes cycliques, ce qui les rend insaturés. Cependant, en raison de la structure cyclique, les propriétés des cycles aromatiques sont généralement très différentes, et ils ne se comportent pas comme des alcènes typiques. Les composés aromatiques servent de base à de nombreux médicaments, antiseptiques, explosifs, solvants et plastiques (par exemple, les polyesters et le polystyrène).
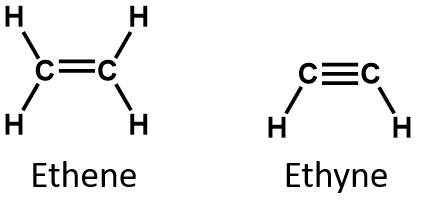
Les deux composés insaturés les plus simples – l’éthylène (éthène) et l’acétylène (éthyne) – étaient autrefois utilisés comme anesthésiques et ont été introduits dans le domaine médical en 1924. Cependant, on a découvert que l’acétylène forme des mélanges explosifs avec l’air, de sorte que son utilisation médicale a été abandonnée en 1925. On pensait que l’éthylène était plus sûr, mais il a lui aussi été impliqué dans de nombreux incendies et explosions mortels pendant l’anesthésie. Malgré cela, il est resté un anesthésique important jusque dans les années 1960, lorsqu’il a été remplacé par des anesthésiques ininflammables comme l’halothane (CHBrClCF3).
- (Back to the Top)
- 8.1 Aperçu des alcènes et des alcynes
- (Back to the Top)
- 8.2 Propriétés des alcènes
- Looking Closer : Note environnementale
- Exercices de révision des concepts
- Réponses
- Clef à retenir
- Exercices
- Réponse
- Exercices de révision des concepts
- Réponses
- Clef à retenir
- 8.3 Alcynes
- Note
- Exercices de révision des concepts
- Principes à retenir
- Exercices
- (Back to the Top)
- 8.4. Composés aromatiques : Benzène
- Note
- Pour votre santé : Le benzène et nous
- Exercices de révision des concepts
- Reconnaître les composés aromatiques
- Exercice de construction de compétences
- Clef à retenir
- (Retour en haut de page)
- Hydrocarbures aromatiques polycycliques
- Pour votre santé : Hydrocarbures aromatiques polycycliques et cancer
- Composés biologiquement importants avec des anneaux benzéniques
- Note
- 8.5 Isomères géométriques
- Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur la structure des alcènes.
- Nomenclature cis-trans
- Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur l’isomérisation Cis/Trans
- À votre santé
- Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur les graisses saturées, insaturées et trans
- Facteurs clés pour déterminer l’isomérisation Cis/Trans
- Exemple travaillé
- Exercice de construction de compétences
- Exercices de révision des concepts
- Réponses
- Key Takeaway
- (Back to the Top)
- Nomenclature E-Z
- Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur l’isomérisation E/Z.
- (Back to the Top)
(Back to the Top)
8.1 Aperçu des alcènes et des alcynes
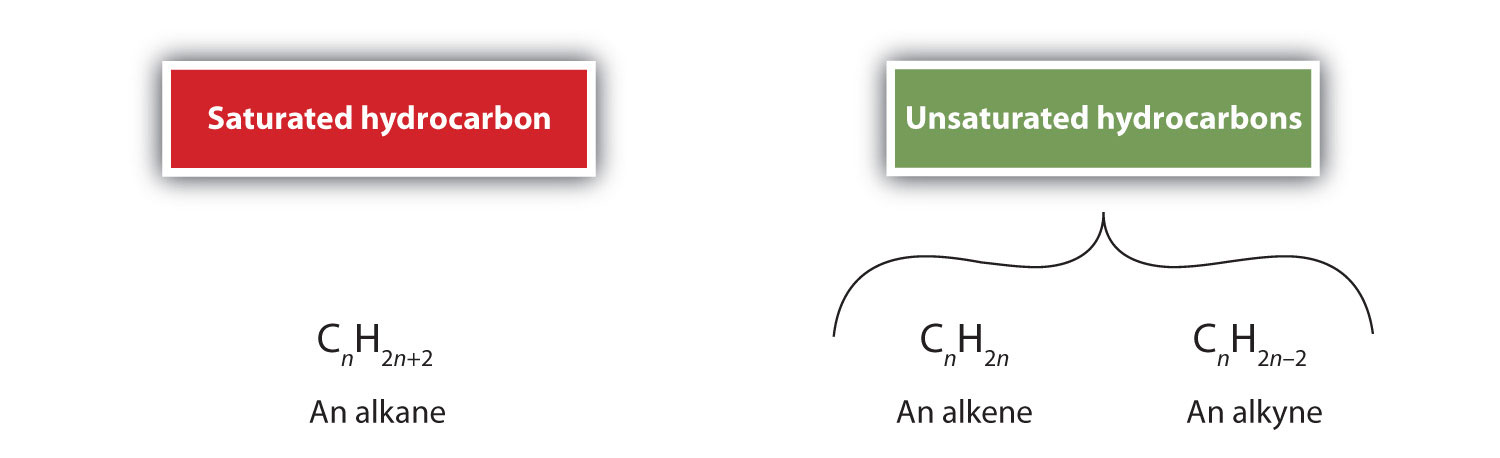
Par définition, les alcènes sont des hydrocarbures comportant une ou plusieurs doubles liaisons carbone-carbone (R2C=CR2), tandis que les alcynes sont des hydrocarbures comportant une ou plusieurs triples liaisons carbone-carbone (R-C≡C-R). Collectivement, ils sont appelés hydrocarbures insaturés, qui sont définis comme des hydrocarbures ayant une ou plusieurs liaisons multiples (doubles ou triples) entre les atomes de carbone. En raison de la nature de la double ou triple liaison, les alcènes et les alcynes ont moins d’atomes d’hydrogène que les alcanes comparables ayant le même nombre d’atomes de carbone. Mathématiquement, cela peut être indiqué par les formules générales suivantes :
Dans un alcène, la double liaison est partagée par les deux atomes de carbone et n’implique pas les atomes d’hydrogène, bien que la formule condensée ne rende pas ce point évident, c’est-à-dire que la formule condensée de l’éthène est CH2CH2. La nature de la liaison double ou triple d’une molécule est encore plus difficile à discerner à partir des formules moléculaires. Notez que la formule moléculaire de l’éthène est C2H4, alors que celle de l’éthyne est C2H2. Ainsi, jusqu’à ce que vous soyez plus familier avec le langage de la chimie organique, il est souvent plus utile de dessiner des structures linéaires ou partiellement condensées, comme indiqué ci-dessous :
(Back to the Top)
8.2 Propriétés des alcènes
Les propriétés physiques des alcènes sont similaires à celles des alcanes. Le tableau 8.1 montre que les points d’ébullition des alcènes à chaîne droite augmentent avec la masse molaire, tout comme pour les alcanes. Pour des molécules ayant le même nombre d’atomes de carbone et la même forme générale, les points d’ébullition ne diffèrent généralement que légèrement, comme on peut s’y attendre pour des substances dont la masse molaire ne diffère que de 2 u (équivalent à deux atomes d’hydrogène). Comme les autres hydrocarbures, les alcènes sont insolubles dans l’eau mais solubles dans les solvants organiques.
Certains alcènes représentatifs – leurs noms, leurs structures et leurs propriétés physiques – sont donnés dans le tableau 8.1.
Tableau 8.1 Propriétés physiques de quelques alcènes sélectionnés
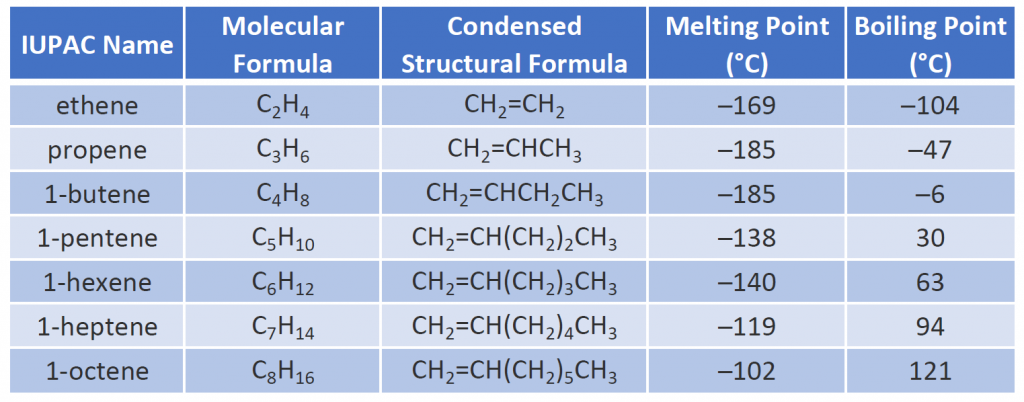
Les deux premiers alcènes du tableau 8.1 -éthène et propène, sont le plus souvent appelés par leurs noms communs -éthylène et propylène, respectivement. L’éthylène est un produit chimique commercial majeur. L’industrie chimique américaine produit environ 25 milliards de kilogrammes d’éthylène par an, soit plus que tout autre produit chimique organique synthétique. Plus de la moitié de cet éthylène entre dans la fabrication du polyéthylène, l’une des matières plastiques les plus connues. Le propylène est également un produit chimique industriel important. Il est transformé en plastiques, en alcool isopropylique et en une variété d’autres produits.
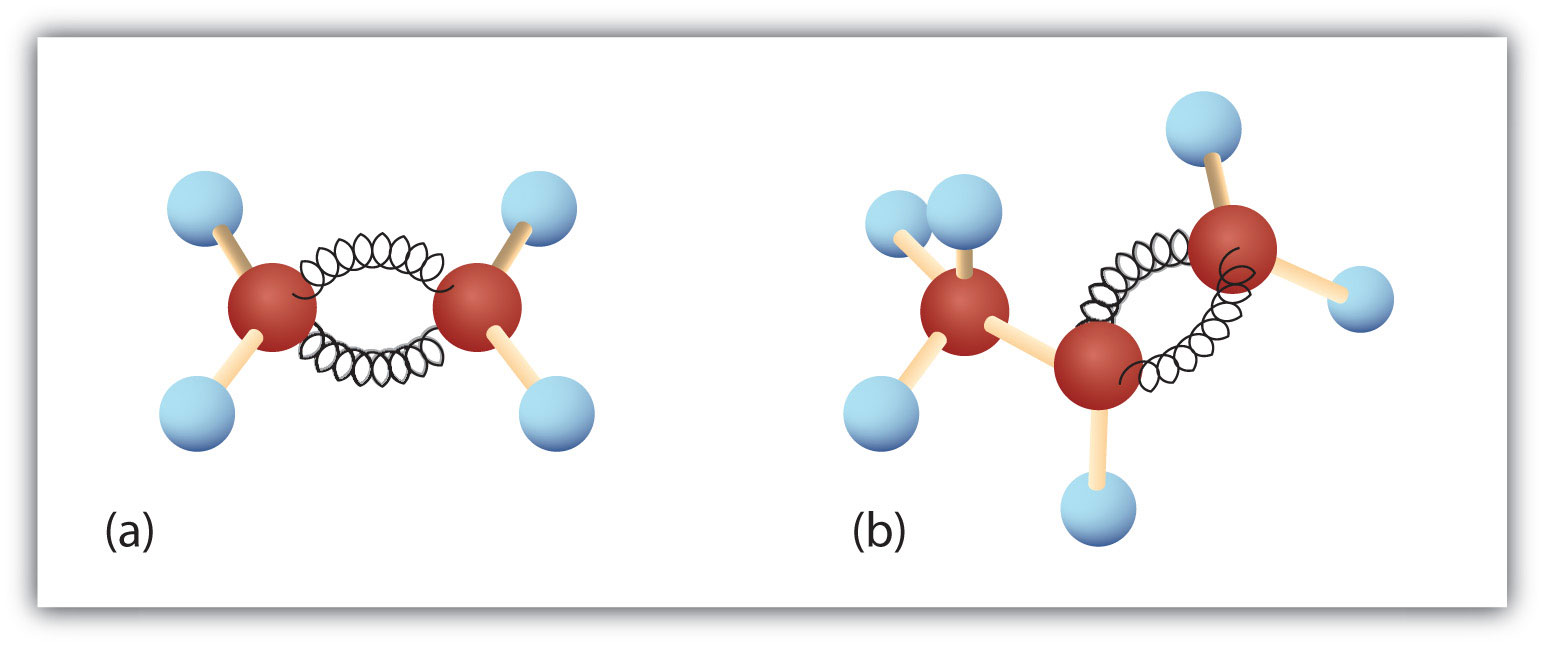
Figure 8.3. L’éthène et le propène. Les modèles à bille et à ressort de l’éthène/éthylène (a) et du propène/propylène (b) montrent leurs formes respectives, notamment les angles de liaison.
Looking Closer : Note environnementale
Les alcènes sont largement présents dans la nature. Les fruits et légumes qui mûrissent dégagent de l’éthylène, qui déclenche une nouvelle maturation. Les transformateurs de fruits introduisent artificiellement de l’éthylène pour accélérer le processus de mûrissement ; une exposition à seulement 0,1 mg d’éthylène pendant 24 heures peut faire mûrir 1 kg de tomates. Malheureusement, ce procédé ne reproduit pas exactement le processus de mûrissement, et les tomates cueillies vertes et traitées de cette façon n’ont pas vraiment le goût des tomates mûries sur pied fraîchement sorties du jardin.
Les autres alcènes présents dans la nature comprennent le 1-octène, un constituant de l’huile de citron, et l’octadécène (C18H36) que l’on trouve dans le foie des poissons. Les diènes (deux doubles liaisons) et les polyènes (trois doubles liaisons ou plus) sont également courants. Le butadiène (CH2=CHCH=CH2) est présent dans le café. Le lycopène et les carotènes sont des polyènes isomères (C40H56) qui donnent les belles couleurs rouge, orange et jaune aux pastèques, tomates, carottes et autres fruits et légumes. La vitamine A, essentielle à une bonne vision, est dérivée d’un carotène. Le monde serait beaucoup moins coloré sans les alcènes.

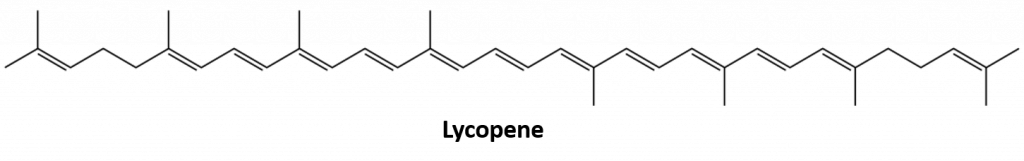
Figure 8.4 La couleur rouge vif des tomates est due au lycopène.
Photo de : © Thinkstock ; Structure du lycopène de : Jeff Dahl
Exercices de révision des concepts
-
Décrivez brièvement les propriétés physiques des alcènes. Comment ces propriétés se comparent-elles à celles des alcanes ?
-
Sans consulter de tableaux, classez les alcènes suivants par ordre croissant de point d’ébullition :

Réponses
-
Les alcènes ont des propriétés physiques (faible point d’ébullition, insoluble dans l’eau) assez similaires à celles de leurs alcanes correspondants.
-
éthène <propène < 1-butène <1-hexène
Clef à retenir
- Les propriétés physiques des alcènes sont très proches de celles des alcanes : leur point d’ébullition augmente avec la masse molaire, et ils sont insolubles dans l’eau.
Exercices
-
Sans vous référer à un tableau ou à une autre référence, prédisez quel membre de chaque paire a le point d’ébullition le plus élevé.
- 1-pentène ou 1-butène
- 3-heptène ou 3-nonène
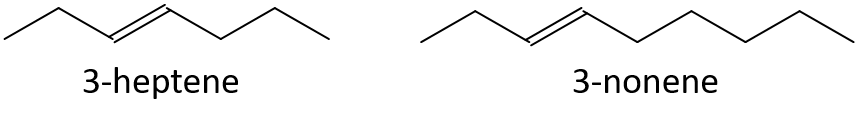
- 1-pentène ou 1-butène
-
Quel est un bon solvant pour le cyclohexène ? le pentane ou l’eau ?
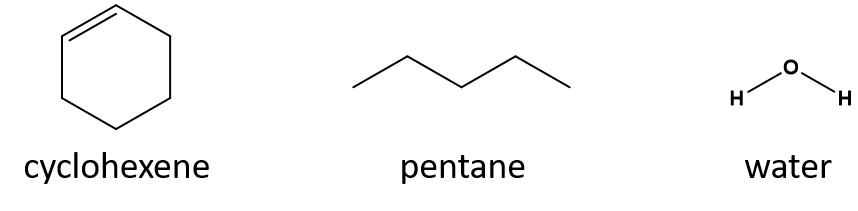
Réponse
-
- 1-pentène
- 3-nonène
Exercices de révision des concepts
-
Identifiez brièvement les distinctions importantes entre un hydrocarbure saturé et un hydrocarbure insaturé.
-
Identifiez brièvement les distinctions importantes entre un alcène et un alcane.
-
Classez chaque composé comme saturé ou insaturé. Identifiez chacun comme un alcane, un alcène ou un alcyne.
-
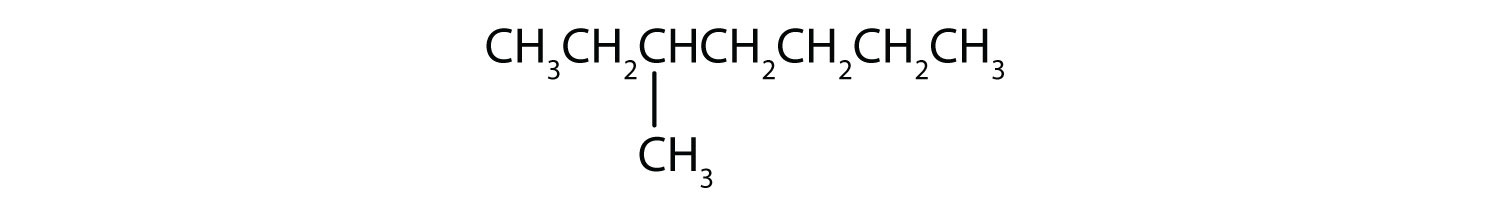
- CH3CH2C≡CCH3
-

-
Réponses
-
Les hydrocarbures insaturés ont des liaisons doubles ou triples et sont assez réactifs ; les hydrocarbures saturés n’ont que des liaisons simples et sont assez peu réactifs.
-
Un alcène a une double liaison ; un alcane n’a que des liaisons simples.
-
- saturé ; alcane
- insaturé ; alcyne
- insaturé ; alcène
Clef à retenir
- Les alcènes sont des hydrocarbures possédant une double liaison carbone-carbone.
8.3 Alcynes
L’alcyne le plus simple – un hydrocarbure avec une triple liaison carbone-carbone – a la formule moléculaire C2H2 et est connu sous son nom commun – acétylène (Fig 8.5). Sa structure est H-C≡C-H.
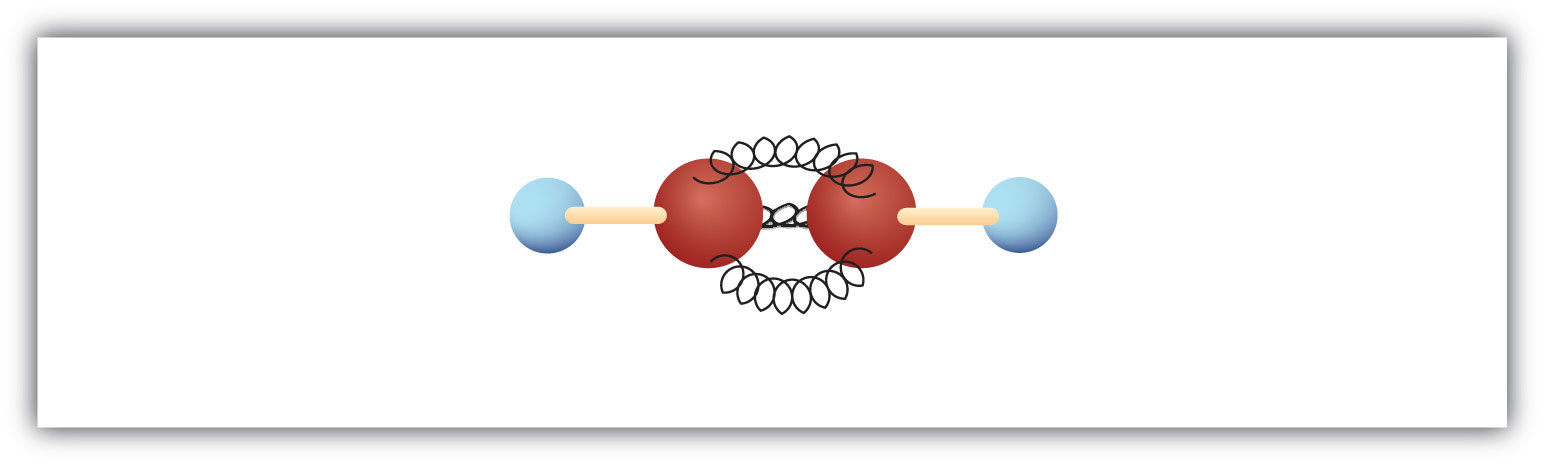
Figure 8.5 Modèle à bille et ressort de l’acétylène. L’acétylène (éthyne) est le membre le plus simple de la famille des alcynes.
Note
L’acétylène est utilisé dans les chalumeaux oxyacétyléniques pour couper et souder les métaux. La flamme d’un tel chalumeau peut être très chaude. La plupart de l’acétylène, cependant, est converti en intermédiaires chimiques qui sont utilisés pour fabriquer des plastiques vinyliques et acryliques, des fibres, des résines et une variété d’autres produits.
Les alcynes sont similaires aux alcènes dans leurs propriétés physiques et chimiques. Par exemple, les alcynes subissent de nombreuses réactions d’addition typiques des alcènes. Les noms de l’Union internationale de chimie pure et appliquée (UICPA) pour les alcynes sont parallèles à ceux des alcènes, sauf que la terminaison de la famille est -yne plutôt que -ène. Le nom UICPA de l’acétylène est éthyne. Les noms d’autres alcynes sont illustrés dans les exercices suivants.
Exercices de révision des concepts
-
Identifiez brièvement les différences importantes entre un alcène et un alcyne. En quoi sont-ils similaires ?
-
L’alcène (CH3)2CHCH2CH=CH2 est nommé 4-méthyl-1-pentène. Quel est le nom de (CH3)2CHCH2C≡CH ?
-
Les alcynes présentent-ils une isomérie cis-trans ? Expliquez.
Réponses
-
Les alcènes ont des doubles liaisons ; les alcynes ont des triples liaisons. Ils subissent tous deux des réactions d’addition.
-
4-méthyl-1-pentyne
-
Non ; un atome de carbone triplement lié ne peut former qu’une seule autre liaison. Il faudrait que deux groupes soient attachés pour montrer une isomérie cis-trans.
Principes à retenir
- Les alcynes sont des hydrocarbures avec des triples liaisons carbone-carbone et des propriétés très proches de celles des alcènes.
Exercices
-
Dessinez la structure de chaque composé.
- acétylène
- 3-méthyl-1-hexyne
-
Dessinez la structure de chaque composé.
- 4-méthyl-2-hexyne
- 3-octyne
-
Nommez chaque alcyne.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Réponses
-
- H-C≡C-H
-
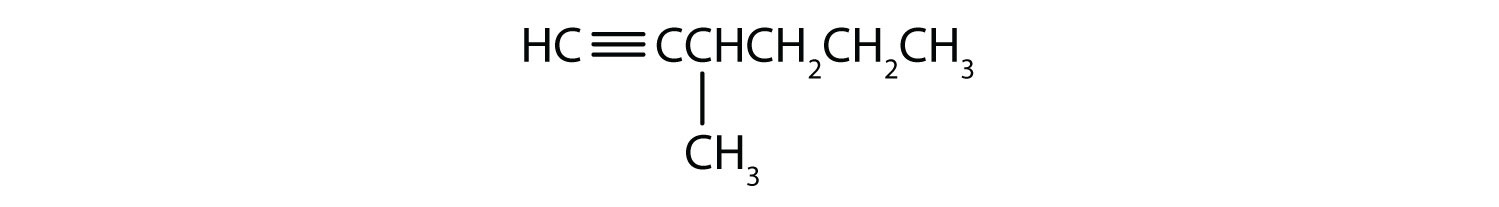
-
- 1-pentyne
- 2-hexyne
(Back to the Top)
8.4. Composés aromatiques : Benzène
Puis nous considérons une classe d’hydrocarbures dont la formule moléculaire ressemble à celle des hydrocarbures insaturés, mais qui, contrairement aux alcènes, ne subissent pas facilement de réactions d’addition. Ces composés constituent une classe distincte, appelée hydrocarbures aromatiques. Les hydrocarbures aromatiques sont des composés qui contiennent une structure cyclique benzénique.Le composé aromatique le plus simple est le benzène (C6H6) et il a une grande importance commerciale, mais il a aussi des effets délétères notables sur la santé (voir « Pour votre santé : le benzène et nous »).
La formule C6H6 semble indiquer que le benzène a un degré élevé d’insaturation. (L’hexane, l’hydrocarbure saturé à six atomes de carbone a la formule C6H14 – huit atomes d’hydrogène de plus que le benzène). Cependant, malgré ce faible niveau de saturation apparent, le benzène est plutôt peu réactif. Cela est dû à la structure de résonance formée à partir de la structure à double liaison alternée du cycle aromatique.

Note
Le benzène est un liquide qui sent l’essence, bout à 80°C et congèle à 5,5°C. C’est l’hydrocarbure aromatique produit dans le plus grand volume. Il était autrefois utilisé pour décaféiner le café et était un composant important de nombreux produits de consommation, tels que les décapants pour peinture, les ciments pour caoutchouc et les détachants pour nettoyage à sec. Il a été retiré de la formulation de nombreux produits dans les années 1950, mais d’autres ont continué à utiliser le benzène dans des produits jusque dans les années 1970, lorsqu’il a été associé à des décès dus à la leucémie. Le benzène est encore important dans l’industrie en tant que précurseur dans la production de plastiques (comme le Styrofoam et le nylon), de médicaments, de détergents, de caoutchouc synthétique, de pesticides et de colorants. Il est utilisé comme solvant, notamment pour le nettoyage et l’entretien des équipements d’impression et pour les adhésifs tels que ceux utilisés pour fixer les semelles des chaussures. Le benzène est un constituant naturel des produits pétroliers, mais comme il est un cancérigène connu, son utilisation comme additif dans l’essence est maintenant limitée.
Pour votre santé : Le benzène et nous
La majeure partie du benzène utilisé commercialement provient du pétrole. Il est employé comme matière première pour la production de détergents, de médicaments, de colorants, d’insecticides et de plastiques. Autrefois largement utilisé comme solvant organique, le benzène est désormais connu pour ses effets toxiques à court et à long terme. L’inhalation de fortes concentrations peut provoquer des nausées et même la mort par insuffisance respiratoire ou cardiaque, tandis que l’exposition répétée entraîne une maladie progressive dans laquelle la capacité de la moelle osseuse à fabriquer de nouvelles cellules sanguines finit par être détruite. Il en résulte un état appelé anémie aplastique, dans lequel il y a une diminution du nombre de globules rouges et de globules blancs.
Exercices de révision des concepts
-
En quoi les réactions typiques du benzène diffèrent-elles de celles des alcènes ?
-
Décrivez brièvement la liaison dans le benzène.
-
Que signifie le cercle dans la représentation du benzène par le chimiste ?
Réponses
-
Le benzène est plutôt peu réactif vis-à-vis des réactions d’addition par rapport à un alcène.
-
Les électrons de valence sont partagés de manière égale par les six atomes de carbone (c’est-à-dire que les électrons sont délocalisés).
-
Les six électrons sont partagés également par les six atomes de carbone.
Reconnaître les composés aromatiques
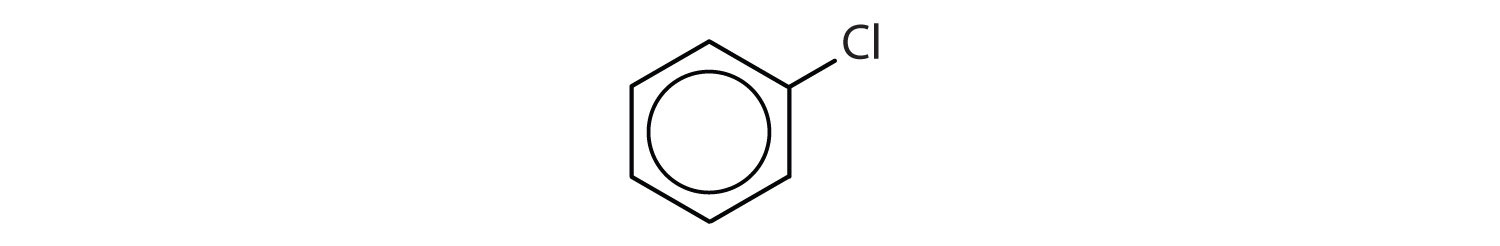
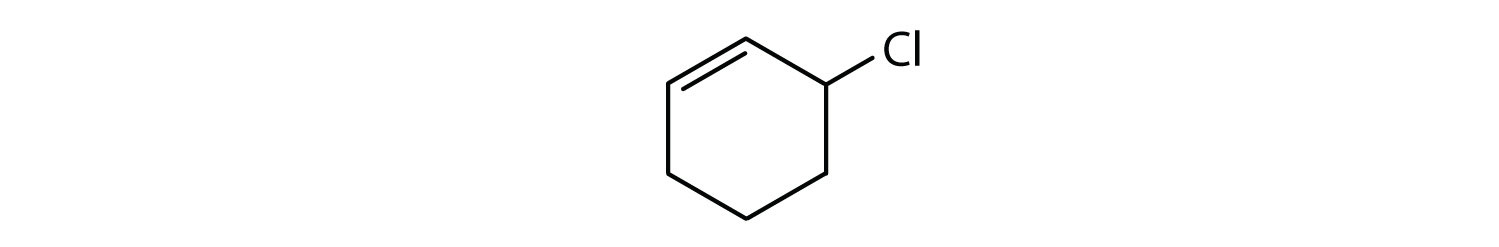
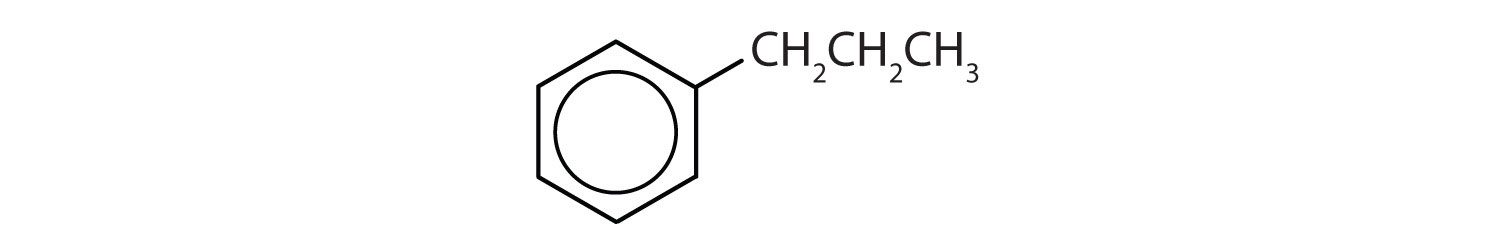
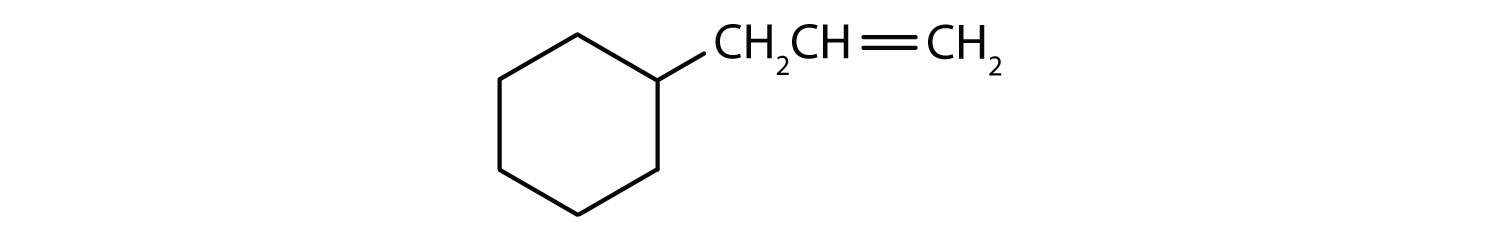
Quels sont les composés aromatiques ?
Solution
- Le composé possède un cycle benzénique (avec un atome de chlore substitué à l’un des atomes d’hydrogène) ; il est aromatique.
- Le composé est cyclique, mais il ne possède pas de cycle benzénique ; il n’est pas aromatique.
- Le composé possède un cycle benzénique (avec un groupe propyle substitué à l’un des atomes d’hydrogène) ; il est aromatique.
- Le composé est cyclique, mais il ne possède pas de cycle benzénique ; il n’est pas aromatique.
Exercice de construction de compétences
Quels composés sont aromatiques ?
Dans le système de l’Union internationale de chimie pure et appliquée (UICPA), les hydrocarbures aromatiques sont nommés comme des dérivés du benzène. Cinq exemples sont présentés ci-dessous. Dans ces structures, il est indifférent que le substituant unique soit écrit en haut, sur le côté ou en bas du cycle : un hexagone est symétrique, et donc toutes les positions sont équivalentes.
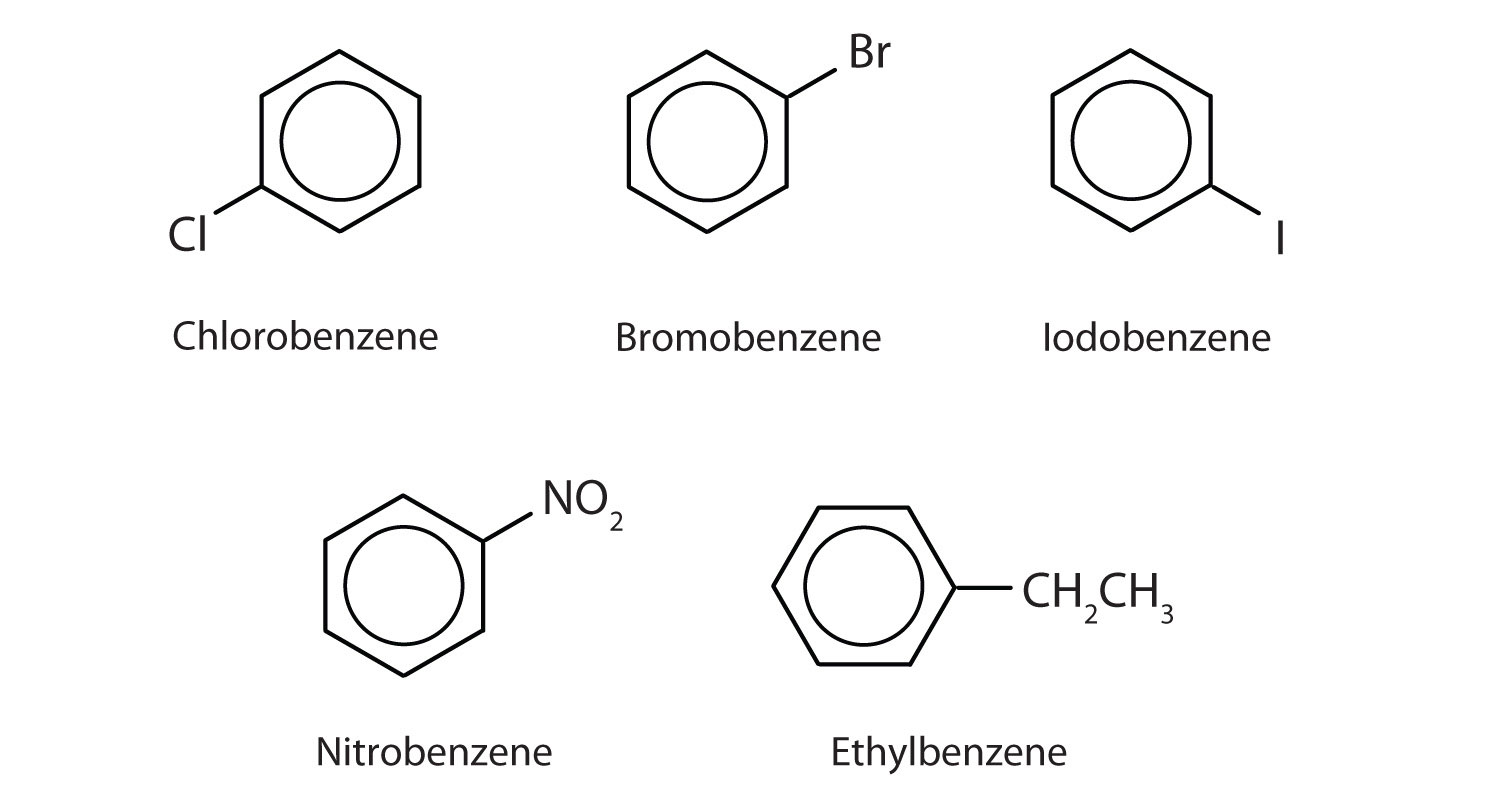
Ces composés sont nommés de la manière habituelle, le groupe qui remplace un atome d’hydrogène étant nommé comme groupe substituant : Cl comme chloro, Br comme bromo, I comme iodo, NO2 comme nitro et CH3CH2 comme éthyle.
Bien que certains composés soient désignés exclusivement par des noms de l’UICPA, certains sont plus fréquemment désignés par des noms communs, comme cela est indiqué ci-dessous.
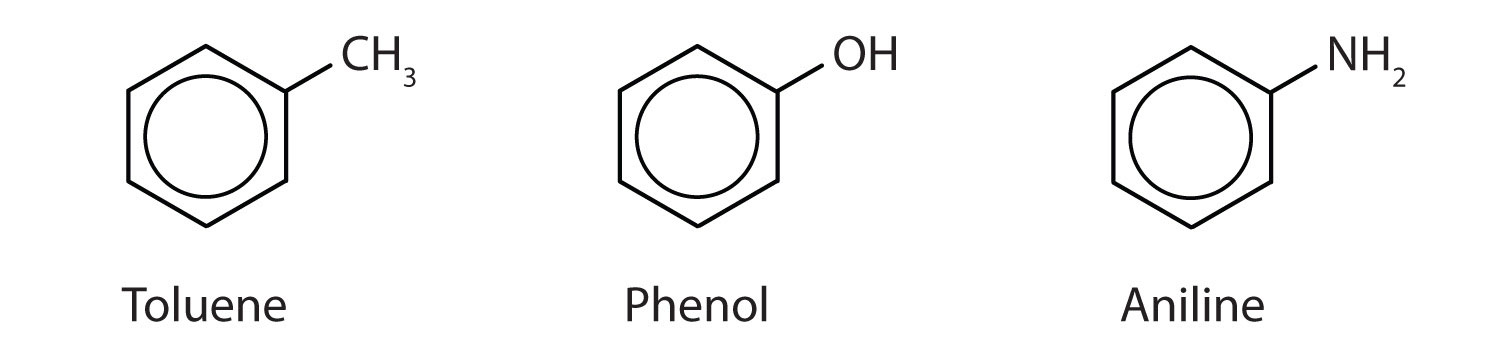
-
Clef à retenir
- Les hydrocarbures aromatiques semblent insaturés, mais ils ont un type de liaison particulier et ne subissent pas de réactions d’addition.
(Retour en haut de page)
Hydrocarbures aromatiques polycycliques
Certains hydrocarbures aromatiques courants sont constitués de cycles benzéniques fusionnés – des cycles qui partagent un côté commun. Ces composés sont appelés hydrocarbures aromatiques polycycliques (HAP)Un hydrocarbure aromatique constitué de cycles benzéniques fusionnés partageant un côté commun..
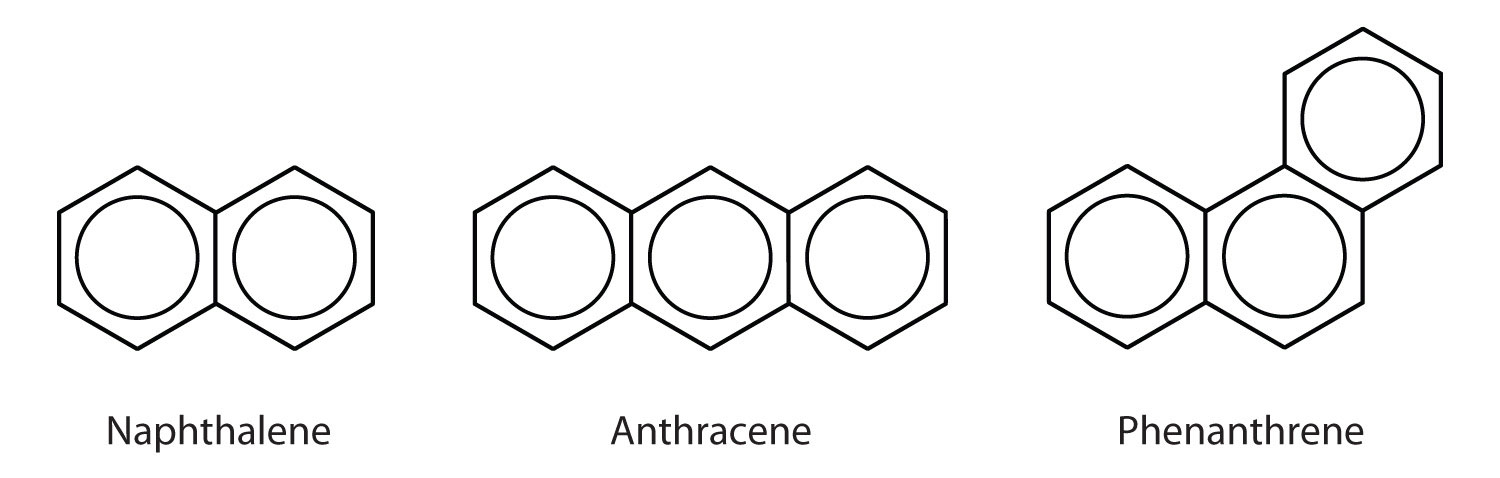
Les trois exemples présentés ici sont des solides incolores et cristallins généralement obtenus à partir de goudron de houille. Le naphtalène a une odeur piquante et est utilisé dans les boules à mites. L’anthracène est utilisé dans la fabrication de certaines teintures. Les stéroïdes, dont le cholestérol et les hormones, œstrogènes et testostérone, contiennent la structure du phénanthrène.
Pour votre santé : Hydrocarbures aromatiques polycycliques et cancer
Le chauffage intense nécessaire à la distillation du goudron de houille entraîne la formation de HAP. Depuis de nombreuses années, on sait que les travailleurs des raffineries de goudron de houille sont susceptibles de développer un type de cancer de la peau appelé cancer du goudron. Des études ont montré qu’un certain nombre de HAP sont cancérigènes. L’un des composés cancérigènes les plus actifs, le benzopyrène, est présent dans le goudron de houille et a également été isolé dans la fumée de cigarette, la fumée de marijuana, les gaz d’échappement des automobiles et les steaks grillés au charbon de bois. On estime que plus de 1 000 t de benzopyrène sont émises dans l’air au-dessus des États-Unis chaque année. Seuls quelques milligrammes de benzopyrène par kilogramme de poids corporel sont nécessaires pour induire un cancer chez les animaux de laboratoire.
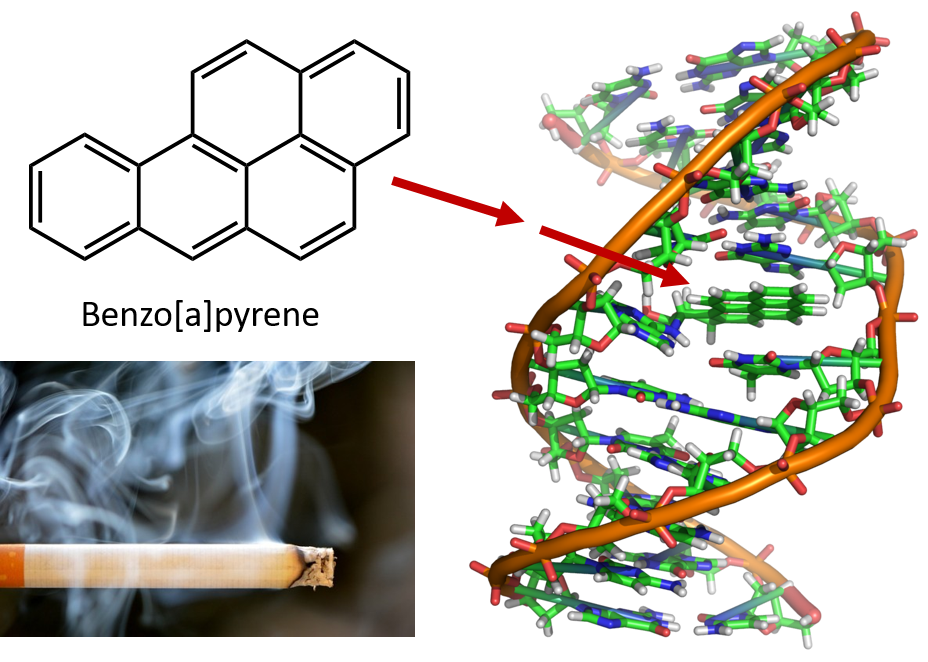
Figure 8.6 Le benzopyrène est un hydrocarbure aromatique polycyclique produit comme sous-produit dans le goudron de houille, la fumée de cigarette et de marijuana, et dans les steaks grillés au charbon de bois. Le benzopyrène est métabolisé pour produire des composés biologiquement actifs qui peuvent former des adduits physiques sur les molécules d’ADN. Ces adduits peuvent provoquer des mutations génétiques à l’origine de cancers.
Photo de fumée de cigarette
Composés biologiquement importants avec des anneaux benzéniques
Les substances contenant l’anneau benzénique sont communes aux animaux et aux plantes, bien qu’elles soient plus abondantes chez ces dernières. Les plantes peuvent synthétiser le cycle benzénique à partir de dioxyde de carbone, d’eau et de matières inorganiques. Les animaux ne peuvent pas le synthétiser, mais ils dépendent de certains composés aromatiques pour leur survie et doivent donc les obtenir dans leur alimentation. La phénylalanine, la tyrosine et le tryptophane (acides aminés essentiels) et les vitamines K, B2 (riboflavine) et B9 (acide folique) contiennent tous le cycle benzénique. De nombreux médicaments importants, dont quelques-uns sont présentés dans le tableau 8.2, comportent également un cycle benzénique.
Note
Pour l’instant, nous n’avons étudié que les composés aromatiques dont le cycle contient du carbone. Cependant, de nombreux composés cycliques ont un élément autre que les atomes de carbone dans le cycle. Les structures cycliques organiques qui contiennent un atome autre que le carbone sont appelées composés hétérocycliques…, Les composés aromatiques hétérocycliques ont également des propriétés uniques et médicalement pertinentes.
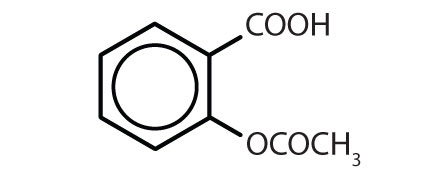
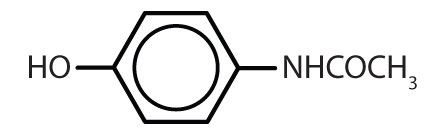
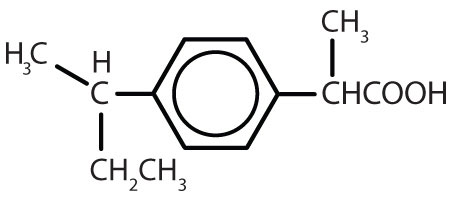
Tableau 8.2 Quelques médicaments qui contiennent un cycle benzénique
| Nom | Structure |
|---|---|
| aspirine |
 |
| acétaminophène |
 |
| ibuprofène |
 |
| amphétamine |
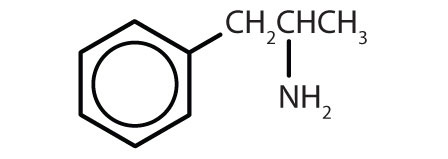 |
| sulfanilamide |
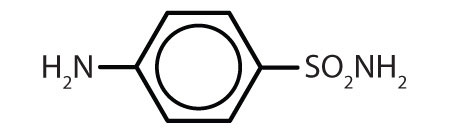 |
8.5 Isomères géométriques
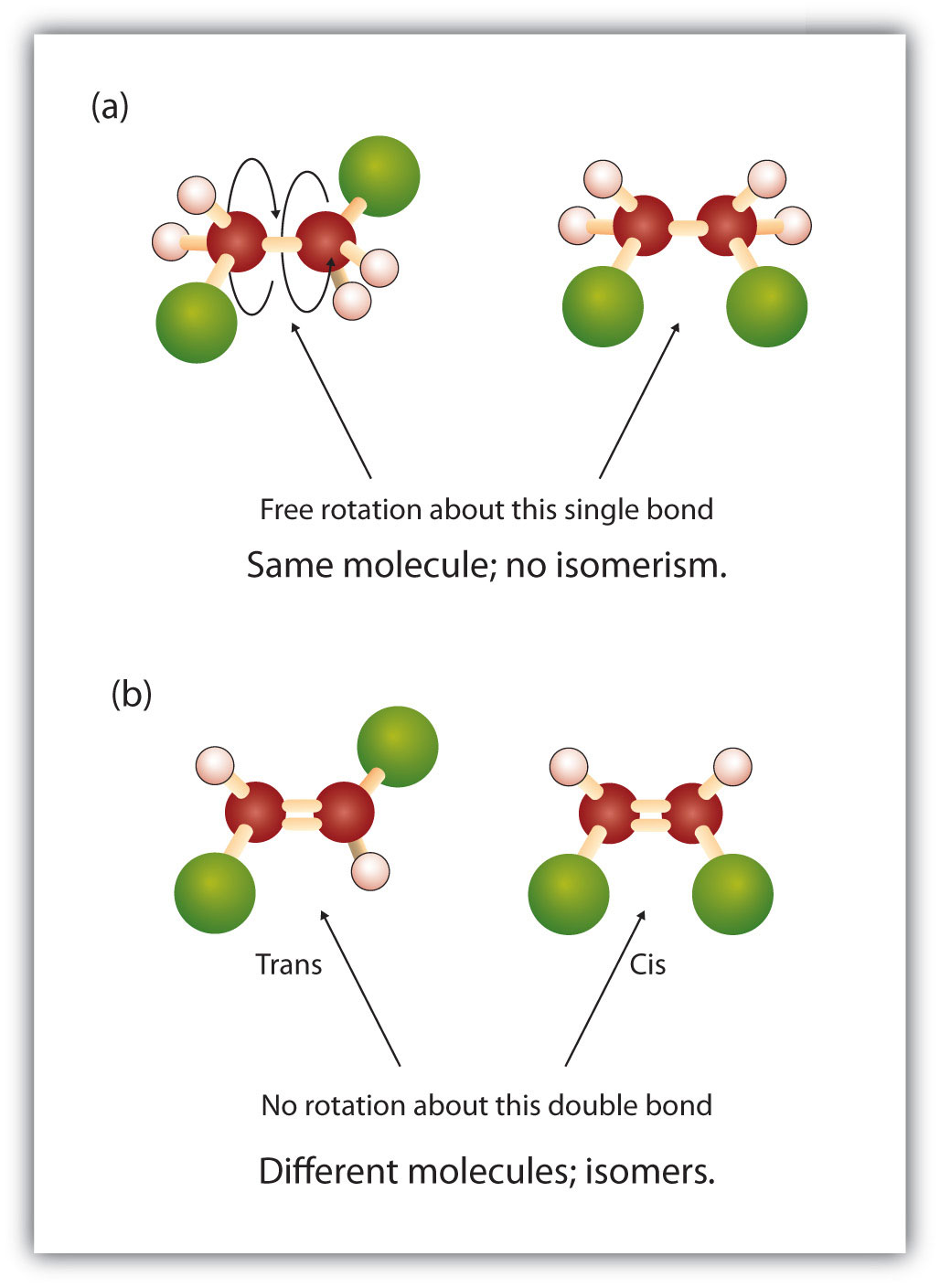
Dans la structure des alcanes, il existe une rotation libre autour des liaisons simples carbone-carbone (C-C). En revanche, la structure des alcènes nécessite que les atomes de carbone forment une double liaison. Les doubles liaisons entre éléments sont créées à l’aide de coquilles orbitales p (également appelées orbitales pi). Ces orbitales ont la forme d’haltères plutôt que les orbitales circulaires utilisées dans les liaisons simples. Cela empêche la rotation libre des atomes de carbone autour de la double liaison, car cela provoquerait la rupture de la double liaison pendant la rotation (figure 8.7). Ainsi, une liaison simple est analogue à deux planches clouées ensemble par un seul clou. Les planches sont libres de tourner autour du clou unique. Une liaison double, par contre, est analogue à deux planches clouées ensemble avec deux clous. Dans le premier cas, vous pouvez tordre les planches, alors que dans le second cas, vous ne pouvez pas les tordre.

Figure 8.7 La formation de liaisons doubles nécessite l’utilisation de liaisons pi. Pour que les molécules puissent créer des liaisons doubles, les électrons doivent partager des orbites pi qui se chevauchent entre les deux atomes. Pour cela, les orbites paires en forme d’haltères (illustrées à gauche) doivent rester dans une conformation fixe pendant la formation de la double liaison. Cela permet la formation d’orbitales électroniques qui peuvent être partagées par les deux atomes (illustré à droite). Une rotation autour de la double liaison entraînerait un désalignement des orbitales pi, ce qui romprait la double liaison.
Diagramme fourni par : JoJanderivative work – Vladsinger (talk)
La nature fixe et rigide de la double liaison crée la possibilité d’un centre chiral supplémentaire, et donc, le potentiel pour les stéréoisomères. De nouveaux stéréoisomères se forment si chacun des carbones impliqués dans la double liaison a deux atomes ou groupes différents attachés à lui. Par exemple, regardez les deux hydrocarbures chlorés de la figure 8.8. Dans la figure supérieure, l’alcane halogéné est représenté. La rotation autour de cette liaison carbone-carbone est possible et n’entraîne pas de conformations isomères différentes. Dans le schéma inférieur, l’alcène halogéné présente une rotation restreinte autour de la double liaison. Notez également que chaque carbone impliqué dans la double liaison est également attaché à deux atomes différents (un hydrogène et un chlore). Ainsi, cette molécules peut former deux stéréoisomères : l’un qui a les deux atomes de chlore du même côté de la double liaison, et l’autre où les chlore résident sur les côtés opposés de la double liaison.
Figure 8.8 Les doubles liaisons de l’alcène peuvent former des isomères géométriques. (a) Montre la rotation libre autour d’une liaison simple carbone-carbone dans la structure de l’alcane. (b) Montre la position fixe de la double liaison carbone-carbone qui conduit à des isomères géométiques (spatiaux).
Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur la structure des alcènes.
Pour cette section, nous ne sommes pas concernés par la dénomination qui est également incluse dans ce tutoriel vidéo.(Remarque : tout le contenu de la Khan Academy est disponible gratuitement en utilisant la licence CC-BY-NC-SA à l’adresse www.khanacademy.org )
Nomenclature cis-trans
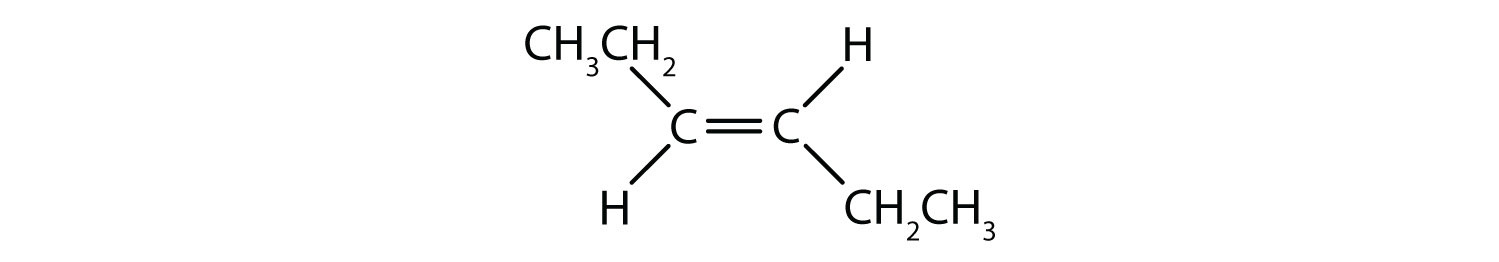
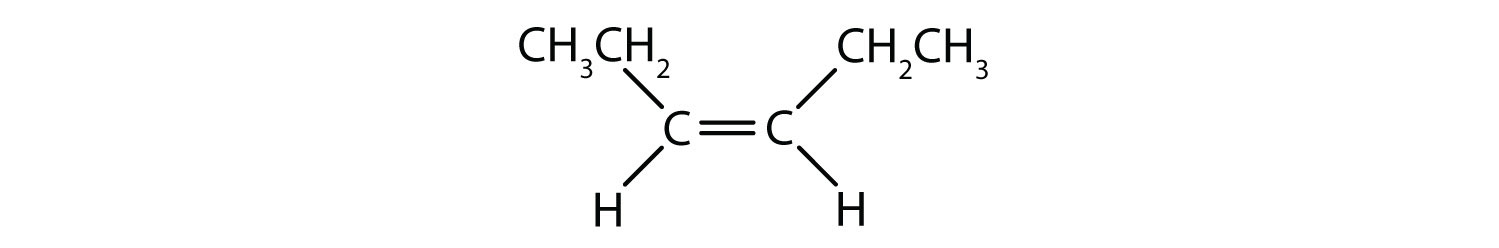
Le système de dénomination cis-trans peut être utilisé pour distinguer les isomères simples, où chaque carbone de la double liaison a un ensemble de groupes identiques attachés à lui. Par exemple, dans la figure 8.8b, chaque carbone impliqué dans la double liaison, a un chlore qui lui est attaché, et a également un hydrogène qui lui est attaché. Le système cis et trans identifie si les groupes identiques sont du même côté (cis) de la double liaison ou s’ils sont du côté opposé (trans) de la double liaison. Par exemple, si les atomes d’hydrogène se trouvent du côté opposé de la double liaison, on dit que la liaison est dans la conformation trans. Lorsque les groupes hydrogène se trouvent du même côté de la double liaison, on dit que la liaison est dans la conformation cis. Remarquez que vous pourriez également dire que si les deux groupes de chlore sont du côté opposé de la double liaison, que la molécule est dans la conformation trans ou s’ils sont du même côté de la double liaison, que la molécule est dans la conformation cis.
Pour déterminer si une molécule est cis ou trans, il est utile de tracer une ligne pointillée au centre de la double liaison puis d’encercler les groupes identiques, comme le montre la figure 8.9. Les deux molécules illustrées dans la figure 8.9 portent le nom de 1,2-dichloroéthène. Ainsi, la désignation cis et trans ne définit que la stéréochimie autour de la double liaison, elle ne change pas l’identité globale de la molécule. Cependant, les isomères cis et trans ont souvent des propriétés physiques et chimiques différentes, en raison de la nature fixe des liaisons dans l’espace.
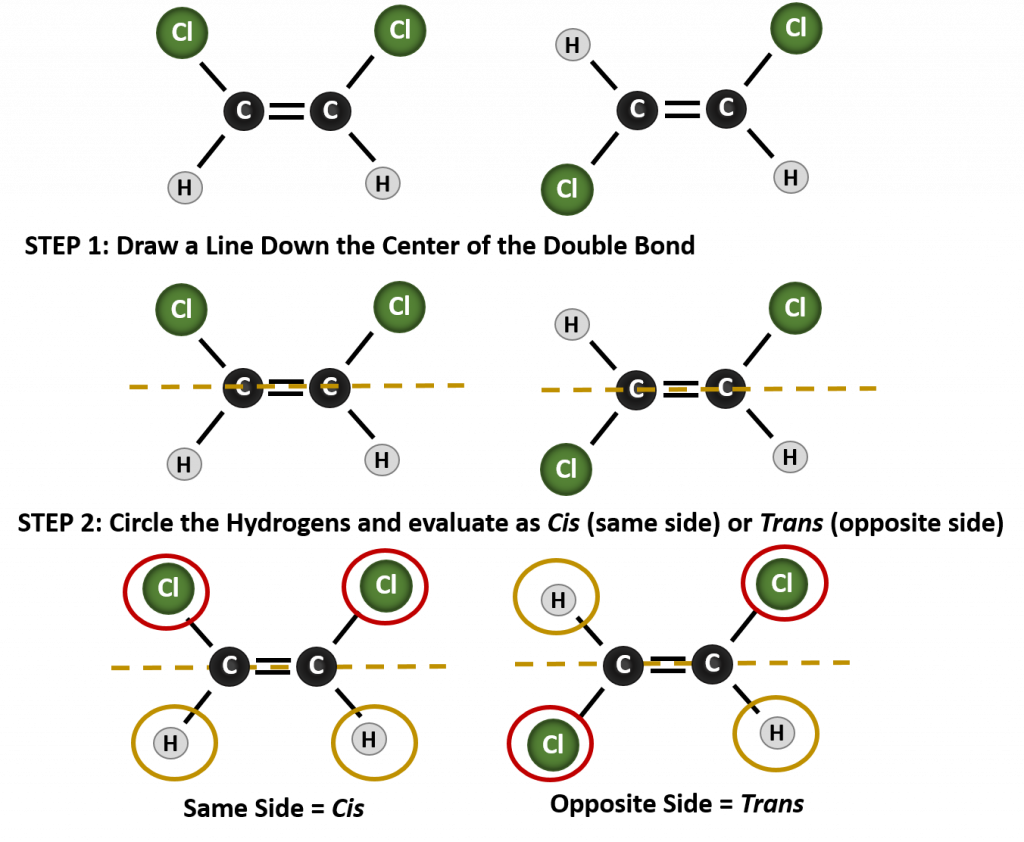
Figure 8.9 Guide pour déterminer les conformations cis ou trans.
Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur l’isomérisation Cis/Trans
(Remarque : tout le contenu de la Khan Academy est disponible gratuitement en utilisant la licence CC-BY-NC-SA à l’adresse www.khanacademy.org )
L’isomérie Cis-trans se produit également dans les composés cycliques. Dans les structures cycliques, les groupes ne peuvent tourner autour d’aucune des liaisons carbone-carbone du cycle. Par conséquent, les groupes peuvent être soit sur le même côté du cycle (cis), soit sur des côtés opposés du cycle (trans). Pour nos besoins ici, nous représentons tous les cycloalcanes comme des structures planes, et nous indiquons les positions des groupes, soit au-dessus, soit au-dessous du plan de l’anneau.

À votre santé
Possiblement l’endroit le plus commun où vous entendrez la référence aux conformations cis-trans dans la vie quotidienne est au supermarché ou dans le cabinet de votre médecin. Il s’agit de notre consommation de graisses alimentaires. Une consommation inappropriée ou excessive de graisses alimentaires a été liée à de nombreux troubles de la santé, tels que le diabète et l’athérosclérose, et les maladies coronariennes. Alors, quelles sont les différences entre les graisses saturées et insaturées et que sont les graisses trans et pourquoi sont-elles si préoccupantes pour la santé ?

Figure 8.10 Sources courantes de graisses alimentaires.
Photo de : TyMaHe
La forme la plus courante de graisses alimentaires et le principal constituant de la graisse corporelle chez les humains et les autres animaux sont les triglycérides (TAG). Les TAG, comme le montre la figure 8.10, sont constitués d’une molécule de glycérol et de trois molécules d’acides gras reliées entre elles par une liaison ester. Dans cette section, nous nous concentrerons sur la structure des longues queues d’acides gras, qui peuvent être composées de structures alcane ou alcène. Le chapitre 10 se concentrera davantage sur la formation des liaisons esters.

Figure 8.11. Exemple de structure d’un triglycéride (TAG). Remarquez que chaque triglycéride possède trois acides gras à longue chaîne s’étendant à partir du squelette de glycérol. Chaque acide gras peut avoir différents degrés de saturation et d’insaturation.
Structure adaptée de : Wolfgang Schaefer
Les graisses qui sont totalement saturées n’auront que des acides gras avec des queues d’alcane à longue chaîne. On dit qu’elles sont » saturées » en atomes d’hydrogène. Les graisses saturées sont courantes dans le régime alimentaire américain et se trouvent dans la viande rouge, les produits laitiers comme le lait, le fromage et le beurre, l’huile de noix de coco, et se retrouvent dans de nombreux produits de boulangerie. Les graisses saturées sont généralement solides à température ambiante. Cela est dû au fait que les alcanes à longue chaîne peuvent s’empiler les uns sur les autres en ayant plus de forces de dispersion intermoléculaires de Londres. Cela donne aux graisses saturées des points de fusion et d’ébullition plus élevés que les graisses insaturées que l’on trouve dans de nombreuses huiles végétales.
La plupart des graisses insaturées que l’on trouve dans la nature sont dans la conformation cis, comme le montre la figure 8.11. Notez que les acides gras représentés sur la figure 8.11 sont dessinés pour des raisons de commodité, afin qu’ils soient faciles à regarder et ne prennent pas trop de place sur le papier, mais les angles de liaison écrits ne représentent pas correctement la véritable orientation spatiale des molécules. Lorsque les acides gras du TAG illustré à la figure 8.11 sont dessinés avec des angles de liaison corrects, il est facile de voir que les liaisons cis-doubles provoquent des coudes dans la chaîne alcène (figure 8.12).
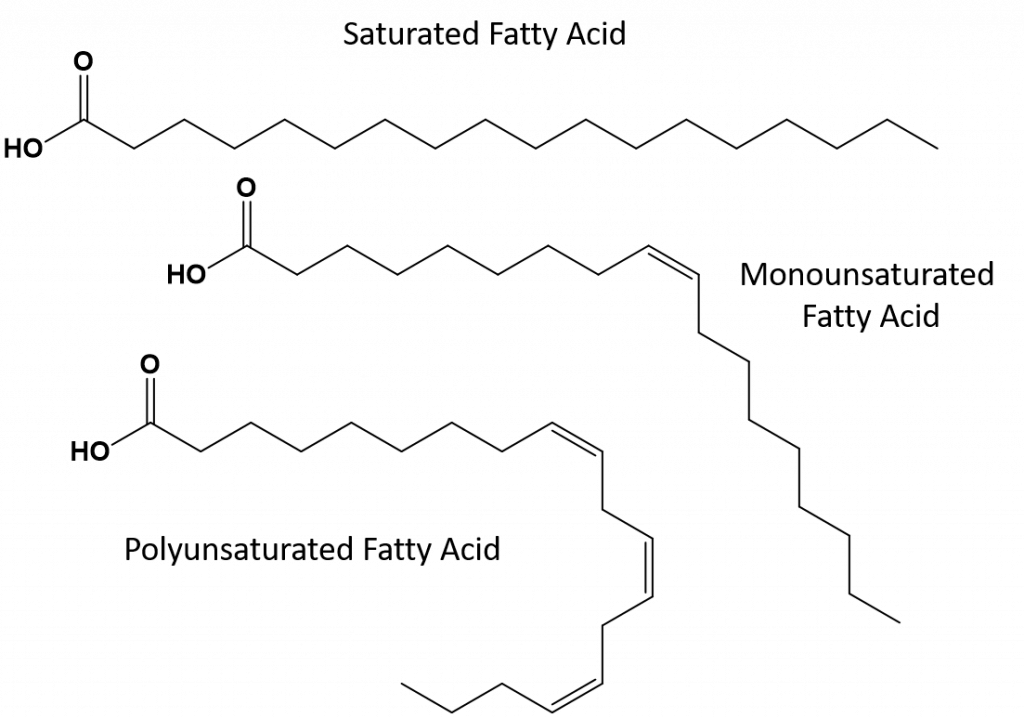
Figure 8.12 Les liaisons cis-doubles provoquent des coudes dans la structure des acides gras
Donc, les graisses monoinsaturées et polyinsaturées ne peuvent pas s’empiler aussi facilement et n’ont pas autant de forces d’attraction intermoléculaires par rapport aux graisses saturées. Par conséquent, elles ont des points de fusion et d’ébullition plus bas et ont tendance à être liquides à température ambiante. Il a été démontré que la réduction ou le remplacement des graisses saturées par des graisses mono- et polyinsaturées dans le régime alimentaire, aide à réduire les niveaux de la forme de cholestérol à lipoprotéines de basse densité (LDL), qui est un facteur de risque de maladie coronarienne.
Les graisses trans, en revanche, contiennent des doubles liaisons qui sont dans la conformation trans. Ainsi, la forme des acides gras est linéaire, semblable à celle des graisses saturées. Les graisses trans ont également des points de fusion et d’ébullition similaires à ceux des graisses saturées. Toutefois, contrairement aux graisses saturées, les graisses trans ne sont pas couramment présentes dans la nature et ont des effets négatifs sur la santé. Les graisses trans sont principalement un sous-produit de la transformation des aliments (principalement le processus d’hydrogénation pour créer des margarines et des shortenings) ou de la cuisson, notamment la friture. En fait, de nombreux établissements de restauration rapide utilisent des graisses trans dans leur processus de friture, car les graisses trans peuvent être utilisées plusieurs fois avant de devoir être remplacées. La consommation de graisses trans augmente le taux de cholestérol LDL dans l’organisme (le mauvais cholestérol qui est associé aux maladies coronariennes) et tend à diminuer le taux de cholestérol à lipoprotéines de haute densité (HDL) (le bon cholestérol dans l’organisme). La consommation de graisses trans augmente le risque de maladie cardiaque et d’accident vasculaire cérébral, ainsi que le risque de développer un diabète de type II. Le risque a été si fortement corrélé que de nombreux pays ont interdit l’utilisation des acides gras trans, notamment la Norvège, la Suède, l’Autriche et la Suisse. Aux États-Unis, la Food and Drug Administration (FDA) a récemment adopté une mesure visant à éliminer progressivement l’utilisation des graisses trans dans les aliments d’ici 2018. Cette mesure devrait permettre d’éviter 20 000 crises cardiaques et 7 000 décès par an.
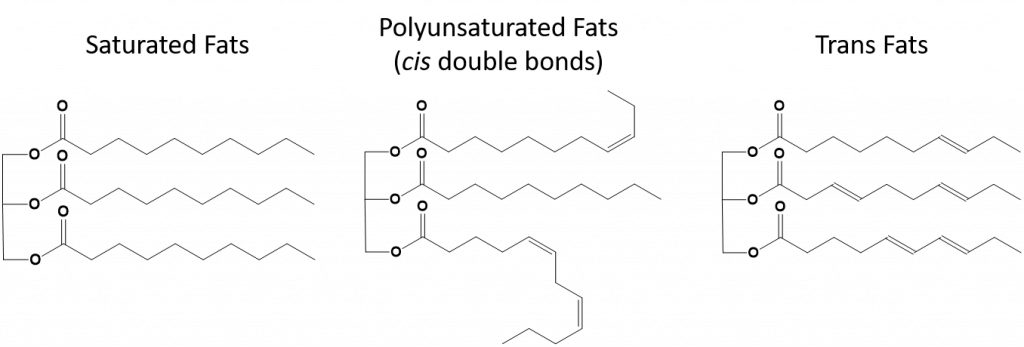
Figure 8.13 Différences structurelles des graisses saturées, polyinsaturées et trans.
Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur les graisses saturées, insaturées et trans
(Remarque : tout le contenu de la Khan Academy est disponible gratuitement sous licence CC-BY-NC-SA sur www.khanacademy.org )
Facteurs clés pour déterminer l’isomérisation Cis/Trans
- Le composé doit contenir une double ou triple liaison, ou avoir une structure cyclique qui ne permettra pas une rotation libre autour de la liaison carbone-carbone.
- Le composé doit avoir deux groupes non identiques attachés à chaque carbone impliqué dans la double ou triple liaison carbone-carbone.
Exemple travaillé
Quels composés peuvent exister en tant qu’isomères cis-trans (géométriques) ? Dessinez-les.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CHCH2CH3
Solution
Les quatre structures ont une double liaison et répondent donc à la règle 1 de l’isomérie cis-trans.
-
Ce composé répond à la règle 2 ; il possède deux groupes non identiques sur chaque atome de carbone (H et Cl sur l’un et H et Br sur l’autre). Il existe en tant qu’isomères cis et trans :

- Ce composé possède deux atomes d’hydrogène sur l’un de ses atomes de carbone doublement liés ; il échoue à la règle 2 et n’existe pas en tant qu’isomères cis et trans.

- Ce composé possède deux groupes méthyle (CH3) sur l’un de ses atomes de carbone doublement liés. Il échoue à la règle 2 et n’existe pas en tant qu’isomères cis et trans.

-
Ce composé répond à la règle 2 ; il possède deux groupes non identiques sur chaque atome de carbone et existe sous forme d’isomères cis et trans :

Exercice de construction de compétences
-
Quels composés peuvent exister sous forme d’isomères cis-trans ? Dessinez-les.
- CH2=CH2CH2CH3
- CH3CH=CH2CH3
- CH3CH2CH=CH2CH3
-
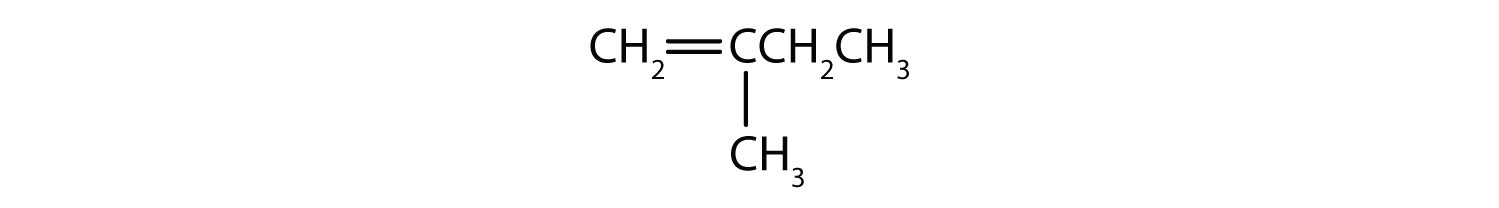
-
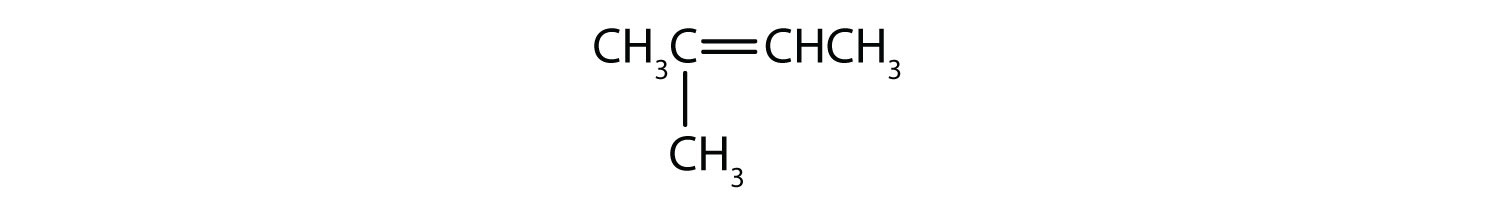
.
Exercices de révision des concepts
-
Que sont les isomères cis-trans (géométriques) ? Quels sont les deux types de composés qui peuvent présenter une isomérie cis-trans ?
-
Classez chaque composé comme un isomère cis, un isomère trans, ou aucun des deux.
-
Réponses
-
Les isomères cis…Les isomères trans sont des composés qui ont des configurations différentes (groupes en permanence à différents endroits de l’espace) en raison de la présence d’une structure rigide dans leur molécule. Les alcènes et les composés cycliques peuvent présenter une isomérie cis-trans.
-
- trans
- cis
- cis
- neither
Key Takeaway
- Isomérie cis-trans (géométrique) existe lorsqu’il y a une rotation restreinte dans une molécule et qu’il y a deux groupes différents sur chaque atome de carbone impliqué dans la liaison chimique.
(Back to the Top)
Nomenclature E-Z
La situation devient plus complexe lorsqu’il y a 4 groupes différents attachés aux atomes de carbone impliqués dans la formation de la double liaison. Le système de dénomination cis-trans ne peut pas être utilisé dans ce cas, car il n’y a aucune référence aux groupes décrits par la nomenclature. Par exemple, dans la molécule ci-dessous, vous pouvez dire que le chlore est trans par rapport au groupe brome, ou vous pouvez dire que le chlore est cis par rapport au groupe méthyle (CH3). Ainsi, le simple fait d’écrire cis ou trans dans ce cas ne permet pas de délimiter clairement l’orientation spatiale des groupes par rapport à la double liaison.
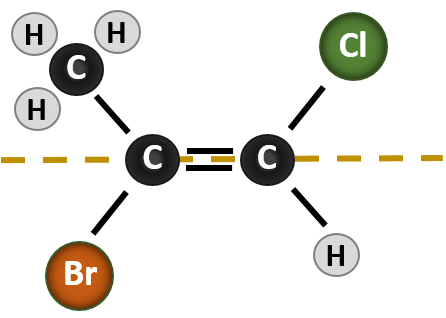
Nommer les différents stéréoisomères formés dans cette situation, nécessite de connaître les règles de priorité. Rappelez-vous du chapitre 5 que dans le système de priorité Cahn-Ingold-Prelog (CIP), les groupes qui sont attachés au carbone chiral sont prioritaires en fonction de leur numéro atomique (Z). Les atomes ayant un numéro atomique plus élevé (plus de protons) ont une priorité plus élevée (c’est-à-dire S > P > O > N > C > H). Pour ce système de nomenclature, les désignations de (Z) et (E) sont utilisées à la place du système cis/trans. (E) vient du mot allemand entgegen, ou opposé. Ainsi, lorsque les groupes de priorité supérieure se trouvent du côté opposé de la double liaison, on dit que la liaison est dans la conformation (E). (Z), quant à lui, vient du mot allemand zusammen, ou ensemble. Ainsi, lorsque les groupes de priorité supérieure se trouvent du même côté de la double liaison, on dit que la liaison est dans la conformation (Z). La figure 8.14 montre les étapes utilisées pour attribuer les conformations (E) ou (Z) d’une molécule.
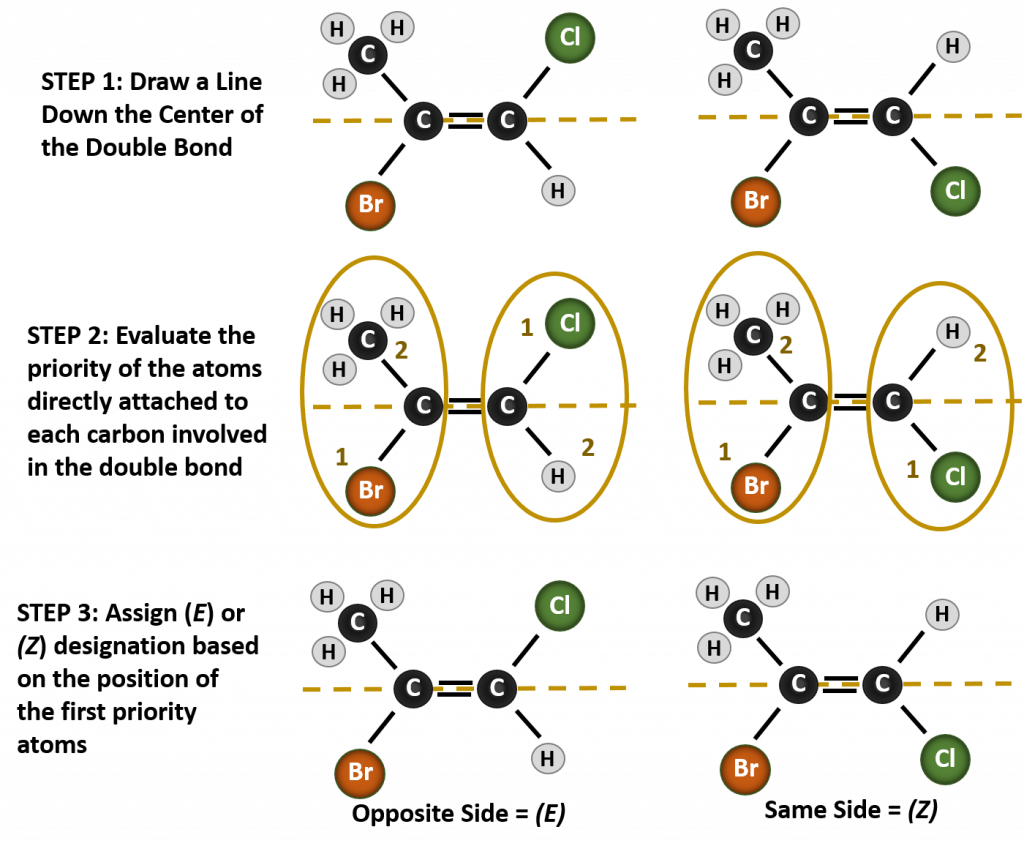
Figure 8.14 Étapes utilisées pour attribuer les conformations (E) et (Z).
Cliquez ici pour un tutoriel vidéo de la Kahn Academy sur l’isomérisation E/Z.
(Remarque : tout le contenu de la Khan Academy est disponible gratuitement en utilisant la licence CC-BY-NC-SA à l’adresse www.khanacademy.org )
(Back to the Top)
.