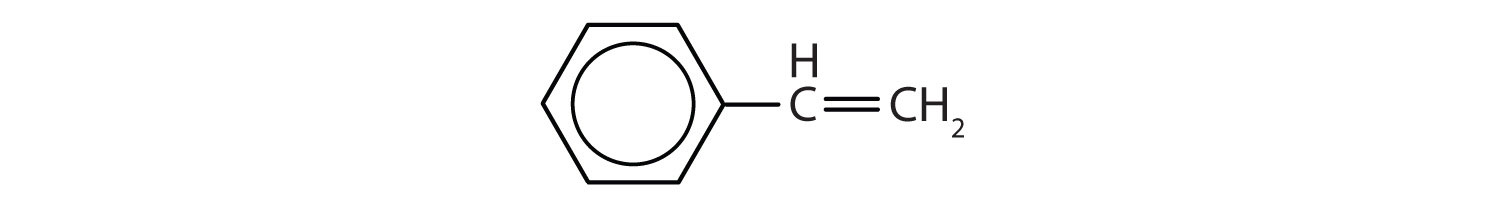
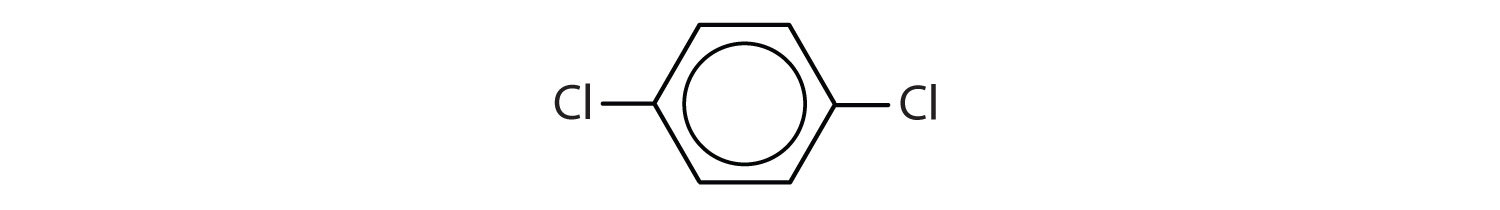
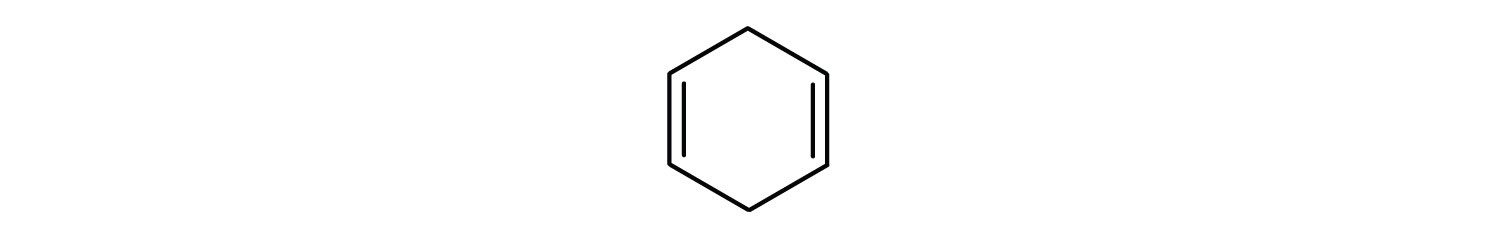
Węglowodory aromatyczne są zdefiniowane przez posiadanie 6-członowych struktur pierścieniowych z naprzemiennymi wiązaniami podwójnymi (rys. 8.2).
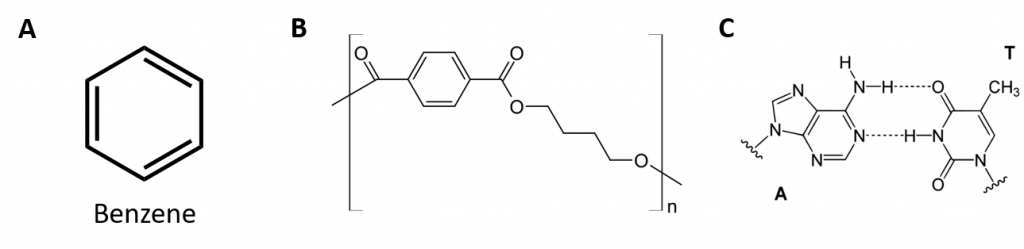
Rysunek 8.2: Węglowodory aromatyczne. Węglowodory aromatyczne zawierają 6-członową strukturę pierścienia benzenowego (A), która charakteryzuje się występowaniem naprzemiennych wiązań podwójnych. Ultradur, PBT jest polimerem z tworzywa sztucznego, który zawiera aromatyczną grupę funkcyjną. Powtarzający się monomer Ultraduru jest pokazany w (B). Ultradur można znaleźć w głowicach prysznicowych, włosiu szczoteczek do zębów, plastikowych obudowach kabli światłowodowych oraz w zewnętrznych i wewnętrznych elementach samochodów. Biologicznie ważne cząsteczki, takie jak kwas dezoksyrybonukleinowy, DNA (C) również zawierają struktury pierścienia aromatycznego.
Dlatego mają wzory, które mogą być rysowane jako cyklicznych alkenów, co czyni je nienasycone. Jednak ze względu na cykliczną budowę, właściwości pierścieni aromatycznych są na ogół zupełnie inne i nie zachowują się one jak typowe alkeny. Związki aromatyczne są podstawą wielu leków, środków antyseptycznych, materiałów wybuchowych, rozpuszczalników i tworzyw sztucznych (np. poliestrów i polistyrenu).
Dwa najprostsze związki nienasycone – etylen (eten) i acetylen (etyn) – były kiedyś stosowane jako środki znieczulające i zostały wprowadzone do medycyny w 1924 roku. Odkryto jednak, że acetylen tworzy z powietrzem mieszaniny wybuchowe, więc w 1925 roku zaniechano jego stosowania w medycynie. Uważano, że etylen jest bezpieczniejszy, ale i on był zamieszany w liczne śmiertelne pożary i eksplozje podczas znieczulenia. Mimo to pozostał ważnym anestetykiem do lat 60-tych, kiedy został zastąpiony przez niepalne anestetyki, takie jak halotan (CHBrClCF3).
- (Powrót do początku)
- 8.1 Przegląd alkenów i alkinów
- (Back to the Top)
- 8.2 Właściwości alkenów
- Looking Closer: Uwaga środowiskowa
- Concept Review Exercises
- Odpowiedzi
- Key Takeaway
- Ćwiczenia
- Odpowiedź
- Ćwiczenia sprawdzające pojęcia
- Answers
- Key Takeaway
- 8.3 Alkeny
- Uwaga
- Concept Review Exercises
- Key Takeaway
- Ćwiczenia
- (Powrót na górę)
- 8.4 Związki aromatyczne: Benzen
- Uwaga
- To Your Health: Benzene and Us
- Ćwiczenia sprawdzające pojęcia
- Rozpoznawanie związków aromatycznych
- Ćwiczenie rozwijające umiejętności
- Key Takeaway
- (Powrót do początku)
- Policykliczne węglowodory aromatyczne
- To Your Health: Polycyclic Aromatic Hydrocarbons and Cancer
- Biologicznie ważne związki z pierścieniami benzenowymi
- Uwaga
- 8.5 Izomery geometryczne
- Click Here for a Kahn Academy Video Tutorial on Alkene Structure.
- Nomenklatura cis-trans
- Click Here for a Kahn Academy Video Tutorial on Cis/Trans Isomerization
- Do Twojego Zdrowia
- Click Here for a Kahn Academy Video Tutorial on Saturated-, Unsaturated-, and Trans-Fats
- Key Factors for Determining Cis/Trans Isomerization
- Przykład praktyczny
- Ćwiczenie sprawności
- Ćwiczenia sprawdzające pojęcia
- Odpowiedzi
- Key Takeaway
- (Back to the Top)
- Nomenklatura E-Z
- Click Here for a Kahn Academy Video Tutorial on E/Z Isomerization.
- (Back to the Top)
(Powrót do początku)
8.1 Przegląd alkenów i alkinów
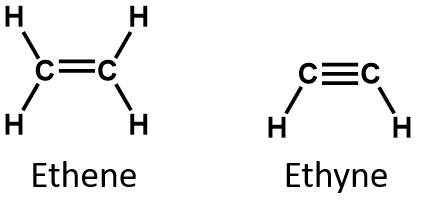
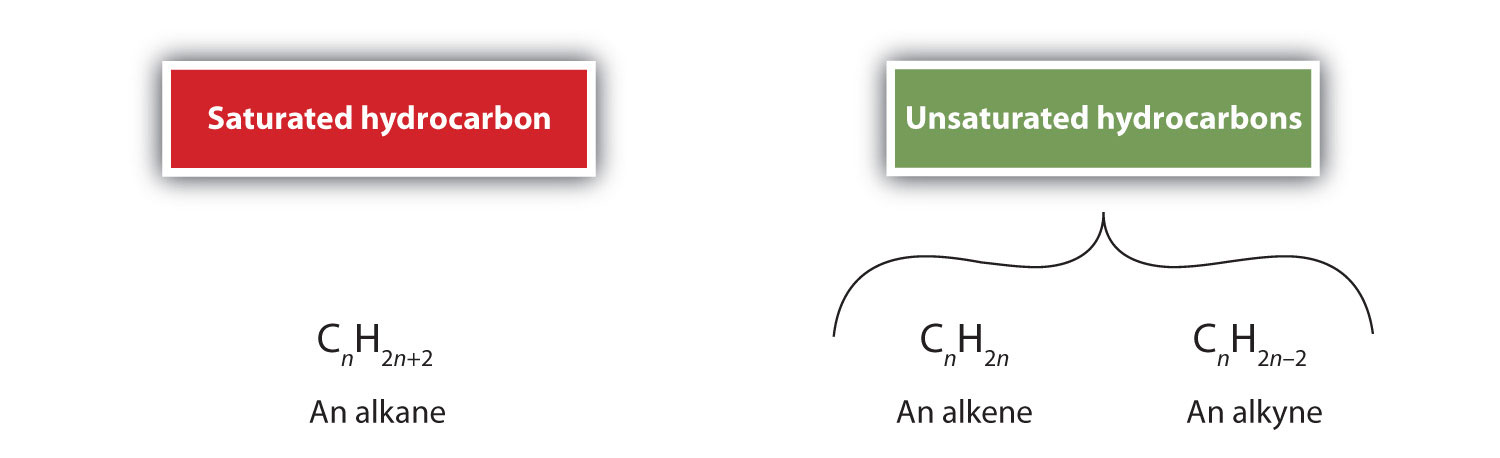
Z definicji, alkeny są węglowodorami z jednym lub więcej podwójnymi wiązaniami węgiel-węgiel (R2C=CR2), podczas gdy alkiny są węglowodorami z jednym lub więcej potrójnymi wiązaniami węgiel-węgiel (R-C≡C-R). Łącznie są one nazywane węglowodorami nienasyconymi, które definiuje się jako węglowodory posiadające jedno lub więcej wiązań wielokrotnych (podwójnych lub potrójnych) pomiędzy atomami węgla. W wyniku charakteru wiązania podwójnego lub potrójnego, alkeny i alkeny mają mniej atomów wodoru niż porównywalne alkany o tej samej liczbie atomów węgla. Z matematycznego punktu widzenia można to przedstawić za pomocą następujących wzorów ogólnych:
W alkenie wiązanie podwójne jest wspólne dla dwóch atomów węgla i nie obejmuje atomów wodoru, chociaż wzór skrócony nie czyni tego punktu oczywistym, tj. wzór skrócony dla etenu to CH2CH2. Natura podwójne lub potrójne wiązanie cząsteczki jest jeszcze trudniejsze do rozróżnienia z wzorów cząsteczkowych. Zauważ, że wzór cząsteczkowy dla etenu to C2H4, podczas gdy wzór dla etynu to C2H2. Dlatego, do czasu lepszego poznania języka chemii organicznej, często najbardziej użyteczne jest rysowanie struktur liniowych lub częściowo skondensowanych, jak pokazano poniżej:
(Back to the Top)
8.2 Właściwości alkenów
Właściwości fizyczne alkenów są podobne do właściwości alkanów. Tabela 8.1 pokazuje, że punkty wrzenia alkenów o prostym łańcuchu rosną wraz ze wzrostem masy molowej, podobnie jak w przypadku alkanów. Dla cząsteczek o tej samej liczbie atomów węgla i tym samym kształcie ogólnym, temperatury wrzenia zwykle różnią się tylko nieznacznie, tak jak można by się spodziewać dla substancji, których masy molowe różnią się tylko o 2 u (co odpowiada dwóm atomom wodoru). Podobnie jak inne węglowodory, alkeny są nierozpuszczalne w wodzie, ale rozpuszczalne w rozpuszczalnikach organicznych.
Kilka reprezentatywnych alkenów – ich nazwy, struktury i właściwości fizyczne – podano w tabeli 8.1.
Tabela 8.1 Właściwości fizyczne wybranych alkenów
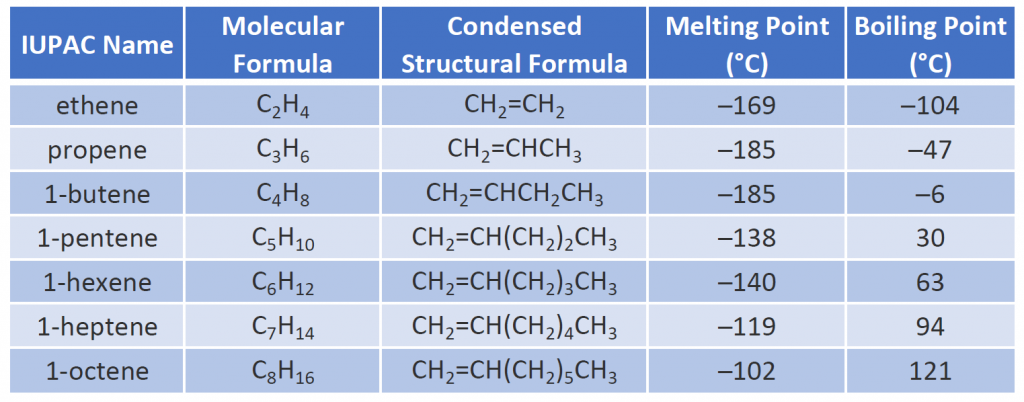
Pierwsze dwa alkeny w tabeli 8.1 – eten i propen, są najczęściej określane ich nazwami zwyczajowymi – odpowiednio etylen i propylen. Etylen jest jednym z głównych komercyjnych związków chemicznych. Amerykański przemysł chemiczny produkuje rocznie około 25 miliardów kilogramów etylenu, więcej niż jakiejkolwiek innej syntetycznej organicznej substancji chemicznej. Ponad połowa tego etylenu jest wykorzystywana do produkcji polietylenu, jednego z najbardziej znanych tworzyw sztucznych. Propylen jest również ważnym przemysłowym związkiem chemicznym. Jest on przetwarzany na tworzywa sztuczne, alkohol izopropylowy i wiele innych produktów.
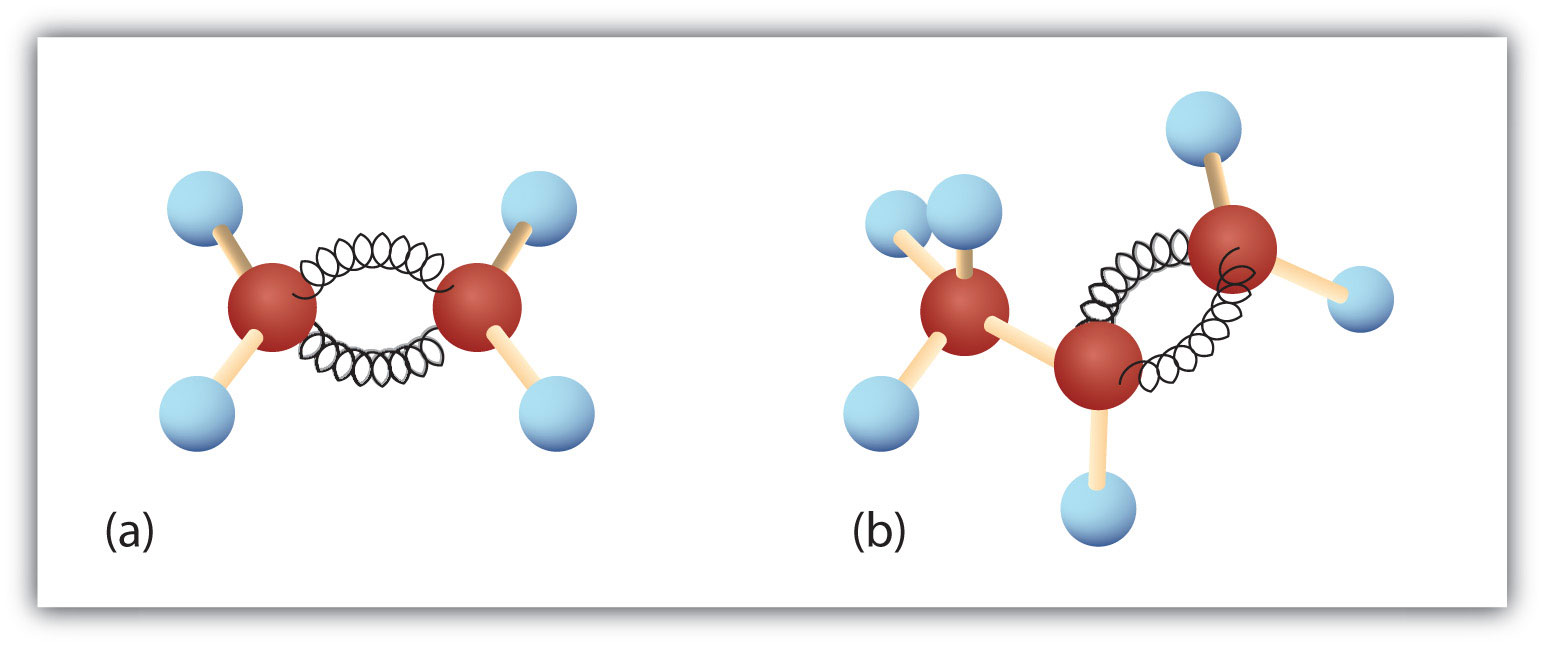
Rysunek 8.3. Eten i propen. Kuliste modele etenu/etylenu (a) i propenu/propylenu (b) pokazują ich odpowiednie kształty, a zwłaszcza kąty wiązań.
Looking Closer: Uwaga środowiskowa
Alkeny występują powszechnie w przyrodzie. Dojrzewające owoce i warzywa wydzielają etylen, który wywołuje dalsze dojrzewanie. Przetwórcy owoców sztucznie wprowadzają etylen, aby przyspieszyć proces dojrzewania; wystawienie na działanie zaledwie 0,1 mg etylenu przez 24 godziny może spowodować dojrzewanie 1 kg pomidorów. Niestety, proces ten nie powiela dokładnie procesu dojrzewania, a pomidory zbierane na zielono i traktowane w ten sposób nie smakują tak, jak dojrzałe pomidory z ogrodu.
Inne alkeny występujące w przyrodzie to 1-okten, składnik olejku cytrynowego, oraz oktadeken (C18H36) występujący w wątrobie ryb. Dien (dwa wiązania podwójne) i polien (trzy lub więcej wiązań podwójnych) są również powszechne. Butadien (CH2=CHCH=CH2) znajduje się w kawie. Likopen i karoteny są izomerycznymi polienami (C40H56), które nadają atrakcyjny czerwony, pomarańczowy i żółty kolor arbuzom, pomidorom, marchewkom oraz innym owocom i warzywom. Witamina A, niezbędna do dobrego widzenia, pochodzi z karotenu. Świat byłby znacznie mniej kolorowym miejscem bez alkenów.

Rys. 8.4 Jasnoczerwony kolor pomidorów zawdzięczamy likopenowi.
Photo from : © Thinkstock; Lycopene structure from: Jeff Dahl
Concept Review Exercises
-
Krótko opisz właściwości fizyczne alkenów. Jak te właściwości mają się do właściwości alkanów?
-
Nie korzystając z tabel, ułóż następujące alkeny w kolejności rosnącej temperatury wrzenia:

Odpowiedzi
-
Alkeny mają właściwości fizyczne (niskie temperatury wrzenia, nierozpuszczalność w wodzie) dość podobne do właściwości odpowiadających im alkanów.
-
eten < propen < 1-buten < 1-heksen
Key Takeaway
- Właściwości fizyczne alkenów są bardzo podobne do właściwości alkanów: ich punkty wrzenia rosną wraz ze wzrostem masy molowej i są nierozpuszczalne w wodzie.
Ćwiczenia
-
Bez odwoływania się do tabeli lub innego odnośnika, przewidz, który członek każdej pary ma wyższą temperaturę wrzenia.
- 1-penten lub 1-buten
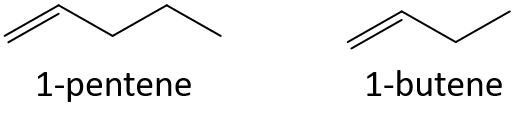
- 3-hepten lub 3-nonen
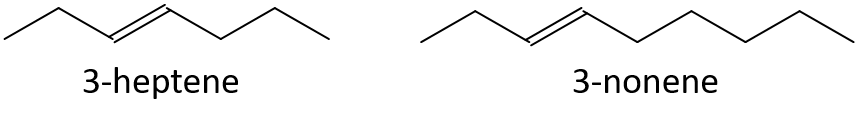
- 1-penten lub 1-buten
-
Który jest dobrym rozpuszczalnikiem dla cykloheksenu? pentan czy woda?
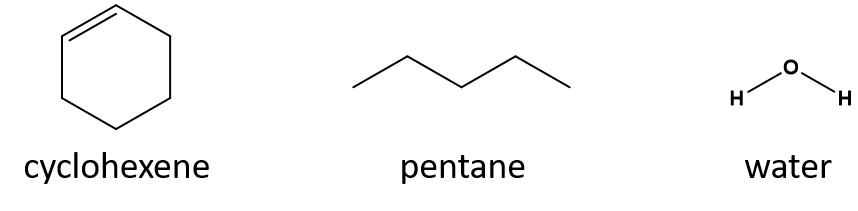
Odpowiedź
-
- 1-penten
- 3-.nonen
Ćwiczenia sprawdzające pojęcia
-
Krótko określ istotne różnice między węglowodorem nasyconym a nienasyconym.
-
Krótko zidentyfikuj ważne rozróżnienia między alkenem i alkanem.
-
Klasyfikuj każdy związek jako nasycony lub nienasycony. Zidentyfikuj każdy z nich jako alkan, alken lub alkin.
-
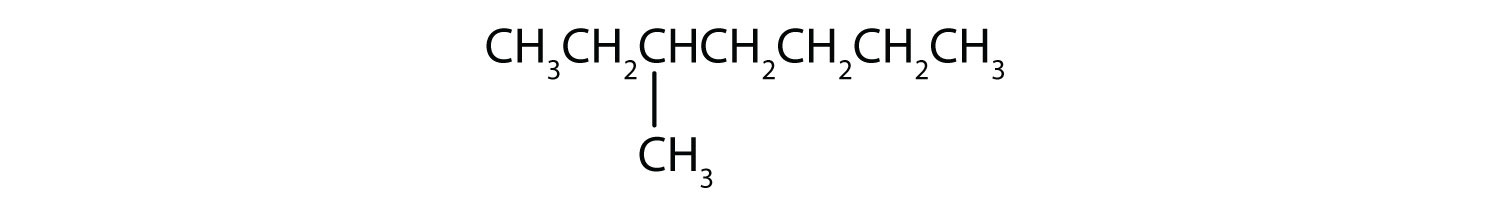
- CH3CH2C≡CCH3
-

-
.
Answers
-
Węglowodory nienasycone mają wiązania podwójne lub potrójne i są dość reaktywne; Węglowodory nasycone mają tylko pojedyncze wiązania i są raczej niereaktywne.
-
Alken ma podwójne wiązania; alkan ma tylko pojedyncze wiązania.
-
- nasycony; alkan
- nienasycony; alkin
- nienasycony; alken
Key Takeaway
- Alkeny to węglowodory z podwójnym wiązaniem węgiel-węgiel.
8.3 Alkeny
Najprostszy alkin – węglowodór z potrójnym wiązaniem węgiel-węgiel – ma wzór cząsteczkowy C2H2 i jest znany pod swoją potoczną nazwą – acetylen (rys. 8.5). Jego struktura to H-C≡C-H.
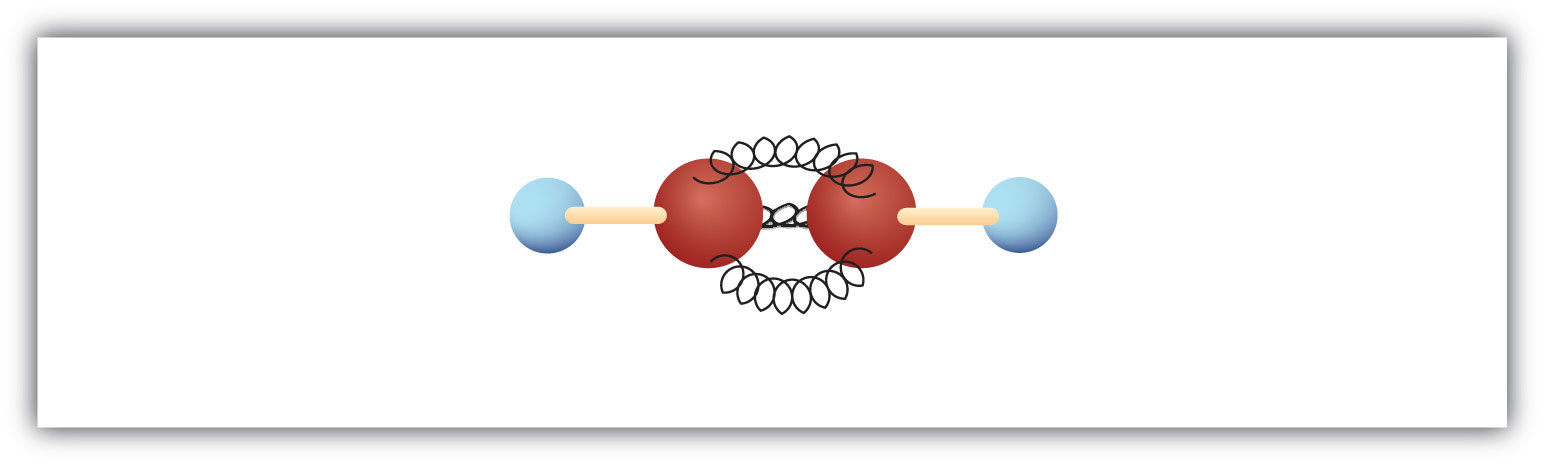
Rysunek 8.5 Model kulkowo-sprężynowy acetylenu. Acetylen (etyn) jest najprostszym członkiem rodziny alkinów.
Uwaga
Acetylen jest stosowany w palnikach tlenowoacetylenowych do cięcia i spawania metali. Płomień z takiego palnika może być bardzo gorący. Większość acetylenu jest jednak przekształcana w półprodukty chemiczne, które są wykorzystywane do wytwarzania tworzyw winylowych i akrylowych, włókien, żywic i wielu innych produktów.
Alkeny są podobne do alkenów zarówno pod względem właściwości fizycznych, jak i chemicznych. Na przykład, alkiny ulegają wielu typowym reakcjom addycji alkenów. Nazwy Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC) dla alkinów są równoległe do nazw alkenów, z wyjątkiem tego, że końcówka rodziny jest -yne zamiast -ene. Nazwa IUPAC dla acetylenu to etyn. Nazwy innych alkinów są zilustrowane w następujących ćwiczeniach.
Concept Review Exercises
-
Krótko określ istotne różnice między alkenem a alkinem. W czym są one podobne?
-
Alken (CH3)2CHCH2CH=CH2 nosi nazwę 4-metylo-1-pentenu. Jak nazywa się (CH3)2CHCH2C≡CH?
-
Czy alkiny wykazują izomeryzm cis-trans? Wyjaśnij.
Odpowiedzi
-
Alkeny mają wiązania podwójne; alkiny mają wiązania potrójne. Oba ulegają reakcjom addycji.
-
4-metylo-1-pentyna
-
Nie; potrójnie związany atom węgla może utworzyć tylko jedno inne wiązanie. Musiałby mieć dołączone dwie grupy, aby wykazać izomeryzm cis-trans.
Key Takeaway
- Alkeny to węglowodory z potrójnymi wiązaniami węgiel-węgiel i właściwościami podobnymi do alkenów.
Ćwiczenia
-
Narysuj strukturę dla każdego związku.
- acetylen
- 3-metylo-1-heksyna
-
Narysuj strukturę dla każdego związku.
- 4-metylo-2-heksyny
- 3-oktyny
-
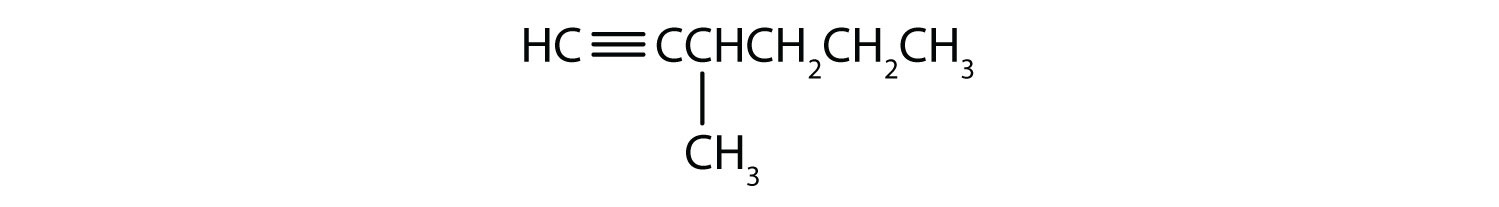
Nazwij każdy alkin.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Odpowiedzi
.
-
- H-C≡C-H
-
-
- 1-.pentyna
- 2-heksyna
(Powrót na górę)
8.4 Związki aromatyczne: Benzen
Następnie rozpatrujemy klasę węglowodorów o wzorach cząsteczkowych podobnych do wzorów węglowodorów nienasyconych, które jednak, w przeciwieństwie do alkenów, nie ulegają łatwo reakcjom addycji. Związki te stanowią odrębną klasę, zwaną węglowodorami aromatycznymi. Węglowodory aromatyczne to związki, które zawierają strukturę pierścienia benzenowego.Najprostszym związkiem aromatycznym jest benzen (C6H6) i ma on duże znaczenie handlowe, ale ma również godne uwagi szkodliwe skutki zdrowotne (patrz „To Your Health: Benzene and Us”).
Wzór C6H6 wydaje się wskazywać, że benzen ma wysoki stopień nienasycenia. (Heksan, węglowodór nasycony z sześcioma atomami węgla ma wzór C6H14 – osiem atomów wodoru więcej niż benzen). Jednakże, pomimo pozornie niskiego poziomu nasycenia, benzen jest raczej mało reaktywny. Wynika to ze struktury rezonansowej utworzonej z naprzemiennej struktury podwójnych wiązań pierścienia aromatycznego.

Uwaga
Benzen jest cieczą, która pachnie jak benzyna, wrze w temperaturze 80°C i zamarza w temperaturze 5,5°C. Jest to węglowodór aromatyczny produkowany w największych ilościach. Dawniej używano go do dekofeinizacji kawy i był znaczącym składnikiem wielu produktów konsumenckich, takich jak środki do usuwania farby, cementy do gumy i domowe środki do usuwania plam po praniu chemicznym. Został on usunięty z wielu preparatów w latach 50-tych, ale inni nadal stosowali benzen w produktach aż do lat 70-tych, kiedy to powiązano go ze śmiertelnością z powodu białaczki. Benzen jest nadal ważny w przemyśle jako prekursor w produkcji tworzyw sztucznych (takich jak styropian i nylon), leków, detergentów, kauczuku syntetycznego, pestycydów i barwników. Jest on stosowany jako rozpuszczalnik do czyszczenia i konserwacji sprzętu drukarskiego oraz do klejów, takich jak te używane do mocowania podeszew do butów. Benzen jest naturalnym składnikiem produktów naftowych, ale ponieważ jest znanym czynnikiem rakotwórczym, jego stosowanie jako dodatku do benzyny jest obecnie ograniczone.
To Your Health: Benzene and Us
Większość benzenu używanego komercyjnie pochodzi z ropy naftowej. Jest on stosowany jako materiał wyjściowy do produkcji detergentów, leków, barwników, środków owadobójczych i tworzyw sztucznych. Kiedyś szeroko stosowany jako rozpuszczalnik organiczny, obecnie wiadomo, że benzen ma zarówno krótko-, jak i długoterminowe działanie toksyczne. Wdychanie dużych stężeń może powodować mdłości, a nawet śmierć z powodu niewydolności oddechowej lub serca, natomiast powtarzające się narażenie prowadzi do postępującej choroby, w której zdolność szpiku kostnego do tworzenia nowych komórek krwi zostaje ostatecznie zniszczona. Powoduje to stan zwany niedokrwistością aplastyczną, w którym dochodzi do spadku liczby zarówno czerwonych, jak i białych krwinek.
Ćwiczenia sprawdzające pojęcia
-
Jak typowe reakcje benzenu różnią się od reakcji alkenów?
-
Krótko opisz wiązania w benzenie.
-
Co oznacza koło w przedstawieniu benzenu przez chemika?
Odpowiedzi
-
Benzen jest raczej mało reaktywny w reakcjach addycji w porównaniu z alkenem.
-
Elektrony walencyjne są równo dzielone przez wszystkie sześć atomów węgla (to znaczy, że elektrony są zdelokalizowane).
-
Sześć elektronów jest dzielonych równo przez wszystkie sześć atomów węgla.
Rozpoznawanie związków aromatycznych
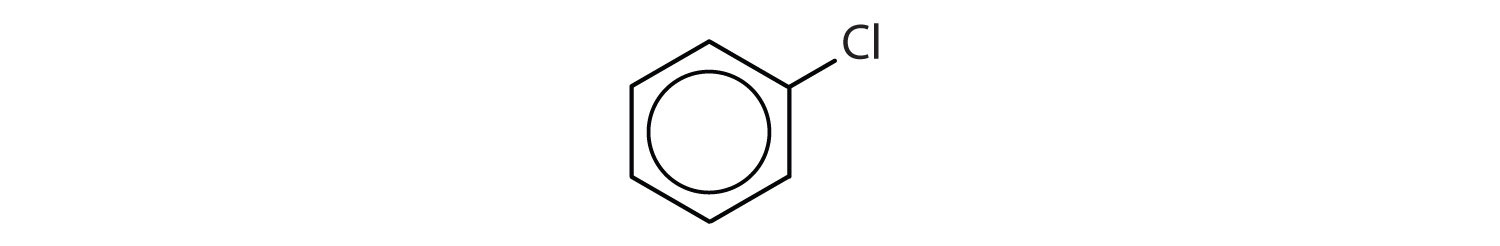
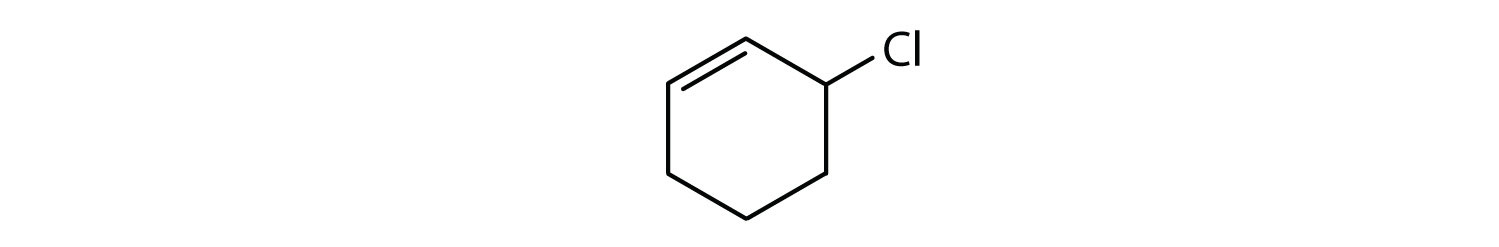
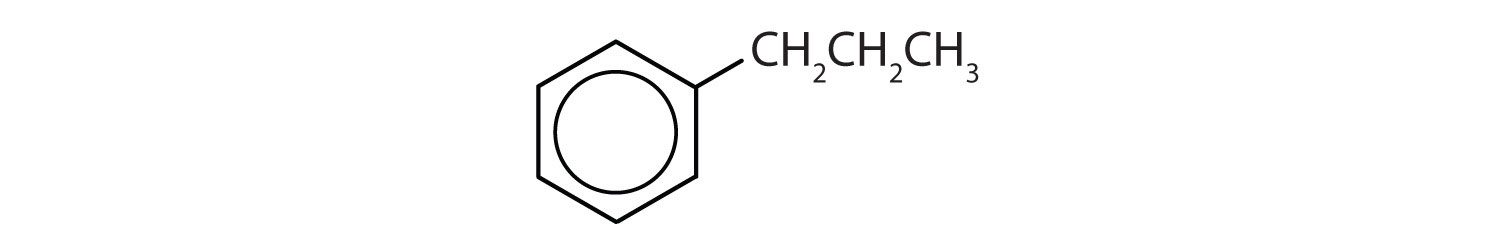
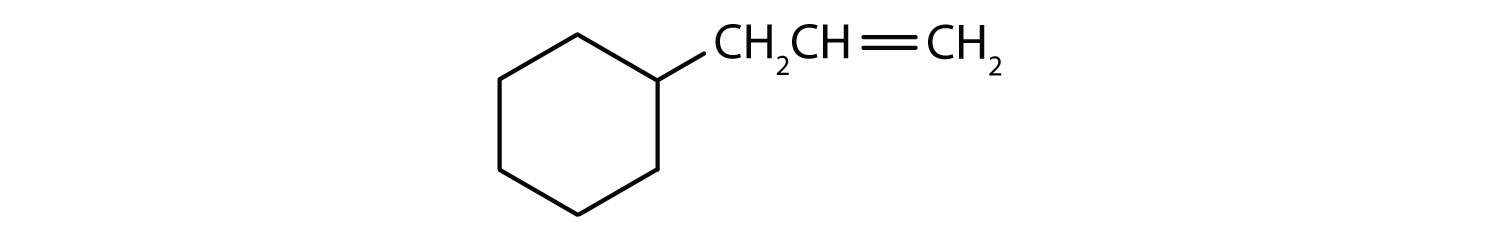
Które związki są aromatyczne?
Rozwiązanie
- Związek posiada pierścień benzenowy (z atomem chloru podstawionym za jeden z atomów wodoru); jest aromatyczny.
- Związek jest cykliczny, ale nie posiada pierścienia benzenowego; nie jest aromatyczny.
- Związek posiada pierścień benzenowy (z grupą propylowa podstawioną za jeden z atomów wodoru); jest aromatyczny.
- Związek jest cykliczny, ale nie ma pierścienia benzenowego; nie jest aromatyczny.
Ćwiczenie rozwijające umiejętności
Które związki są aromatyczne?
W systemie Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC) węglowodory aromatyczne noszą nazwę pochodnych benzenu. Poniżej przedstawiono pięć przykładów. W tych strukturach nie ma znaczenia, czy pojedynczy podstawnik jest zapisany na górze, z boku, czy na dole pierścienia: sześciokąt jest symetryczny, a zatem wszystkie pozycje są równoważne.
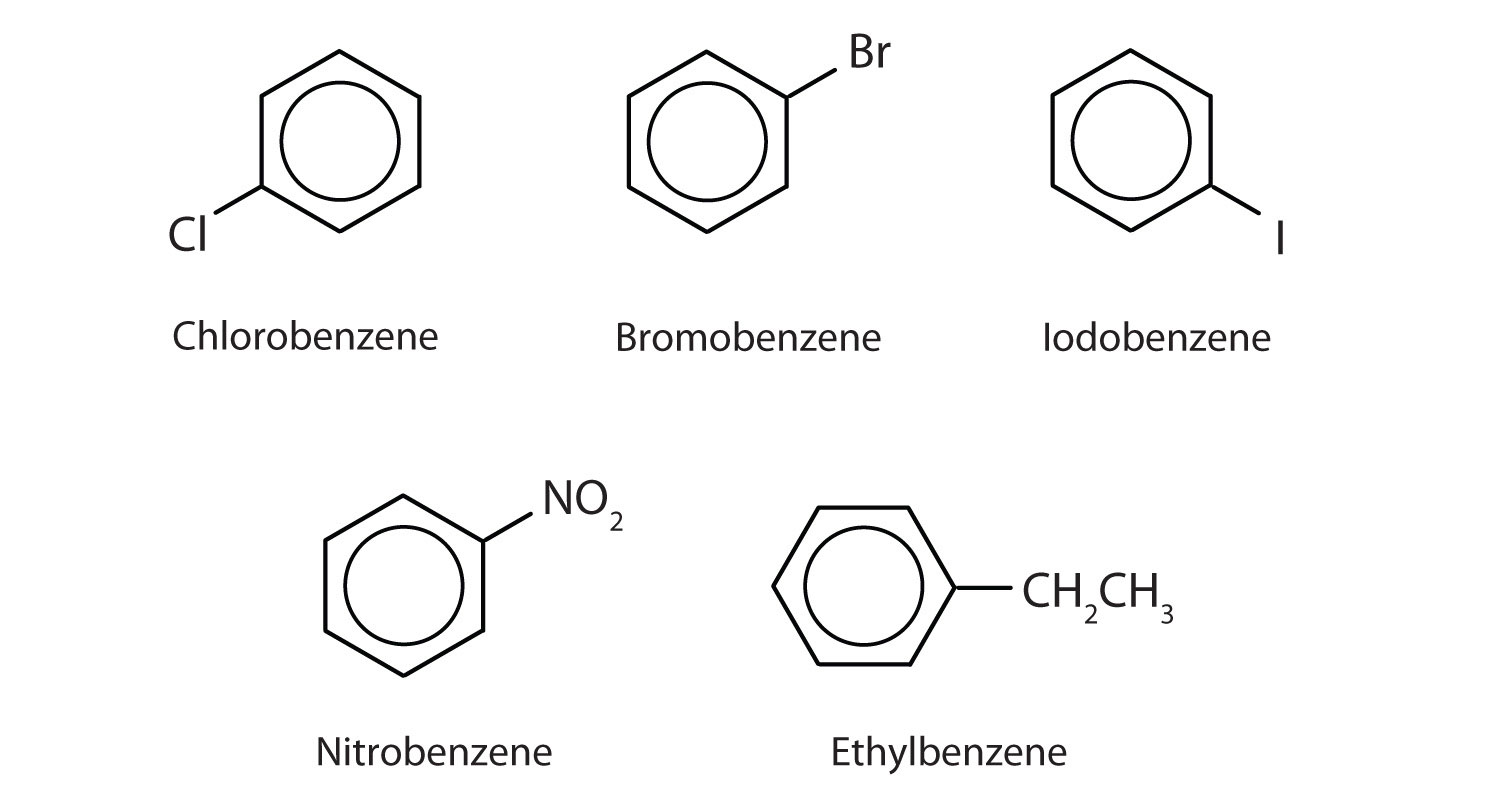
Związki te są nazwane w zwykły sposób z grupy, która zastępuje atom wodoru o nazwie grupy podstawnika: Cl jako chloro, Br jako bromo, I jako jodo, NO2 jako nitro i CH3CH2 jako etyl.
Chociaż niektóre związki są określane wyłącznie nazwami IUPAC, niektóre są częściej oznaczane nazwami zwyczajowymi, jak wskazano poniżej.
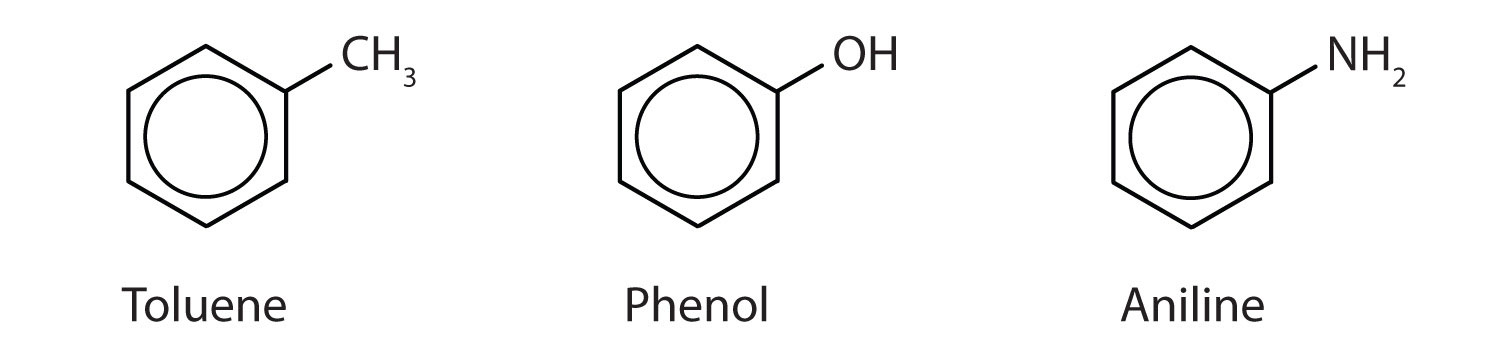
-
Key Takeaway
- Węglowodory aromatyczne wydają się być nienasycone, ale mają specjalny rodzaj wiązań i nie ulegają reakcjom addycji.
(Powrót do początku)
Policykliczne węglowodory aromatyczne
Niektóre popularne węglowodory aromatyczne składają się z połączonych pierścieni benzenowych, które mają wspólną stronę. Związki te nazywane są wielopierścieniowymi węglowodorami aromatycznymi (WWA)Węglowodór aromatyczny składający się ze stopionych pierścieni benzenowych mających wspólną stronę..
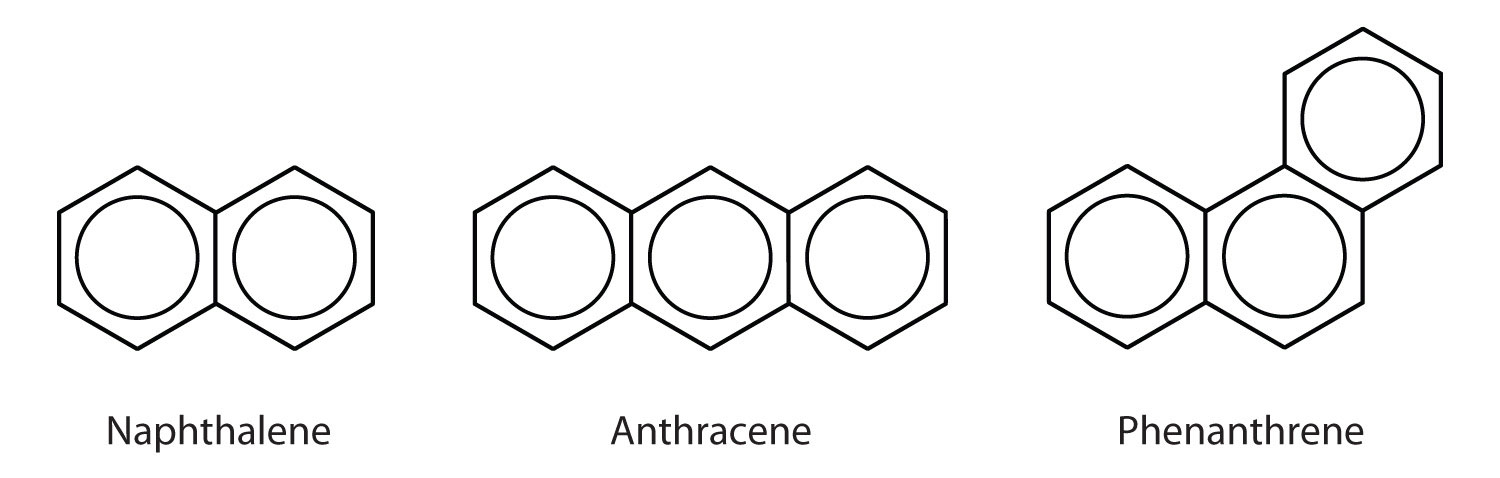
Trzy przedstawione tu przykłady są bezbarwnymi, krystalicznymi ciałami stałymi otrzymywanymi na ogół ze smoły węglowej. Naftalen ma ostry zapach i jest stosowany w kulach na mole. Antracen jest stosowany w produkcji niektórych barwników. Steroidy, w tym cholesterol i hormony, estrogen i testosteron, zawierają strukturę fenantrenu.
To Your Health: Polycyclic Aromatic Hydrocarbons and Cancer
Intensywne ogrzewanie wymagane do destylacji smoły węglowej powoduje powstawanie WWA. Od wielu lat wiadomo, że pracownicy rafinerii smoły węglowej są podatni na rodzaj raka skóry, znanego jako rak smołowy. Badania wykazały, że szereg policyklicznych węglowodorów aromatycznych jest rakotwórczych. Jeden z najbardziej aktywnych związków rakotwórczych, benzopiren, występuje w smole węglowej i został również wyizolowany z dymu papierosowego, dymu marihuany, spalin samochodowych i steków pieczonych na węglu drzewnym. Szacuje się, że ponad 1000 ton benzopirenu jest emitowane do powietrza nad Stanami Zjednoczonymi każdego roku. Tylko kilka miligramów benzopirenu na kilogram masy ciała jest potrzebnych do wywołania raka u zwierząt doświadczalnych.
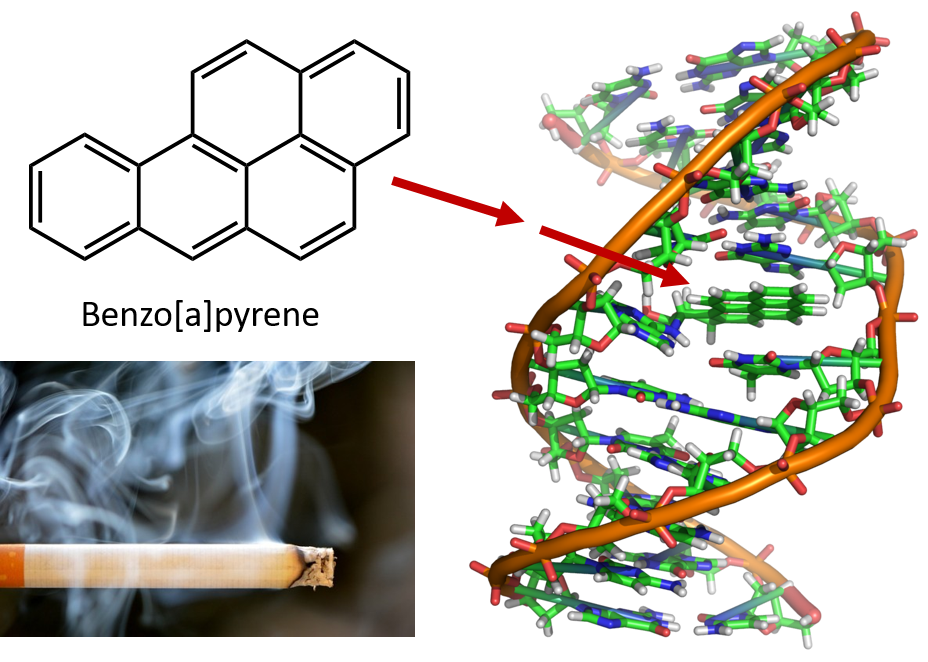
Rysunek 8.6 Benzopiren jest wielopierścieniowym węglowodorem aromatycznym wytwarzanym jako produkt uboczny w smole węglowej, dymie papierosowym i marihuanowym oraz w stekach smażonych na węglu drzewnym. Benzopiren jest metabolizowany w celu wytworzenia biologicznie aktywnych związków, które mogą tworzyć fizyczne addukty na cząsteczkach DNA. Te addukty mogą powodować mutacje genetyczne, które powodują raka.
Zdjęcie dymu papierosowego
Biologicznie ważne związki z pierścieniami benzenowymi
Substancje zawierające pierścień benzenowy są powszechne zarówno u zwierząt, jak i u roślin, chociaż w tych ostatnich występują w większych ilościach. Rośliny mogą syntetyzować pierścień benzenowy z dwutlenku węgla, wody i materiałów nieorganicznych. Zwierzęta nie mogą go syntetyzować, ale są zależne od pewnych związków aromatycznych, aby przetrwać i dlatego muszą je pozyskiwać z pożywienia. Fenyloalanina, tyrozyna i tryptofan (aminokwasy egzogenne) oraz witaminy K, B2 (ryboflawina) i B9 (kwas foliowy) zawierają pierścień benzenowy. Wiele ważnych leków, z których kilka przedstawiono w tabeli 8.2, również posiada pierścień benzenowy.
Uwaga
Do tej pory badaliśmy tylko związki aromatyczne z pierścieniami zawierającymi węgiel. Jednak wiele związków cyklicznych ma w pierścieniu pierwiastek inny niż atomy węgla. Organiczne struktury pierścieniowe, które zawierają atom inny niż węgiel nazywamy związkami heterocyklicznymi.., Heterocykliczne związki aromatyczne mają również unikalne i medycznie istotne właściwości.
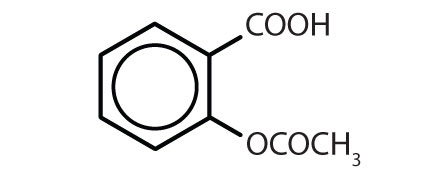
Tabela 8.2 Some Drugs That Contain a Benzene Ring
| Name | Structure |
|---|---|
| aspiryna |
 |
| acetaminofen |
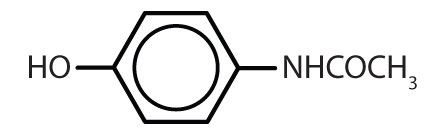 |
| ibuprofen |
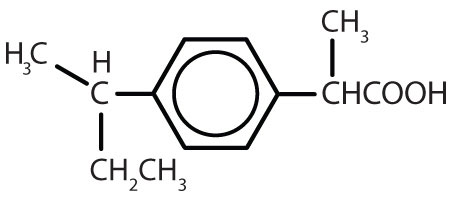 |
| amfetamina |
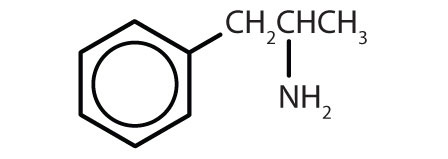 |
| sulfanilamid |
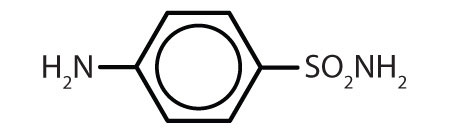 |
8.5 Izomery geometryczne
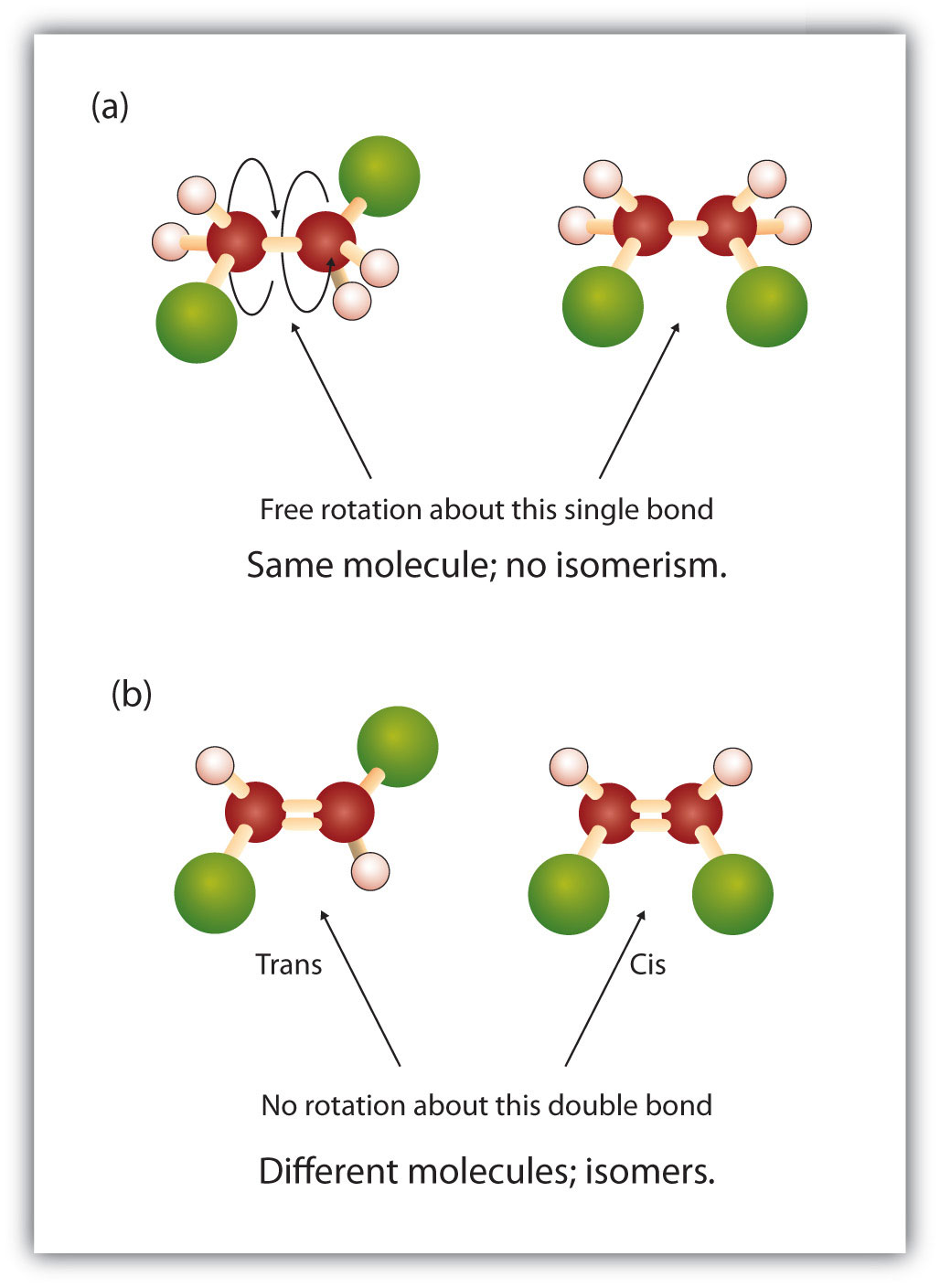
Wewnątrz struktury alkanów występuje swobodna rotacja wokół wiązań pojedynczych węgiel-węgiel (C-C). Natomiast struktura alkenów wymaga, aby atomy węgla tworzyły wiązanie podwójne. Wiązania podwójne pomiędzy pierwiastkami tworzone są za pomocą powłok orbitali p (zwanych również orbitalami pi). Te powłoki orbitalne mają kształt hantli, a nie okrągłych orbitali używanych w wiązaniach pojedynczych. Uniemożliwia to swobodną rotację atomów węgla wokół wiązania podwójnego, gdyż spowodowałoby to rozerwanie wiązania podwójnego podczas rotacji (rysunek 8.7). Wiązanie pojedyncze jest więc analogiczne do dwóch desek zbitych jednym gwoździem. Deski mogą się swobodnie obracać wokół pojedynczego gwoździa. Z kolei wiązanie podwójne jest analogiczne do dwóch desek zbitych dwoma gwoździami. W pierwszym przypadku można deski skręcić, natomiast w drugim nie można ich skręcić.

Rysunek 8.7 Tworzenie wiązań podwójnych wymaga użycia wiązań pi-. Aby cząsteczki mogły tworzyć wiązania podwójne, elektrony muszą dzielić nakładające się na siebie orbitale pi- pomiędzy dwa atomy. Wymaga to, aby pi-orbitale w kształcie hantli (pokazane po lewej stronie) pozostawały w stałej konformacji podczas tworzenia wiązania podwójnego. Pozwala to na utworzenie orbitali elektronowych, które mogą być współdzielone przez oba atomy (pokazane po prawej). Rotacja wokół wiązania podwójnego spowodowałaby, że orbitale pi byłyby źle ustawione, przerywając wiązanie podwójne.
Diagram provided from: JoJanderivative work – Vladsinger (talk)
Stały i sztywny charakter podwójnego wiązania stwarza możliwość dodatkowego centrum chiralnego, a tym samym, potencjał dla stereoizomerów. Nowe stereoizomery tworzą się, jeśli każdy z węgli zaangażowanych w podwójne wiązanie ma dwa różne atomy lub grupy do niego dołączone. Na przykład, spójrz na dwa chlorowcopochodne węglowodorów na rysunku 8.8. W górnej części rysunku pokazany jest chlorowcowany alkan. Rotacja wokół tego wiązania węgiel-węgiel jest możliwa i nie powoduje powstania różnych konformacji izomerycznych. Na dolnym rysunku, fluorowcowany alken ma ograniczoną rotację wokół wiązania podwójnego. Zauważmy również, że każdy węgiel biorący udział w wiązaniu podwójnym jest również przyłączony do dwóch różnych atomów (wodoru i chloru). Tak więc, cząsteczki te mogą tworzyć dwa stereoizomery: jeden, który ma dwa atomy chloru po tej samej stronie podwójnego wiązania, a drugi, w którym chloryny znajdują się po przeciwnych stronach podwójnego wiązania.
Rysunek 8.8 Alkenowe wiązania podwójne mogą tworzyć izomery geometryczne. (a) Pokazuje swobodną rotację wokół pojedynczego wiązania węgiel-węgiel w strukturze alkanu. (b) Pokazuje stałe położenie wiązania podwójnego węgiel-węgiel, które prowadzi do izomerów geometrycznych (przestrzennych).
Click Here for a Kahn Academy Video Tutorial on Alkene Structure.
W tej sekcji nie zajmujemy się nazewnictwem, które jest również zawarte w tym samouczku wideo.(Uwaga: Cała zawartość Khan Academy jest dostępna za darmo przy użyciu licencji CC-BY-NC-SA na www.khanacademy.org )
Nomenklatura cis-trans
System nazewnictwa cis-trans może być użyty do rozróżnienia prostych izomerów, gdzie każdy węgiel wiązania podwójnego ma zestaw identycznych grup do niego dołączonych. Na przykład, na rysunku 8.8b, każdy węgiel zaangażowany w podwójne wiązanie, ma chlor dołączony do niego, a także ma wodór dołączony do niego. System cis i trans identyfikuje, czy identyczne grupy znajdują się po tej samej stronie (cis) wiązania podwójnego, czy po przeciwnej stronie (trans) wiązania podwójnego. Na przykład, jeśli atomy wodoru znajdują się po przeciwnej stronie wiązania podwójnego, mówi się, że wiązanie jest w konformacji trans. Gdy grupy wodorowe znajdują się po tej samej stronie wiązania podwójnego, mówi się, że wiązanie jest w konformacji cis. Zauważ, że można również powiedzieć, że jeśli obie grupy chlorowe są po przeciwnej stronie wiązania podwójnego, że cząsteczka jest w konformacji trans lub jeśli są one po tej samej stronie wiązania podwójnego, że cząsteczka jest w konformacji cis.
Aby określić, czy cząsteczka jest cis czy trans, pomocne jest narysowanie przerywanej linii w dół środka wiązania podwójnego, a następnie zakreślenie identycznych grup, jak pokazano na rysunku 8.9. Obie cząsteczki przedstawione na rysunku 8.9 noszą nazwę 1,2-dichloroetenu. Tak więc oznaczenie cis i trans określa jedynie stereochemię wokół wiązania podwójnego, nie zmienia natomiast ogólnej tożsamości cząsteczki. Jednak izomery cis i trans często mają różne właściwości fizyczne i chemiczne, ze względu na stały charakter wiązań w przestrzeni.
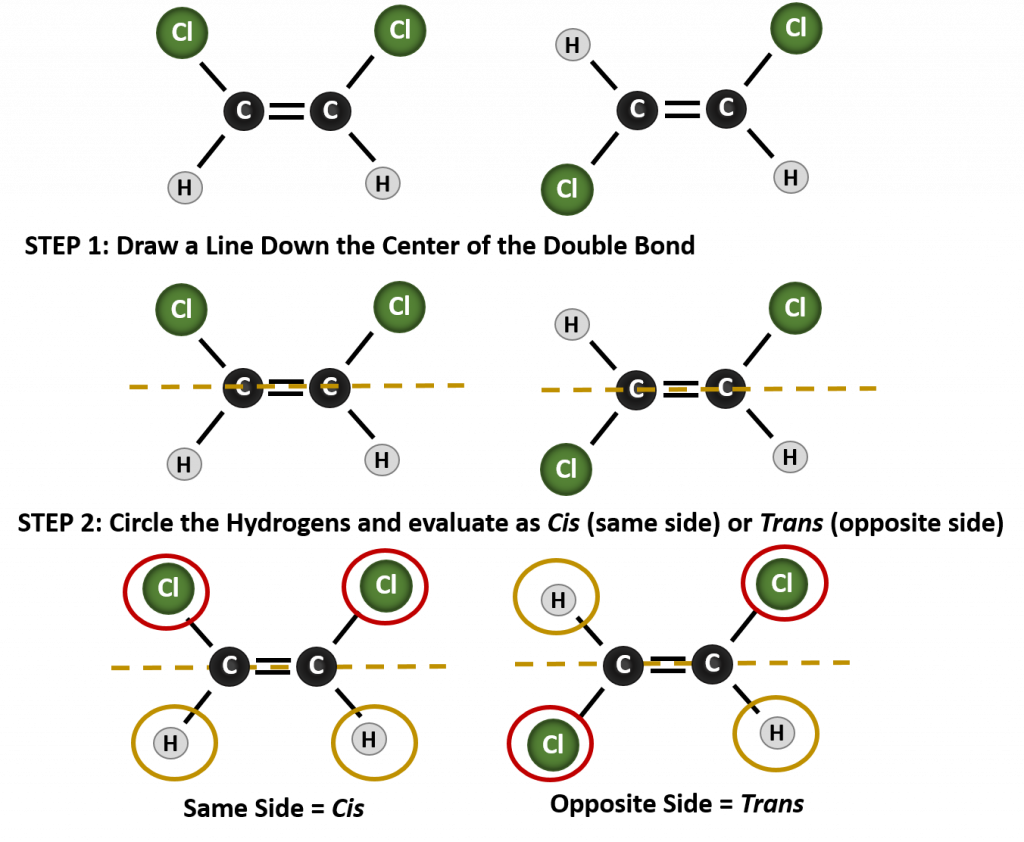
Rysunek 8.9 Przewodnik do określania konformacji Cis lub Trans.
Click Here for a Kahn Academy Video Tutorial on Cis/Trans Isomerization
(Uwaga: Cała zawartość Khan Academy jest dostępna za darmo z wykorzystaniem licencji CC-BY-NC-SA na stronie www.khanacademy.org )
Izomeryzm cis-trans występuje również w związkach cyklicznych. W strukturach pierścieniowych, grupy nie są w stanie obracać się wokół żadnego z pierścieniowych wiązań węgiel-węgiel. Dlatego grupy mogą znajdować się albo po tej samej stronie pierścienia (cis), albo po przeciwnych stronach pierścienia (trans). Dla naszych celów tutaj, przedstawiamy wszystkie cykloalkany jako struktury planarne, i wskazujemy pozycje grup, albo powyżej lub poniżej płaszczyzny pierścienia.

Do Twojego Zdrowia
Prawdopodobnie najczęstszym miejscem, że usłyszysz odniesienie do cis-trans konformacji w życiu codziennym jest w supermarkecie lub gabinecie lekarskim. Odnosi się to do naszego spożycia tłuszczów w diecie. Niewłaściwe lub nadmierne spożycie tłuszczów w diecie zostało powiązane z wieloma zaburzeniami zdrowotnymi, takimi jak cukrzyca i miażdżyca, a także choroba wieńcowa. Jakie są więc różnice między tłuszczami nasyconymi i nienasyconymi, czym są tłuszcze trans i dlaczego stanowią taki problem zdrowotny?

Rysunek 8.10 Wspólne źródła tłuszczów dietetycznych.
Zdjęcie od: TyMaHe
Najczęstszą formą tłuszczów dietetycznych i głównym składnikiem tkanki tłuszczowej u ludzi i innych zwierząt są trójglicerydy (TAG). TAGi, jak pokazano na rysunku 8.10, są zbudowane z jednej cząsteczki glicerolu i trzech cząsteczek kwasów tłuszczowych, które są połączone ze sobą wiązaniem estrowym. W tym rozdziale skoncentrujemy się na strukturze długich ogonów kwasów tłuszczowych, które mogą składać się ze struktur alkanowych lub alkenowych. Rozdział 10 skupi się bardziej na tworzeniu wiązań estrowych.

Rysunek 8.11. Przykład struktury triglicerydu (TAG). Zauważ, że każdy trigliceryd ma trzy długołańcuchowe kwasy tłuszczowe rozciągające się od kręgosłupa glicerolu. Każdy kwas tłuszczowy może mieć różne stopnie nasycenia i nienasycenia.
Struktura zaadaptowana z: Wolfgang Schaefer
Tłuszcze, które są w pełni nasycone będą miały tylko kwasy tłuszczowe z długimi łańcuchami alkanów. Mówi się, że są one „nasycone” atomami wodoru. Tłuszcze nasycone są powszechne w amerykańskiej diecie i znajdują się w czerwonym mięsie, produktach mlecznych, takich jak mleko, ser i masło, olej kokosowy, i znajdują się w wielu wypiekach. Tłuszcze nasycone są zazwyczaj ciałami stałymi w temperaturze pokojowej. Dzieje się tak dlatego, że długołańcuchowe alkany mogą układać się razem, mając więcej międzycząsteczkowych londyńskich sił rozpraszających. To daje tłuszcze nasycone wyższe temperatury topnienia i wrzenia niż nienasycone tłuszcze znalezione w wielu olejach roślinnych.
Większość nienasyconych tłuszczów znalezionych w przyrodzie są w cis-konformacji, jak pokazano na rysunku 8.11. Zauważmy, że kwasy tłuszczowe pokazane na rysunku 8.11 są narysowane dla wygody, tak aby łatwo było na nie patrzeć i aby nie zajmowały zbyt wiele miejsca na papierze, ale zapisane kąty wiązań nie oddają odpowiednio prawdziwej orientacji przestrzennej cząsteczek. Kiedy kwasy tłuszczowe z TAG pokazanego na Rysunku 8.11 są narysowane z poprawnymi kątami wiązań, łatwo zauważyć, że wiązania cis-dwukrotne powodują zagięcia w łańcuchu alkenowym (Rys. 8.12).
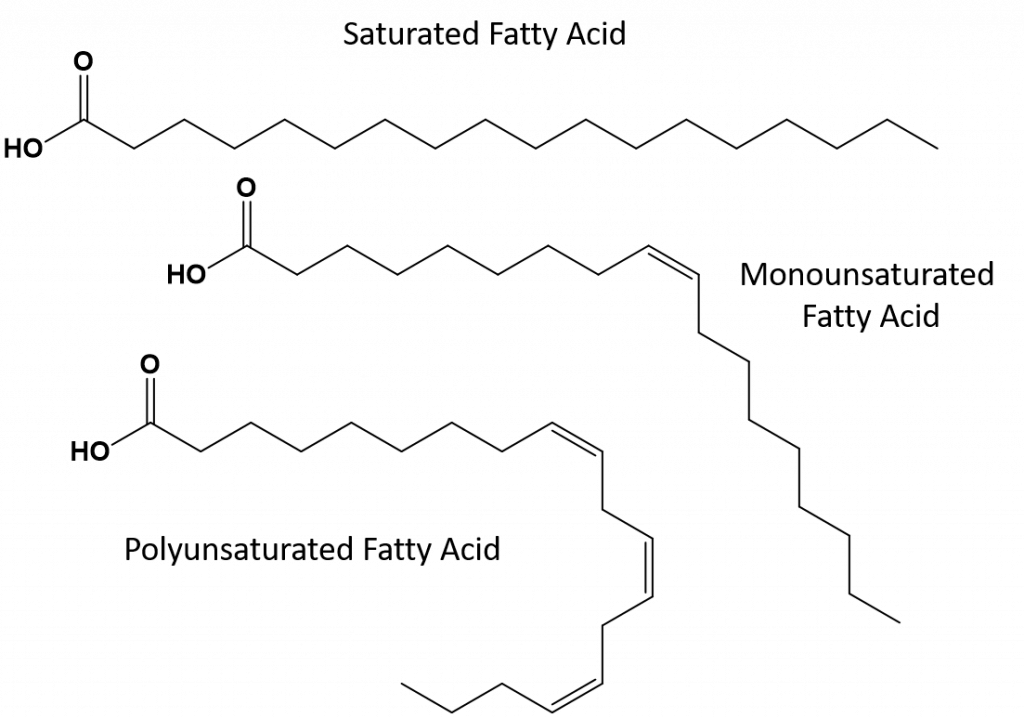
Rysunek 8.12 Cis-Double Bonds Cause Bends in Fatty Acid Structure
Tym samym, tłuszcze jednonienasycone i wielonienasycone nie mogą układać się razem tak łatwo i nie mają tak wielu międzycząsteczkowych sił przyciągania w porównaniu z tłuszczami nasyconymi. W rezultacie mają one niższe temperatury topnienia i wrzenia oraz tendencję do bycia cieczami w temperaturze pokojowej. Wykazano, że redukcja lub zastąpienie tłuszczów nasyconych tłuszczami jedno- i wielonienasyconymi w diecie, pomaga obniżyć poziom cholesterolu w postaci LDL (low-density-lipoprotein), który jest czynnikiem ryzyka choroby wieńcowej serca.
Tłuszcze trans, z drugiej strony, zawierają wiązania podwójne, które są w konformacji trans. W ten sposób kształt kwasów tłuszczowych jest liniowy, podobny do tłuszczów nasyconych. Tłuszcze trans mają również podobne temperatury topnienia i wrzenia w porównaniu z tłuszczami nasyconymi. Jednakże, w przeciwieństwie do tłuszczów nasyconych, tłuszcze trans nie występują powszechnie w przyrodzie i mają negatywny wpływ na zdrowie. Tłuszcze trans powstają głównie jako produkt uboczny w procesie przetwarzania żywności (głównie w procesie uwodorniania w celu wytworzenia margaryn i skrótów) lub podczas gotowania, zwłaszcza smażenia na głębokim tłuszczu. W rzeczywistości, wiele fast foodów używa tłuszczów trans w procesie smażenia na głębokim tłuszczu, ponieważ tłuszcze trans mogą być używane wiele razy zanim będą musiały zostać zastąpione. Spożywanie tłuszczów trans podnosi poziom cholesterolu LDL w organizmie (złego cholesterolu, który jest związany z chorobą wieńcową serca) i ma tendencję do obniżania poziomu lipoprotein o wysokiej gęstości (HDL) cholesterolu (dobrego cholesterolu w organizmie). Spożywanie tłuszczów trans zwiększa ryzyko wystąpienia chorób serca i udaru mózgu oraz rozwoju cukrzycy typu II. Ryzyko jest tak wysoko skorelowane, że wiele krajów zakazało stosowania tłuszczów trans, w tym Norwegia, Szwecja, Austria i Szwajcaria. W Stanach Zjednoczonych, Food and Drug Administration (FDA) przyjęła ostatnio środek mający na celu stopniowe wycofanie tłuszczów trans z żywności do 2018 roku. Szacuje się, że środek ten zapobiegnie 20 000 zawałów serca i 7 000 zgonów rocznie.
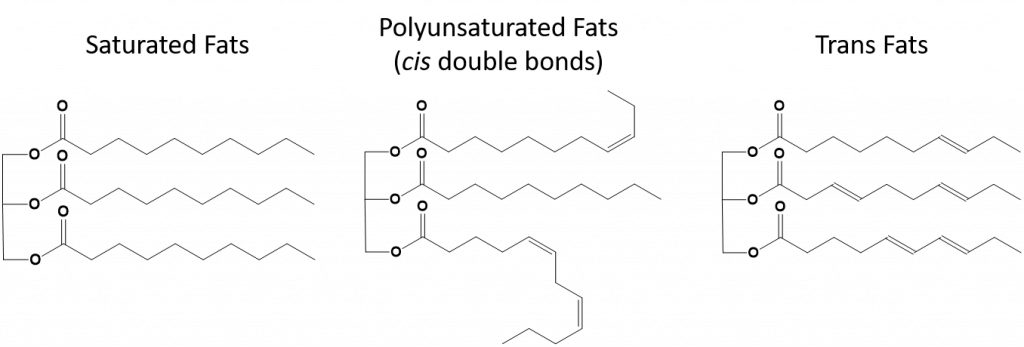
Rysunek 8.13 Różnice strukturalne w tłuszczach nasyconych, wielonienasyconych i trans.
Click Here for a Kahn Academy Video Tutorial on Saturated-, Unsaturated-, and Trans-Fats
(Uwaga: Cała zawartość Khan Academy jest dostępna za darmo na licencji CC-BY-NC-SA pod adresem www.khanacademy.org )
Key Factors for Determining Cis/Trans Isomerization
- The compound needs to contain a double or triple bond, or have a ring structure that will not allow free rotation around the carbon-carbon bond.
- Związek musi mieć dwie nieidentyczne grupy przyłączone do każdego węgla zaangażowanego w podwójne lub potrójne wiązanie węgiel-węgiel.
Przykład praktyczny
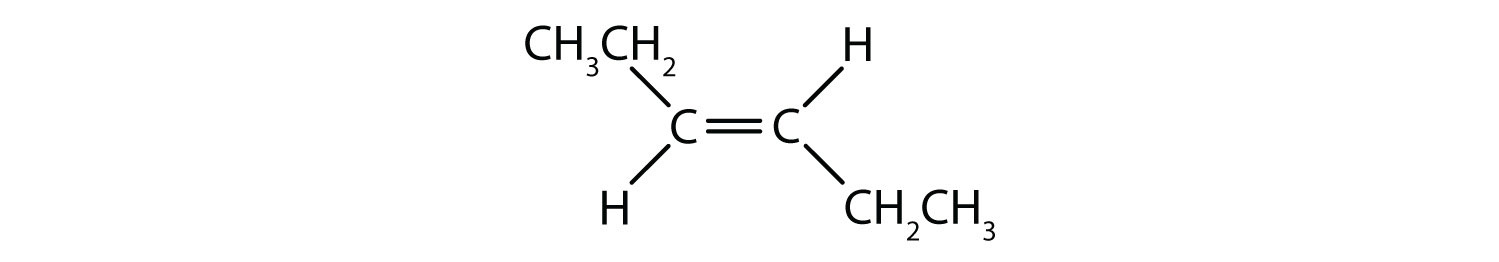
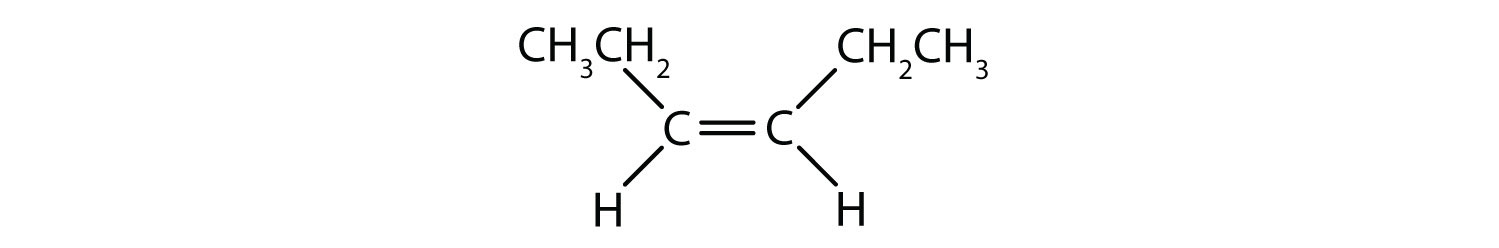
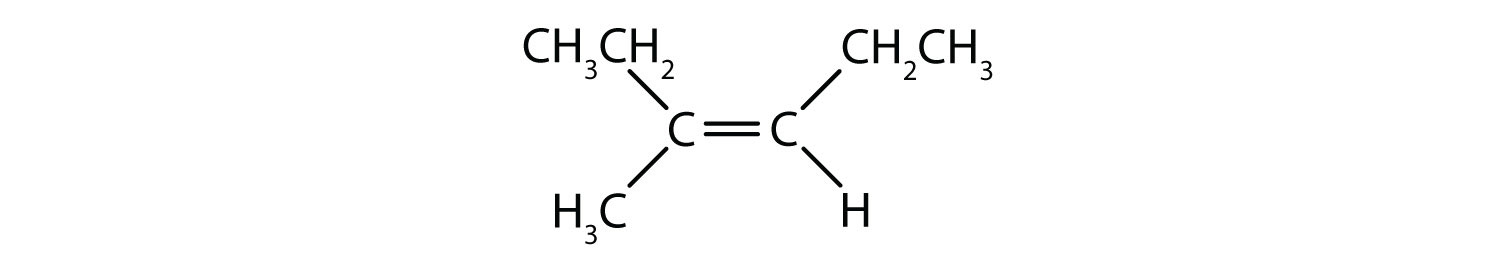
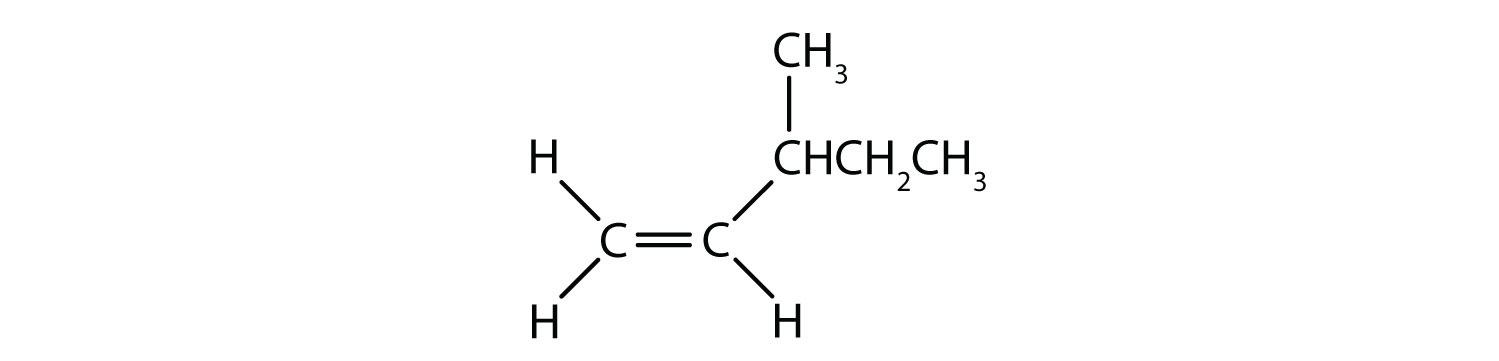
Które związki mogą istnieć jako izomery cis-trans (geometryczne)? Narysuj je.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CHCHCH2CH3
Rozwiązanie
Wszystkie cztery struktury mają wiązanie podwójne, a więc spełniają regułę 1 dla izomerii cis-trans.
-
Ten związek spełnia regułę 2; ma dwie nieidentyczne grupy na każdym atomie węgla (H i Cl na jednym oraz H i Br na drugim). Istnieje zarówno jako izomery cis i trans:

- Ten związek ma dwa atomy wodoru na jednym z podwójnie związanych atomów węgla; nie spełnia zasady 2 i nie istnieje jako izomery cis i trans.

- Ten związek ma dwie grupy metylowe (CH3) na jednym z podwójnie związanych atomów węgla. To nie spełnia zasady 2 i nie istnieje jako izomery cis i trans.

-
Ten związek spełnia regułę 2; ma dwie nieidentyczne grupy na każdym atomie węgla i istnieje jako izomery cis i trans:

Ćwiczenie sprawności
-
Które związki mogą istnieć jako izomery cis-trans? Narysuj je.
- CH2=CH2CH2CH3
- CH3CH=CH2CH3
- CH3CH2CH=CH2CH3
-
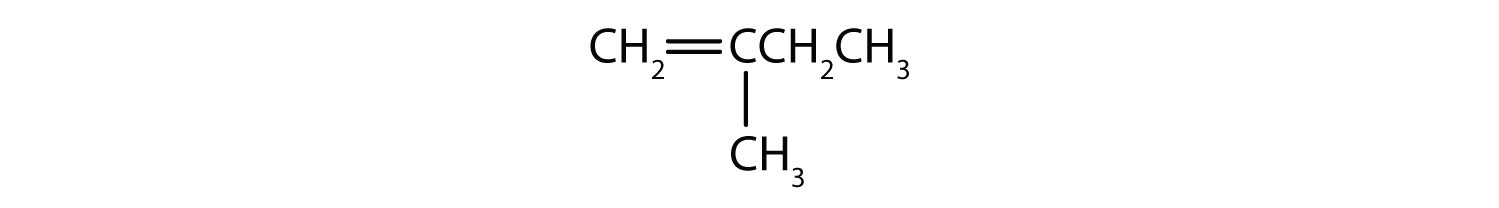
-
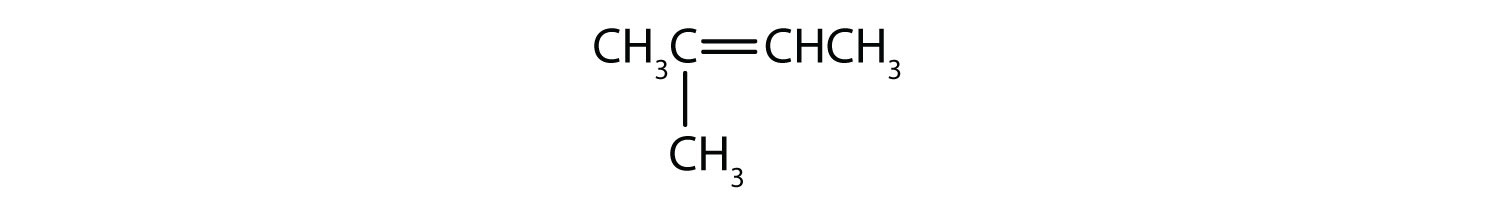
.
Ćwiczenia sprawdzające pojęcia
-
Co to są izomery cis-…trans (geometryczne) izomery? Jakie dwa typy związków mogą wykazywać izomeryzm cis-trans?
-
Klasyfikuj każdy związek jako izomer cis, izomer trans lub żaden z nich.
-
Odpowiedzi
-
Izomery cis-.Izomery trans to związki, które mają różne konfiguracje (grupy trwale w różnych miejscach w przestrzeni) ze względu na obecność sztywnej struktury w ich cząsteczce. Izomeria cis-trans może występować w alkenach i związkach cyklicznych.
-
- trans
- cis
- nigdy
Key Takeaway
- Izomeria cis->trans (geometryczna).Izomeria cis- trans (geometryczna) występuje wtedy, gdy w cząsteczce występuje ograniczona rotacja, a na każdym atomie węgla biorącym udział w wiązaniu chemicznym znajdują się dwie różne grupy.
(Back to the Top)
Nomenklatura E-Z
Sytuacja staje się bardziej złożona, gdy istnieją 4 różne grupy przyłączone do atomów węgla biorących udział w tworzeniu wiązania podwójnego. System nazewnictwa cis-trans nie może być stosowany w tym przypadku, ponieważ nie ma odniesienia do tego, które grupy są opisywane przez nomenklaturę. Na przykład, w poniższej cząsteczce można powiedzieć, że chlor jest trans do grupy bromowej, lub można powiedzieć, że chlor jest cis do grupy metylowej (CH3). Tak więc, proste napisanie cis lub trans w tym przypadku nie określa jasno orientacji przestrzennej grup w stosunku do wiązania podwójnego.
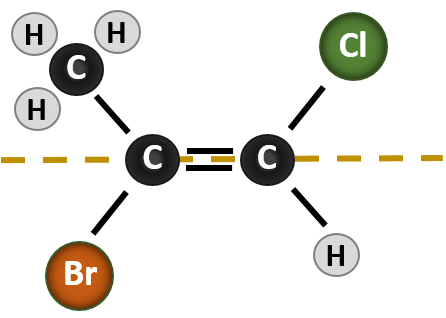
Nazwanie różnych stereoizomerów powstałych w tej sytuacji, wymaga znajomości zasad pierwszeństwa. Przypomnijmy sobie z rozdziału 5, że w systemie pierwszeństwa Cahn-Ingold-Prelog (CIP), grupy, które są przyłączone do węgla chiralnego mają pierwszeństwo w oparciu o ich liczbę atomową (Z). Atomy o wyższej liczbie atomowej (więcej protonów) mają wyższy priorytet (tj. S > P > O > N > C > H). Dla tego systemu nomenklatury stosuje się oznaczenia (Z) i (E) zamiast systemu cis/trans. (E) pochodzi od niemieckiego słowa entgegen, czyli przeciwieństwo. Tak więc, gdy grupy o wyższym priorytecie znajdują się po przeciwnej stronie wiązania podwójnego, mówi się, że wiązanie jest w konformacji (E). (Z), z drugiej strony, pochodzi od niemieckiego słowa zusammen, czyli razem. Tak więc, gdy grupy o wyższym priorytecie znajdują się po tej samej stronie wiązania podwójnego, mówi się, że wiązanie jest w konformacji (Z). Rysunek 8.14 przedstawia kroki stosowane w przypisywaniu konformacji (E) lub (Z) cząsteczki.
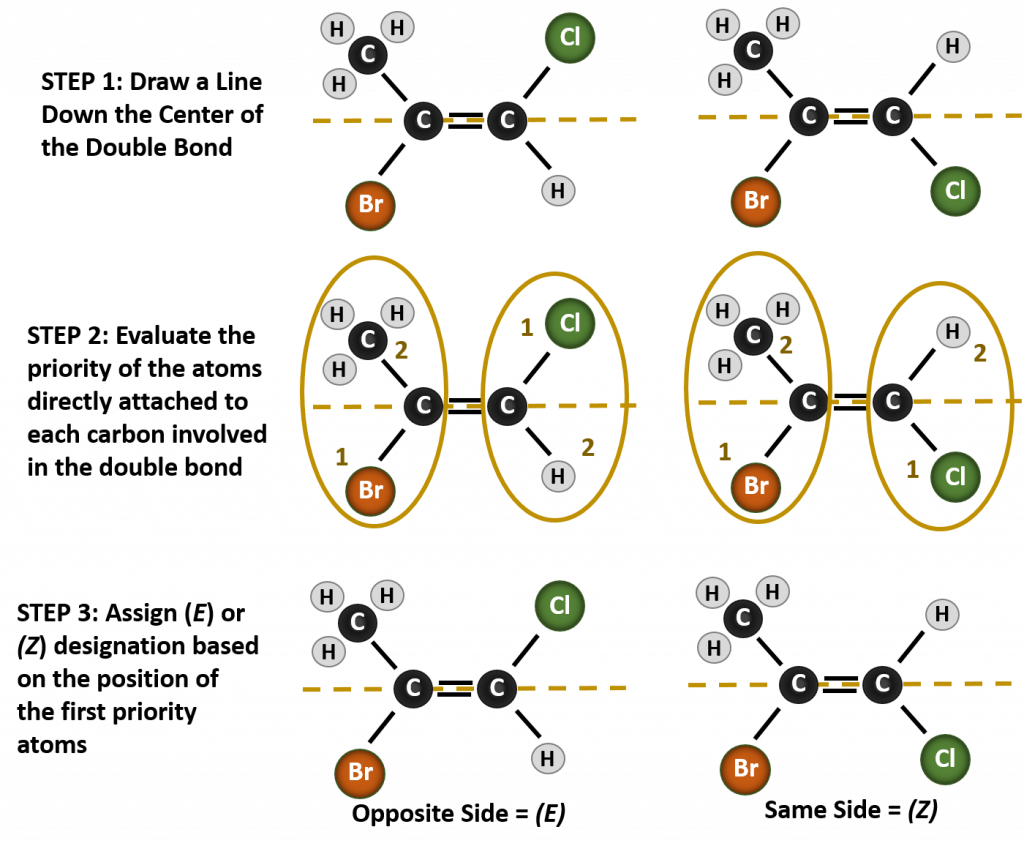
Rysunek 8.14 Kroki stosowane w przypisywaniu konformacji (E) i (Z).
Click Here for a Kahn Academy Video Tutorial on E/Z Isomerization.
(Uwaga: Cała zawartość Khan Academy jest dostępna za darmo przy użyciu licencji CC-BY-NC-SA na www.khanacademy.org )
(Back to the Top)
.