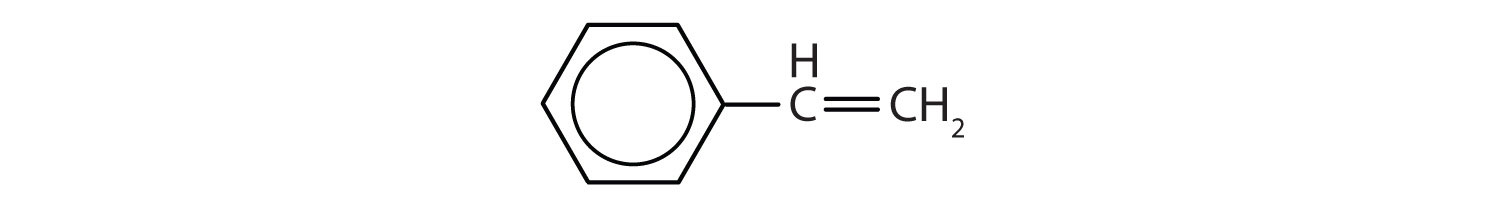
Aromatic hydrocarbons are defined by having 6-membered ring structures with alternating double bonds (Fig 8.2).
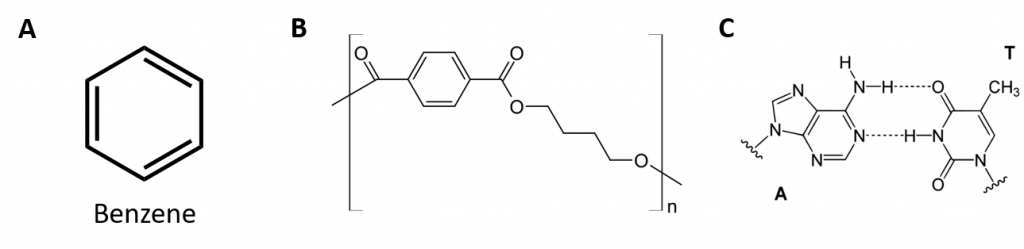
Figura 8.2: Hidrocarbonetos aromáticos. Os hidrocarbonetos aromáticos contêm a estrutura de 6 anéis de benzeno (A) que se caracteriza por ligações duplas alternadas. Ultradur, PBT é um polímero plástico que contém um grupo funcional aromático. O monômero repetitivo de Ultradur é mostrado em (B). Ultradur pode ser encontrado em chuveiros, cerdas de escovas de dentes, caixas plásticas para cabos de fibra óptica, e em componentes exteriores e interiores de automóveis. Moléculas biologicamente importantes, como o ácido desoxirribonucleico, o DNA (C) também contém uma estrutura em forma de anel aromático.
Assim, elas têm fórmulas que podem ser desenhadas como alcenos cíclicos, tornando-as insaturadas. Contudo, devido à estrutura cíclica, as propriedades dos anéis aromáticos são geralmente bastante diferentes, e não se comportam como alcenos típicos. Os compostos aromáticos servem como base para muitos medicamentos, anti-sépticos, explosivos, solventes e plásticos (por exemplo, poliésteres e poliestireno).
Os dois compostos insaturados mais simples – o etileno (etileno) e o acetileno (etino) – já foram usados como anestésicos e foram introduzidos no campo médico em 1924. Entretanto, foi descoberto que o acetileno forma misturas explosivas com o ar, portanto seu uso médico foi abandonado em 1925. Pensava-se que o etileno era mais seguro, mas também estava implicado em numerosos incêndios e explosões letais durante a anestesia. Mesmo assim, permaneceu um anestésico importante nos anos 60, quando foi substituído por anestésicos não inflamáveis como o halotano (CHBrClCF3).
- (Back to the Top)
- 8.1 Alkene e Alkyne Overview
- (Back to the Top)
- 8.2 Propriedades dos alcenos
- Looking Closer: Nota Ambiental
- Exercícios de revisão de conceitos
- Respostas
- Key Takeaway
- Exercícios
- Resposta
- Exercícios de Revisão de Conceito
- Respostas
- Key Takeaway
- 8.3 Alkynes
- Nota
- Exercícios de Revisão de Conceito
- Key Takeaway
- Exercícios
- (Back to the Top)
- 8.4 Compostos Aromáticos: Benzeno
- Nota
- À Sua Saúde: Benzeno e Nós
- Exercícios de Revisão de Conceito
- Recognizing Aromatic Compounds
- Exercício de construção de silos
- Key Takeaway
- (Back to the Top)
- Hidrocarbonetos aromáticos policíclicos
- Para a sua saúde: Hidrocarbonetos aromáticos policíclicos e câncer
- Compostos Biologicamente Importantes com Anéis de Benzeno
- Nota
- 8.5 Isómeros Geométricos
- Click Here for a Kahn Academy Video Tutorial on Alkene Structure.
- Cis-Trans Nomenclature
- Click Here for a Kahn Academy Video Tutorial on Cis/Trans Isomerization
- À sua saúde
- Click Here for a Kahn Academy Video Tutorial on Saturated-, Unsaturated-, and Trans-Fats
- Key Factors for Determining Cis/Trans Isomerization
- Exemplo trabalhado
- Exercício de construção de silos
- Exercícios de Revisão de Conceito
- Respostas
- Key Takeaway
- (Back to the Top)
- Nomenclatura E-Z
- Click Here for a Kahn Academy Video Tutorial on E/Z Isomerization.
- (Back to the Top)
(Back to the Top)
8.1 Alkene e Alkyne Overview
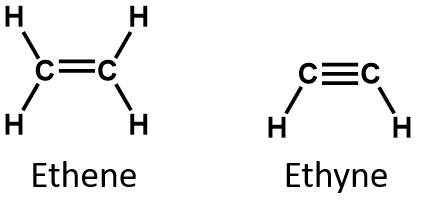
Por definição, alcenos são hidrocarbonetos com uma ou mais ligações duplas carbono-carbono (R2C=CR2), enquanto alcinos são hidrocarbonetos com uma ou mais ligações triplas carbono-carbono (R-C≡C-R). Coletivamente, eles são chamados de hidrocarbonetos insaturados, que são definidos como hidrocarbonetos com uma ou mais ligações múltiplas (duplas ou triplas) entre átomos de carbono. Como resultado da natureza da ligação dupla ou tripla, os alcenos e alcinos têm menos átomos de hidrogénio do que alcanos comparáveis com o mesmo número de átomos de carbono. Matematicamente, isto pode ser indicado pelas seguintes fórmulas gerais:
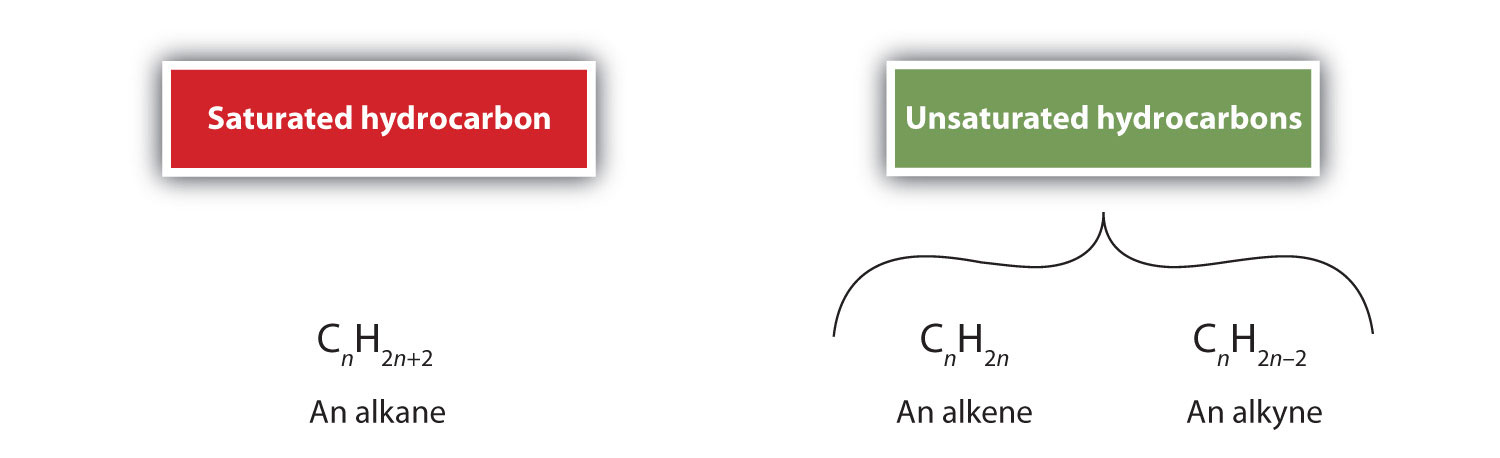
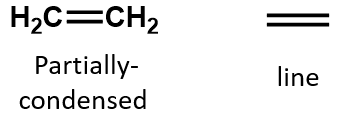
Num alceno, a ligação dupla é partilhada pelos dois átomos de carbono e não envolve os átomos de hidrogénio, embora a fórmula condensada não torne este ponto óbvio, ou seja, a fórmula condensada para o eteno é CH2CH2. A natureza de dupla ou tripla ligação de uma molécula é ainda mais difícil de discernir a partir das fórmulas moleculares. Observe que a fórmula molecular do eteno é C2H4, enquanto a do eteno é C2H2. Assim, até se tornar mais familiar a linguagem da química orgânica, muitas vezes é mais útil traçar linhas ou estruturas parcialmente condensadas, como mostrado abaixo:
(Back to the Top)
8.2 Propriedades dos alcenos
As propriedades físicas dos alcenos são semelhantes às dos alcanos. A tabela 8.1 mostra que os pontos de ebulição dos alcenos de cadeia reta aumentam com o aumento da massa molar, assim como com os alcanos. Para moléculas com o mesmo número de átomos de carbono e a mesma forma geral, os pontos de ebulição geralmente diferem apenas ligeiramente, tal como seria de esperar para substâncias cuja massa molar difere apenas em 2 u (equivalente a dois átomos de hidrogénio). Como outros hidrocarbonetos, os alcenos são insolúveis em água, mas solúveis em solventes orgânicos.
alguns alcenos representativos – seus nomes, estruturas e propriedades físicas – são dados na Tabela 8.1.
Tabela 8.1 Propriedades físicas de alguns alcenos selecionados
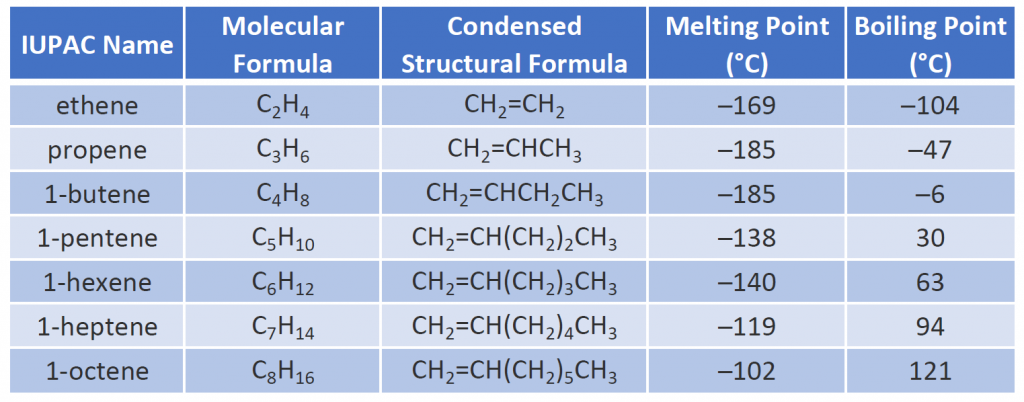
Os dois primeiros alcenos da Tabela 8.1 – etileno e propeno, são mais freqüentemente chamados por seus nomes comuns – etileno e propileno, respectivamente. O etileno é um dos principais produtos químicos comerciais. A indústria química americana produz anualmente cerca de 25 bilhões de quilos de etileno, mais do que qualquer outra substância química orgânica sintética. Mais da metade desse etileno vai para a fabricação de polietileno, um dos plásticos mais conhecidos. O propileno é também um importante produto químico industrial. É convertido em plásticos, álcool isopropílico e uma variedade de outros produtos.
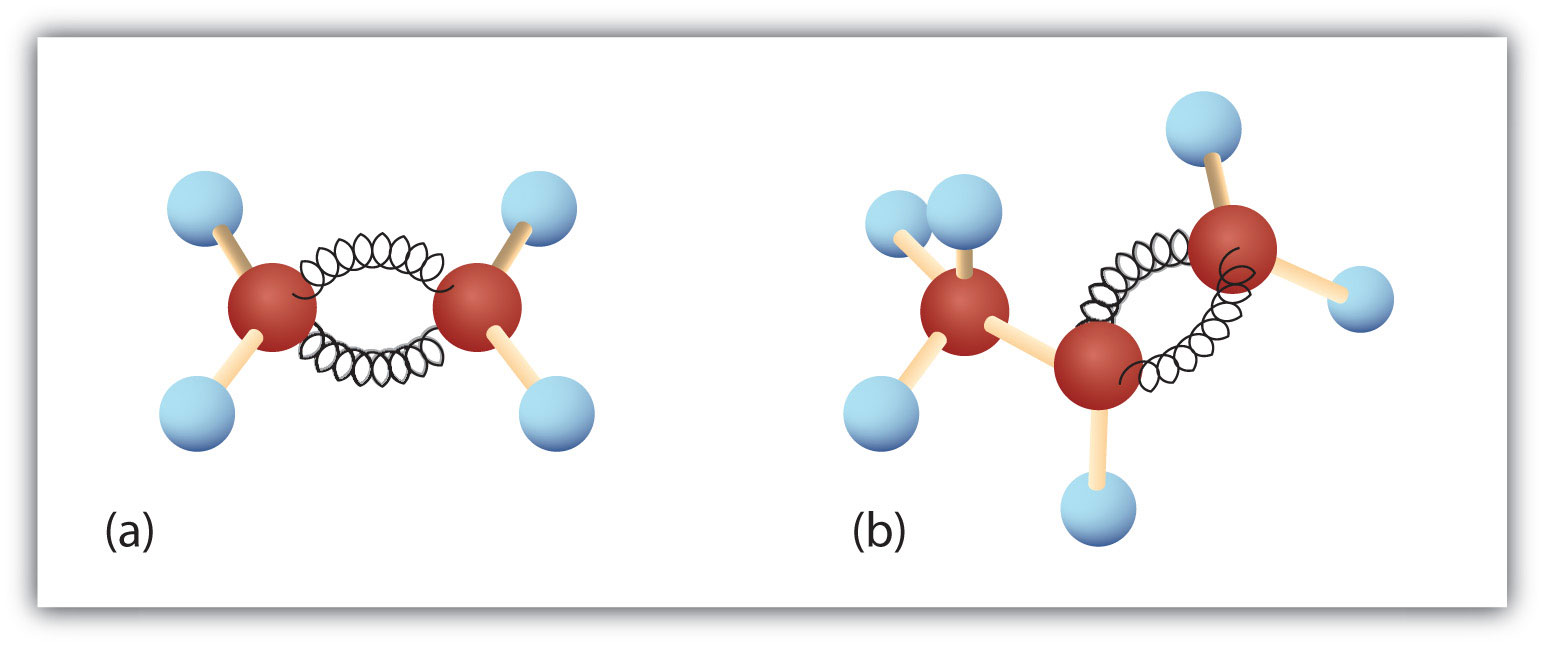
Figure 8.3. Eteno e Propeno. Os modelos ball-and-spring de eteno/etileno (a) e propeno/propileno (b) mostram as suas respectivas formas, especialmente ângulos de ligação.
Looking Closer: Nota Ambiental
Alkenes ocorrem amplamente na natureza. Frutas e vegetais em maturação libertam etileno, o que desencadeia uma maturação posterior. Os processadores de frutos introduzem artificialmente o etileno para acelerar o processo de maturação; a exposição a tão pouco quanto 0,1 mg de etileno por 24 h pode maturar 1 kg de tomates. Infelizmente, este processo não duplica exactamente o processo de maturação, e os tomates colhidos verdes e tratados desta forma não têm muito o mesmo sabor que os tomates amadurecidos na vinha, frescos do jardim.
Outros alcenos que ocorrem na natureza incluem 1-octeno, um constituinte do óleo de limão, e o octadeceno (C18H36) encontrado no fígado do peixe. Dienos (duas ligações duplas) e polienos (três ou mais ligações duplas) também são comuns. O butadieno (CH2=CHCH=CH2) é encontrado no café. O licopeno e os carotenos são polienos isoméricos (C40H56) que dão as atraentes cores vermelha, laranja e amarela às melancias, tomates, cenouras e outras frutas e vegetais. A vitamina A, essencial para uma boa visão, é derivada de um caroteno. O mundo seria um lugar muito menos colorido sem alcenos.

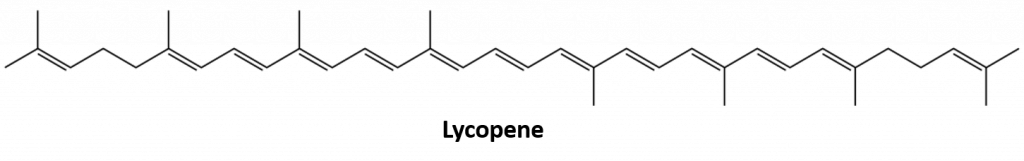
Figure 8.4 A cor vermelha brilhante dos tomates é devida ao licopeno.
Foto de: © Thinkstock; Estrutura do licopeno de: Jeff Dahl
Exercícios de revisão de conceitos
-
Descrever as propriedades físicas dos alcenos. Como se comparam estas propriedades com as dos alcanos?
-
Sem consultar tabelas, disponha os seguintes alcenos por ordem de aumento do ponto de ebulição:

Respostas
-
Alcenos possuem propriedades físicas (pontos de ebulição baixos, insolúveis na água) bastante semelhantes às dos alcanos correspondentes.
-
eteno < propeno < 1-buteno < 1-hexeno
>
Key Takeaway
- As propriedades físicas dos alcenos são muito semelhantes às dos alcanos: os seus pontos de ebulição aumentam com o aumento da massa molar, e são insolúveis em água.
Exercícios
-
Sem referência a uma tabela ou outra referência, prever qual membro de cada par tem o maior ponto de ebulição.
- 1-penteno ou 1-buteno
- 3-hepteno ou 3-noneno
- 1-penteno ou 1-buteno
-
Qual é um bom solvente para ciclohexeno? pentano ou água?
Resposta
-
- 1-penteno
- 3-nonene
Exercícios de Revisão de Conceito
-
Identificar, de forma breve, as distinções importantes entre um hidrocarboneto saturado e um hidrocarboneto insaturado.
-
Identificar de forma breve as distinções importantes entre um alceno e um alcano.
-
Classificar cada composto como saturado ou insaturado. Identificar cada um como um alcano, um alqueno ou um alkyne.
-
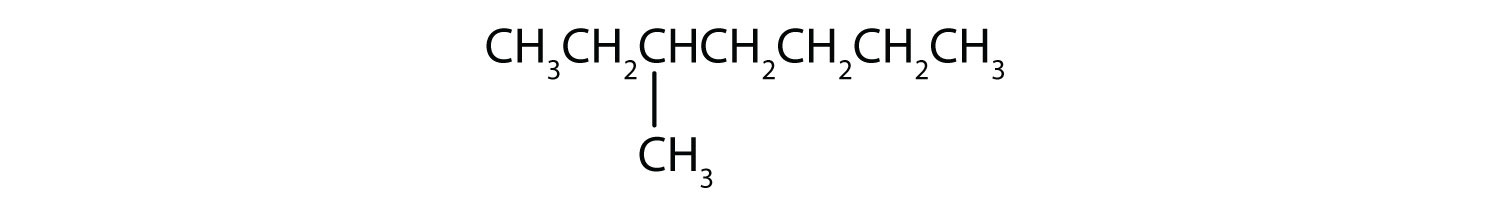
- CH3CH2C≡CCH3
-

-
Respostas
-
Os hidrocarbonetos insaturados têm ligações duplas ou triplas e são bastante reactivos; os hidrocarbonetos saturados têm apenas ligações simples e são bastante não reactivos.
-
Um alceno tem uma ligação dupla; um alcano tem apenas ligações simples.
>
-
- saturado; alcano
- insaturado; alqueno
- insaturado; alceno
Key Takeaway
- Alquenos são hidrocarbonetos com uma ligação dupla de carbono a carbono.
8.3 Alkynes
O alquino mais simples – um hidrocarboneto com tripla ligação carbono-carbono – tem a fórmula molecular C2H2 e é conhecido pelo seu nome comum – acetileno (Fig 8.5). A sua estrutura é H-C≡C-H.
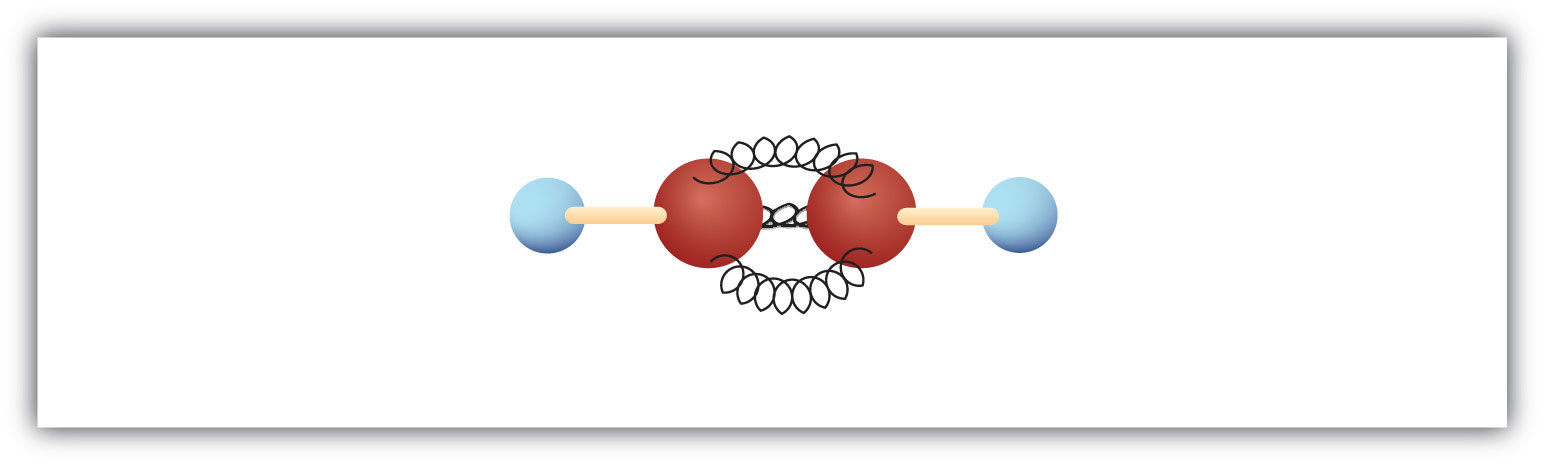
Figure 8.5 Ball-and-Spring Model of Acetylene. O acetileno (etino) é o membro mais simples da família do alquileno.
Nota
Acetileno é usado em maçaricos oxiacetilénicos para corte e soldadura de metais. A chama de uma tocha deste tipo pode ser muito quente. A maioria do acetileno, entretanto, é convertida em intermediários químicos que são usados para fazer plásticos vinílicos e acrílicos, fibras, resinas e uma variedade de outros produtos.
As alcinos são similares aos alcenos tanto em propriedades físicas como químicas. Por exemplo, os alcinos sofrem muitas das típicas reações de adição de alcenos. Os nomes da União Internacional de Química Pura e Aplicada (IUPAC) para alcinos são paralelos aos dos alcenos, exceto que o final de família é -yne em vez de -ene. O nome IUPAC para acetileno é ethyne. Os nomes de outros alcinos são ilustrados nos seguintes exercícios.
Exercícios de Revisão de Conceito
-
Denumerar brevemente as diferenças importantes entre um alceno e um alqueno. Como são semelhantes?
-
O alceno (CH3)2CHCH2CH=CH2 é nomeado 4-metil-1-penteno. Qual é o nome do (CH3)2CHCH2C≡CH?
-
Os alcinos mostram isomerismo cis-trans? Explique.
Respostas
-
Alkynes têm ligações duplas; os alcinos têm ligações triplas. Ambos sofrem reacções de adição.
-
4-metil-1-pentine
-
Não; um átomo de carbono triplamente ligado pode formar apenas uma outra ligação. Ele teria que ter dois grupos ligados para mostrar o isomerismo cis-trans.
Key Takeaway
- Alkynes são hidrocarbonetos com ligações triplas carbono-carbono e propriedades muito semelhantes às dos alcenos.
Exercícios
-
Desenhar a estrutura para cada composto.
- acetileno
- 3-metil-1-hexileno
-
Desenhar a estrutura para cada composto.
- 4-metil-2-hexina
- 3-octilo
-
Nome de cada alquino.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Respostas
-
- H-C≡C-H
-
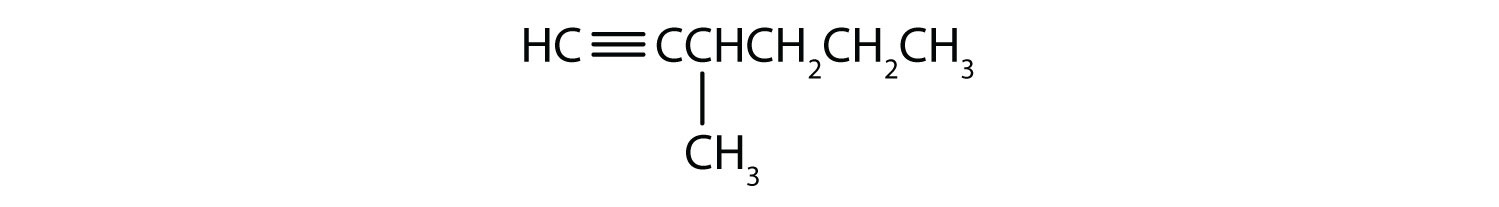
-
- 1-pentyne
- 2-hexyne
(Back to the Top)
8.4 Compostos Aromáticos: Benzeno
Próximo consideramos uma classe de hidrocarbonetos com fórmulas moleculares como as de hidrocarbonetos insaturados, mas que, ao contrário dos alcenos, não sofrem facilmente reacções de adição. Estes compostos compreendem uma classe distinta, chamada hidrocarbonetos aromáticos. O composto aromático mais simples é o benzeno (C6H6) e é de grande importância comercial, mas também tem efeitos prejudiciais à saúde (ver “À Sua Saúde: Benzeno e Nós”).
A fórmula C6H6 parece indicar que o benzeno tem um alto grau de insaturação. (Hexano, o hidrocarboneto saturado com seis átomos de carbono tem a fórmula C6H14 – oito átomos de hidrogénio a mais do que o benzeno). No entanto, apesar do aparentemente baixo nível de saturação, o benzeno é bastante pouco reactivo. Isto deve-se à estrutura de ressonância formada pela estrutura de dupla ligação alternada do anel aromático.

Nota
Benzeno é um líquido que cheira a gasolina, ferve a 80°C, e congela a 5,5°C. É o hidrocarboneto aromático produzido no maior volume. Era usado anteriormente para descafeinar o café e era um componente significativo de muitos produtos de consumo, tais como decapantes, cimentos de borracha e removedores de manchas de limpeza a seco domésticos. Foi removido de muitas formulações de produtos nos anos 50, mas outros continuaram a usar benzeno em produtos até os anos 70, quando foi associado a mortes por leucemia. O benzeno ainda é importante na indústria como um precursor na produção de plásticos (como isopor e nylon), drogas, detergentes, borracha sintética, pesticidas e corantes. Ele é usado como solvente para coisas como limpeza e manutenção de equipamentos de impressão e para adesivos, como os usados para fixar solas em calçados. O benzeno é um constituinte natural dos produtos petrolíferos, mas como é um conhecido carcinógeno, seu uso como aditivo na gasolina é agora limitado.
À Sua Saúde: Benzeno e Nós
A maior parte do benzeno usado comercialmente vem do petróleo. É empregado como matéria-prima para a produção de detergentes, drogas, corantes, inseticidas e plásticos. Uma vez amplamente utilizado como um solvente orgânico, o benzeno é agora conhecido por ter efeitos tóxicos a curto e longo prazo. A inalação de grandes concentrações pode causar náuseas e até morte devido a insuficiência respiratória ou cardíaca, enquanto que a exposição repetida leva a uma doença progressiva na qual a capacidade da medula óssea de produzir novas células sanguíneas é eventualmente destruída. Isso resulta em uma condição chamada anemia aplástica, na qual há uma diminuição do número de glóbulos vermelhos e brancos.
Exercícios de Revisão de Conceito
-
Como as reações típicas do benzeno diferem das dos alcenos?
-
Descreva de forma breve a ligação do benzeno.
-
O que significa o círculo na representação do benzeno por parte do químico?
Respostas
-
Benzeno é bastante pouco reactivo em relação às reacções de adição em comparação com um alceno.
-
Os electrões de valência são partilhados igualmente pelos seis átomos de carbono (ou seja, os electrões são deslocalizados).
-
Os seis elétrons são compartilhados igualmente pelos seis átomos de carbono.
Recognizing Aromatic Compounds
Que compostos são aromáticos?
-
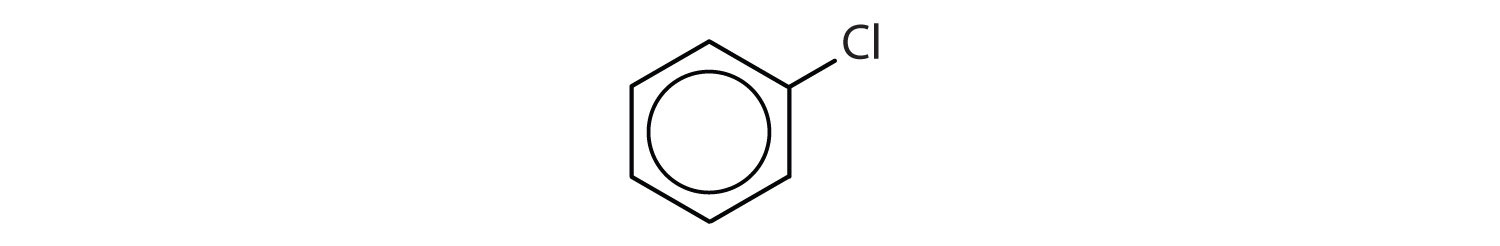
-
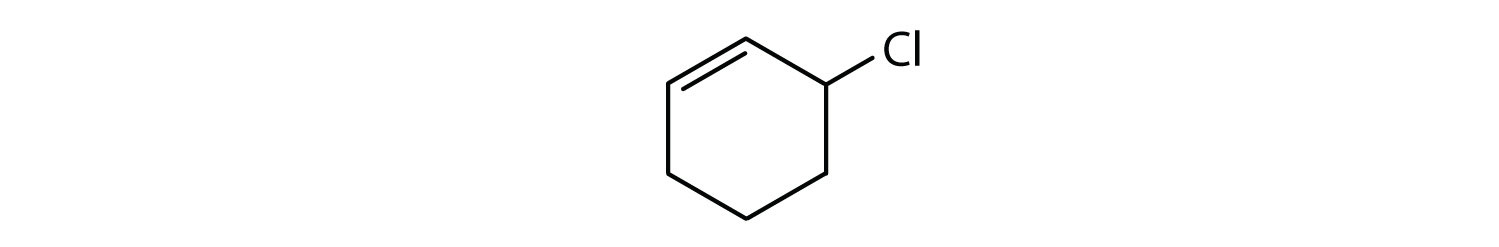
-
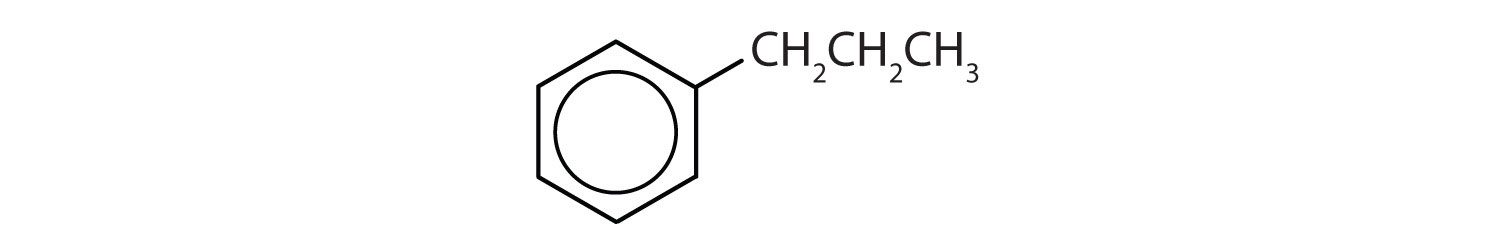
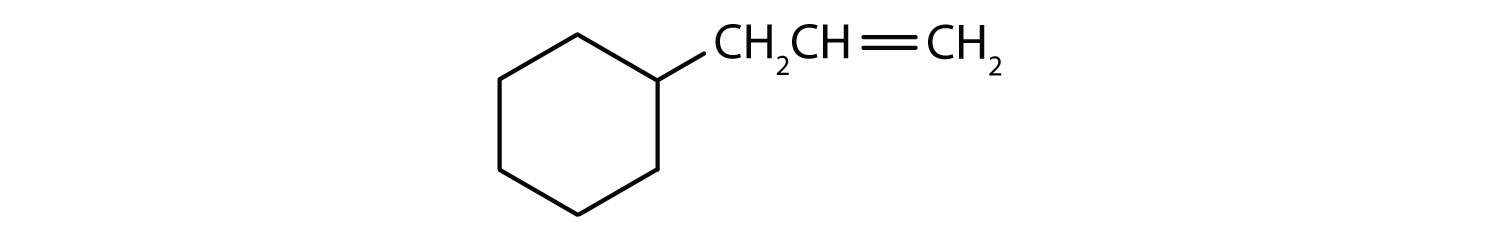
Solução
- O composto tem um anel de benzeno (com um átomo de cloro substituído por um dos átomos de hidrogénio); é aromático.
- O composto é cíclico, mas não tem um anel de benzeno; não é aromático.
- O composto tem um anel de benzeno (com um grupo propilo substituído por um dos átomos de hidrogénio); é aromático.
- O composto é cíclico, mas não tem um anel de benzeno; não é aromático.
Exercício de construção de silos
Que compostos são aromáticos?
No sistema da União Internacional de Química Pura e Aplicada (IUPAC), os hidrocarbonetos aromáticos são nomeados como derivados do benzeno. Cinco exemplos são mostrados abaixo. Nestas estruturas, é irrelevante se o substituto único é escrito na parte superior, lateral ou inferior do anel: um hexágono é simétrico, e portanto todas as posições são equivalentes.
Estes compostos são nomeados da forma usual com o grupo que substitui um átomo de hidrogênio nomeado como um grupo substituto: Cl como cloro, Br como bromo, I como iodo, NO2 como nitro e CH3CH2 como etilo.
Embora alguns compostos sejam referidos exclusivamente pelos nomes da IUPAC, alguns são mais frequentemente denotados por nomes comuns, como é indicado abaixo.
-
Key Takeaway
- Hidrocarbonetos aromáticos parecem estar insaturados, mas têm um tipo especial de ligação e não sofrem reacções de adição.
(Back to the Top)
Hidrocarbonetos aromáticos policíclicos
Alguns hidrocarbonetos aromáticos comuns consistem em anéis de benzeno fundido – anéis que partilham um lado comum. Estes compostos são chamados hidrocarbonetos aromáticos policíclicos (PAHs)Um hidrocarboneto aromático que consiste em anéis de benzeno fundido que partilham um lado comum..
Os três exemplos aqui apresentados são sólidos incolores, cristalinos geralmente obtidos de alcatrão de carvão. O naftaleno tem um odor pungente e é usado em bolas de naftalina. O antraceno é utilizado na fabricação de certos corantes. Os esteróides, incluindo colesterol e os hormônios, estrogênio e testosterona, contêm a estrutura fenantrena.
Para a sua saúde: Hidrocarbonetos aromáticos policíclicos e câncer
O intenso aquecimento necessário para destilar alcatrão de carvão resulta na formação de PAHs. Durante muitos anos, sabe-se que os trabalhadores das refinarias de alcatrão de carvão são susceptíveis a um tipo de cancro da pele conhecido como cancro do alcatrão. Investigações têm mostrado que vários PAHs são carcinogênicos. Um dos compostos cancerígenos mais ativos, o benzopireno, ocorre no alcatrão de carvão e também tem sido isolado da fumaça do cigarro, fumaça da maconha, gases de escape de automóveis e bifes grelhados com carvão. Estima-se que mais de 1.000 toneladas de benzopireno são emitidas para o ar nos Estados Unidos a cada ano. Apenas alguns miligramas de benzopireno por quilograma de peso corporal são necessários para induzir câncer em animais experimentais.
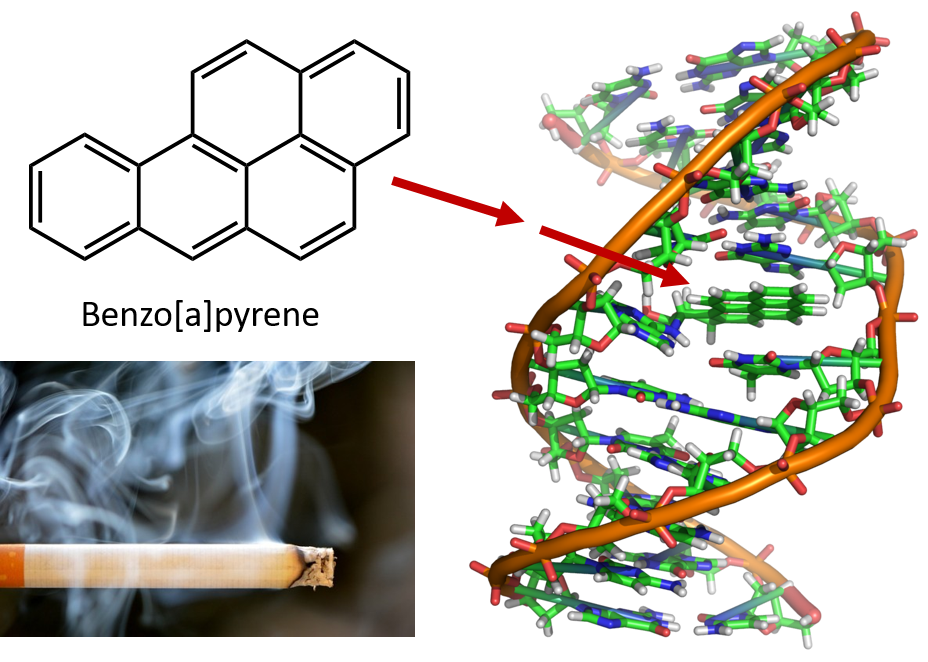
Figure 8.6 O benzopireno é um hidrocarboneto aromático policíclico produzido como subproduto no alcatrão de carvão, cigarro e fumaça de maconha, e em bifes grelhados. O benzopireno é metabolizado para produzir compostos biologicamente ativos que podem formar adutos físicos em moléculas de DNA. Estes aductos podem causar mutações genéticas que causam câncer.
Foto de fumo de cigarro
Compostos Biologicamente Importantes com Anéis de Benzeno
Substâncias contendo o anel de benzeno são comuns tanto em animais como em plantas, embora sejam mais abundantes neste último. As plantas podem sintetizar o anel de benzeno a partir de dióxido de carbono, água e materiais inorgânicos. Os animais não podem sintetizá-lo, mas dependem de certos compostos aromáticos para sobreviver e, portanto, devem obtê-los dos alimentos. Fenilalanina, tirosina, e triptofano (aminoácidos essenciais) e vitaminas K, B2 (riboflavina) e B9 (ácido fólico) contêm o anel de benzeno. Muitos medicamentos importantes, alguns dos quais são mostrados na Tabela 8.2 também contêm um anel de benzeno.
Nota
Até agora estudamos apenas compostos aromáticos com anéis contendo carbono. No entanto, muitos compostos cíclicos têm um elemento que não os átomos de carbono no anel. As estruturas anulares orgânicas que contêm um átomo que não seja carbono são chamadas compostos heterocíclicos, Os compostos aromáticos heterocíclicos também têm propriedades únicas e medicamente relevantes.
Tabela 8.2 Algumas drogas que contêm um anel de benzeno
| Nome | Estrutura |
|---|---|
| aspirin |
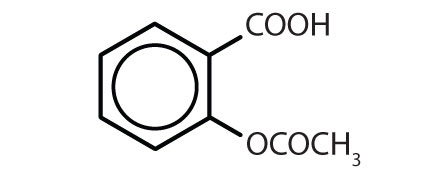 |
| acetaminofen |
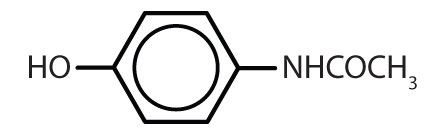 |
| ibuprofeno |
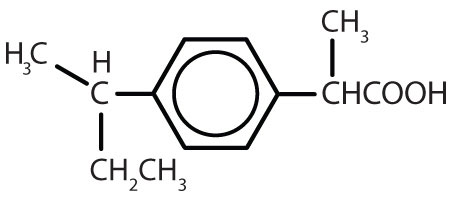 |
| anfetamina |
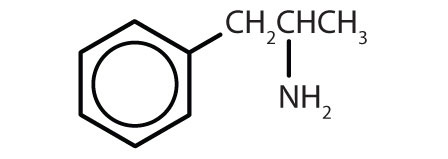 |
| sulfanilamida |
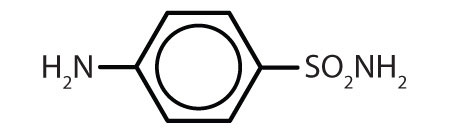 |
8.5 Isómeros Geométricos
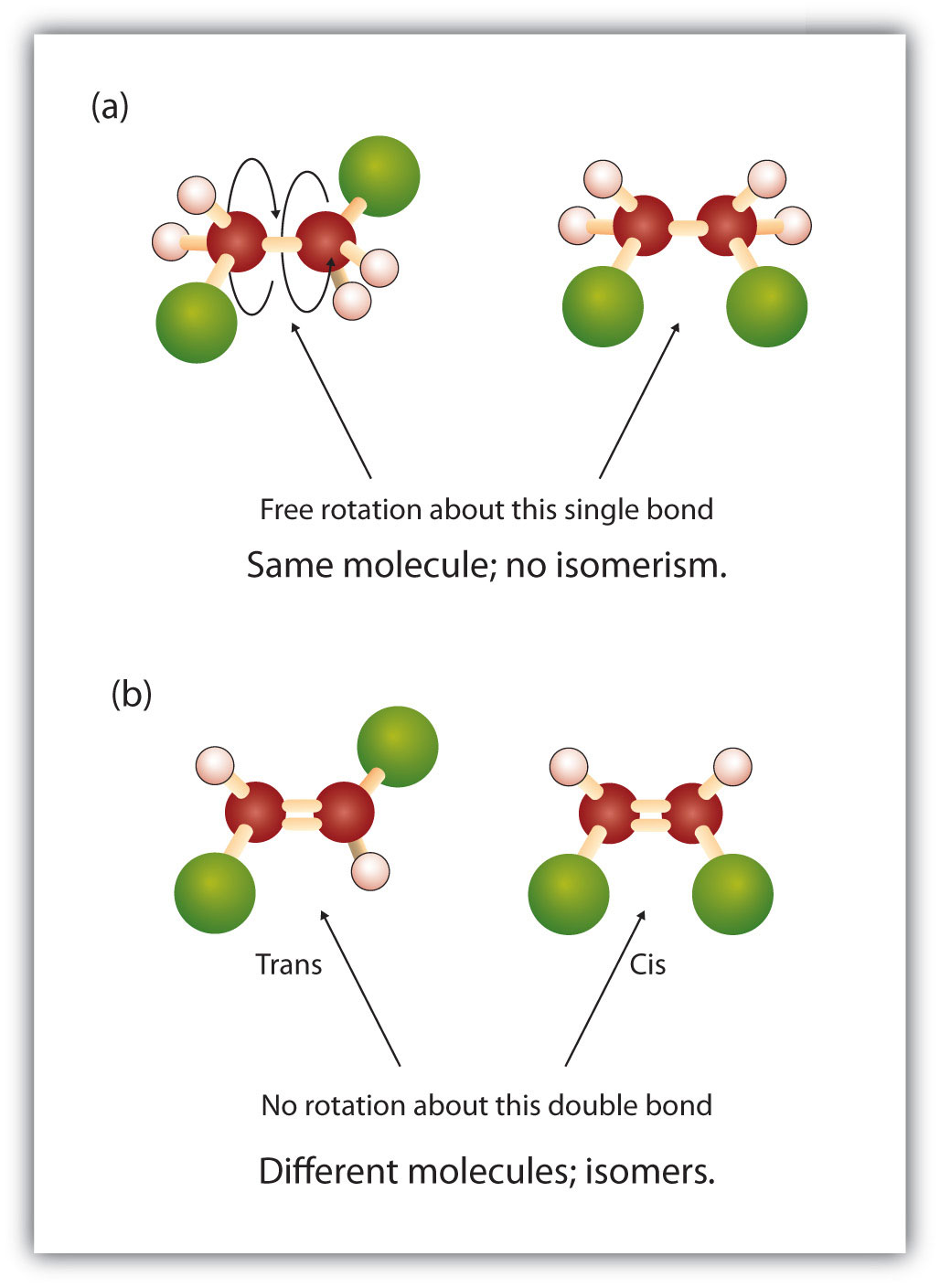
Em estrutura alcalina há rotação livre sobre as ligações simples carbono-carbono (C-C). Em contraste, a estrutura dos alcenos requer que os átomos de carbono formem uma ligação dupla. Ligações duplas entre elementos são criadas usando conchas p-orbitais (também chamadas de orbitais pi). Estas conchas orbitais têm a forma de halteres em vez dos orbitais circulares usados nas ligações simples. Isto impede a rotação livre dos átomos de carbono ao redor da ligação dupla, pois isso causaria a quebra da ligação dupla durante a rotação (Figura 8.7). Assim, uma ligação simples é análoga a duas placas pregadas com um prego. As tábuas são livres de girar ao redor do prego simples. Uma ligação dupla, por outro lado, é análoga a duas tábuas pregadas juntamente com dois pregos. No primeiro caso você pode torcer as tábuas, enquanto no segundo caso você não pode torcê-las.

Figure 8.7 A formação de duplas ligações requer o uso de pi-bonds. Para que as moléculas criem ligações duplas, os elétrons devem compartilhar pi-orbitais sobrepostos entre os dois átomos. Isto requer que os pi-orbitais em forma de haltere (mostrados à esquerda) permaneçam em uma conformação fixa durante a formação da dupla ligação. Isto permite a formação de orbitais de electrões que podem ser partilhados pelos dois átomos (mostrados à direita). A rotação em torno da dupla ligação causaria o desalinhamento das orbitais pi, quebrando a dupla ligação.
Diagrama fornecido por: JoJanderivative work – Vladsinger (talk)
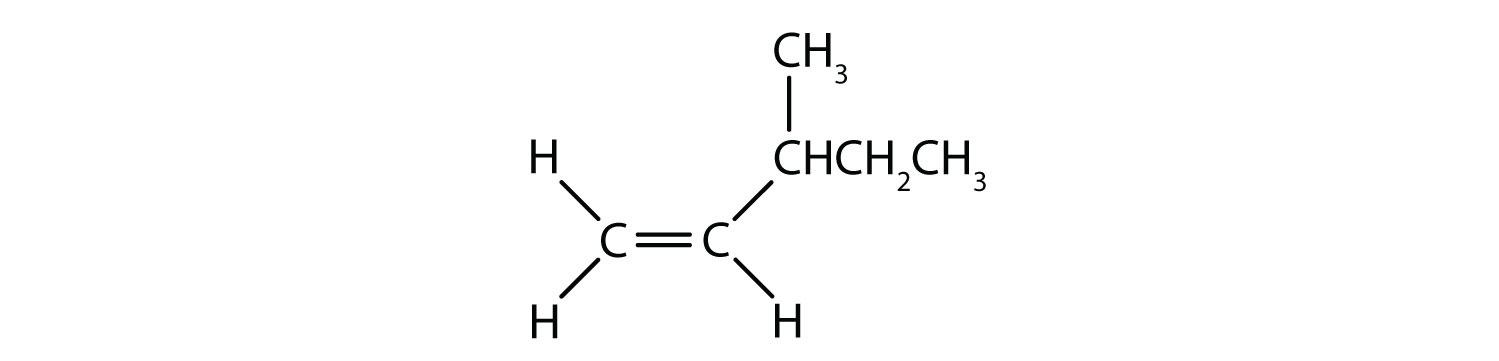
A natureza fixa e rígida da dupla ligação cria a possibilidade de um centro quiral adicional, e assim, o potencial para os estereoisómeros. Formam-se novos estereoisómeros se cada um dos carbonos envolvidos na dupla ligação tiver dois átomos ou grupos diferentes ligados a ele. Por exemplo, veja os dois hidrocarbonetos clorados na Figura 8.8. Na figura superior, é mostrado o alcano halogenado. A rotação em torno desta ligação carbono-carbono é possível e não resulta em diferentes conformações de isómeros. No diagrama inferior, o alceno halogenado tem rotação restrita em torno da dupla ligação. Note também que cada carbono envolvido na dupla ligação também está ligado a dois átomos diferentes (um de hidrogênio e um de cloro). Assim, estas moléculas podem formar dois estereoisómeros: um que tem os dois átomos de cloro no mesmo lado da dupla ligação, e outro onde os cloros residem em lados opostos da dupla ligação.
Figure 8.8 As Duplas Ligações Alkene Podem Formar Isómeros Geométricos. (a) Mostra a rotação livre em torno de uma ligação simples de carbono-carbono na estrutura do alkane. (b) Mostra a posição fixa da dupla ligação carbono-carbono que leva aos isômeros geométricos (espaciais).
Click Here for a Kahn Academy Video Tutorial on Alkene Structure.
Para esta seção, não estamos preocupados com a nomenclatura que também está incluída neste tutorial em vídeo.(Nota: Todo o conteúdo da Academia Khan está disponível gratuitamente usando o licenciamento CC-BY-NC-SA em www.khanacademy.org )
Cis-Trans Nomenclature
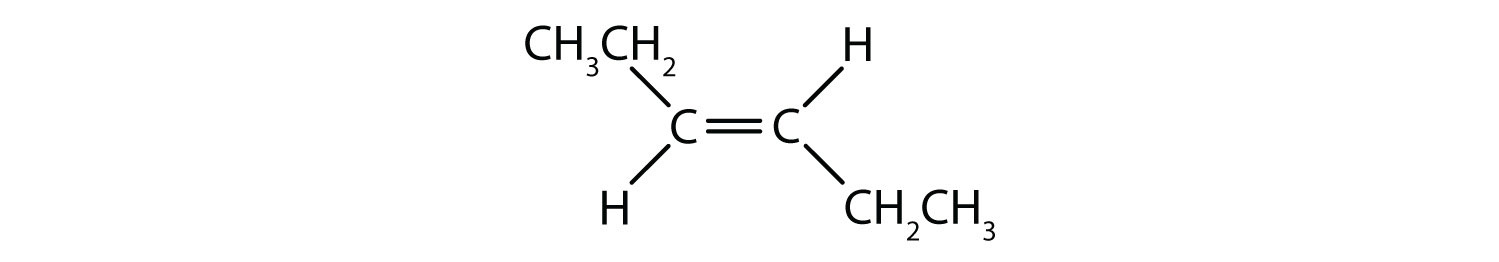
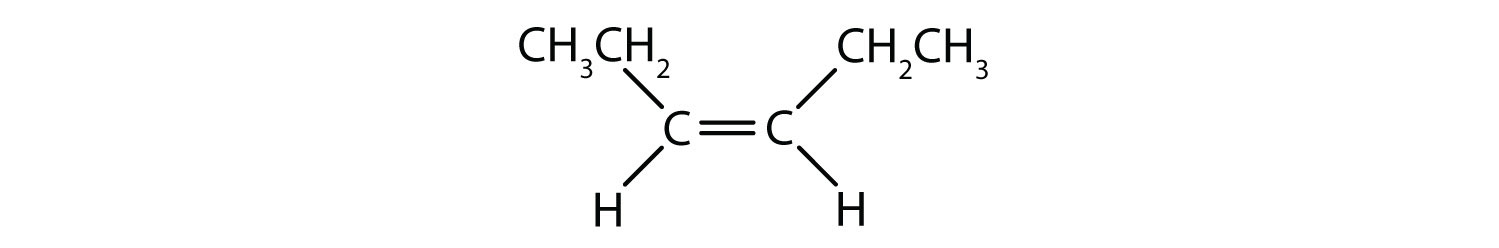
O sistema de nomenclatura cis-trans pode ser usado para distinguir isómeros simples, onde cada carbono da ligação dupla tem um conjunto de grupos idênticos ligados a ele. Por exemplo, na Figura 8.8b, cada carbono envolvido na dupla ligação, tem um cloro ligado a ele, e também tem hidrogênio ligado a ele. O sistema cis e trans, identifica se grupos idênticos estão no mesmo lado (cis) da ligação dupla ou se estão no lado oposto (trans) da ligação dupla. Por exemplo, se os átomos de hidrogênio estão do lado oposto da ligação dupla, diz-se que a ligação está na conformação trans. Quando os grupos de hidrogênio estão no mesmo lado da ligação dupla, diz-se que a ligação está na conformação cis. Note que você também poderia dizer que se ambos os grupos de cloro estão no lado oposto da ligação dupla, que a molécula está na conformação trans ou se eles estão no mesmo lado da ligação dupla, que a molécula está na conformação cis.
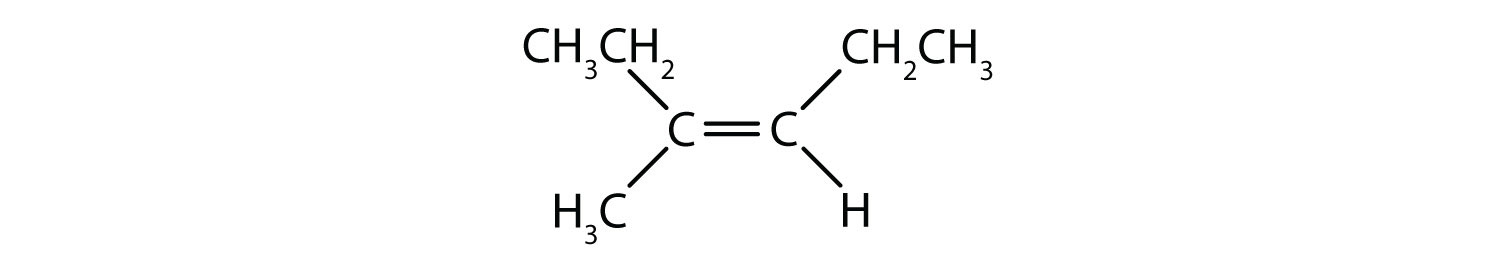
Para determinar se uma molécula é cis ou trans, é útil traçar uma linha tracejada no centro da ligação dupla e depois fazer um círculo em torno dos grupos idênticos, como mostrado na figura 8.9. Ambas as moléculas mostradas na Figura 8.9, são chamadas de 1,2-dicloroeteno. Assim, a designação cis e trans, apenas define a estereoquímica em torno da dupla ligação, não altera a identidade geral da molécula. No entanto, os isómeros cis e trans têm frequentemente propriedades físicas e químicas diferentes, devido à natureza fixa das ligações no espaço.
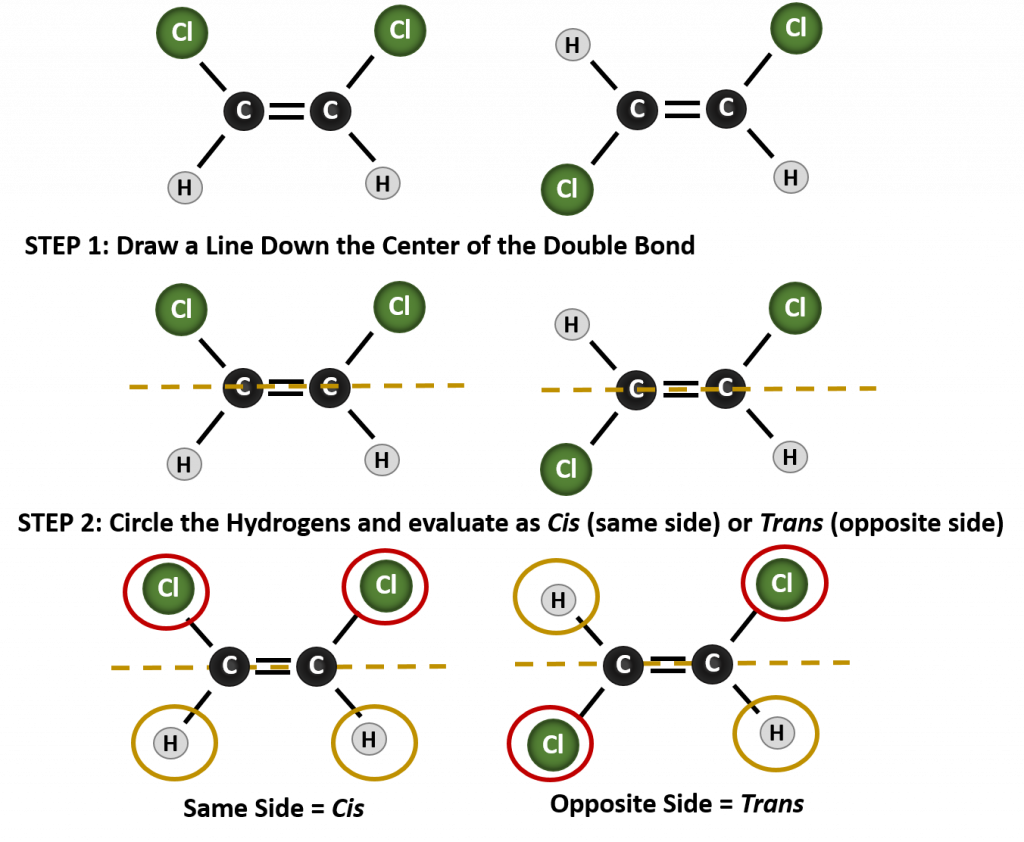
Figure 8.9 A Guide for Determining Cis or Trans Conformations.
Click Here for a Kahn Academy Video Tutorial on Cis/Trans Isomerization
(Nota: Todo o conteúdo da Academia Khan está disponível gratuitamente usando o licenciamento CC-BY-NC-SA em www.khanacademy.org )
Cis-trans isomerism also occurs in cyclic compounds. Em estruturas em anel, os grupos são incapazes de girar sobre qualquer uma das ligações anelares de carbono carbono. Portanto, os grupos podem estar no mesmo lado do anel (cis) ou em lados opostos do anel (trans). Para nossos propósitos aqui, representamos todos os cicloalcanos como estruturas planas, e indicamos as posições dos grupos, seja acima ou abaixo do plano do anel.

À sua saúde
Possivelmente o lugar mais comum que você vai ouvir referência às conformações cis-trans na vida cotidiana é no supermercado ou no consultório do seu médico. Está relacionado com o nosso consumo de gorduras dietéticas. O consumo inapropriado ou excessivo de gorduras dietéticas tem sido ligado a muitos distúrbios de saúde, como diabetes e aterosclerose, e doenças coronárias. Então quais são as diferenças entre gorduras saturadas e insaturadas e o que são gorduras trans e porque são tão preocupantes para a saúde?

Figure 8.10 Common Sources of Dietary Fats.
Photo from: TyMaHe
A forma mais comum de gorduras dietéticas e o principal constituinte da gordura corporal em humanos e outros animais são os triglicéridos (TAGs). Os TAGs, como mostrado na figura 8.10, são construídos a partir de uma molécula de glicerol e três moléculas de ácidos gordos que estão ligadas entre si por uma ligação éster. Nesta secção, vamos focar a estrutura dos caudas longas de ácidos gordos, que podem ser compostos por estruturas alcanas ou alcenos. O capítulo 10 focará mais na formação das ligações ésteres.

Figure 8.11. Exemplo de uma estrutura de triglicéridos (TAG). Note que cada triglicérido tem três ácidos gordos de cadeia longa que se estendem da espinha dorsal do glicerol. Cada ácido graxo pode ter diferentes graus de saturação e insaturação.
Estrutura adaptada de: Wolfgang Schaefer
As gorduras que estão completamente saturadas só terão ácidos gordos com caudas de cadeia longa de alcanos. Diz-se que estão ‘saturados’ com átomos de hidrogénio. As gorduras saturadas são comuns na dieta americana e são encontradas em carne vermelha, produtos lácteos como leite, queijo e manteiga, óleo de coco, e são encontradas em muitos produtos cozidos. As gorduras saturadas são tipicamente sólidas à temperatura ambiente. Isto porque os alcanos de cadeia longa podem se empilhar juntos tendo mais forças de dispersão intermoleculares de Londres. Isto dá às gorduras saturadas pontos de fusão e de ebulição mais altos do que as gorduras insaturadas encontradas em muitos óleos vegetais.
A maior parte das gorduras insaturadas encontradas na natureza estão na cis-conformação, como mostrado na Figura 8.11. Observe que os ácidos graxos mostrados na Figura 8.11 são desenhados por conveniência, para que sejam fáceis de serem vistos e não ocupem muito espaço no papel, mas os ângulos de ligação escritos não retratam adequadamente a verdadeira orientação espacial das moléculas. Quando os ácidos gordos do TAG mostrado na Figura 8.11 são desenhados com ângulos de ligação correctos, é fácil ver que as ligações cis-double causam dobras na cadeia alkene (Fig. 8.12).
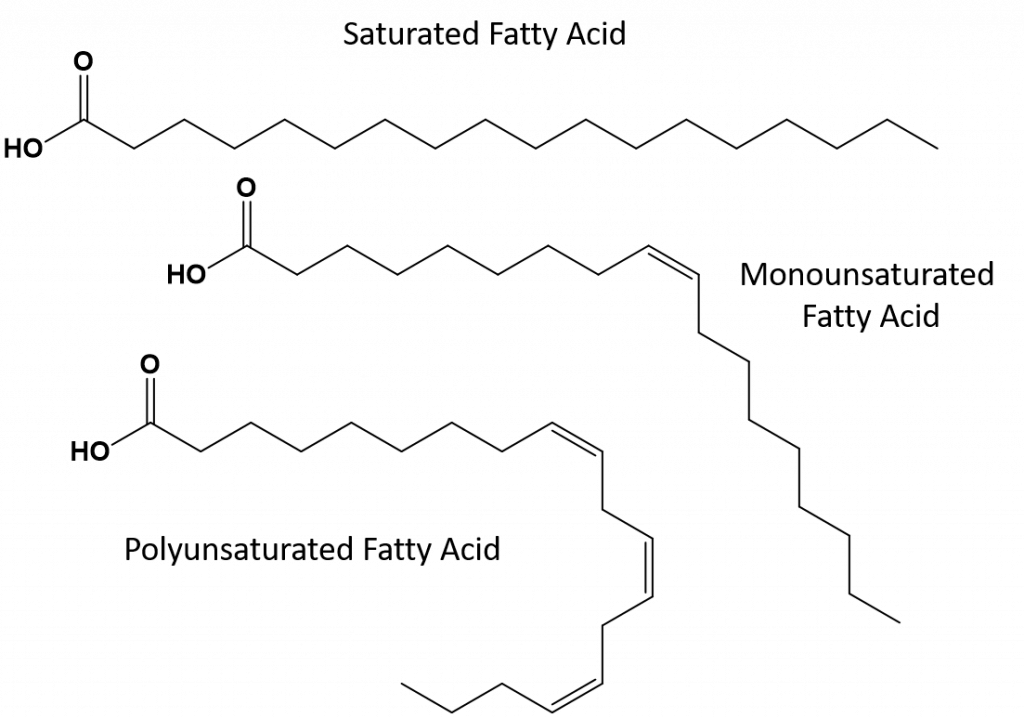
Figure 8.12 Cis-Double Bonds Cause Bends in Fatty Acid Structure
Thus, monounsaturated and polyunsaturated fats cannot stack together as easily and do not have not as many intermolecular attractive forces when compared with saturated fats. Como resultado, elas têm pontos de fusão e de ebulição mais baixos e tendem a ser líquidas à temperatura ambiente. Foi demonstrado que a redução ou substituição das gorduras saturadas por gorduras mono e polinsaturadas na dieta, ajuda a reduzir os níveis da forma de baixa densidade-lipoproteína (LDL) de colesterol, que é um fator de risco para doenças coronárias.
Gorduras trans, por outro lado, contêm ligações duplas que estão na conformação trans. Assim, a forma dos ácidos graxos é linear, semelhante à das gorduras saturadas. As gorduras trans também têm pontos de fusão e ebulição semelhantes quando comparadas com as gorduras saturadas. No entanto, ao contrário das gorduras saturadas, as gorduras trans não são normalmente encontradas na natureza e têm impactos negativos na saúde. As gorduras trans ocorrem principalmente como subproduto no processamento de alimentos (principalmente no processo de hidrogenação para criar margarinas e encurtar) ou durante o cozimento, especialmente na fritura de gorduras profundas. De fato, muitos estabelecimentos de fast food utilizam gorduras trans em seu processo de fritura de gordura profunda, pois as gorduras trans podem ser usadas muitas vezes antes de precisarem ser substituídas. O consumo de gorduras trans eleva os níveis de colesterol LDL no organismo (o mau colesterol que está associado a doenças coronárias) e tende a baixar o colesterol HDL (o bom colesterol dentro do organismo). O consumo de gordura trans aumenta o risco de doenças cardíacas e acidentes vasculares cerebrais, e de desenvolvimento de diabetes tipo II. O risco tem sido tão altamente correlacionado que muitos países proibiram o uso de gorduras trans, incluindo Noruega, Suécia, Áustria e Suíça. Nos Estados Unidos, a Food and Drug Administration (FDA) aprovou recentemente uma medida para eliminar gradualmente o uso de gorduras trans nos alimentos até 2018. Esta medida é estimada para prevenir 20.000 ataques cardíacos e 7.000 mortes por ano.
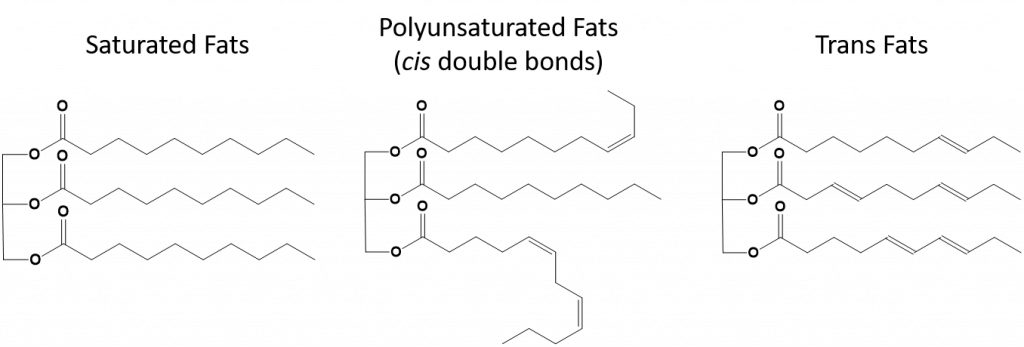
Figure 8.13 Diferenças estruturais em gorduras saturadas, polinsaturadas e gorduras trans.
Click Here for a Kahn Academy Video Tutorial on Saturated-, Unsaturated-, and Trans-Fats
(Nota: Todo o conteúdo da Academia Khan está disponível gratuitamente usando o licenciamento CC-BY-NC-SA em www.khanacademy.org )
Key Factors for Determining Cis/Trans Isomerization
- O composto precisa conter uma ligação dupla ou tripla, ou ter uma estrutura de anel que não permita uma rotação livre em torno da ligação carbono-carbono.
- O composto precisa ter dois grupos não idênticos ligados a cada carbono envolvido na ligação carbono-carbono dupla ou tripla.
Exemplo trabalhado
Que compostos podem existir como isómeros cis-trans (geométricos)? Desenhe-os.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CH2CH3
- CH3CH=CH2CH3
Solução
Todas as quatro estruturas têm uma ligação dupla e assim cumprem a regra 1 para o isomerismo cis-trans.
-
Este composto cumpre a regra 2; tem dois grupos não idênticos em cada átomo de carbono (H e Cl em um e H e Br no outro). Existe como isómeros cis e trans:

- Este composto tem dois átomos de hidrogénio num dos seus átomos de carbono duplamente ligados; falha a regra 2 e não existe como isómeros cis e trans.

- Este composto tem dois grupos metilo (CH3) num dos seus átomos de carbono duplamente ligados. Ele falha a regra 2 e não existe como isômeros cis e trans.

-
Este composto cumpre a regra 2; tem dois grupos não idênticos em cada átomo de carbono e existe como isómeros cis e trans:

Exercício de construção de silos
-
Que compostos podem existir como isómeros cis-trans? Desenha-os.
- CH2=CH2CH2CH2CH3
- CH3CH=CHCH2CH3
- CH3CH2CH=CH2CH3
-
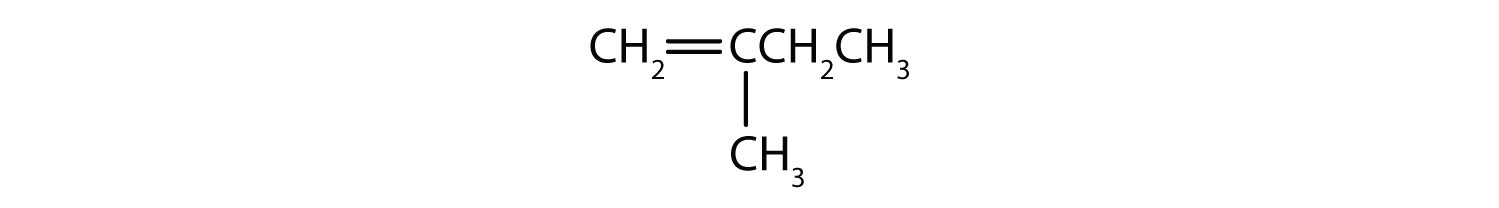
-
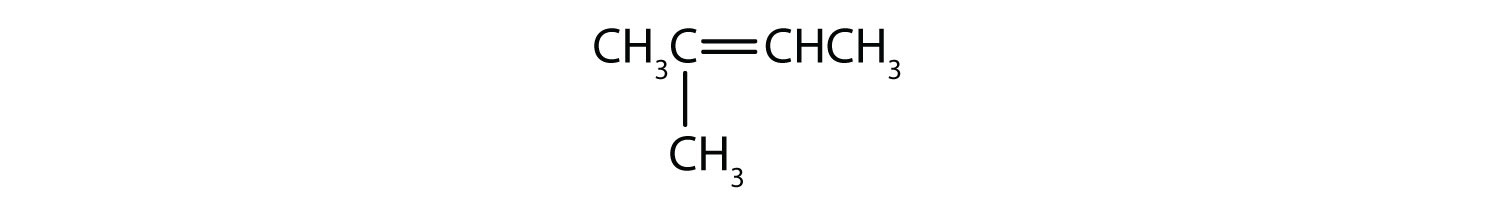
>
Exercícios de Revisão de Conceito
-
O que são cis-isómeros trans (geométricos)? Que dois tipos de compostos podem exibir isomerismo cis-trans?
-
Classificar cada composto como um isomer cis, um isomer trans, ou nenhum deles.
-
Respostas
-
Cis-Os isómeros trans são compostos que têm configurações diferentes (grupos permanentemente em locais diferentes no espaço) devido à presença de uma estrutura rígida na sua molécula. Alkenes e compostos cíclicos podem apresentar isomerismo cis-trans.
-
- trans
- cis
- cis
- aqui
Key Takeaway
- Cis-O isomerismo trans (geométrico) existe quando há rotação restrita em uma molécula e há dois grupos diferentes em cada átomo de carbono envolvido na ligação química.
(Back to the Top)
Nomenclatura E-Z
A situação torna-se mais complexa quando existem 4 grupos diferentes ligados aos átomos de carbono envolvidos na formação da dupla ligação. O sistema de nomenclatura cis-trans não pode ser usado neste caso, pois não há referência a quais grupos estão sendo descritos pela nomenclatura. Por exemplo, na molécula abaixo, pode-se dizer que o cloro é trans para o grupo do bromo, ou pode-se dizer que o cloro é cis para o grupo do metilo (CH3). Assim, escrever simplesmente cis ou trans neste caso não delimita claramente a orientação espacial dos grupos em relação à dupla ligação.
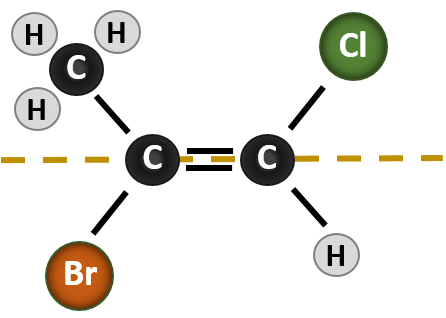
Nomear os diferentes estereoisómeros formados nesta situação, requer o conhecimento das regras de prioridade. Lembrando do capítulo 5 que no sistema de prioridade Cahn-Ingold-Prelog (CIP), os grupos que estão ligados ao carbono quiral recebem prioridade com base no seu número atómico (Z). Átomos com número atômico maior (mais prótons) recebem prioridade maior (isto é, S > P > O > N > C > H). Para este sistema de nomenclatura são usadas as designações de (Z) e (E) em vez do sistema cis/trans. (E) vem da palavra alemã entgegen, ou oposta. Assim, quando os grupos de maior prioridade estão no lado oposto da dupla ligação, diz-se que a ligação está na conformação (E). (Z), por outro lado, vem da palavra alemã zusammen, ou juntos. Assim, quando os grupos de prioridade mais alta estão do mesmo lado da ligação dupla, diz-se que a ligação está na conformação (Z). A Figura 8.14 mostra os passos usados na atribuição das conformações (E) ou (Z) de uma molécula.
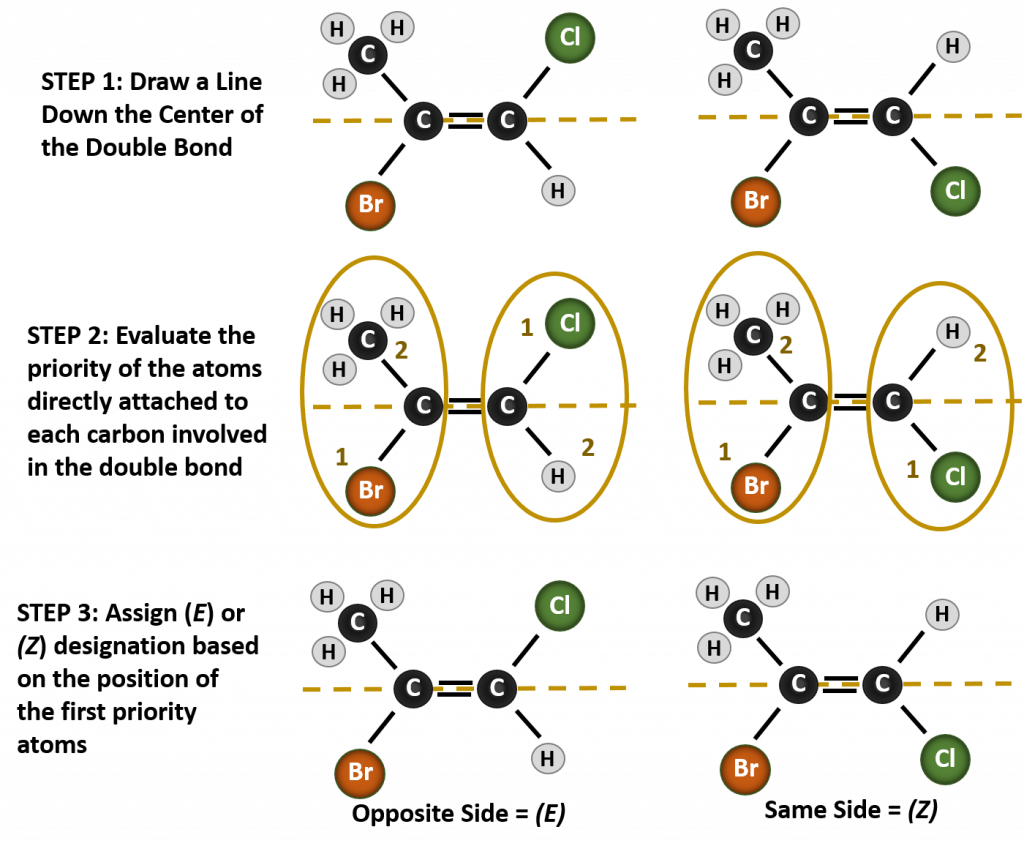
Figure 8.14 Passos usados para atribuir as conformações (E) e (Z).
Click Here for a Kahn Academy Video Tutorial on E/Z Isomerization.
(Nota: Todo o conteúdo da Academia Khan está disponível gratuitamente usando o licenciamento CC-BY-NC-SA em www.khanacademy.org )