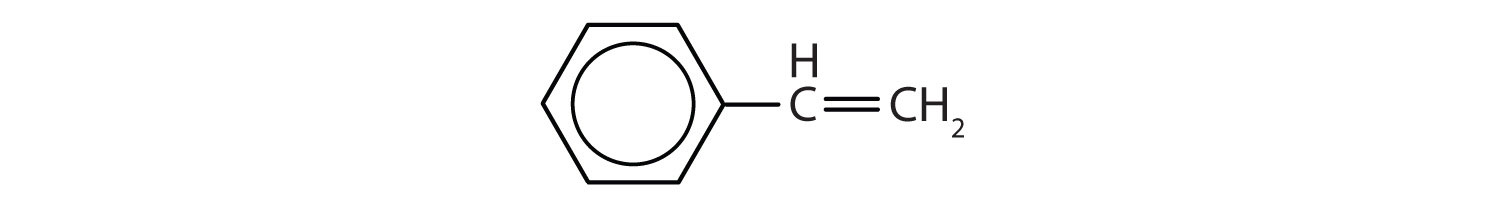
Hidrocarburile aromatice se definesc prin faptul că au structuri inelare cu 6 membri, cu legături duble alternante (fig. 8.2).
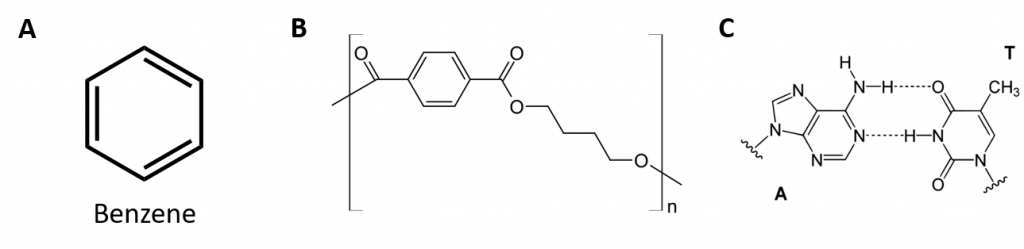
Figura 8.2: Hidrocarburi aromatice. Hidrocarburile aromatice conțin structura inelară benzenică cu 6 membri (A) care se caracterizează prin legături duble alternante. Ultradur, PBT este un polimer plastic care conține o grupare funcțională aromatică. Monomerul repetitiv al Ultradur este prezentat în (B). Ultradur poate fi găsit în căștile de duș, perii periuțelor de dinți, în carcasele de plastic pentru cabluri de fibră optică și în componentele exterioare și interioare ale automobilelor. Moleculele importante din punct de vedere biologic, cum ar fi acidul dezoxiribonucleic, ADN (C), conțin, de asemenea, structuri inelare aromatice.
Așa, ele au formule care pot fi desenate ca alchene ciclice, ceea ce le face nesaturate. Cu toate acestea, din cauza structurii ciclice, proprietățile inelelor aromatice sunt, în general, destul de diferite și nu se comportă ca niște alchene tipice. Compușii aromatici servesc ca bază pentru multe medicamente, antiseptice, explozivi, solvenți și materiale plastice (de exemplu, poliesteri și polistiren).
Cei mai simpli doi compuși nesaturați – etilena (etena) și acetilena (etena) – au fost folosiți cândva ca anestezice și au fost introduși în domeniul medical în 1924. Cu toate acestea, s-a descoperit că acetilena formează amestecuri explozive cu aerul, astfel încât utilizarea sa medicală a fost abandonată în 1925. Etilena a fost considerată mai sigură, dar și ea a fost implicată în numeroase incendii și explozii letale în timpul anesteziei. Chiar și așa, a rămas un anestezic important până în anii 1960, când a fost înlocuit de anestezicele neinflamabile, cum ar fi halotanul (CHBrClCF3).
- (Back to the Top)
- 8.1 Prezentare generală a alchenelor și alchenelor
- (Back to the Top)
- 8.2 Proprietățile alchenelor
- Cu o privire mai atentă: Notă de mediu
- Exerciții de recapitulare a noțiunilor
- Răspunsuri
- Ceea mai importantă concluzie
- Exerciții
- Răspuns
- Exerciții de recapitulare a noțiunilor
- Răspunsuri
- Ceea ce trebuie reținut
- 8.3 Alchene
- Nota
- Exerciții de recapitulare a noțiunilor
- Key Takeaway
- Exerciții
- (Back to the Top)
- 8.4 Compuși aromatici: Benzenul
- Nota
- Pentru sănătatea dumneavoastră: Benzenul și noi
- Exerciții de recapitulare a noțiunilor
- Recunoașterea compușilor aromatici
- Exercițiu de dezvoltare a abilităților
- Ceea ce trebuie reținut
- (Back to the Top)
- Hidrocarburi aromatice policiclice
- În sănătatea dumneavoastră: Hidrocarburile aromatice policiclice și cancerul
- Compuși importanți din punct de vedere biologic cu inele benzenice
- Nota
- 8.5 Izomeri geometrici
- Click aici pentru un tutorial video al Academiei Kahn despre structura alchenelor.
- Nomenclatura cis-trans
- Click aici pentru un tutorial video al Academiei Kahn despre izomerizarea Cis/Trans
- Sănătate
- Click aici pentru un tutorial video al Academiei Kahn despre grăsimile saturate, nesaturate și trans
- Factori cheie pentru determinarea izomerizării Cis/Trans
- Exemplu de lucru
- Exercițiu de dezvoltare a abilităților
- Exerciții de revizuire a conceptelor
- Răspunsuri
- Key Takeaway
- (Back to the Top)
- Nomenclatura E-Z
- Click aici pentru un tutorial video al Academiei Kahn despre izomerizarea E/Z.
- (Înapoi sus)
(Back to the Top)
8.1 Prezentare generală a alchenelor și alchenelor
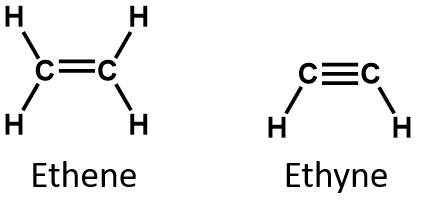
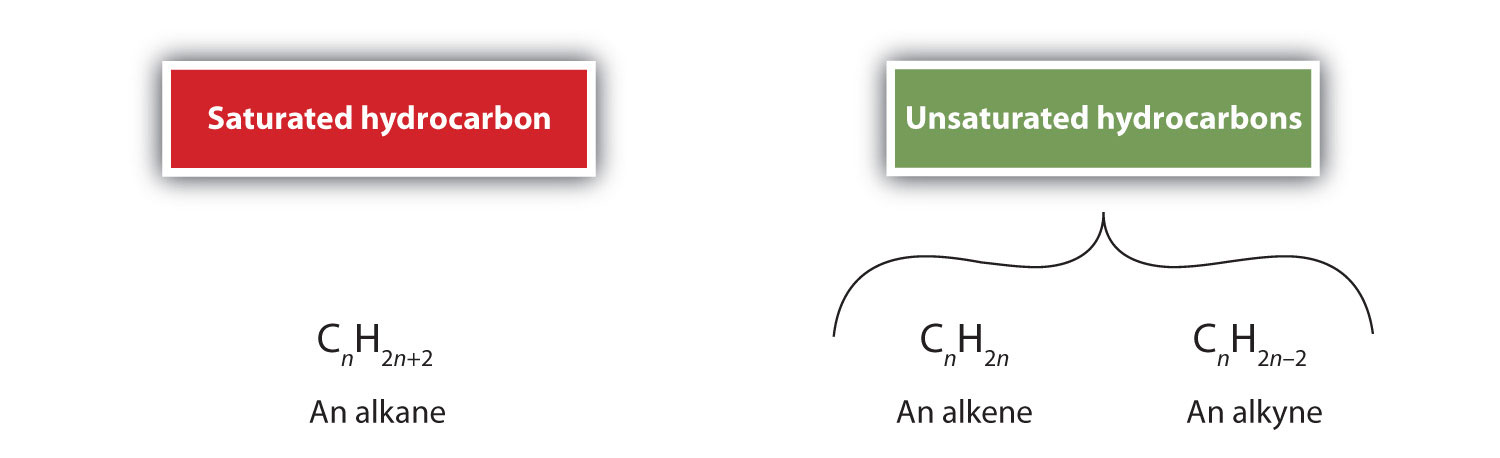
Prin definiție, alchenele sunt hidrocarburi cu una sau mai multe legături duble carbon-carbon (R2C=CR2), în timp ce alchenele sunt hidrocarburi cu una sau mai multe legături triple carbon-carbon (R-C≡C-R). Colectiv, acestea se numesc hidrocarburi nesaturate, care sunt definite ca fiind hidrocarburi care au una sau mai multe legături multiple (duble sau triple) între atomii de carbon. Ca urmare a naturii duble sau triplei legături, alchenele și alchinele au mai puțini atomi de hidrogen decât alcani comparabili cu același număr de atomi de carbon. Din punct de vedere matematic, acest lucru poate fi indicat prin următoarele formule generale:
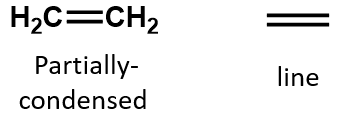
Într-o alchenă, legătura dublă este împărțită de cei doi atomi de carbon și nu implică atomii de hidrogen, deși formula condensată nu face acest lucru evident, adică formula condensată pentru etenă este CH2CH2. Natura legăturii duble sau triple a unei molecule este și mai greu de distins din formulele moleculare. Rețineți că formula moleculară a etenei este C2H4, în timp ce cea a etenei este C2H2. Astfel, până când vă veți familiariza mai bine cu limbajul chimiei organice, este adesea cel mai util să desenați structuri lineare sau parțial condensate, așa cum se arată mai jos:
(Back to the Top)
8.2 Proprietățile alchenelor
Proprietățile fizice ale alchenelor sunt similare cu cele ale alcanilor. Tabelul 8.1 arată că punctele de fierbere ale alchenelor cu catenă dreaptă cresc odată cu creșterea masei molare, la fel ca în cazul alcanilor. Pentru moleculele cu același număr de atomi de carbon și aceeași formă generală, punctele de fierbere diferă, de obicei, doar puțin, așa cum ne-am aștepta pentru substanțe a căror masă molară diferă doar cu 2 u (echivalentul a doi atomi de hidrogen). Ca și alte hidrocarburi, alchenele sunt insolubile în apă, dar solubile în solvenți organici.
Câteva alchene reprezentative – denumirile, structurile și proprietățile lor fizice – sunt prezentate în tabelul 8.1.
Tabelul 8.1 Proprietățile fizice ale unor alchene selectate
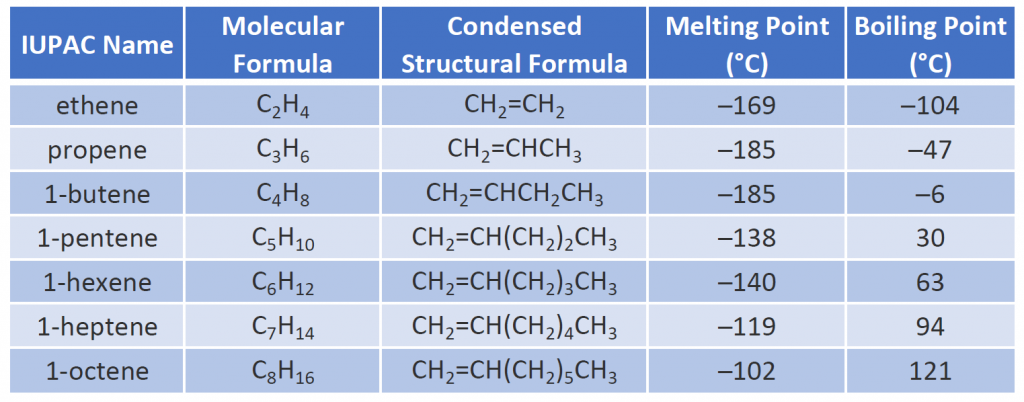
Primele două alchene din tabelul 8.1 -etena și propena, sunt cel mai adesea numite prin denumirile lor uzuale – etilenă și, respectiv, propilenă. Etilena este un produs chimic comercial important. Industria chimică din SUA produce anual aproximativ 25 de miliarde de kilograme de etilenă, mai mult decât orice altă substanță chimică organică de sinteză. Mai mult de jumătate din această etilenă intră în fabricarea polietilenei, unul dintre cele mai cunoscute materiale plastice. Propilena este, de asemenea, un produs chimic industrial important. Aceasta este transformată în materiale plastice, alcool izopropilic și o varietate de alte produse.
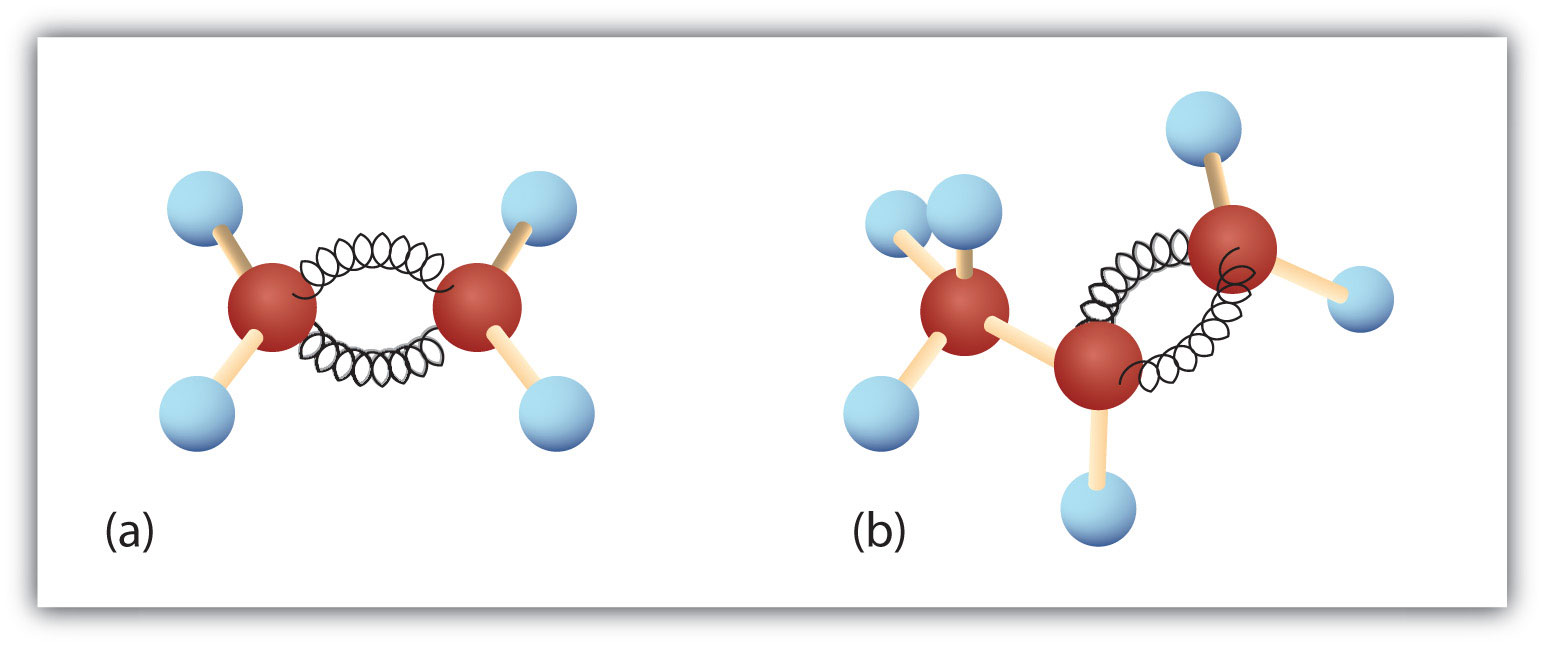
Figura 8.3. Etenă și propenă. Modelele cu bilă și arc ale etenei/etilenei (a) și ale propenei/propenei (b) arată formele lor respective, în special unghiurile de legătură.
Cu o privire mai atentă: Notă de mediu
Alchenele se găsesc pe scară largă în natură. Fructele și legumele în curs de coacere degajă etilenă, care declanșează continuarea coacerii. Procesatorii de fructe introduc în mod artificial etilenă pentru a grăbi procesul de coacere; expunerea la doar 0,1 mg de etilenă timp de 24 de ore poate coace 1 kg de roșii. Din nefericire, acest proces nu reproduce exact procesul de coacere, iar roșiile culese verzi și tratate în acest fel nu au un gust prea asemănător cu cel al roșiilor coapte în viță de vie, proaspăt culese din grădină.
Alți alchene care apar în natură includ 1-octenul, un constituent al uleiului de lămâie, și octadecena (C18H36) care se găsește în ficatul de pește. Dienele (două legături duble) și polienii (trei sau mai multe legături duble) sunt, de asemenea, frecvente. Butadiena (CH2=CHCH=CH2) se găsește în cafea. Licopenul și carotenii sunt polienii izomerici (C40H56) care dau culorile atractive roșu, portocaliu și galben pepenilor verzi, roșiilor, morcovilor și altor fructe și legume. Vitamina A, esențială pentru o bună vedere, este derivată dintr-un caroten. Lumea ar fi un loc mult mai puțin colorat fără alchene.

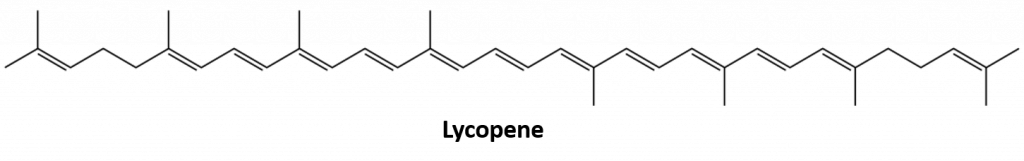
Figura 8.4. Culoarea roșu aprins a roșiilor se datorează licopenului.
Fotografie de la : © Thinkstock; Structura licopenului de la: Jeff Dahl
Exerciții de recapitulare a noțiunilor
-
Descrieți pe scurt proprietățile fizice ale alchenelor. Cum se compară aceste proprietăți cu cele ale alcanilor?
-
Fără a consulta tabele, aranjați următoarele alchene în ordinea creșterii punctului de fierbere:

Răspunsuri
-
Alchenele au proprietăți fizice (puncte de fierbere scăzute, insolubile în apă) destul de asemănătoare cu cele ale alcanilor lor corespunzători.
-
etena < propenă < 1-butenă < 1-hexenă
Ceea mai importantă concluzie
- Proprietățile fizice ale alchenelor sunt foarte asemănătoare cu cele ale alcanilor: punctele lor de fierbere cresc odată cu creșterea masei molare și sunt insolubile în apă.
Exerciții
-
Fără a vă referi la un tabel sau la alte referințe, preziceți care membru al fiecărei perechi are punctul de fierbere mai mare.
- 1-pentena sau 1-butena
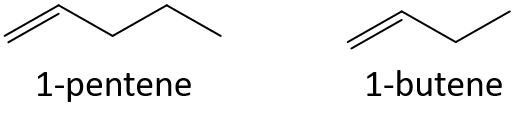
- 3-heptene sau 3-nonene
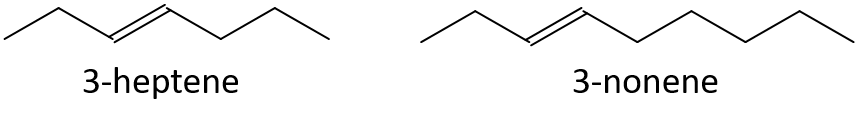
- 1-pentena sau 1-butena
-
Care este un bun solvent pentru ciclohexenă? pentanul sau apa?
Răspuns
-
- 1-pentena
- 3-.nonen
Exerciții de recapitulare a noțiunilor
-
Identificați pe scurt distincțiile importante dintre o hidrocarbură saturată și o hidrocarbură nesaturată.
-
Identificați pe scurt distincțiile importante dintre o alchenă și un alcan.
-
Clasificați fiecare compus ca fiind saturat sau nesaturat. Identificați fiecare ca fiind un alcan, o alchena sau o alchină.
-
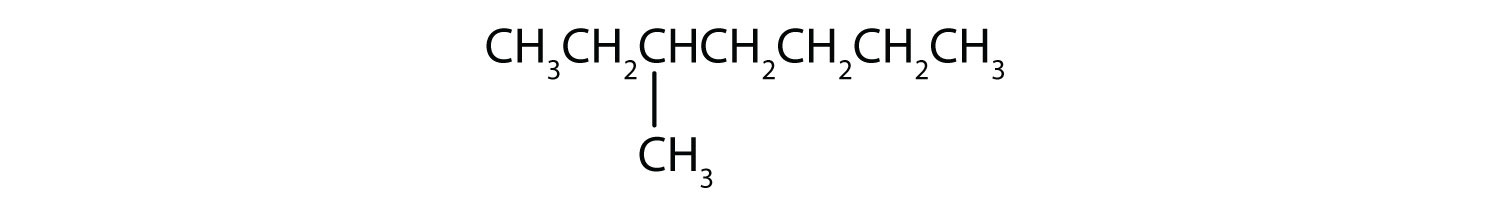
- CH3CH2C≡CCH3
-

-
.
Răspunsuri
-
Hidrocarburile nesaturate au legături duble sau triple și sunt destul de reactive; hidrocarburile saturate au doar legături simple și sunt destul de puțin reactive.
-
Un alchenă are o legătură dublă; un alcan are doar legături simple.
-
- saturat; alcan
- insaturat; alchenă
- insaturată; alchenă
- insaturată; alchenă
Ceea ce trebuie reținut
- Alchenele sunt hidrocarburi cu o legătură dublă carbon-carbură.
8.3 Alchene
Cea mai simplă alchenă – o hidrocarbură cu legătură triplă de carbon la carbon – are formula moleculară C2H2 și este cunoscută sub denumirea uzuală de acetilenă (fig. 8.5). Structura sa este H-C≡C-H.
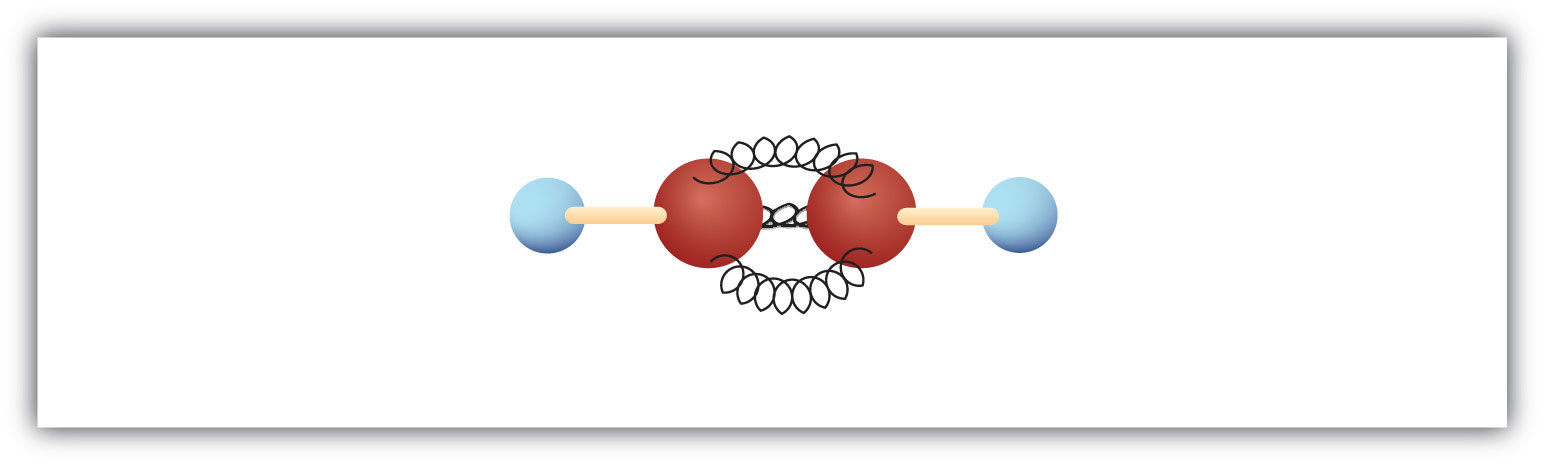
Figura 8.5 Modelul cu bilă și arc al acetilenei. Acetilena (etena) este cel mai simplu membru al familiei alchenei.
Nota
Acetilena este utilizată în torțele oxiacetilenice pentru tăierea și sudarea metalelor. Flacăra de la o astfel de torță poate fi foarte fierbinte. Cu toate acestea, cea mai mare parte a acetilenei este transformată în intermediari chimici care sunt utilizați la fabricarea materialelor plastice vinilice și acrilice, a fibrelor, a rășinilor și a unei varietăți de alte produse.
Alchenele sunt similare cu alchenele atât în ceea ce privește proprietățile fizice, cât și cele chimice. De exemplu, alchenele suferă multe dintre reacțiile de adiție tipice ale alchenelor. Denumirile Uniunii Internaționale de Chimie Pură și Aplicată (IUPAC) pentru alchine sunt paralele cu cele ale alchenelor, cu excepția faptului că terminația familiei este -yne în loc de -ene. Denumirea IUPAC pentru acetilenă este etenă. Denumirile altor alchene sunt ilustrate în următoarele exerciții.
Exerciții de recapitulare a noțiunilor
-
Identificați pe scurt diferențele importante dintre o alchenă și o alchină. În ce fel sunt ele asemănătoare?
-
Alchena (CH3)2CHCH2CH=CH2 se numește 4-metil-1-pentena. Cum se numește (CH3)2CHCH2C≡CH?
-
Acelenele prezintă izomerie cis-trans? Explicați.
Răspunsuri
-
Alchenele au legături duble; alchenele au legături triple. Ambele suferă reacții de adiție.
-
4-metil-1-pentena
-
Nu; un atom de carbon cu legătură triplă poate forma doar o altă legătură. Ar trebui să aibă două grupări atașate pentru a prezenta izomerie cis-trans.
Key Takeaway
- Alchenele sunt hidrocarburi cu legături triple carbon la carbon și proprietăți foarte asemănătoare cu cele ale alchenelor.
Exerciții
-
Desenați structura pentru fiecare compus.
- Acetilenă
- 3-metil-1-hexină
-
Desenați structura pentru fiecare compus.
- 4-metil-2-hexina
- 3-octyne
-
Numiți fiecare alchină.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Răspunsuri
.
-
- H-C≡C-H
-
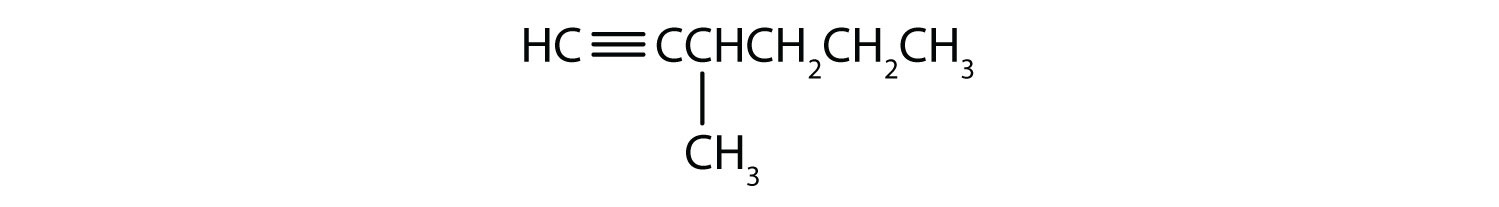
-
-
- 1-pentyne
- 2-hexyne
-
(Back to the Top)
8.4 Compuși aromatici: Benzenul
În continuare considerăm o clasă de hidrocarburi cu formule moleculare asemănătoare cu cele ale hidrocarburilor nesaturate, dar care, spre deosebire de alchene, nu suferă cu ușurință reacții de adiție. Acești compuși alcătuiesc o clasă distinctă, numită hidrocarburi aromatice. Hidrocarburile aromatice sunt compuși care conțin o structură inelară benzenică. cel mai simplu compus aromatic este benzenul (C6H6) și are o mare importanță comercială, dar are și efecte nocive notabile asupra sănătății (vezi „Pentru sănătatea dumneavoastră: Benzenul și noi”).
Formula C6H6 pare să indice că benzenul are un grad ridicat de nesaturare. (Hexanul, hidrocarbura saturată cu șase atomi de carbon are formula C6H14 – opt atomi de hidrogen în plus față de benzen). Cu toate acestea, în ciuda nivelului aparent scăzut de saturație, benzenul este mai degrabă nereactiv. Acest lucru se datorează structurii de rezonanță formată din structura cu legături duble alternante a inelului aromatic.

Nota
Benzenul este un lichid care miroase a benzină, fierbe la 80°C și îngheață la 5,5°C. Este hidrocarbura aromatică produsă în cel mai mare volum. În trecut, a fost folosit pentru decafeinizarea cafelei și a fost o componentă importantă a multor produse de consum, cum ar fi decapanții de vopsele, cimenturile de cauciuc și produsele de îndepărtare a petelor de la curățătoria chimică de acasă. A fost eliminat din formulările multor produse în anii 1950, dar alții au continuat să folosească benzenul în produse până în anii 1970, când a fost asociat cu decese cauzate de leucemie. Benzenul este încă important în industrie ca precursor în producția de materiale plastice (cum ar fi polistirenul și nailon), medicamente, detergenți, cauciuc sintetic, pesticide și coloranți. Este utilizat ca solvent pentru lucruri precum curățarea și întreținerea echipamentelor de tipărire și pentru adezivi, cum ar fi cei utilizați pentru a fixa tălpile la pantofi. Benzenul este un constituent natural al produselor petroliere, dar, deoarece este un carcinogen cunoscut, utilizarea sa ca aditiv în benzină este acum limitată.
Pentru sănătatea dumneavoastră: Benzenul și noi
Cei mai mulți dintre benzenii folosiți în comerț provin din petrol. Acesta este utilizat ca materie primă pentru producerea de detergenți, medicamente, coloranți, insecticide și materiale plastice. Odată utilizat pe scară largă ca solvent organic, benzenul este acum cunoscut ca având efecte toxice atât pe termen scurt, cât și pe termen lung. Inhalarea unor concentrații mari poate provoca greață și chiar moartea din cauza insuficienței respiratorii sau cardiace, în timp ce expunerea repetată duce la o boală progresivă în care capacitatea măduvei osoase de a produce noi celule sanguine este în cele din urmă distrusă. Aceasta duce la o afecțiune numită anemie aplastică, în care se produce o scădere a numărului de globule roșii și albe.
Exerciții de recapitulare a noțiunilor
-
Cum diferă reacțiile tipice ale benzenului de cele ale alchenelor?
-
Descrieți pe scurt legăturile din benzen.
-
Ce înseamnă cercul în reprezentarea benzenului de către chimist?
Răspunsuri
-
Benzenul este destul de puțin reactiv față de reacțiile de adiție, în comparație cu o alchenă.
-
Electronii de valență sunt împărțiți în mod egal de toți cei șase atomi de carbon (adică electronii sunt delocalizați).
-
Cei șase electroni sunt împărțiți în mod egal de toți cei șase atomi de carbon.
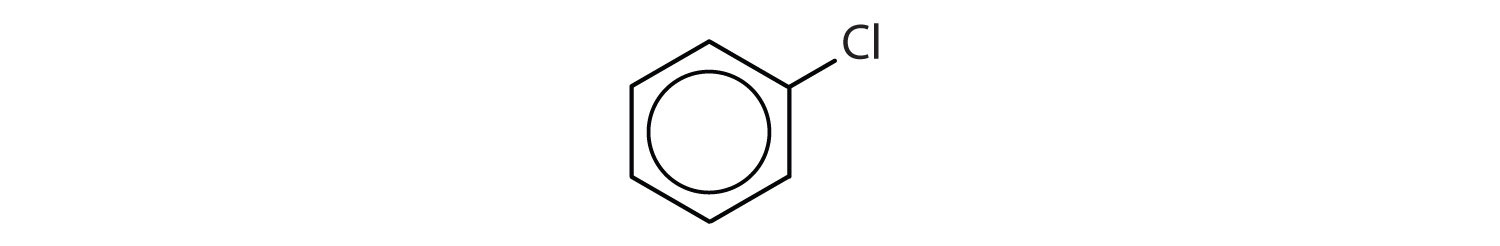
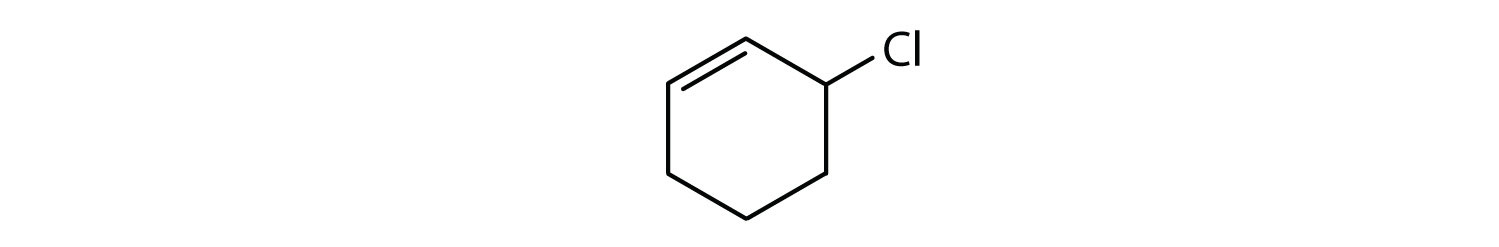
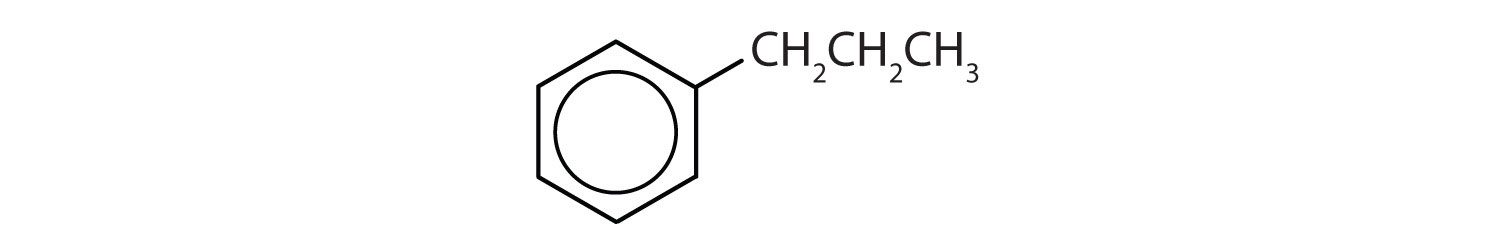
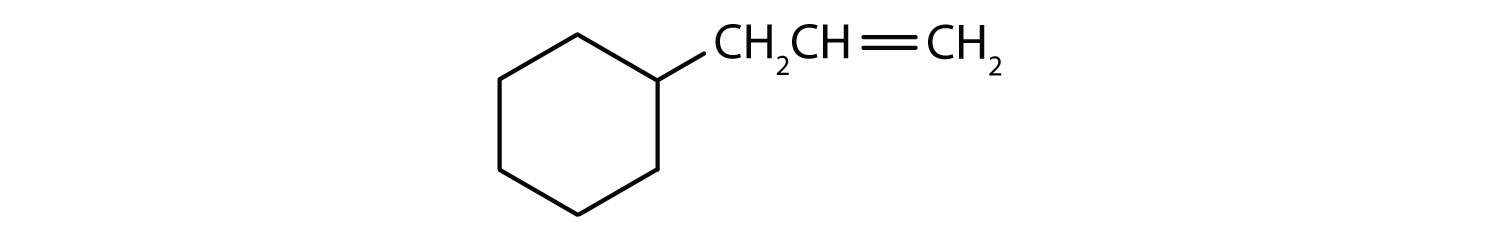
Recunoașterea compușilor aromatici
Ce compuși sunt aromatici?
Soluție
- Compusul are un inel benzenic (cu un atom de clor substituit pentru unul dintre atomii de hidrogen); este aromatic.
- Compusul este ciclic, dar nu are un inel benzenic; nu este aromatic.
- Compusul are un inel benzenic (cu o grupare propil înlocuită cu un grup propil în locul unuia dintre atomii de hidrogen); este aromatic.
- Compusul este ciclic, dar nu are un inel benzenic; nu este aromatic.
Exercițiu de dezvoltare a abilităților
Ce compuși sunt aromatici?
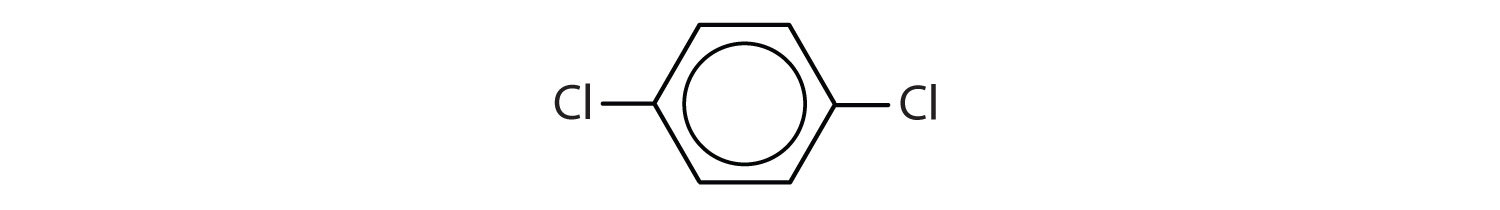
-
-
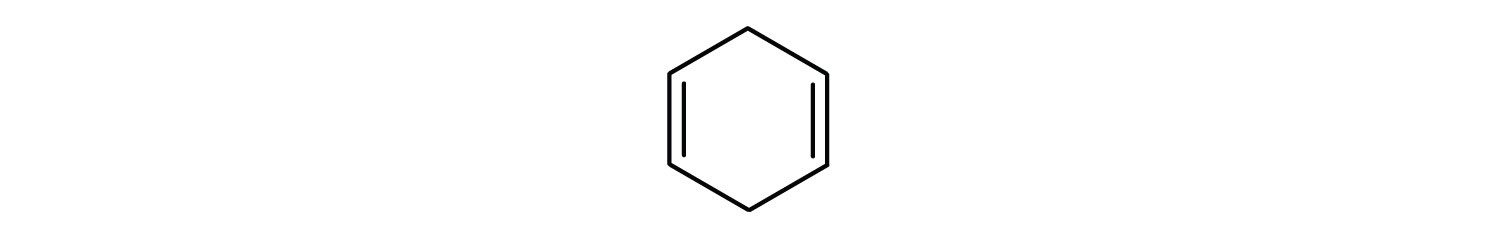
În sistemul Uniunii Internaționale de Chimie Pură și Aplicată (IUPAC), hidrocarburile aromatice sunt numite ca derivați ai benzenului. Cinci exemple sunt prezentate mai jos. În aceste structuri, este irelevant dacă substituentul unic este scris în partea superioară, laterală sau inferioară a inelului: un hexagon este simetric și, prin urmare, toate pozițiile sunt echivalente.
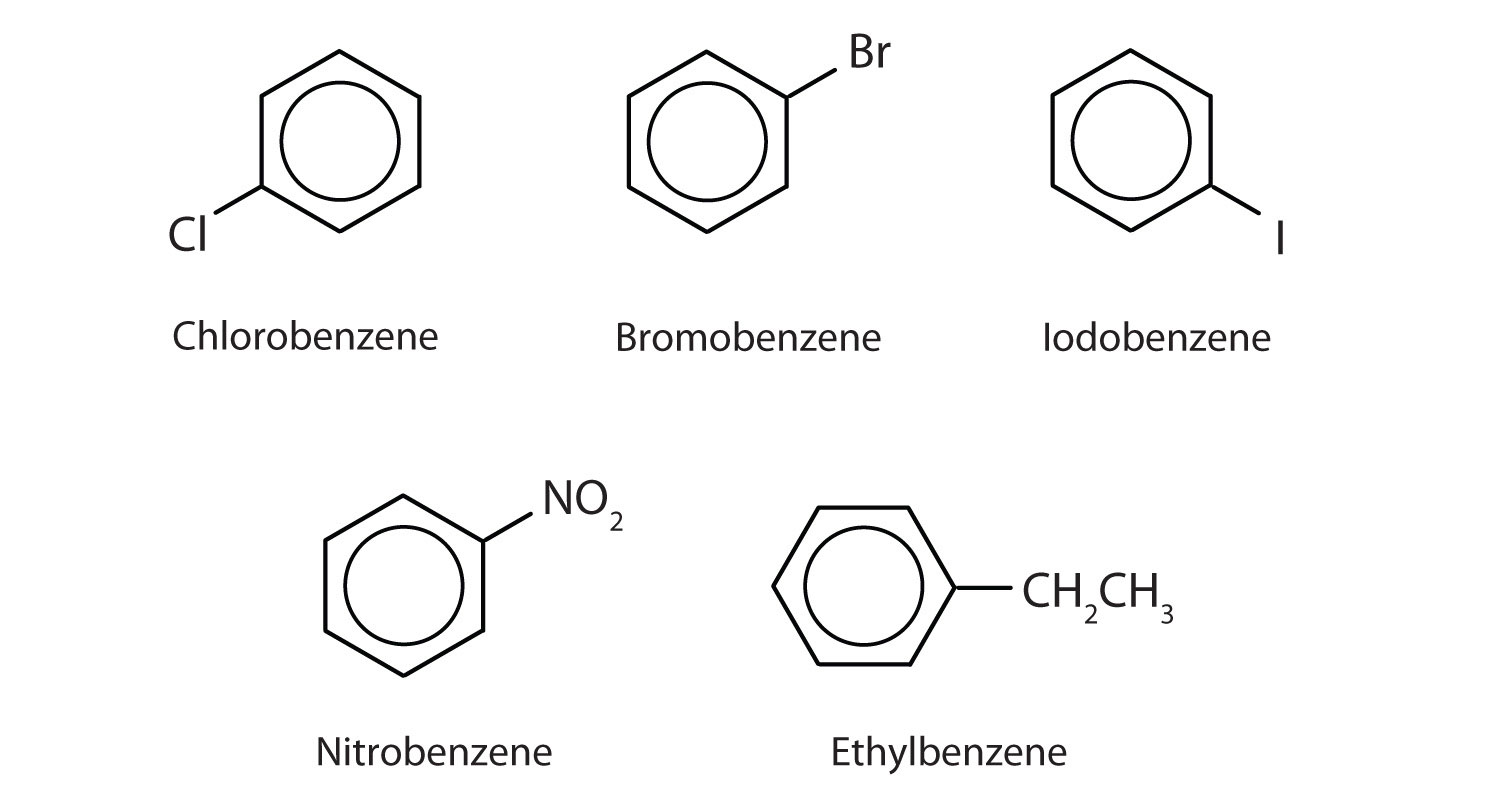
Acesti compuși sunt denumiți în mod obișnuit, grupul care înlocuiește un atom de hidrogen fiind numit grup substituent: Cl ca și cloro, Br ca și bromo, I ca și iodo, NO2 ca și nitro și CH3CH2 ca și etil.
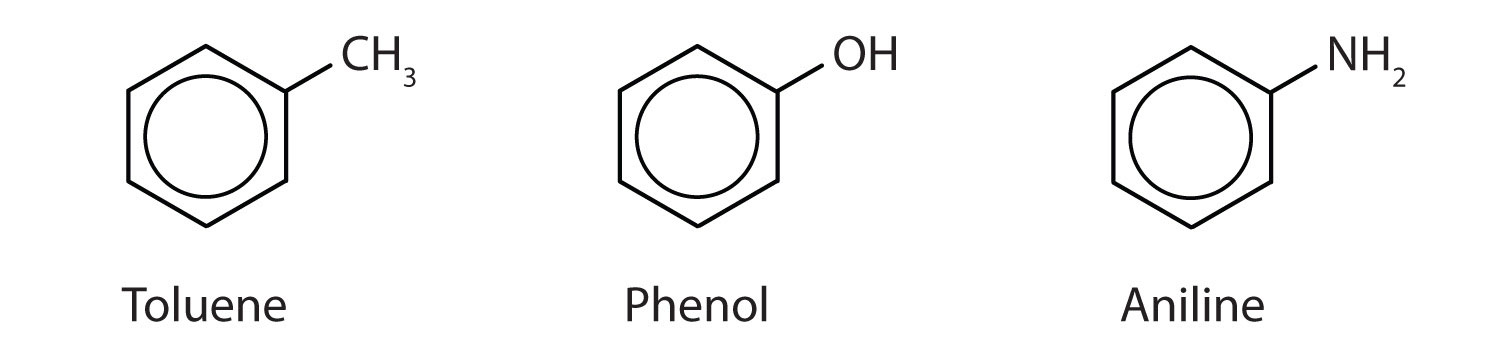
Deși unii compuși sunt denumiți exclusiv prin denumirile IUPAC, unii sunt mai frecvent desemnați prin denumiri uzuale, așa cum este indicat mai jos.
Ceea ce trebuie reținut
- Hidrocarburile aromatice par a fi nesaturate, dar ele au un tip special de legătură și nu suferă reacții de adiție.
(Back to the Top)
Hidrocarburi aromatice policiclice
Câteva hidrocarburi aromatice comune constau din inele benzenice fuzionate – inele care au o latură comună. Acești compuși se numesc hidrocarburi aromatice policiclice (HAP)O hidrocarbură aromatică constând din inele benzenice fuzionate care au o latură comună…
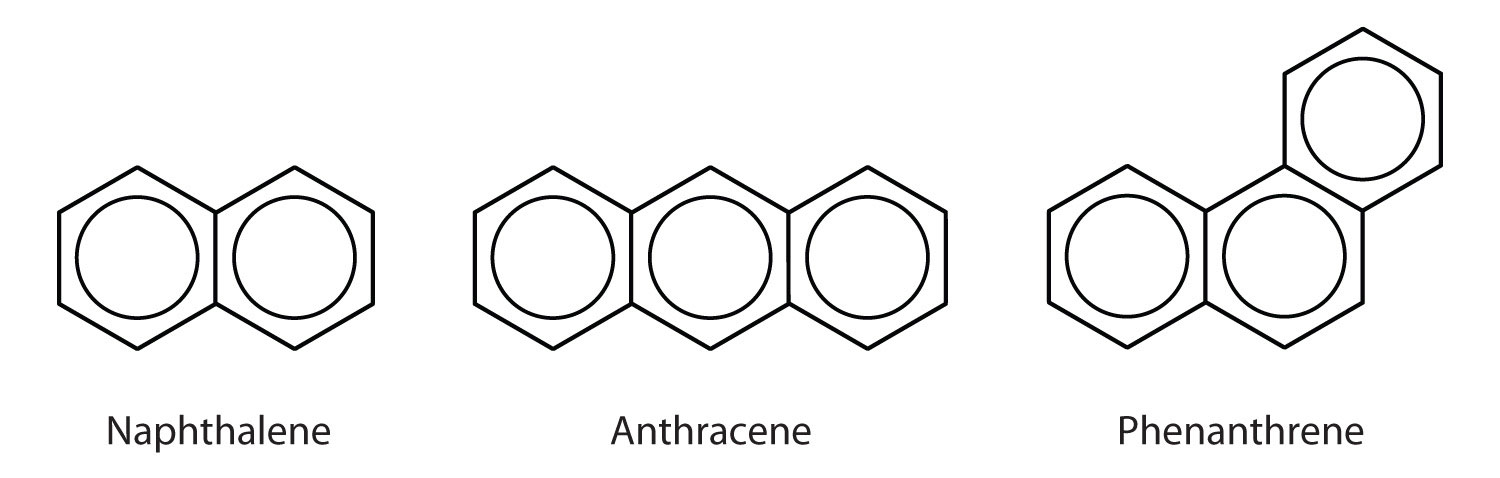
Cele trei exemple prezentate aici sunt solide incolore, cristaline, obținute în general din gudron de huilă. Naftalina are un miros înțepător și este folosită în naftalină. Antracenul este utilizat la fabricarea anumitor coloranți. Steroizii, inclusiv colesterolul și hormonii, estrogenul și testosteronul, conțin structura fenantrenului.
În sănătatea dumneavoastră: Hidrocarburile aromatice policiclice și cancerul
Încălzirea intensă necesară pentru distilarea gudronului de huilă duce la formarea de HAP. De mulți ani, se știe că lucrătorii din rafinăriile de gudron de huilă sunt predispuși la un tip de cancer de piele cunoscut sub numele de cancer de gudron. Investigațiile au arătat că o serie de HAP sunt agenți cancerigeni. Unul dintre cei mai activi compuși cancerigeni, benzopirenul, se găsește în gudronul de huilă și a fost, de asemenea, izolat din fumul de țigară, fumul de marijuana, gazele de eșapament ale automobilelor și fripturile prăjite cu cărbune. Se estimează că peste 1.000 de tone de benzopiren sunt emise în aer deasupra Statelor Unite în fiecare an. Sunt necesare doar câteva miligrame de benzopiren pe kilogram de greutate corporală pentru a induce cancerul la animalele de laborator.
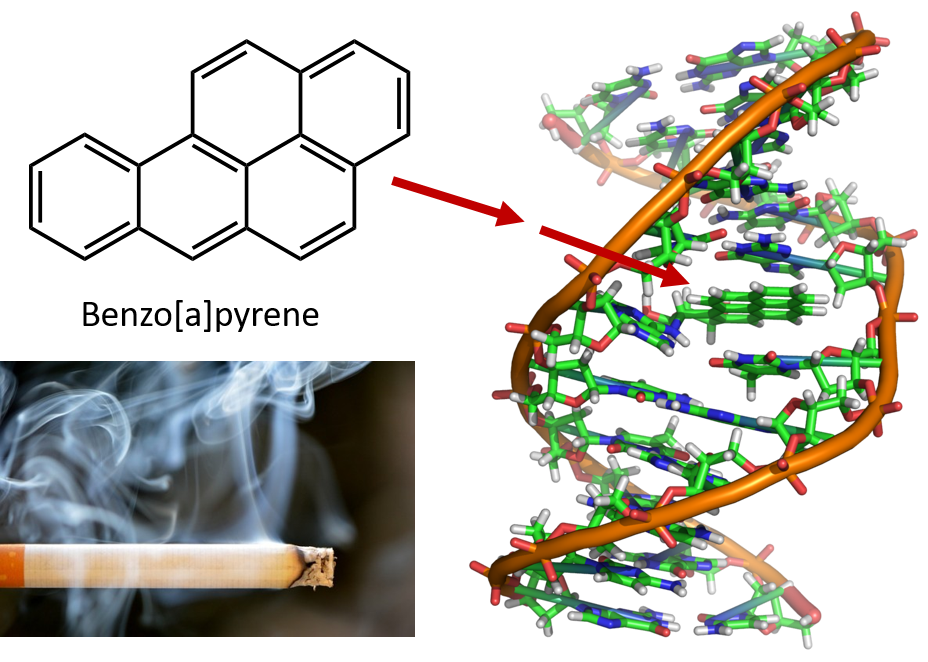
Figura 8.6 Benzopirenul este o hidrocarbură aromatică policiclică produsă ca produs secundar în gudronul de huilă, fumul de țigară și de marijuana și în fripturile prăjite la cărbune. Benzopirenul este metabolizat pentru a produce compuși biologic activi care pot forma aducturi fizice pe moleculele de ADN. Acești aduși pot provoca mutații genetice care cauzează cancer.
Fotografie de fum de țigară
Compuși importanți din punct de vedere biologic cu inele benzenice
Substanțele care conțin inelul benzenic sunt comune atât la animale, cât și la plante, deși sunt mai abundente la acestea din urmă. Plantele pot sintetiza inelul benzenic din dioxid de carbon, apă și materiale anorganice. Animalele nu îl pot sintetiza, dar depind de anumiți compuși aromatici pentru a supraviețui și, prin urmare, trebuie să îi obțină din hrană. Fenilalanina, tirozina și triptofanul (aminoacizi esențiali) și vitaminele K, B2 (riboflavina) și B9 (acidul folic) conțin toate inelul benzenic. Multe medicamente importante, dintre care câteva sunt prezentate în tabelul 8.2, prezintă, de asemenea, un inel benzenic.
Nota
Până acum am studiat numai compușii aromatici cu inele care conțin carbon. Cu toate acestea, mulți compuși ciclici au în inel un alt element decât atomii de carbon. Structurile organice inelare care conțin un alt atom decât carbonul se numesc compuși heterociclici.., Compușii aromatici heterociclici au, de asemenea, proprietăți unice și relevante din punct de vedere medical.
Tabelul 8.2 Unele medicamente care conțin un inel benzenic
| Nume | Structură | |
|---|---|---|
| aspirină |
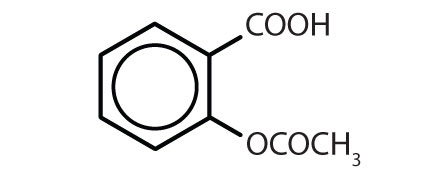 |
|
| acetaminofen |
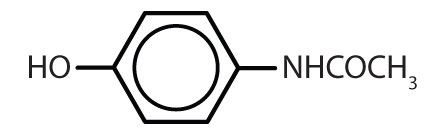 |
 |
| ibuprofen |
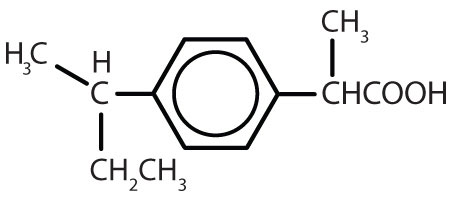 |
|
| amfetamina |
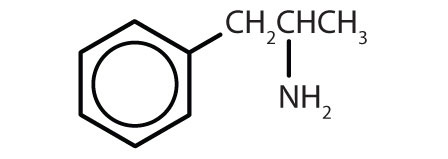 |
|
| sulfanilamidă |
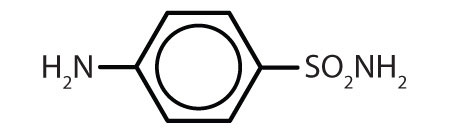 |
8.5 Izomeri geometrici
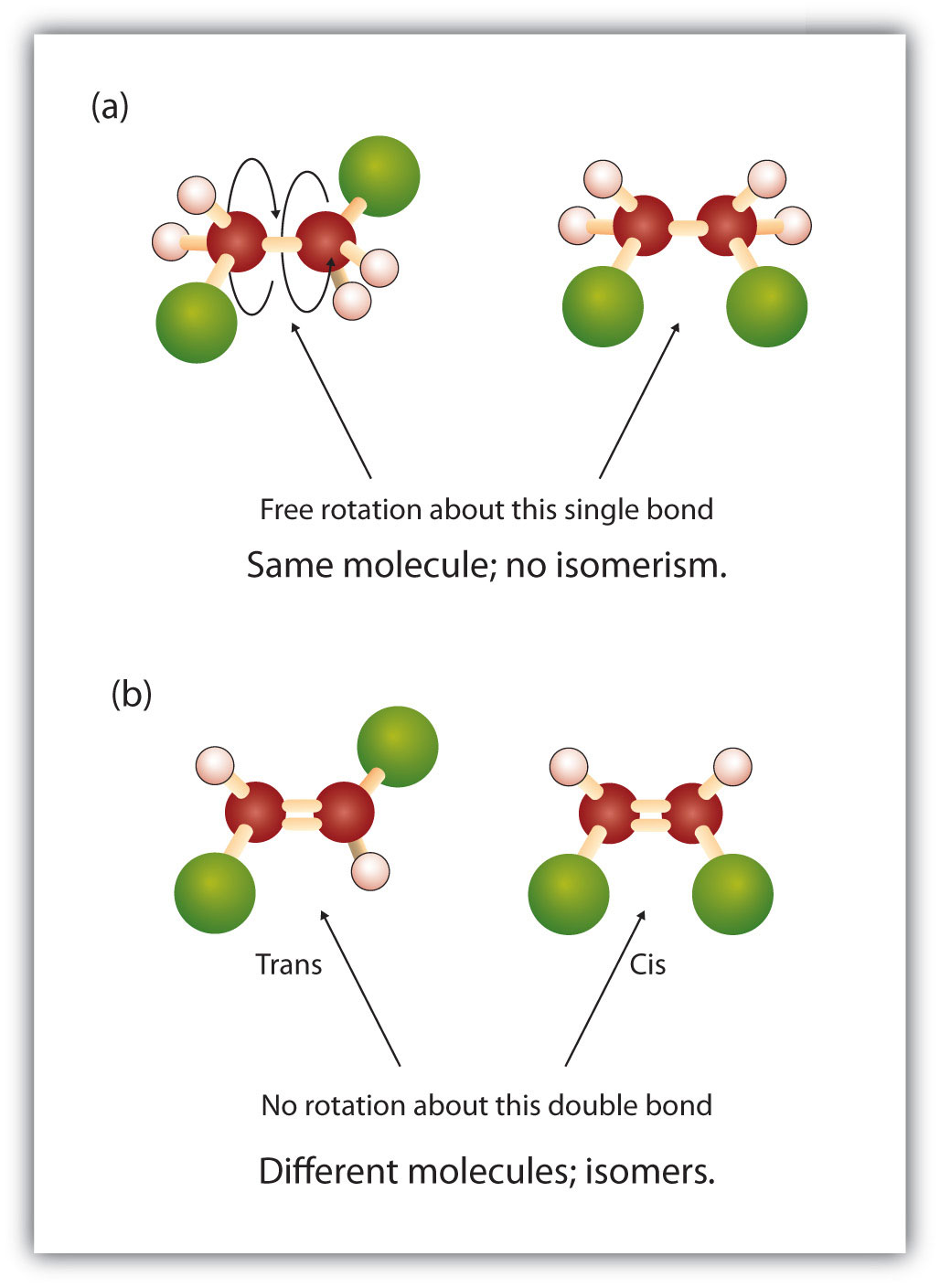
În structura alcanilor există o rotație liberă în jurul legăturilor simple de carbon la carbon (C-C). În schimb, structura alchenelor impune ca atomii de carbon să formeze o legătură dublă. Legăturile duble între elemente sunt create cu ajutorul învelișurilor de orbitali p (numiți și orbitali pi). Aceste învelișuri orbitale au forma unor gantere, mai degrabă decât orbitalii circulari utilizați în legăturile simple. Acest lucru împiedică rotația liberă a atomilor de carbon în jurul legăturii duble, deoarece ar determina ruperea legăturii duble în timpul rotației (figura 8.7). Astfel, o legătură simplă este analogă cu două scânduri bătute în cuie cu un singur cui. Scândurile sunt libere să se rotească în jurul singurului cui. O legătură dublă, pe de altă parte, este analogă cu două scânduri bătute împreună cu două cuie. În primul caz, puteți răsuci scândurile, în timp ce în al doilea caz nu le puteți răsuci.

Figura 8.7 Formarea legăturilor duble necesită utilizarea legăturilor pi. Pentru ca moleculele să creeze legături duble, electronii trebuie să împartă orbite pi suprapuse între cei doi atomi. Acest lucru necesită ca pi-orbitalele în formă de halteră (se arată în stânga) să rămână într-o conformație fixă în timpul formării dublei legături. Acest lucru permite formarea unor orbitali electronici care pot fi împărțiți de ambii atomi (arătați în dreapta). Rotația în jurul dublei legături ar face ca orbitalii pi să fie dezaliniați, rupând dubla legătură.
Diagrama furnizată de: JoJanderivative work – Vladsinger (talk)
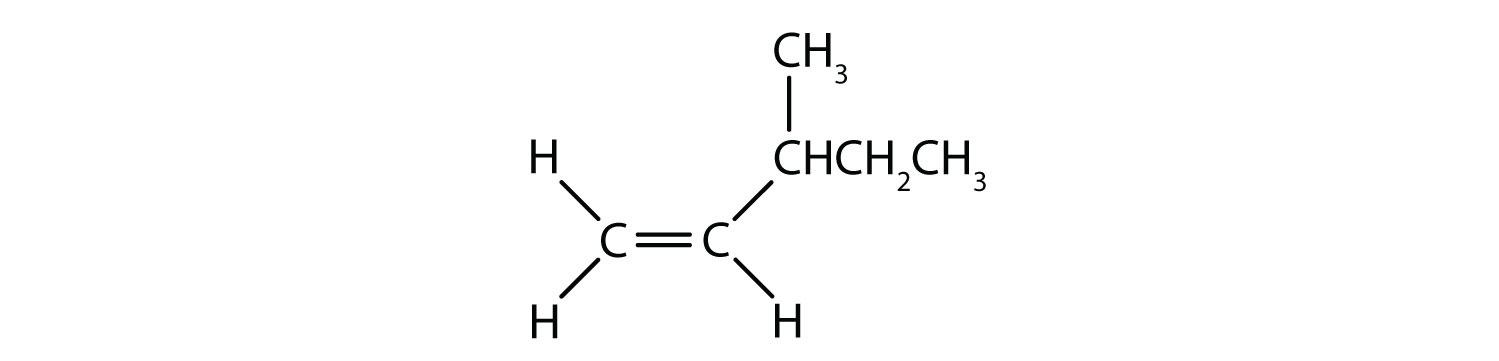
Natura fixă și rigidă a dublei legături creează posibilitatea unui centru chiral suplimentar și, astfel, potențialul pentru stereoisomeri. Noi stereoizomeri se formează dacă fiecare dintre carbonații implicați în dubla legătură are doi atomi sau grupuri diferite atașate la el. De exemplu, priviți cele două hidrocarburi clorurate din figura 8.8. În figura de sus, este prezentat alcanul halogenat. Rotirea în jurul acestei legături carbon-carbon este posibilă și nu are ca rezultat conformații diferite ale izomerilor. În diagrama inferioară, alchena halogenată are o rotație restricționată în jurul legăturii duble. Observați, de asemenea, că fiecare carbon implicat în legătura dublă este, de asemenea, atașat la doi atomi diferiți (un hidrogen și un clor). Astfel, această moleculă poate forma doi stereoizomeri: unul care are cei doi atomi de clor pe aceeași parte a dublei legături, iar celălalt în care clorurile se află pe părți opuse ale dublei legături.
Figura 8.8 Legăturile duble ale alchenei pot forma izomeri geometrici. (a) Arată rotația liberă în jurul unei legături simple carbon-carbon din structura alcanului. (b) Arată poziția fixă a dublei legături carbon-carbon care duce la izomeri geomatici (spațiali).
Click aici pentru un tutorial video al Academiei Kahn despre structura alchenelor.
Pentru această secțiune, nu suntem preocupați de denumirea care este, de asemenea, inclusă în acest tutorial video.(Notă: Tot conținutul Khan Academy este disponibil gratuit folosind licența CC-BY-NC-SA la www.khanacademy.org )
Nomenclatura cis-trans
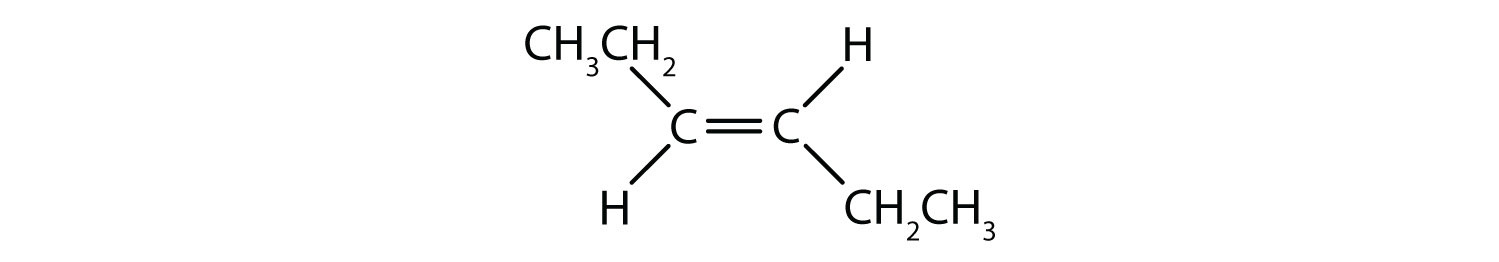
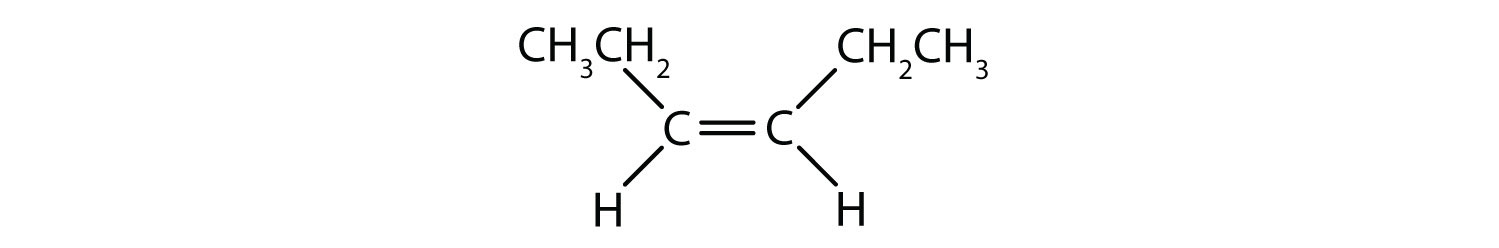
Sistemul de denumire cis-trans poate fi folosit pentru a distinge izomerii simpli, în care fiecare carbon al dublei legături are atașat un set de grupări identice. De exemplu, în figura 8.8b, fiecare carbon implicat în dubla legătură, are atașat un clor și, de asemenea, are atașat un hidrogen. Sistemul cis și trans, identifică dacă grupurile identice se află pe aceeași parte (cis) a dublei legături sau dacă se află pe partea opusă (trans) a dublei legături. De exemplu, dacă atomii de hidrogen se află pe partea opusă a dublei legături, se spune că legătura se află în conformație trans. În cazul în care grupele de hidrogen se află de aceeași parte a dublei legături, se spune că legătura este în conformație cis. Observați că se poate spune, de asemenea, că dacă ambele grupe de clor se află de partea opusă a dublei legături, molecula se află în conformația trans sau dacă se află de aceeași parte a dublei legături, molecula se află în conformația cis.
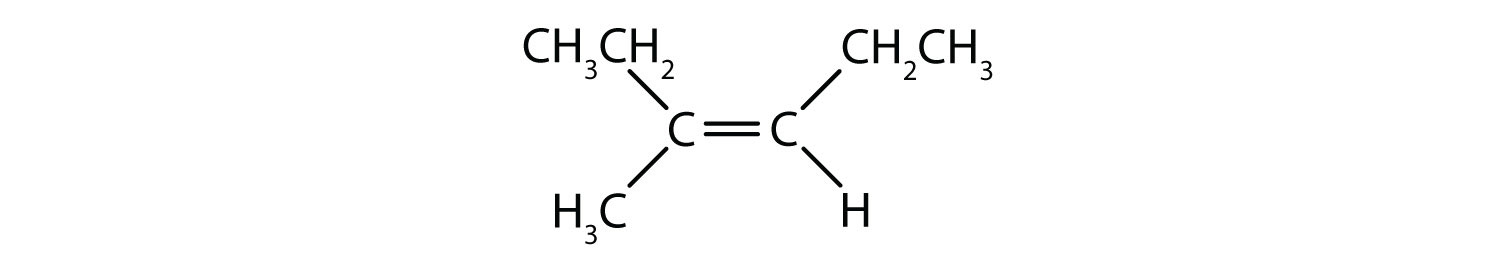
Pentru a determina dacă o moleculă este cis sau trans, este util să se traseze o linie punctată în josul centrului dublei legături și apoi să se încercuiască grupurile identice, așa cum se arată în figura 8.9. Ambele molecule prezentate în figura 8.9, se numesc 1,2-dicloroetenă. Astfel, denumirea cis și trans, definește doar stereochimia din jurul dublei legături, ea nu schimbă identitatea generală a moleculei. Cu toate acestea, izomerii cis și trans au adesea proprietăți fizice și chimice diferite, datorită naturii fixe a legăturilor în spațiu.
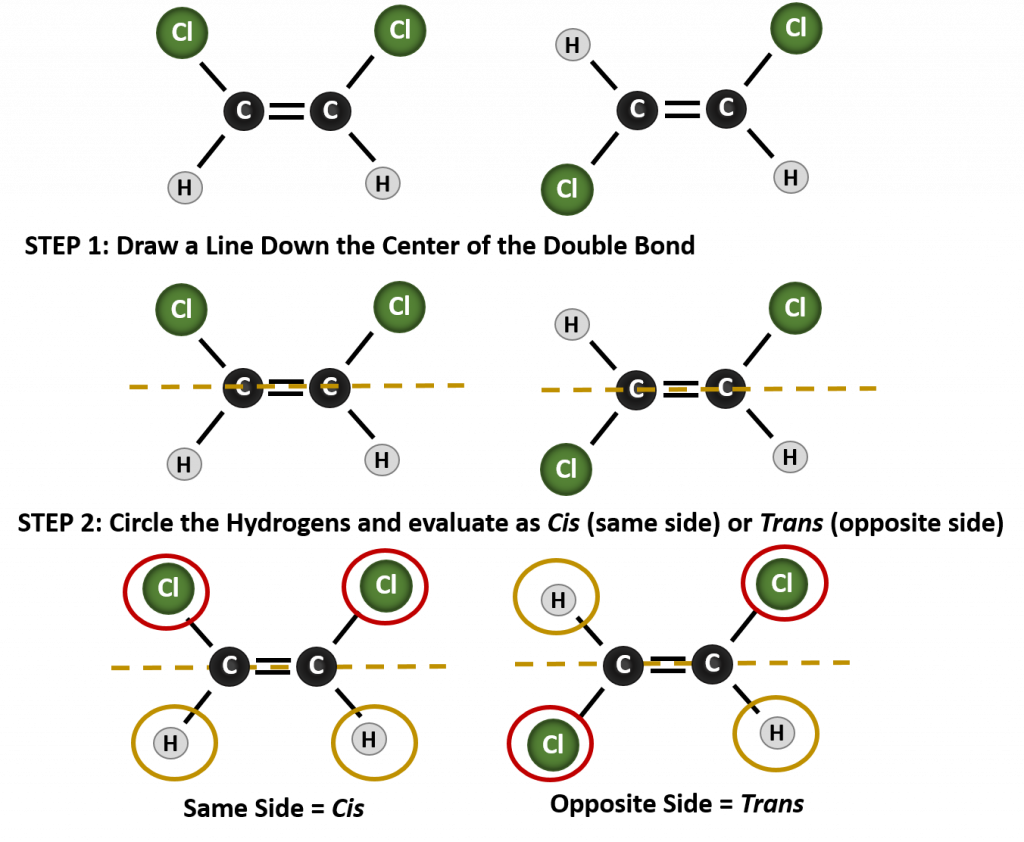
Figura 8.9 Ghid pentru determinarea conformațiilor cis sau trans.
Click aici pentru un tutorial video al Academiei Kahn despre izomerizarea Cis/Trans
(Notă: Tot conținutul Academiei Khan este disponibil gratuit folosind licența CC-BY-NC-SA la www.khanacademy.org )
Izomeria cis-trans apare, de asemenea, în compușii ciclici. În structurile inelare, grupurile nu se pot roti în jurul niciuneia dintre legăturile carbon-carbon din inel. Prin urmare, grupurile pot fi fie pe aceeași parte a inelului (cis), fie pe părți opuse ale inelului (trans). Pentru scopurile noastre de aici, reprezentăm toți cicloalcanii ca structuri plane și indicăm pozițiile grupurilor, fie deasupra, fie sub planul inelului.

Sănătate
Posibil că cel mai frecvent loc în care veți auzi referiri la conformațiile cis-trans în viața de zi cu zi este la supermarket sau la cabinetul medicului dumneavoastră. Aceasta se referă la consumul nostru de grăsimi alimentare. Consumul necorespunzător sau excesiv de grăsimi alimentare a fost legat de multe tulburări de sănătate, cum ar fi diabetul și ateroscleroza, precum și de bolile coronariene. Așadar, care sunt diferențele dintre grăsimile saturate și nesaturate și ce sunt grăsimile trans și de ce reprezintă ele o problemă de sănătate?

Figura 8.10 Surse comune de grăsimi alimentare.
Fotografie de la: TyMaHe
Cea mai comună formă de grăsimi alimentare și principalul constituent al grăsimii corporale la om și la alte animale sunt trigliceridele (TAG). TAG-urile, așa cum se arată în figura 8.10, sunt construite dintr-o moleculă de glicerol și trei molecule de acizi grași care sunt legate între ele printr-o legătură ester. În această secțiune, ne vom concentra asupra structurii cozilor lungi ale acizilor grași, care pot fi compuse din structuri alcanice sau alchene. Capitolul 10 se va concentra mai mult pe formarea legăturilor esterice.

Figura 8.11. Exemplu de structură a unei trigliceride (TAG). Observați că fiecare trigliceridă are trei acizi grași cu lanț lung care se extind din coloana vertebrală de glicerol. Fiecare acid gras poate avea grade diferite de saturație și nesaturație.
Structură adaptată de la: Wolfgang Schaefer
Grăsimile care sunt complet saturate vor avea numai acizi grași cu cozi alcanice cu lanț lung. Se spune că sunt „saturați” cu atomi de hidrogen. Grăsimile saturate sunt comune în dieta americană și se găsesc în carnea roșie, produsele lactate precum laptele, brânza și untul, uleiul de cocos și se găsesc în multe produse de panificație. Grăsimile saturate sunt de obicei solide la temperatura camerei. Acest lucru se datorează faptului că alcanii cu lanț lung se pot suprapune având mai multe forțe de dispersie intermoleculare London. Acest lucru conferă grăsimilor saturate puncte de topire și puncte de fierbere mai ridicate decât grăsimile nesaturate care se găsesc în multe uleiuri vegetale.
Majoritatea grăsimilor nesaturate care se găsesc în natură sunt în conformația cis, așa cum se arată în figura 8.11. Rețineți că acizii grași prezentați în figura 8.11 sunt desenați din comoditate, astfel încât să fie ușor de privit și să nu ocupe prea mult spațiu pe hârtie, dar unghiurile de legătură scrise nu redau în mod adecvat adevărata orientare spațială a moleculelor. Atunci când acizii grași din TAG prezentați în figura 8.11 sunt desenați cu unghiurile de legătură corecte, este ușor de observat că legăturile duble cis provoacă curburi în lanțul alchenic (fig. 8.12).
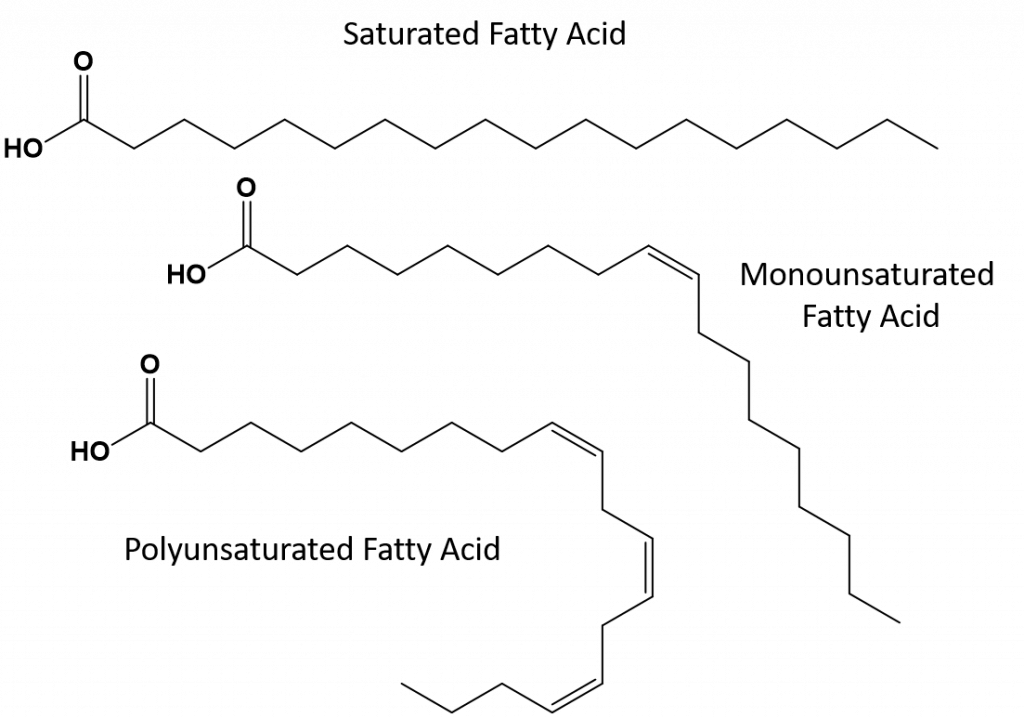
Figura 8.12 Legăturile duble cis cauzează curburi în structura acizilor grași
Din acest motiv, grăsimile mononesaturate și polinesaturate nu se pot suprapune la fel de ușor și nu au la fel de multe forțe atractive intermoleculare în comparație cu grăsimile saturate. Ca urmare, acestea au puncte de topire și puncte de fierbere mai scăzute și tind să fie lichide la temperatura camerei. S-a demonstrat că reducerea sau înlocuirea grăsimilor saturate cu grăsimi mono- și polinesaturate în alimentație, ajută la reducerea nivelurilor formei de colesterol LDL (low-density-lipoprotein), care este un factor de risc pentru bolile coronariene.
Grăsimile trans, pe de altă parte, conțin legături duble care se află în conformația trans. Astfel, forma acizilor grași este liniară, similară cu cea a grăsimilor saturate. Grăsimile trans au, de asemenea, puncte de topire și de fierbere similare în comparație cu grăsimile saturate. Cu toate acestea, spre deosebire de grăsimile saturate, grăsimile trans nu se găsesc în mod obișnuit în natură și au un impact negativ asupra sănătății. Grăsimile trans apar în principal ca un produs secundar în procesarea alimentelor (în special în procesul de hidrogenare pentru a crea margarine și grăsimi) sau în timpul gătitului, în special în timpul prăjirii. De fapt, multe unități de fast-food folosesc grăsimi trans în procesul de prăjire, deoarece grăsimile trans pot fi folosite de mai multe ori înainte de a fi nevoie să fie înlocuite. Consumul de grăsimi trans crește nivelul de colesterol LDL din organism (colesterolul rău care este asociat cu bolile coronariene) și tinde să scadă colesterolul lipoproteic de înaltă densitate (HDL) (colesterolul bun din organism). Consumul de grăsimi trans crește riscul de boli de inimă și de accident vascular cerebral, precum și de apariție a diabetului de tip II. Riscul a fost atât de bine corelat încât multe țări au interzis utilizarea grăsimilor trans, inclusiv Norvegia, Suedia, Austria și Elveția. În Statele Unite, Food and Drug Administration (FDA) a adoptat recent o măsură de eliminare treptată a utilizării grăsimilor trans în alimente până în 2018. Se estimează că această măsură va preveni 20.000 de atacuri de cord și 7.000 de decese pe an.
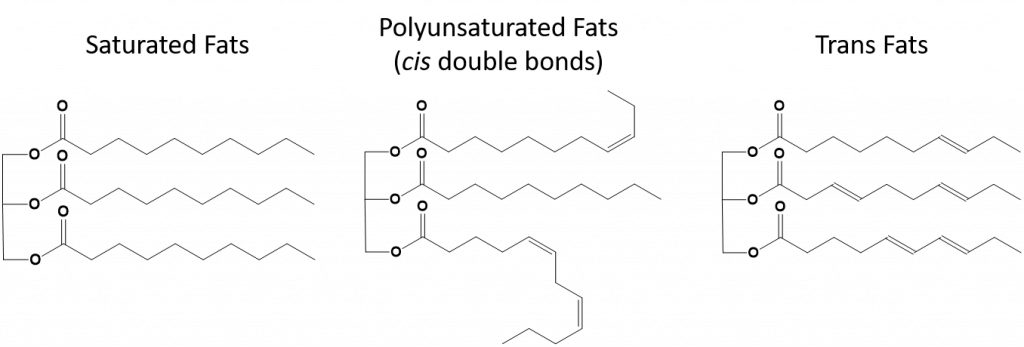
Figura 8.13 Diferențele structurale ale grăsimilor saturate, polinesaturate și trans.
Click aici pentru un tutorial video al Academiei Kahn despre grăsimile saturate, nesaturate și trans
(Notă: Tot conținutul Academiei Khan este disponibil gratuit folosind licența CC-BY-NC-SA la www.khanacademy.org )
Factori cheie pentru determinarea izomerizării Cis/Trans
- Compusul trebuie să conțină o legătură dublă sau triplă, sau să aibă o structură inelară care nu va permite rotația liberă în jurul legăturii carbon-carbon.
- Compusul trebuie să aibă două grupări neidentice atașate fiecărui carbon implicat în legătura dublă sau triplă carbon-carbon.
Exemplu de lucru
Ce compuși pot exista ca izomeri cis-trans (geometrici)? Desenați-i.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CH2CH3
Soluție
Toate cele patru structuri au o legătură dublă și astfel îndeplinesc regula 1 pentru izomerie cis-trans.
-
Acest compus îndeplinește regula 2; are două grupări neidentice pe fiecare atom de carbon (H și Cl pe unul și H și Br pe celălalt). Există ca izomeri cis și trans:

- Acest compus are doi atomi de hidrogen pe unul dintre atomii de carbon dublu legați; nu respectă regula 2 și nu există ca izomeri cis și trans.

- Acest compus are două grupări metil (CH3) pe unul dintre atomii de carbon dublu legați. Nu îndeplinește regula 2 și nu există ca izomeri cis și trans.

-
Acest compus îndeplinește regula 2; are două grupări neidentice pe fiecare atom de carbon și există ca izomeri cis și trans:

Exercițiu de dezvoltare a abilităților
-
Ce compuși pot exista ca izomeri cis-trans? Desenați-i.
- CH2=CH2CH2CH2CH3
- CH3CH=CH2CH3
- CH3CH2CH=CH2CH3CH3
- CH3CH2CH=CH2CH3
-
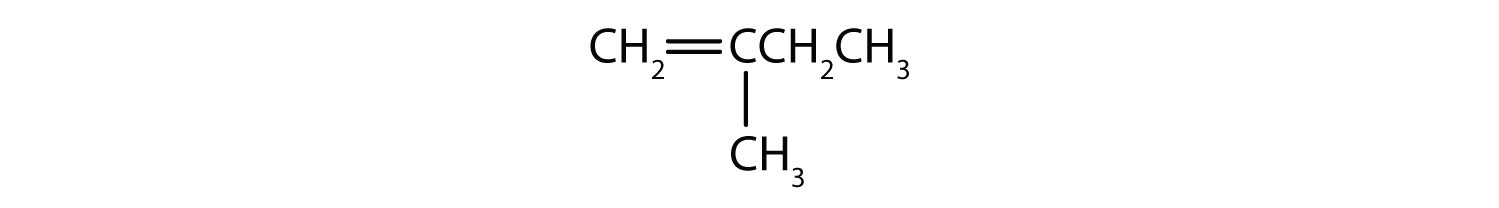
-
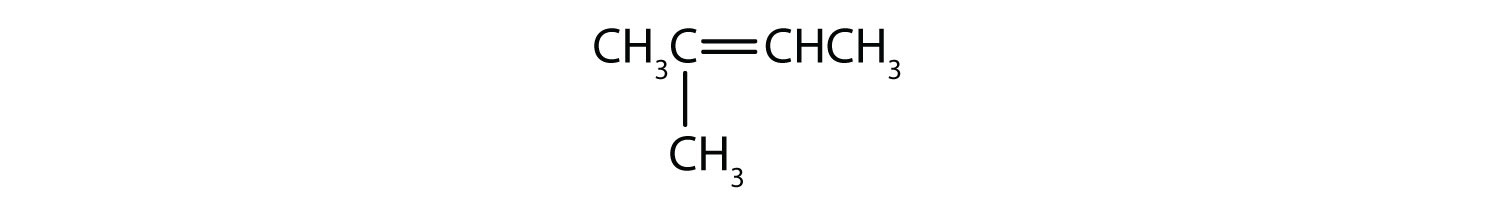
.
Exerciții de revizuire a conceptelor
-
Ce sunt cis-trans (geometric) izomeri? Ce două tipuri de compuși pot prezenta izomerie cis-trans?
-
Clasificați fiecare compus ca izomer cis, izomer trans sau niciunul.
-
Răspunsuri
-
Cis-izomerii trans sunt compuși care au configurații diferite (grupe aflate permanent în locuri diferite în spațiu) din cauza prezenței unei structuri rigide în molecula lor. Alchenele și compușii ciclici pot prezenta izomerie cis-trans.
-
- trans
- cis
- cis
- neither
Key Takeaway
- Cis-trans (geometric) izomerie (geometrică) există atunci când există o rotație restrânsă într-o moleculă și există două grupări diferite pe fiecare atom de carbon implicat în legătura chimică.
(Back to the Top)
Nomenclatura E-Z
Situația devine mai complexă atunci când există 4 grupe diferite atașate la atomii de carbon implicați în formarea dublei legături. Sistemul de denumire cis-trans nu poate fi utilizat în acest caz, deoarece nu există nici o referință la ce grupuri sunt descrise de nomenclatură. De exemplu, în molecula de mai jos, se poate spune că clorul este trans față de grupul brom sau se poate spune că clorul este cis față de grupul metil (CH3). Astfel, simpla scriere cis sau trans în acest caz nu delimitează clar orientarea spațială a grupărilor în raport cu dubla legătură.
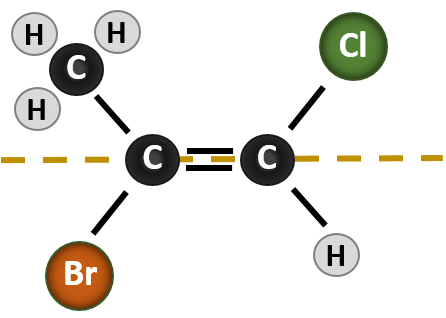
Numirea diferiților stereoizomeri formați în această situație, necesită cunoașterea regulilor de prioritate. Reamintim din capitolul 5 că în sistemul de priorități Cahn-Ingold-Prelog (CIP), grupările care sunt atașate la carbonul chiral au prioritate în funcție de numărul lor atomic (Z). Atomii cu număr atomic mai mare (mai mulți protoni) au prioritate mai mare (de exemplu, S > P > O > N > C > H). Pentru acest sistem de nomenclatură se folosesc denumirile de (Z) și (E) în locul sistemului cis/trans. (E) provine de la cuvântul german entgegen, adică opus. Astfel, atunci când grupele cu prioritate mai mare se află pe partea opusă a dublei legături, se spune că legătura se află în conformația (E). (Z), pe de altă parte, vine de la cuvântul german zusammen, adică împreună. Astfel, atunci când grupele cu prioritate mai mare se află de aceeași parte a dublei legături, se spune că legătura se află în conformația (Z). Figura 8.14 prezintă etapele utilizate pentru atribuirea conformațiilor (E) sau (Z) ale unei molecule.
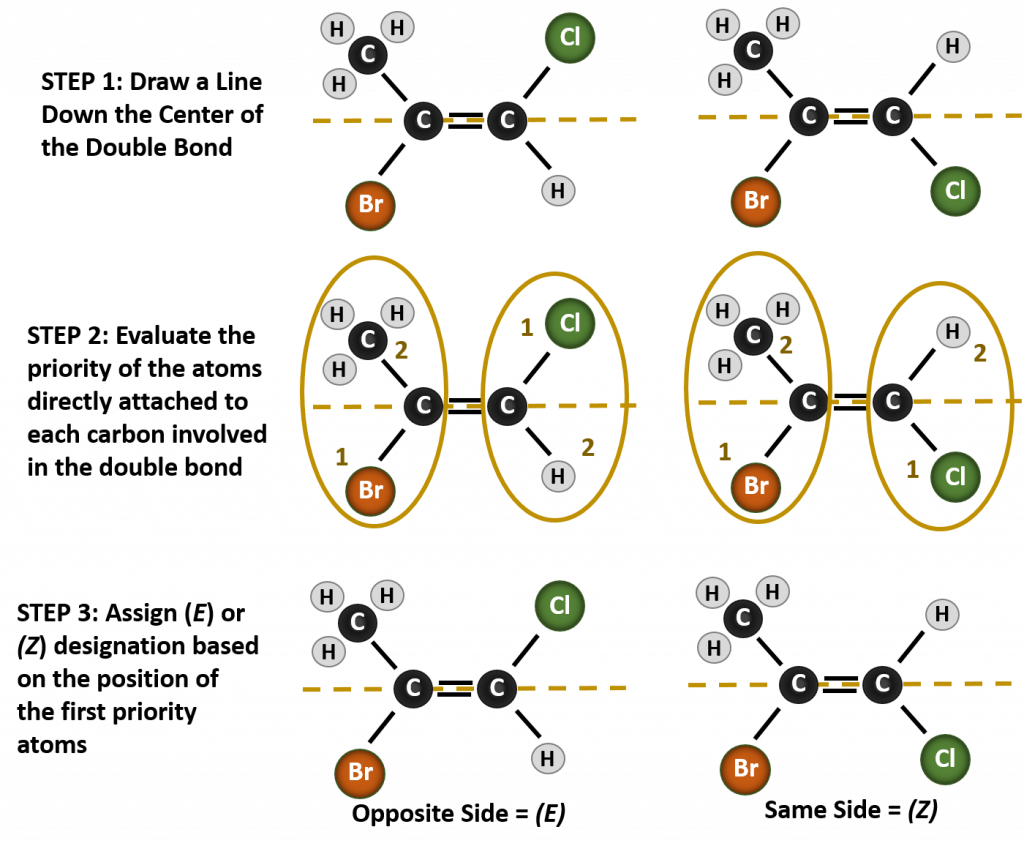
Figura 8.14 Etapele utilizate pentru atribuirea conformațiilor (E) și (Z).
Click aici pentru un tutorial video al Academiei Kahn despre izomerizarea E/Z.
(Notă: Tot conținutul Academiei Khan este disponibil gratuit folosind licența CC-BY-NC-SA la www.khanacademy.org )
(Înapoi sus)
(Înapoi sus).