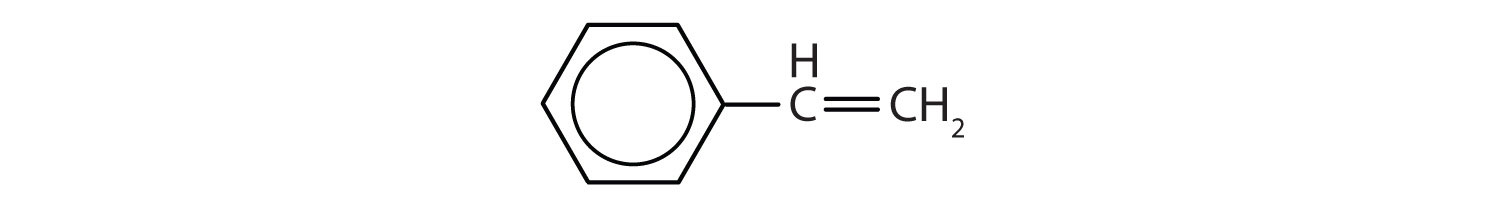
Az aromás szénhidrogéneket úgy határozzuk meg, hogy 6 tagú gyűrűs szerkezetűek, váltakozó kettős kötéssel (8.2. ábra).
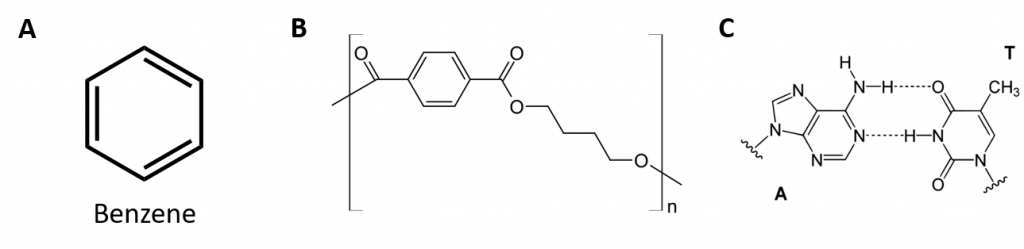
8.2. ábra: Aromás szénhidrogének. Az aromás szénhidrogének 6 tagú benzolgyűrűszerkezetet (A) tartalmaznak, amelyet váltakozó kettős kötések jellemeznek. Az Ultradur, PBT olyan műanyag polimer, amely aromás funkciós csoportot tartalmaz. Az Ultradur ismétlődő monomerje a (B) ábrán látható. Az Ultradur megtalálható a zuhanyfejekben, a fogkefék sörtéiben, az optikai kábelek műanyag burkolatában, valamint az autók külső és belső alkatrészeiben. A biológiailag fontos molekulák, mint például a dezoxiribonukleinsav, a DNS (C) is tartalmaznak aromás gyűrűs szerkezetet.
Ezek képletei tehát ciklikus alkénekként rajzolhatók ki, így telítetlenek. A ciklikus szerkezet miatt azonban az aromás gyűrűk tulajdonságai általában egészen mások, és nem úgy viselkednek, mint a tipikus alkének. Az aromás vegyületek számos gyógyszer, fertőtlenítőszer, robbanóanyag, oldószer és műanyag (pl. poliészterek és polisztirol) alapjául szolgálnak.
A két legegyszerűbb telítetlen vegyületet – az etilént (etén) és az acetilént (etin) – egykor érzéstelenítőként használták, és 1924-ben kerültek be az orvostudományba. Felfedezték azonban, hogy az acetilén robbanásveszélyes keverékeket képez a levegővel, ezért 1925-ben felhagytak orvosi alkalmazásával. Az etilént biztonságosabbnak gondolták, de ez is számos halálos kimenetelű tűz és robbanás okozója volt az altatás során. Ennek ellenére az 1960-as évekig fontos érzéstelenítőszer maradt, amikor felváltották az olyan nem gyúlékony érzéstelenítők, mint a halotán (CHBrClCF3).
- (Vissza a tetejére)
- 8.1 Az alkének és alkinek áttekintése
- (Vissza a tetejére)
- 8.2 Az alkének tulajdonságai
- Nézzük közelebbről: Környezeti jegyzet
- Koncepció áttekintő gyakorlatok
- Válaszok
- Kulcsfogalom
- GYakorlatok
- Válasz
- Koncepció áttekintő gyakorlatok
- Válaszok
- Főbb tanulság
- 8.3 Alkinek
- Megjegyzés
- Koncepció áttekintő gyakorlatok
- Főbb tanulság
- GYakorlatok
- (Vissza a tetejére)
- 8.4 Aromás vegyületek: Benzol
- Jegyzet
- Az egészségre: A benzol és mi
- Koncepció áttekintő gyakorlatok
- Aroma vegyületek felismerése
- Készségfejlesztő gyakorlat
- Főbb tanulság
- (Vissza a tetejére)
- Policiklusos aromás szénhidrogének
- Az Ön egészségére: A policiklikus aromás szénhidrogének és a rák
- Biológiailag fontos benzolgyűrűs vegyületek
- Megjegyzés
- 8.5 Geometriai izomerek
- Kattints ide a Kahn Akadémia alkénszerkezetről szóló videós oktatóanyagáért.
- Cis-Trans nomenklatúra
- Kattints ide a Khan Academy videós oktatóanyagáért a Cis/Trans izomerizációról
- Az egészségedre
- Kattints ide a Kahn Academy videóoktatásáért a telített-, telítetlen- és transzzsírokról
- Key Factors for Determining Cis/Trans Isomerization
- Munkapélda
- Készségfejlesztő gyakorlat
- Koncepció áttekintő gyakorlatok
- Answers
- Key Takeaway
- (Vissza a tetejére)
- E-Z nomenklatúra
- Kattints ide a Khan Academy E/Z izomerizációról szóló videó oktatóanyagáért.
- (Vissza a tetejére)
(Vissza a tetejére)
8.1 Az alkének és alkinek áttekintése
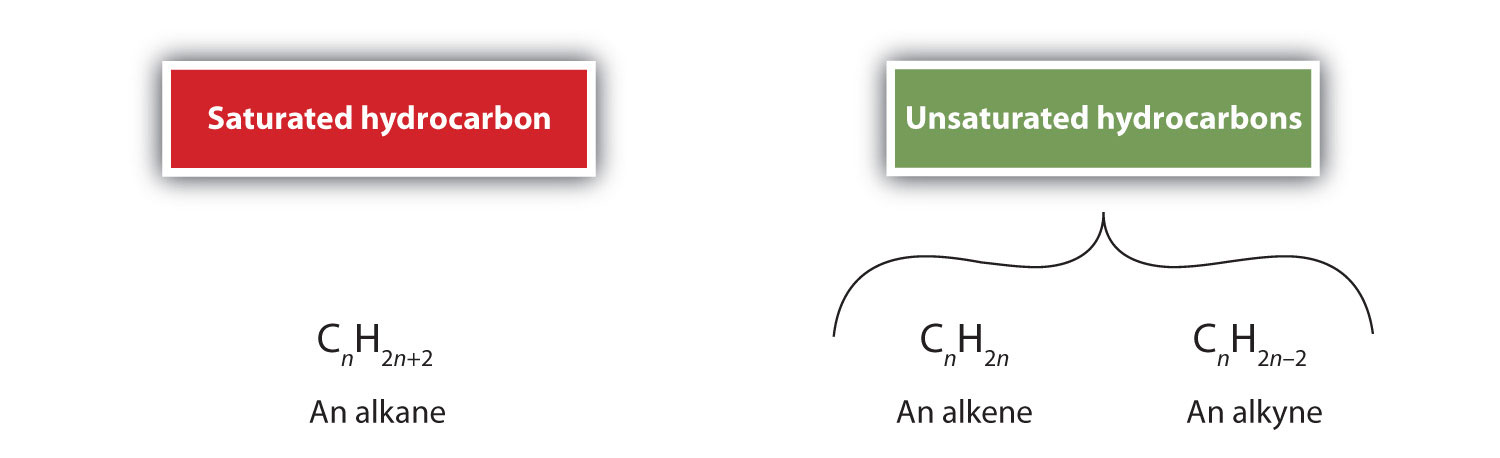
A definíció szerint az alkének olyan szénhidrogének, amelyek egy vagy több szén-szén kettős kötéssel (R2C=CR2), míg az alkinek olyan szénhidrogének, amelyek egy vagy több szén-szén hármas kötéssel (R-C≡C-R) rendelkeznek. Ezeket együttesen telítetlen szénhidrogéneknek nevezzük, amelyeket olyan szénhidrogénekként határozunk meg, amelyek egy vagy többszörös (kettős vagy hármas) kötéssel rendelkeznek a szénatomok között. A kettős vagy hármas kötés jellegéből adódóan az alkének és alkinek kevesebb hidrogénatomot tartalmaznak, mint az azonos számú szénatomot tartalmazó hasonló alkánok. Matematikailag ez a következő általános képletekkel jelezhető:
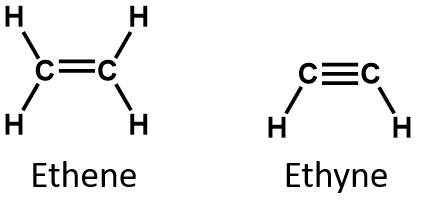
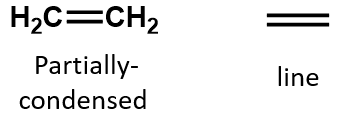
Az alkénben a kettős kötés a két szénatomon osztozik, és nem érinti a hidrogénatomokat, bár a kondenzált képlet nem teszi ezt nyilvánvalóvá, azaz az etén kondenzált képlete CH2CH2. A molekula kettős vagy hármas kötés jellegét még nehezebb a molekuláris képletekből megállapítani. Vegyük észre, hogy az etén molekulaformulája C2H4, míg az etiné C2H2. Ezért amíg nem ismerkedünk meg jobban a szerves kémia nyelvével, gyakran a leghasznosabb, ha vonalas vagy részben kondenzált szerkezeteket rajzolunk ki, ahogy az alábbiakban látható:
(Vissza a tetejére)
8.2 Az alkének tulajdonságai
Az alkének fizikai tulajdonságai hasonlóak az alkánokéhoz. A 8.1. táblázatból látható, hogy az egyenes láncú alkének forráspontja az alkánokhoz hasonlóan a moláris tömeg növekedésével nő. Azonos szénatomszámú és azonos általános alakú molekulák esetében a forráspontok általában csak kis mértékben térnek el egymástól, ahogyan azt olyan anyagok esetében várnánk, amelyek moláris tömege csak 2 u-val (ami két hidrogénatomnak felel meg) tér el egymástól. A többi szénhidrogénhez hasonlóan az alkének is oldhatatlanok vízben, de oldódnak szerves oldószerekben.
Egy pár reprezentatív alként – nevüket, szerkezetüket és fizikai tulajdonságaikat – a 8.1. táblázat tartalmazza.
A 8. táblázat.1 Néhány kiválasztott alkén fizikai tulajdonságai
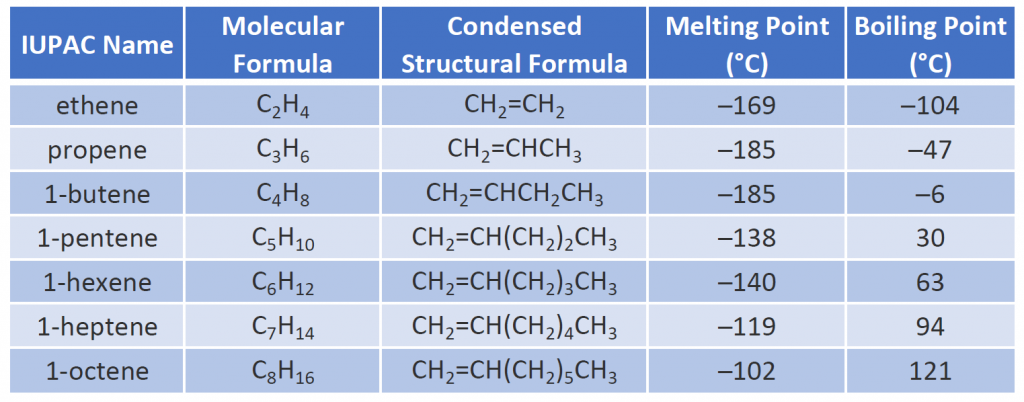
A 8.1. táblázat első két alkénjét – az etént és a propént – leggyakrabban köznapi nevükön – etilénnek, illetve propilénnek – nevezik. Az etilén fontos kereskedelmi vegyi anyag. Az amerikai vegyipar évente mintegy 25 milliárd kilogramm etilént állít elő, többet, mint bármely más szintetikus szerves vegyi anyag. Ennek az etilénnek több mint a fele a polietilén, az egyik legismertebb műanyag előállításához kerül felhasználásra. A propilén szintén fontos ipari vegyi anyag. Műanyagokká, izopropil-alkohollá és számos más termékké alakítják át.
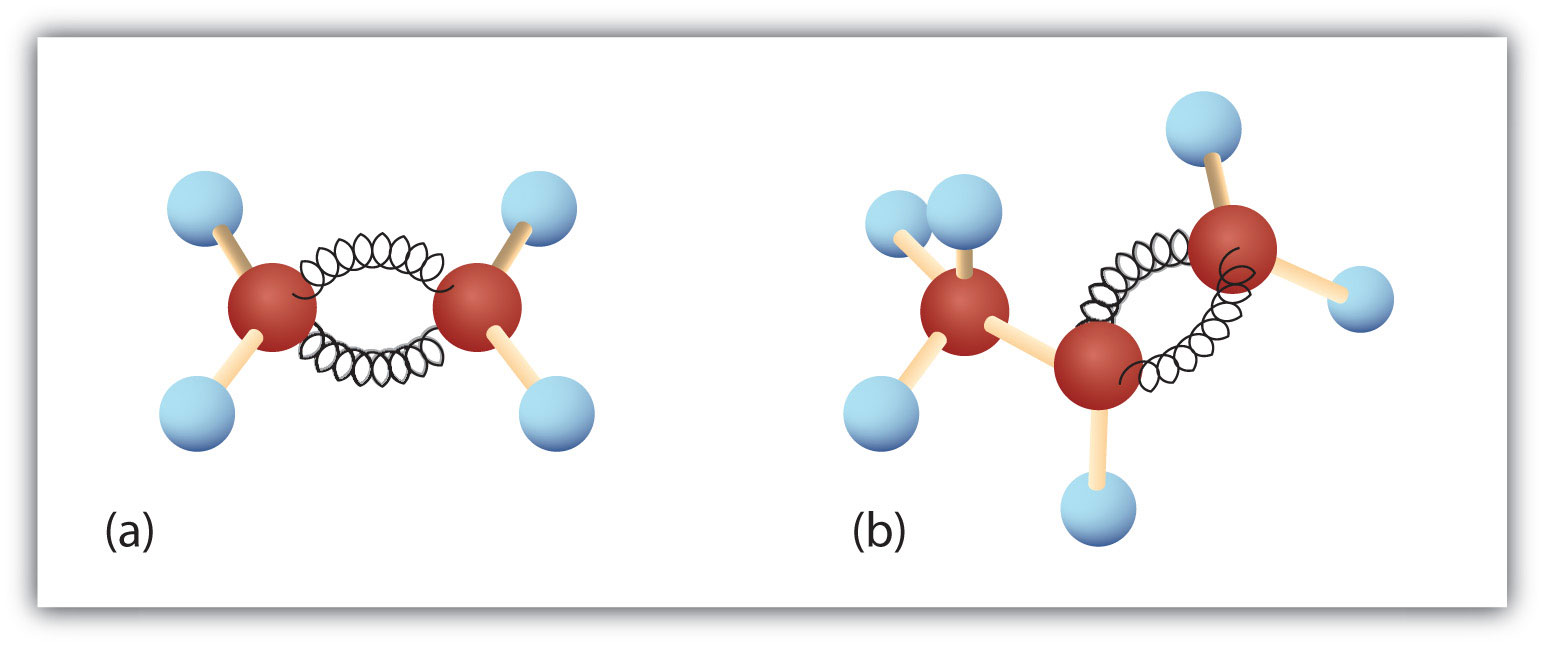
A 8.3. ábra. Etén és propén. Az etén/etilén (a) és a propén/propilén (b) gömb- és rugómodelljei mutatják az alakjukat, különösen a kötésszögeket.
Nézzük közelebbről: Környezeti jegyzet
Az alkének széles körben előfordulnak a természetben. Az érő gyümölcsök és zöldségek etilént bocsátanak ki, ami további érést indít el. A gyümölcsfeldolgozók mesterségesen etilént juttatnak be az érési folyamat meggyorsítása érdekében; már 0,1 mg etilén 24 órán keresztül történő expozíciója 1 kg paradicsomot érlelhet meg. Sajnos ez az eljárás nem pontosan utánozza az érési folyamatot, és a zöldre szedett és így kezelt paradicsom íze nem sokban hasonlít a kertből frissen érlelt szőlőparadicsoméhoz.
A természetben előforduló egyéb alkének közé tartozik az 1-oktén, a citromolaj alkotórésze, és a halmájban található oktadecén (C18H36). A dienek (két kettős kötés) és a poliének (három vagy több kettős kötés) szintén gyakoriak. A butadién (CH2=CHCH=CH=CH2) megtalálható a kávéban. A likopin és a karotinok izomer poliének (C40H56), amelyek a görögdinnye, a paradicsom, a sárgarépa és más gyümölcsök és zöldségek vonzó piros, narancssárga és sárga színét adják. A jó látáshoz nélkülözhetetlen A-vitamin a karotinból származik. A világ sokkal kevésbé lenne színes hely alkének nélkül.

Ábra 8.4. A paradicsom élénkpiros színe a likopinnak köszönhető.
Kép forrása: : © Thinkstock; A likopin szerkezete: Jeff Dahl
Koncepció áttekintő gyakorlatok
-
Röviden ismertesse az alkének fizikai tulajdonságait. Hogyan viszonyulnak ezek a tulajdonságok az alkánokéhoz?
Táblázatok megnézése nélkül rendezze a következő alkéneket a növekvő forráspont szerinti sorrendbe:

Válaszok
-
Az alkének fizikai tulajdonságai (alacsony forráspont, vízben nem oldódnak) meglehetősen hasonlóak a megfelelő alkánokéhoz.
-
etén < propén < 1-butén < 1-hexén
Kulcsfogalom
- Az alkének fizikai tulajdonságai nagyon hasonlítanak az alkánokéhoz: forráspontjuk a moláris tömeg növekedésével nő, és vízben oldhatatlanok.
GYakorlatok
-
Táblázatra vagy más hivatkozásra való hivatkozás nélkül jósolja meg, hogy az egyes párok melyik tagjának magasabb a forráspontja.
- 1-pentén vagy 1-butén
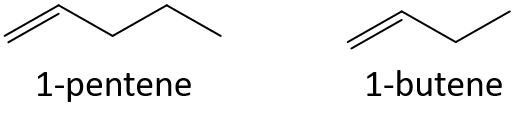
- 3-hepten vagy 3-nonén
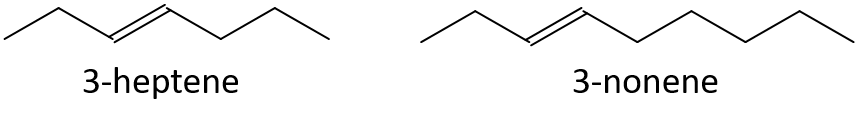
- 1-pentén vagy 1-butén
-
Melyik jó oldószer a ciklohexénnek: a pentán vagy a víz?
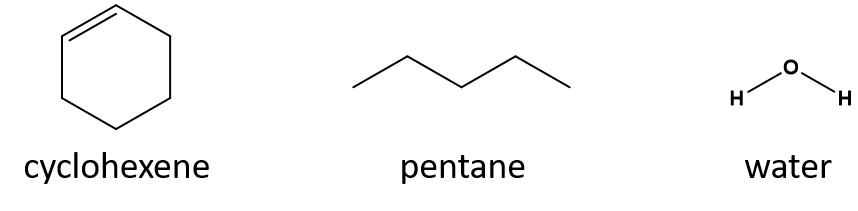
Válasz
-
- 1-penten
- 3-nonén
Koncepció áttekintő gyakorlatok
-
Közölje röviden a telített szénhidrogén és a telítetlen szénhidrogén közötti fontos különbségeket.
-
Röviden azonosítsa az alkén és az alkán közötti fontos különbségeket.
-
Minősítse az egyes vegyületeket telített vagy telítetlen szénhidrogéneknek. Azonosítsa mindegyiket alkánként, alkénként vagy alkinként.
-
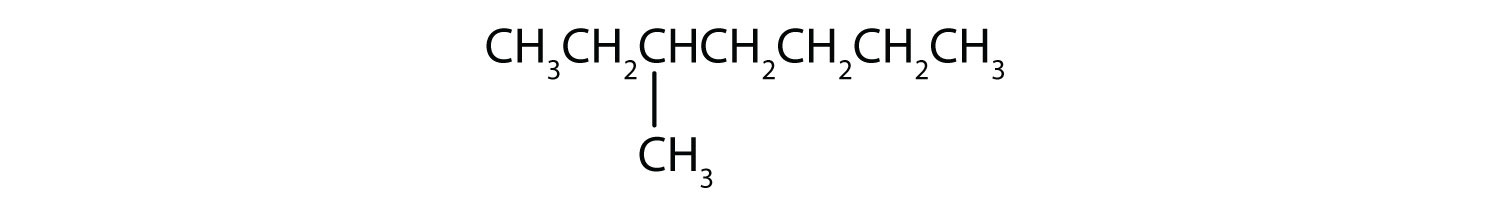
- CH3CH2C≡CCH3
-

-
Válaszok
-
A telítetlen szénhidrogének kettős vagy hármas kötéssel rendelkeznek és meglehetősen reaktívak; A telített szénhidrogéneknek csak egyszeres kötéseik vannak, és meglehetősen reaktívak.
-
Az alkénnek kettős kötése van; az alkánnak csak egyszerű kötései vannak.
-
- telített; alkán
- telítetlen; alkin
- telítetlen; alkén
Főbb tanulság
- Az alkének olyan szénhidrogének, amelyek szén-szén kettős kötéssel rendelkeznek.
8.3 Alkinek
A legegyszerűbb alkinek – szén-szén-háromszoros kötéssel rendelkező szénhidrogének – molekuláris képlete C2H2, és közismert neve acetilén (8.5. ábra). Szerkezete H-C≡C-H.
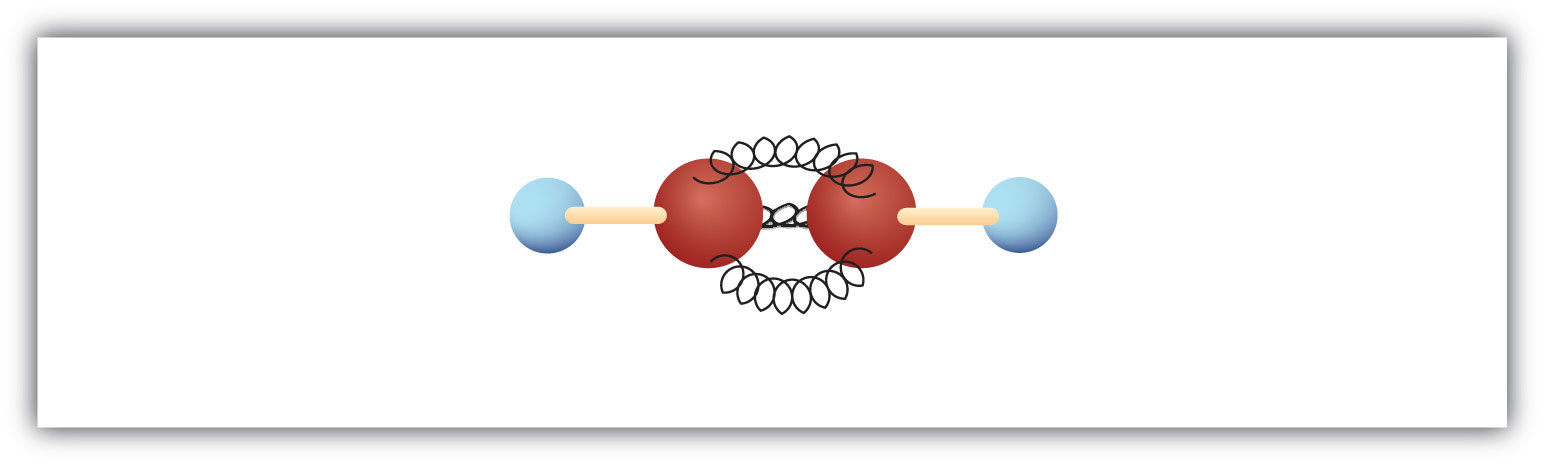
8.5. ábra Az acetilén gömb- és rugómodellje. Az acetilén (etilén) az alkinek családjának legegyszerűbb tagja.
Megjegyzés
Az acetilént a fémek vágására és hegesztésére használt oxacetilénfáklyákban használják. Az ilyen fáklya lángja nagyon forró lehet. A legtöbb acetilén azonban kémiai köztitermékké alakul át, amelyeket vinil- és akrilműanyagok, szálak, gyanták és számos más termék előállítására használnak.
Az alkének mind fizikai, mind kémiai tulajdonságaikban hasonlóak az alkénekhez. Például az alkinek számos, az alkénekre jellemző addíciós reakciót hajtanak végre. Az alkinek Nemzetközi Tiszta és Alkalmazott Kémiai Unió (IUPAC) nevei párhuzamosak az alkének nevével, azzal a különbséggel, hogy a családvégződés -yne és nem -ene. Az acetilén IUPAC-neve etin. Az egyéb alkinek neveit a következő gyakorlatok szemléltetik.
Koncepció áttekintő gyakorlatok
-
Közölje röviden az alkén és az alkin közötti fontos különbségeket. Miben hasonlítanak?
-
Az alként (CH3)2CHCH2CH2CH=CH2 4-metil-1-penténnek nevezik. Mi a (CH3)2CHCHCH2C≡CH neve?
-
Az alkének cisz-transz izomerizmust mutatnak? Magyarázza meg.
Válaszok
-
Az alkéneknek kettős kötésük van, az alkineknek hármas kötésük. Mindkettő addíciós reakciónak megy keresztül.
-
4-metil-1-pentyin
-
Nem; egy háromszorosan kötött szénatom csak egy másik kötést tud kialakítani. Két csoportnak kellene kapcsolódnia ahhoz, hogy cisz-transz izomerizmust mutasson.
Főbb tanulság
- Az alkének szénhidrogének szén-szén hármas kötéssel rendelkező szénhidrogének, amelyek tulajdonságai nagyban hasonlítanak az alkénekéhez.
GYakorlatok
-
Rajzolja le az egyes vegyületek szerkezetét.
- acetilén
- 3-metil-1-hexin
-
Rajzolja le az egyes vegyületek szerkezetét.
- 4-metil-2-hexin
- 3-oktin
-
Nevezze meg az egyes alkineket.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Answers
-
- H-C≡C-H
-
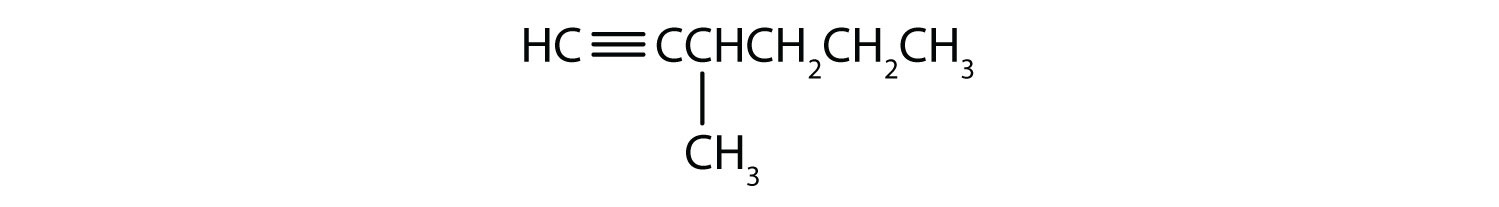
-
- 2-hexyne
(Vissza a tetejére)
8.4 Aromás vegyületek: Benzol
A következőkben a telítetlen szénhidrogénekhez hasonló molekulaformulájú szénhidrogének egy osztályát tekintjük át, amelyek azonban az alkénekkel ellentétben nem mennek át könnyen addíciós reakciókon. Ezek a vegyületek egy külön osztályt alkotnak, amelyet aromás szénhidrogéneknek nevezünk. Az aromás szénhidrogének olyan vegyületek, amelyek benzolgyűrűs szerkezetet tartalmaznak A legegyszerűbb aromás vegyület a benzol (C6H6), és nagy kereskedelmi jelentőséggel bír, de figyelemre méltó egészségkárosító hatásai is vannak (lásd “Az egészségünkre: A benzol és mi”).
A C6H6 képlet látszólag arra utal, hogy a benzol nagyfokú telítetlenséggel rendelkezik. (A hexán, a hat szénatomot tartalmazó telített szénhidrogén képlete C6H14 – nyolc hidrogénatommal több, mint a benzolé). A látszólag alacsony telítettségi szint ellenére azonban a benzol meglehetősen reakcióképtelen. Ez az aromás gyűrű váltakozó kettőskötéses szerkezetéből kialakuló rezonanciaszerkezetnek köszönhető.

Jegyzet
A benzol olyan folyadék, amelynek benzinszaga van, 80 °C-on forr, és 5,5 °C-on fagy meg. Ez a legnagyobb mennyiségben előállított aromás szénhidrogén. Korábban a kávé koffeinmentesítésére használták, és számos fogyasztói termék, például festékeltávolítók, gumicementek és otthoni vegytisztító folteltávolítók jelentős összetevője volt. Az 1950-es években számos termékkészítményből kivonták, de mások továbbra is használták a benzolt a termékekben egészen az 1970-es évekig, amikor is összefüggésbe hozták a leukémiás halálesetekkel. A benzol még mindig fontos szerepet játszik az iparban, mint prekurzor a műanyagok (pl. hungarocell és nejlon), gyógyszerek, mosószerek, szintetikus gumi, peszticidek és színezékek gyártásában. Oldószerként használják például nyomdai berendezések tisztításához és karbantartásához, valamint ragasztókhoz, például a cipőtalpak rögzítéséhez. A benzol a kőolajtermékek természetes alkotóeleme, de mivel ismert rákkeltő, a benzinben adalékanyagként való felhasználása ma már korlátozott.
Az egészségre: A benzol és mi
A kereskedelemben használt benzol nagy része kőolajból származik. Mosószerek, gyógyszerek, színezékek, rovarirtók és műanyagok gyártásának alapanyagaként használják. Az egykor szerves oldószerként széles körben használt benzolról ma már ismert, hogy rövid és hosszú távú mérgező hatásai egyaránt vannak. Nagy koncentrációk belélegzése hányingert és akár légzési vagy szívelégtelenség miatti halált is okozhat, míg az ismételt expozíció progresszív betegséghez vezet, amelyben a csontvelő új vérsejtek létrehozására való képessége végül elpusztul. Ez az aplasztikus vérszegénységnek nevezett állapotot eredményezi, amelyben mind a vörös-, mind a fehérvérsejtek száma csökken.”
Koncepció áttekintő gyakorlatok
-
Miben különböznek a benzol tipikus reakciói az alkének reakcióitól?
-
Írd le röviden a benzol kötéseit.
-
Mit jelent a kör a benzol kémiai ábrázolásában?
Válaszok
-
A benzol egy alkénhez képest meglehetősen reaktív az addíciós reakciókkal szemben.
-
A valenciaelektronokon mind a hat szénatom egyenlően osztozik (vagyis az elektronok delokalizáltak).
-
A hat elektronon mind a hat szénatom egyenlően osztozik.
Aroma vegyületek felismerése
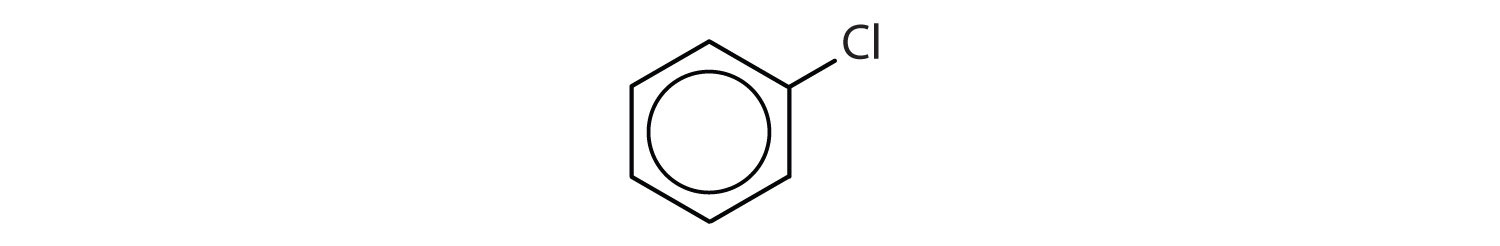
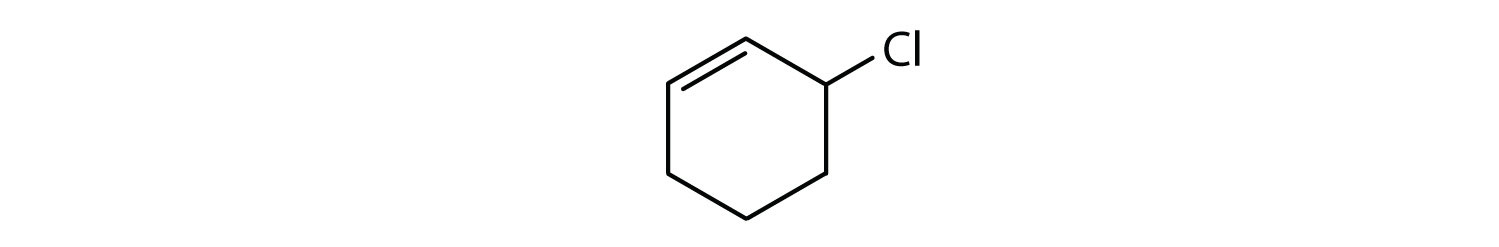
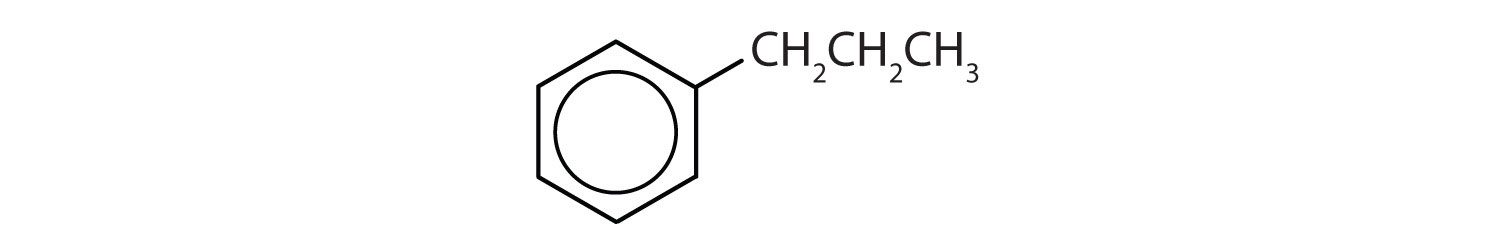
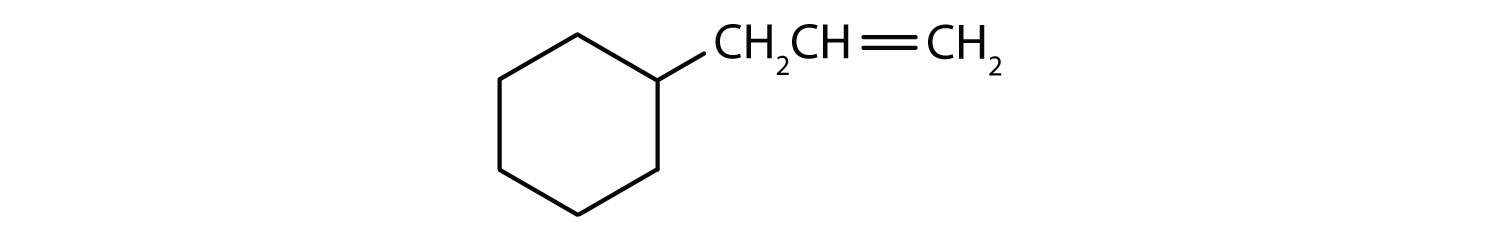
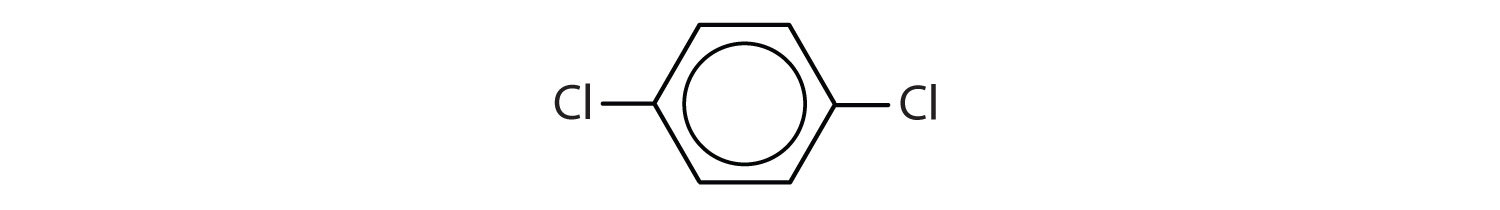
Mely vegyületek aromásak?
Solution
- A vegyületben egy benzolgyűrű van (az egyik hidrogénatomot egy klóratommal helyettesítve); aromás.
- A vegyület ciklikus, de nincs benzolgyűrűje; nem aromás.
- A vegyületnek benzolgyűrűje van (az egyik hidrogénatomot propilcsoporttal helyettesítve); aromás.
- A vegyület ciklikus, de nincs benzolgyűrűje; nem aromás.
Készségfejlesztő gyakorlat
Mely vegyületek aromásak?
A Nemzetközi Tiszta és Alkalmazott Kémiai Unió (IUPAC) rendszerében az aromás szénhidrogéneket a benzol származékainak nevezik. Az alábbiakban öt példát mutatunk be. Ezekben a szerkezetekben mindegy, hogy az egyetlen szubsztituens a gyűrű tetejére, oldalára vagy aljára van-e írva: a hatszög szimmetrikus, ezért minden pozíció egyenértékű.
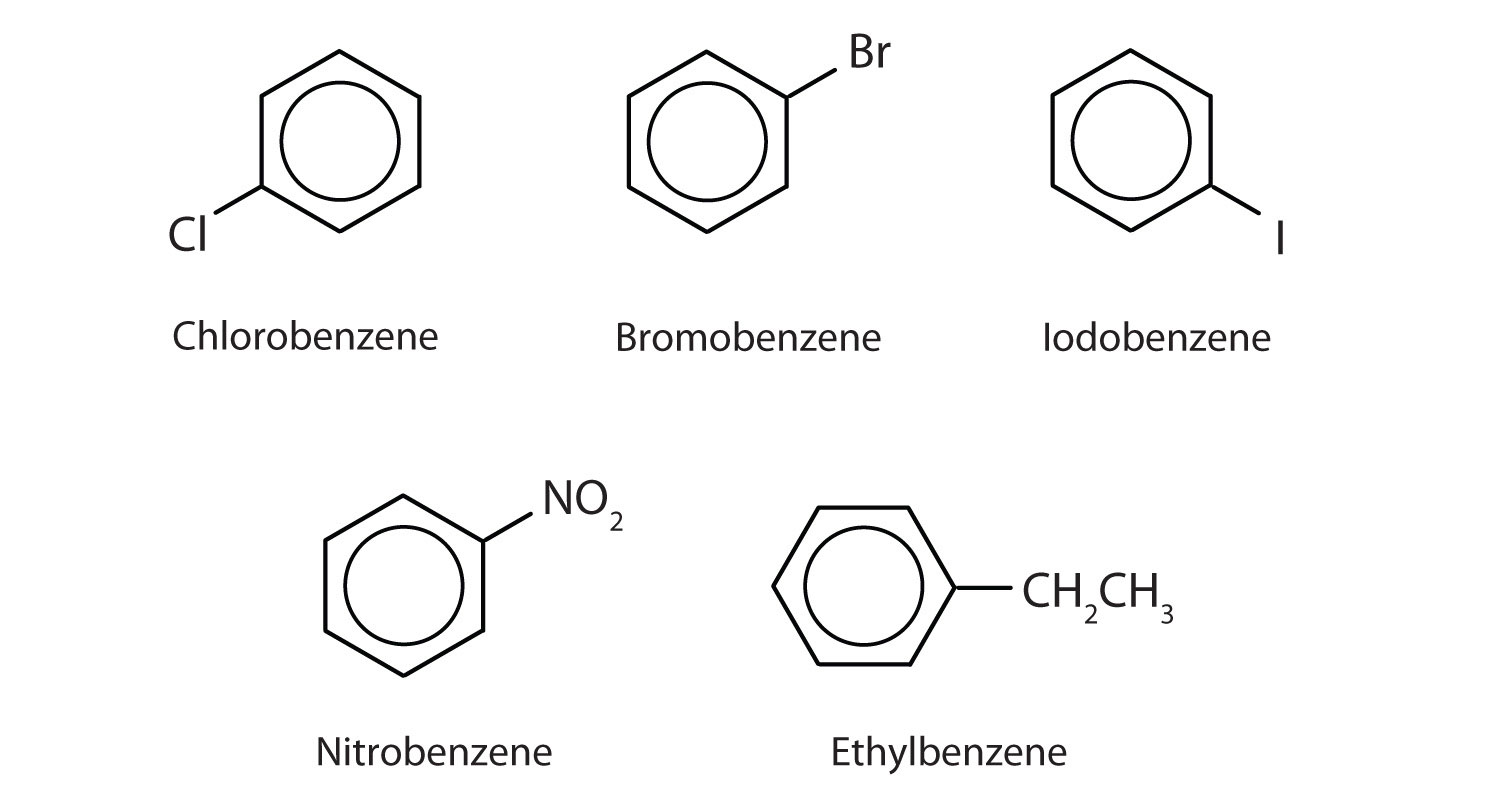
Egy hidrogénatomot helyettesítő csoportot szubsztituenscsoportként nevezzük meg a szokásos módon: Cl mint klór, Br mint bróm, I mint jód, NO2 mint nitro, és CH3CH2 mint etil.
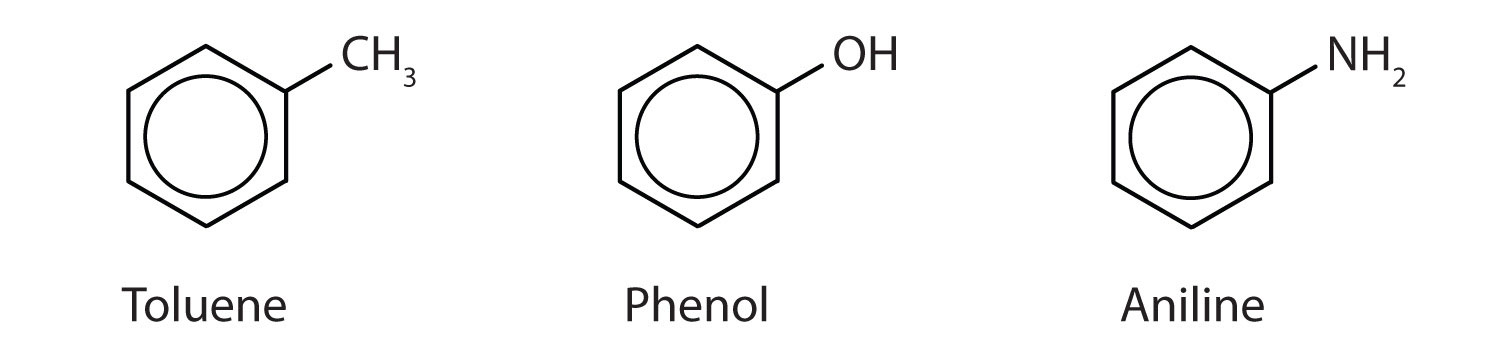
Bár egyes vegyületekre kizárólag az IUPAC-nevek utalnak, néhányat gyakrabban jelölnek köznapi nevekkel, amint az alább látható.
-
Főbb tanulság
- Az aromás szénhidrogének látszólag telítetlenek, de különleges kötéstípusuk van, és nem mennek át addíciós reakciókon.
(Vissza a tetejére)
Policiklusos aromás szénhidrogének
Néhány gyakori aromás szénhidrogén fuzionált benzolgyűrűkből-gyűrűkből áll, amelyeknek közös oldala van. Ezeket a vegyületeket nevezzük policiklusos aromás szénhidrogéneknek (PAH)A közös oldalon osztozó fuzionált benzolgyűrűkből álló aromás szénhidrogén..
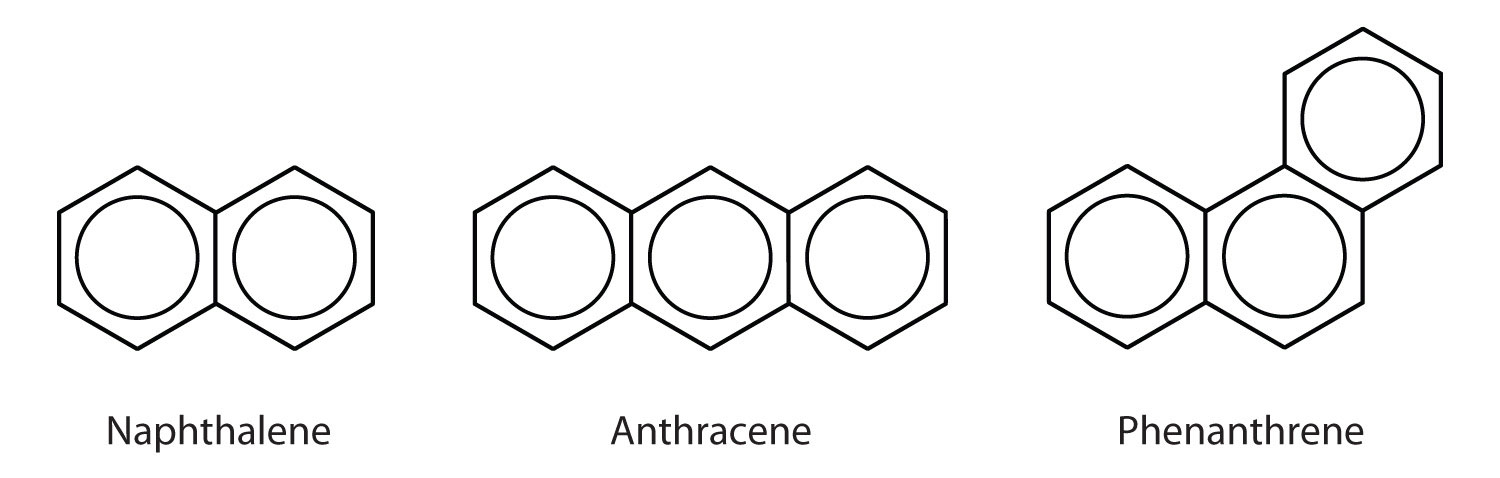
Az itt bemutatott három példa színtelen, kristályos szilárd anyag, amelyet általában kőszénkátrányból nyernek. A naftalin szúrós szagú, és molyirtókban használják. Az antracént bizonyos színezékek előállításához használják. A szteroidok, beleértve a koleszterint és a hormonokat, az ösztrogént és a tesztoszteront, fenantrén szerkezetűek.
Az Ön egészségére: A policiklikus aromás szénhidrogének és a rák
A kőszénkátrány lepárlásához szükséges intenzív hevítés PAH-ok képződését eredményezi. Sok éve ismert, hogy a kőszénkátrány-finomítókban dolgozók hajlamosak a bőrrák egy olyan típusára, amelyet kátrányráknak neveznek. A vizsgálatok kimutatták, hogy számos PAH rákkeltő. Az egyik legaktívabb rákkeltő vegyület, a benzopirén a kőszénkátrányban fordul elő, és izolálták cigarettafüstből, marihuánafüstből, gépjárművek kipufogógázaiból és faszénen sült steakekből is. Becslések szerint évente több mint 1000 tonna benzopirén kerül a levegőbe az Egyesült Államokban. Csak néhány milligramm benzopirénre van szükség testsúlykilogrammonként ahhoz, hogy kísérleti állatokban rákot idézzen elő.
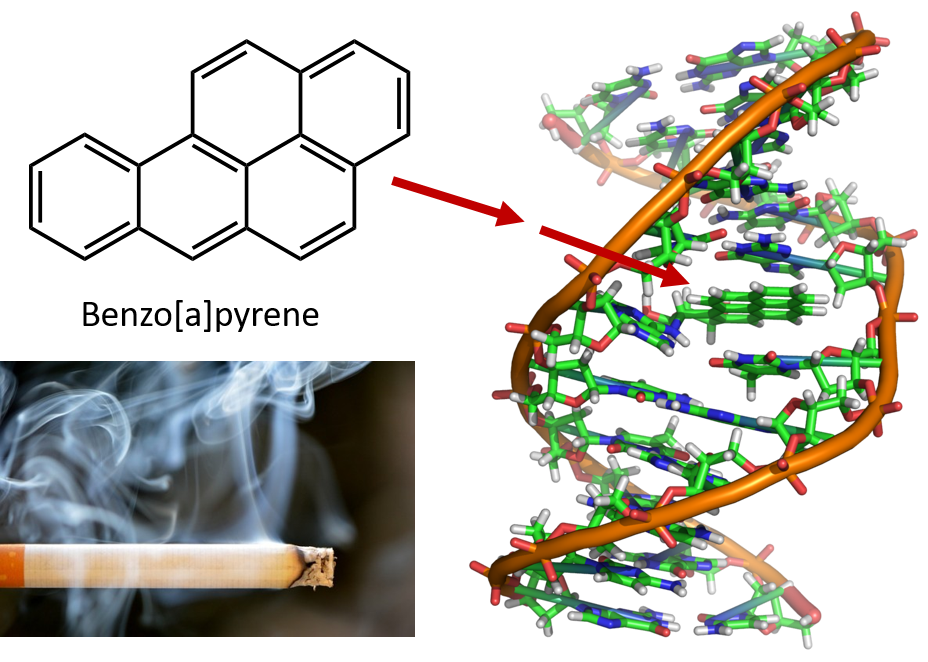
8.6. ábra A benzopirén egy policiklusos aromás szénhidrogén, amely a szénkátrányban, a cigaretta- és marihuánafüstben, valamint a faszénen sült steakekben keletkezik melléktermékként. A benzopirén metabolizálódása során biológiailag aktív vegyületek keletkeznek, amelyek fizikai adduktokat képezhetnek a DNS-molekulákon. Ezek az adduktok genetikai mutációkat okozhatnak, amelyek rákot okoznak.
Fotó cigarettafüstről
Biológiailag fontos benzolgyűrűs vegyületek
A benzolgyűrűt tartalmazó anyagok gyakoriak az állatokban és a növényekben egyaránt, bár az utóbbiakban nagyobb mennyiségben fordulnak elő. A növények szén-dioxidból, vízből és szervetlen anyagokból képesek szintetizálni a benzolgyűrűt. Az állatok nem képesek szintetizálni, de a túlélésükhöz bizonyos aromás vegyületektől függenek, ezért azokat a táplálékból kell beszerezniük. A fenilalanin, a tirozin és a triptofán (esszenciális aminosavak), valamint a K-, B2- (riboflavin) és B9-vitamin (folsav) mind tartalmazzák a benzolgyűrűt. Számos fontos gyógyszer, amelyek közül néhányat a 8.2. táblázat mutat be, szintén benzolgyűrűt tartalmaz.
Megjegyzés
Eleddig csak a széntartalmú gyűrűket tartalmazó aromás vegyületeket vizsgáltuk. Sok ciklikus vegyület gyűrűjében azonban a szénatomokon kívül más elem is található. Azokat a szerves gyűrűs szerkezeteket, amelyek a széntől eltérő atomot tartalmaznak, heterociklusos vegyületeknek nevezzük, A heterociklusos aromás vegyületek egyedi és orvosilag releváns tulajdonságokkal is rendelkeznek.
8. táblázat.2 Néhány benzolgyűrűt tartalmazó gyógyszer
| Név | Szerkezet |
|---|---|
| aspirin |
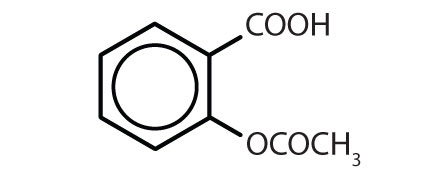 |
| acetaminofen |
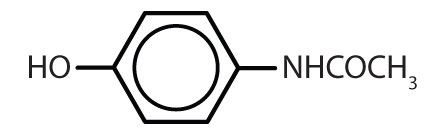 |
| ibuprofen |
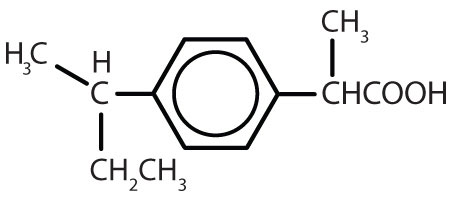 |
| amphetamin |
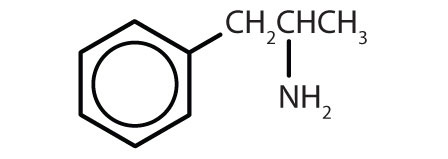 |
| szulfanilamid |
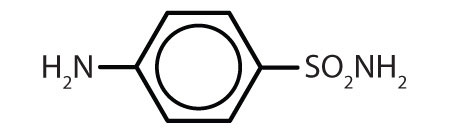 |
8.5 Geometriai izomerek
Az alkánszerkezetben szabad forgás van a szén és szén közötti egyszerű kötések (C-C) körül. Ezzel szemben az alkének szerkezete megköveteli, hogy a szénatomok kettős kötést alkossanak. Az elemek közötti kettős kötések p-orbitális héjak (más néven pi-orbitálisok) segítségével jönnek létre. Ezek az orbitális héjak az egyszerű kötéseknél használt kör alakú orbitálisok helyett inkább súlyzók alakúak. Ez megakadályozza a szénatomok szabad forgását a kettős kötés körül, mivel a forgás során a kettős kötés elszakadna (8.7. ábra). Így az egyszerű kötés analóg két, egy szöggel egymáshoz szegezett deszkával. A deszkák szabadon forognak az egyetlen szög körül. A kettős kötés viszont analóg két, két szöggel egymáshoz szögezett deszkával. Az első esetben el lehet csavarni a deszkákat, míg a második esetben nem lehet elforgatni őket.

8.7. ábra A kettős kötések kialakításához pi-kötések használata szükséges. Ahhoz, hogy a molekulák kettős kötéseket hozzanak létre, az elektronoknak átfedő pi-orbitálisokat kell megosztaniuk a két atom között. Ez megköveteli, hogy a galamb alakú pi-orbitálisok (balra látható) a kettős kötés kialakulása során rögzített konformációban maradjanak. Ez lehetővé teszi olyan elektronpályák kialakulását, amelyeket mindkét atom megoszthat (jobbra látható). A kettős kötés körüli elforgatás a pi-orbitálisok elferdülését okozná, ami a kettős kötés felbontását eredményezné.
A diagram forrása: JoJanderivatív munka – Vladsinger (talk)
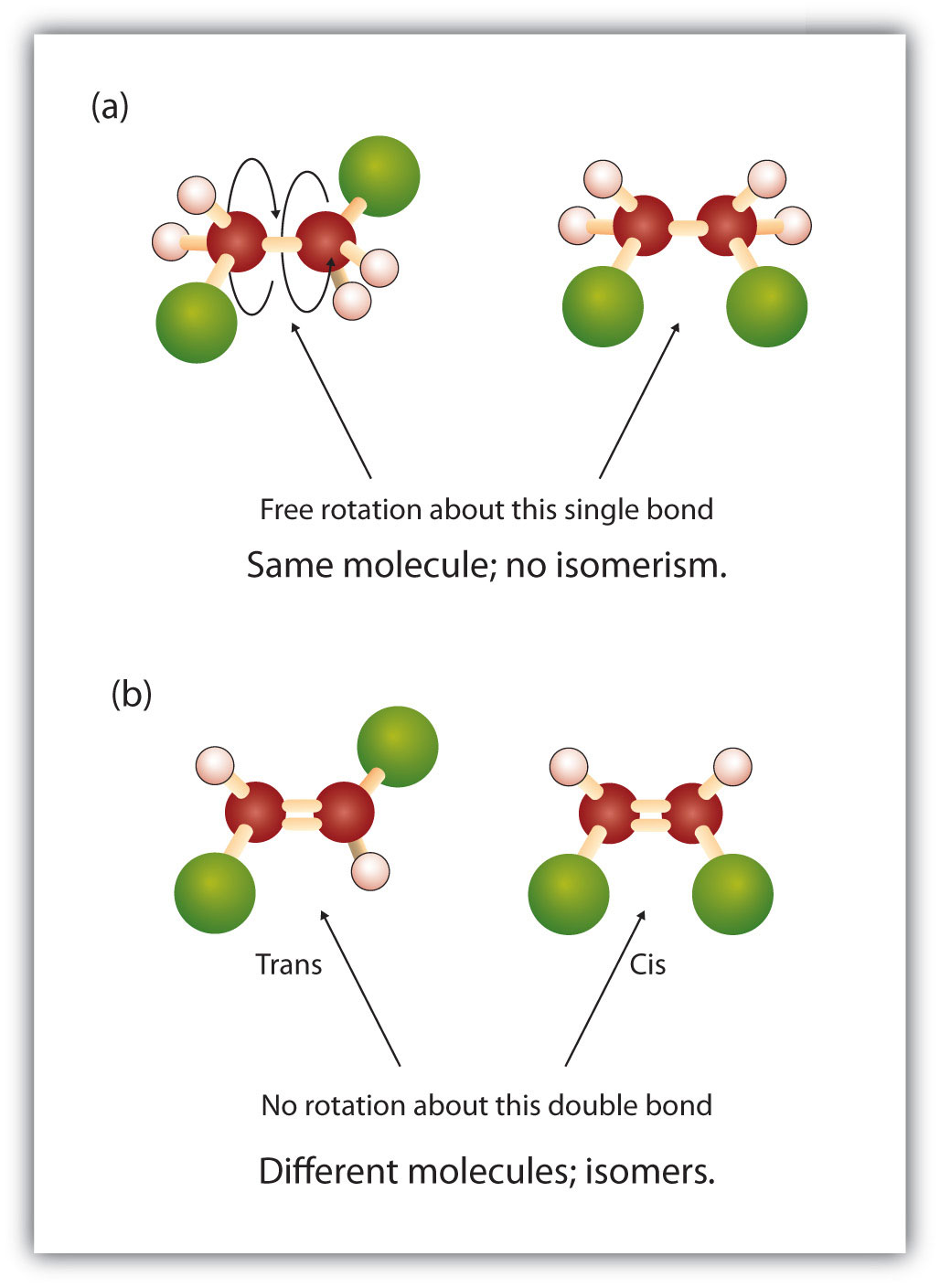
A kettős kötés rögzített és merev természete egy további királis centrum lehetőségét teremti meg, és így a sztereoizomerek lehetőségét. Új sztereoizomerek akkor alakulnak ki, ha a kettős kötésben részt vevő szénatomok mindegyikéhez két különböző atom vagy csoport kapcsolódik. Nézzük például a 8.8. ábrán látható két klórozott szénhidrogént. A felső ábrán a halogénezett alkán látható. E szén-szén kötés körüli forgás lehetséges, és nem eredményez különböző izomer-konformációkat. Az alsó ábrán a halogénezett alkénnél a kettős kötés körüli forgás korlátozott. Figyeljük meg azt is, hogy a kettős kötésben részt vevő minden egyes szén két különböző atomhoz (egy hidrogénhez és egy klórhoz) is kapcsolódik. Így ez a molekula két sztereoizomert alkothat: az egyikben a két klóratom a kettős kötés azonos oldalán van, a másikban pedig a klóratomok a kettős kötés ellentétes oldalán helyezkednek el.
8.8. ábra Az alkén kettőskötései geometriai izomereket képezhetnek. (a) Az alkánszerkezetben a szén-szén kettős kötés körüli szabad forgást mutatja. (b) A szén-szén kettős kötés rögzített helyzetét mutatja, amely geometriai (térbeli) izomerek kialakulásához vezet.
Kattints ide a Kahn Akadémia alkénszerkezetről szóló videós oktatóanyagáért.
Ezért a szakaszért nem foglalkozunk az elnevezéssel, amely szintén szerepel ebben a videós oktatóanyagban.(Megjegyzés: A Khan Academy minden tartalma ingyenesen elérhető CC-BY-NC-SA licenceléssel a www.khanacademy.org )
Cis-Trans nomenklatúra
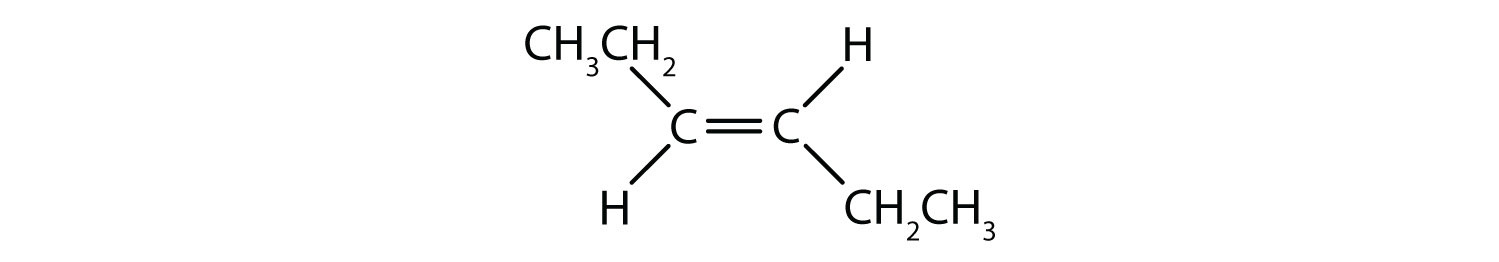
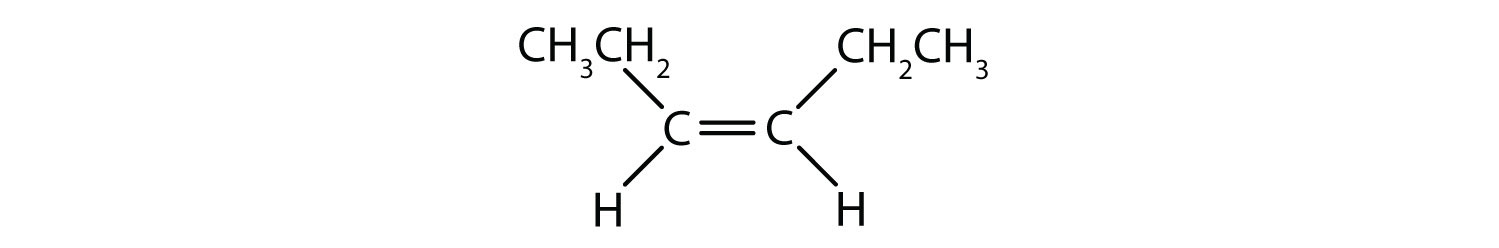
A cis-trans elnevezési rendszer az egyszerű izomerek megkülönböztetésére használható, ahol a kettős kötés minden szénatomjához egy sor azonos csoport kapcsolódik. Például a 8.8b ábrán a kettős kötésben részt vevő minden egyes szénhez egy klór és egy hidrogén is kapcsolódik. A cisz- és transz-rendszer azonosítja, hogy az azonos csoportok a kettős kötés azonos oldalán (cisz) vagy a kettős kötés ellentétes oldalán (transz) helyezkednek el. Például, ha a hidrogénatomok a kettős kötés ellentétes oldalán vannak, akkor a kötésről azt mondjuk, hogy transz konformációban van. Ha a hidrogéncsoportok a kettős kötés azonos oldalán vannak, akkor a kötés cisz-konformációban van. Vegyük észre, hogy azt is mondhatjuk, hogy ha mindkét klórcsoport a kettős kötés ellentétes oldalán van, akkor a molekula transz-konformációban van, vagy ha a kettős kötés azonos oldalán vannak, akkor a molekula cisz-konformációban van.
Az annak megállapításához, hogy egy molekula cisz vagy transz, hasznos, ha a kettős kötés közepén szaggatott vonalat húzunk, majd bekarikázzuk az azonos csoportokat, ahogyan a 8.9. ábrán látható. A 8.9. ábrán látható mindkét molekulát 1,2-diklór-eténnek nevezzük. A cisz- és transz-jelölés tehát csak a kettős kötés körüli sztereokémiát határozza meg, a molekula általános azonosságát nem változtatja meg. A cisz- és transz-izomerek azonban gyakran eltérő fizikai és kémiai tulajdonságokkal rendelkeznek, a kötések térbeli rögzítettsége miatt.
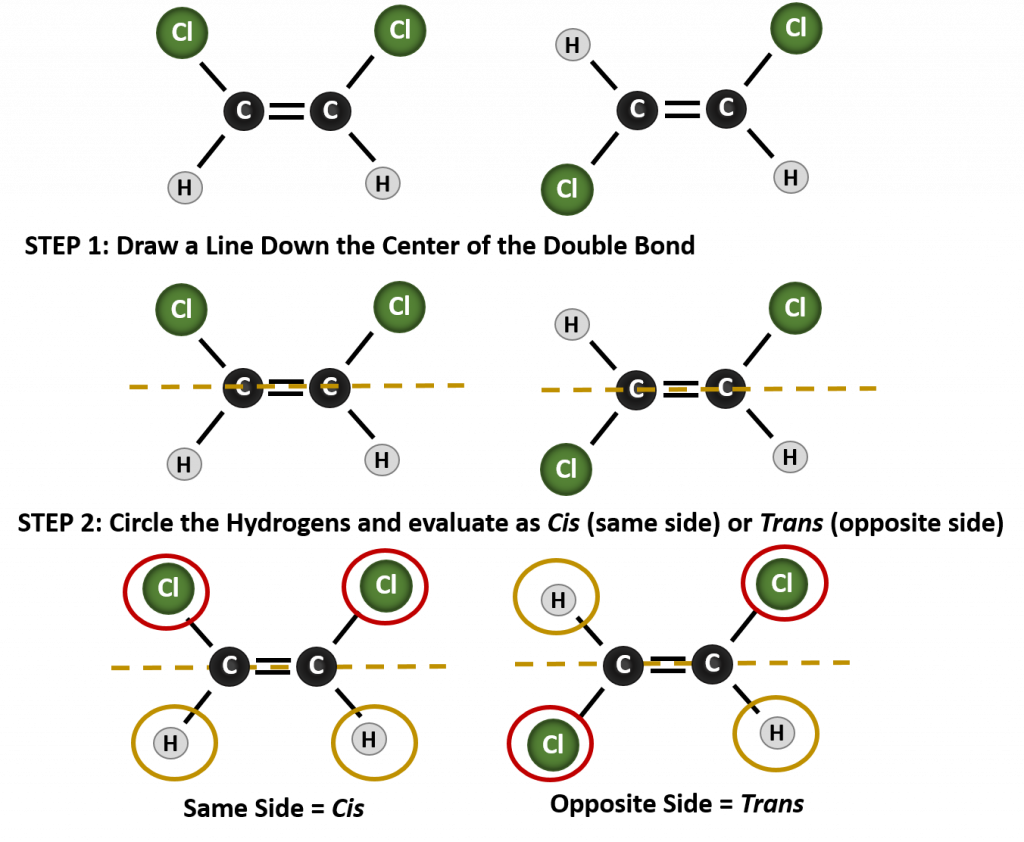
8.9. ábra Útmutató a cisz- vagy transzkonformációk meghatározásához.
Kattints ide a Khan Academy videós oktatóanyagáért a Cis/Trans izomerizációról
(Megjegyzés: A Khan Academy minden tartalma ingyenesen elérhető CC-BY-NC-SA licenceléssel a www.khanacademy.org )
A cisz-transz izomerizmus ciklikus vegyületekben is előfordul. A gyűrűs szerkezetekben a csoportok nem képesek elfordulni a gyűrű egyik szén-szén kötése körül sem. Ezért a csoportok vagy a gyűrű azonos oldalán (cisz), vagy a gyűrű ellentétes oldalán (transz) helyezkedhetnek el. Az alábbiakban minden cikloalkánt síkbeli szerkezetként ábrázolunk, és a csoportok helyzetét a gyűrű síkja felett vagy alatt jelöljük.

Az egészségedre
A mindennapi életben talán a leggyakrabban a szupermarketben vagy az orvosi rendelőben hallasz utalást a cisz-transz konformációra. Ez az étkezési zsírok fogyasztásával kapcsolatos. Az étkezési zsírok nem megfelelő vagy túlzott fogyasztását számos egészségügyi rendellenességgel hozták összefüggésbe, például a cukorbetegséggel, az érelmeszesedéssel és a szívkoszorúér-betegséggel. Mi a különbség tehát a telített és a telítetlen zsírok között, és mik a transzzsírok, és miért jelentenek akkora egészségügyi problémát?

8.10. ábra A táplálékzsírok gyakori forrásai.
Fotó: TyMaHe
A táplálékzsírok leggyakoribb formája és az emberek és más állatok testzsírjának fő alkotóelemei a trigliceridek (TAG-ek). A 8.10. ábrán látható TAG-ok egy molekula glicerinből és három molekula zsírsavból épülnek fel, amelyek észterkötéssel kapcsolódnak egymáshoz. Ebben a szakaszban a hosszú zsírsavvégek szerkezetére összpontosítunk, amelyek alkán- vagy alkénszerkezetekből állhatnak. A 10. fejezetben inkább az észterkötések kialakulására fogunk koncentrálni.

8.11. ábra. Példa egy triglicerid (TAG) szerkezetére. Vegyük észre, hogy minden trigliceridben három hosszú láncú zsírsav nyúlik ki a glicerin gerincéből. Az egyes zsírsavak különböző telítettségi és telítetlenségi fokúak lehetnek.
Szerkezet adaptálva: Wolfgang Schaefer
A teljesen telített zsíroknak csak hosszú láncú alkánfarkú zsírsavai lesznek. Ezeket hidrogénatomokkal “telítettnek” mondjuk. A telített zsírok gyakoriak az amerikai étrendben, és megtalálhatók a vörös húsokban, a tejtermékekben, mint a tej, a sajt és a vaj, a kókuszolaj, és számos pékáruban. A telített zsírok szobahőmérsékleten általában szilárd halmazállapotúak. Ennek oka, hogy a hosszú láncú alkánok több intermolekuláris londoni diszperziós erővel képesek egymásra rakódni. Ennek köszönhetően a telített zsírok olvadás- és forráspontja magasabb, mint a sok növényi olajban található telítetlen zsíroké.
A természetben található telítetlen zsírok többsége cisz-konformációban van, amint azt a 8.11. ábra mutatja. Megjegyezzük, hogy a 8.11. ábrán látható zsírsavak a könnyebbség kedvéért lettek lerajzolva, hogy könnyen áttekinthetőek legyenek, és ne foglaljanak túl sok helyet a papíron, de a felírt kötésszögek nem adják vissza megfelelően a molekulák valódi térbeli orientációját. Ha a 8.11. ábrán látható TAG zsírsavakat helyes kötésszögekkel rajzoljuk meg, könnyen látható, hogy a cisz-kettős kötések kanyarulatokat okoznak az alkénláncban (8.12. ábra).
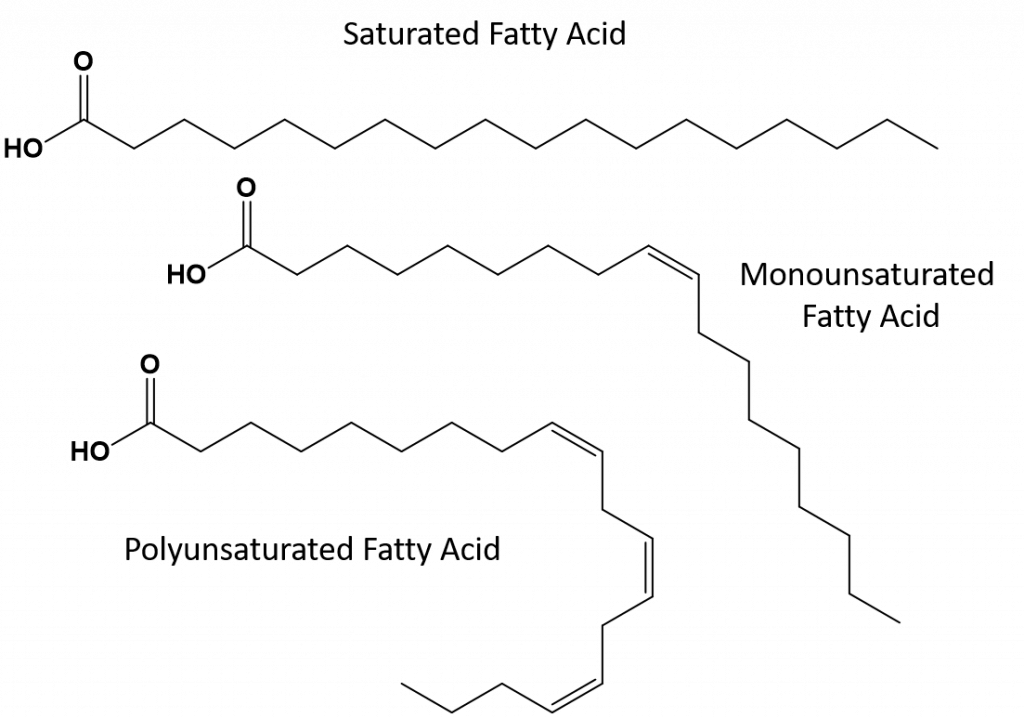
8. ábra.12 Cisz-kettős kötések hajlításokat okoznak a zsírsavak szerkezetében
Az egyszeresen telítetlen és a többszörösen telítetlen zsírok tehát nem tudnak olyan könnyen egymásra rakódni, és a telített zsírokhoz képest nincs annyi molekulák közötti vonzóerő. Ennek eredményeként alacsonyabb az olvadáspontjuk és a forráspontjuk, és szobahőmérsékleten inkább folyadékok. Kimutatták, hogy a telített zsírok csökkentése vagy helyettesítése az étrendben egyszeresen és többszörösen telítetlen zsírokkal segít csökkenteni a koleszterin alacsony sűrűségű lipoprotein (LDL) formájának szintjét, amely a koszorúér-betegség kockázati tényezője.
A transz-zsírok viszont olyan kettős kötéseket tartalmaznak, amelyek transz-konformációban vannak. Így a zsírsavak alakja lineáris, hasonlóan a telített zsírokhoz. A transzzsírok olvadási és forráspontja is hasonló a telített zsírokhoz képest. A telített zsírokkal ellentétben azonban a transzzsírok nem fordulnak elő gyakran a természetben, és negatív hatással vannak az egészségre. A transzzsírok főként az élelmiszer-feldolgozás (főként a margarinok és zsiradékok előállítására szolgáló hidrogénezési folyamat) vagy a főzés, különösen a mélyzsíros sütés során keletkező melléktermékként fordulnak elő. Valójában sok gyorsétterem használ transzzsírokat a mélyzsíros sütési folyamat során, mivel a transzzsírok sokszor felhasználhatók, mielőtt ki kellene őket cserélni. A transzzsírok fogyasztása növeli a szervezet LDL-koleszterinszintjét (a rossz koleszterin, amely összefüggésbe hozható a szívkoszorúér-betegséggel), és csökkenti a nagy sűrűségű lipoprotein (HDL) koleszterinszintet (a jó koleszterin a szervezetben). A transzzsírok fogyasztása növeli a szívbetegségek és a stroke, valamint a II. típusú cukorbetegség kialakulásának kockázatát. A kockázat olyan nagymértékben korrelált, hogy számos ország betiltotta a transzzsírok használatát, köztük Norvégia, Svédország, Ausztria és Svájc. Az Egyesült Államokban az Élelmiszer- és Gyógyszerügyi Hivatal (FDA) a közelmúltban fogadta el azt az intézkedést, hogy 2018-ig fokozatosan megszünteti a transzzsírok használatát az élelmiszerekben. Ez az intézkedés a becslések szerint évente 20 000 szívrohamot és 7 000 halálesetet előz meg.
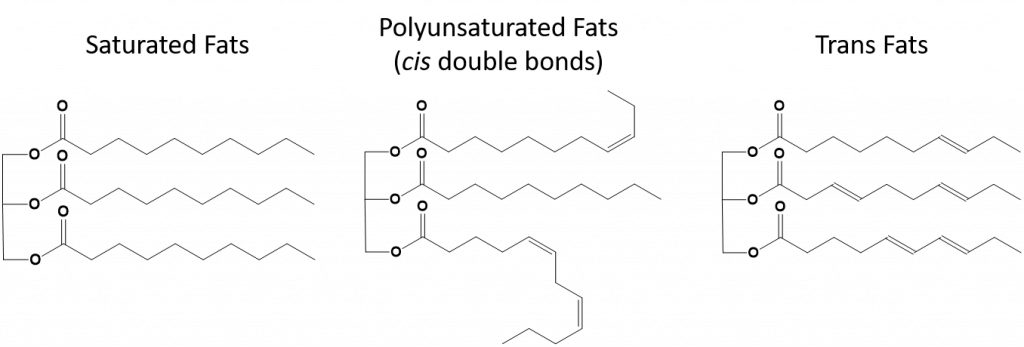
8.13. ábra A telített, a többszörösen telítetlen és a transzzsírok szerkezeti különbségei.
Kattints ide a Kahn Academy videóoktatásáért a telített-, telítetlen- és transzzsírokról
(Megjegyzés: A Khan Academy minden tartalma ingyenesen elérhető a CC-BY-NC-SA licenc alapján a www.khanacademy oldalon.org )
Key Factors for Determining Cis/Trans Isomerization
- A vegyületnek kettős vagy hármas kötést kell tartalmaznia, vagy olyan gyűrűszerkezettel kell rendelkeznie, amely nem teszi lehetővé a szabad forgást a szén-szén kötés körül.
- A vegyületnek két nem azonos csoportnak kell kapcsolódnia a szén-szén kettős vagy hármas kötésben részt vevő minden egyes szénhez.
Munkapélda
Mely vegyületek létezhetnek cisz-transz (geometriai) izomerben? Rajzolja le őket.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CHCHCH2CH3
megoldás
Mind a négy szerkezetben van kettős kötés, így megfelelnek a cis-trans izoméria 1. szabályának.
-
Ez a vegyület megfelel a 2. szabálynak; minden szénatomon két nem azonos csoport van (H és Cl az egyiken, H és Br a másikon). Létezik cisz- és transz-izomerként is:

- Ennek a vegyületnek az egyik kétszeresen kötött szénatomján két hidrogénatom van; nem felel meg a 2. szabálynak, és nem létezik cisz- és transz-izomerként.

- Ennek a vegyületnek az egyik kétszeresen kötött szénatomján két metil (CH3) csoport van. Nem felel meg a 2. szabálynak, és nem létezik cisz- és transz-izomerként.

-
Ez a vegyület megfelel a 2. szabálynak; minden szénatomján két nem azonos csoport található, és cisz- és transz-izomerként is létezik:

Készségfejlesztő gyakorlat
-
Mely vegyületek létezhetnek cisz-transz izomerként? Rajzolja le őket!
- CH2=CHCH2CH2CH2CH3
- CH3CH=CHCH2CH3
- CH3CH2CH=CHCH2CH3
-
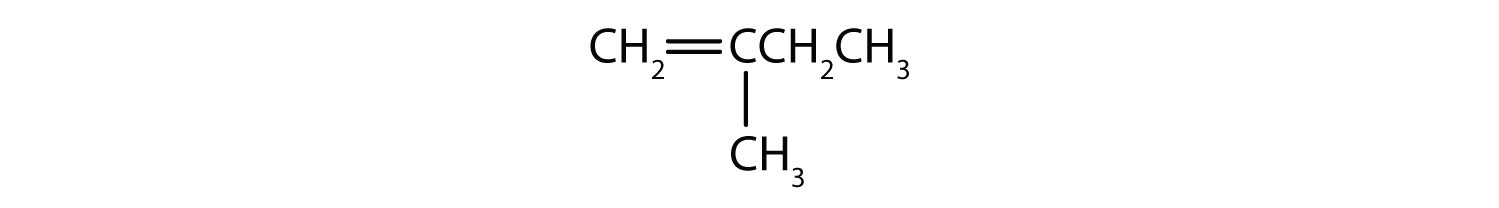
-
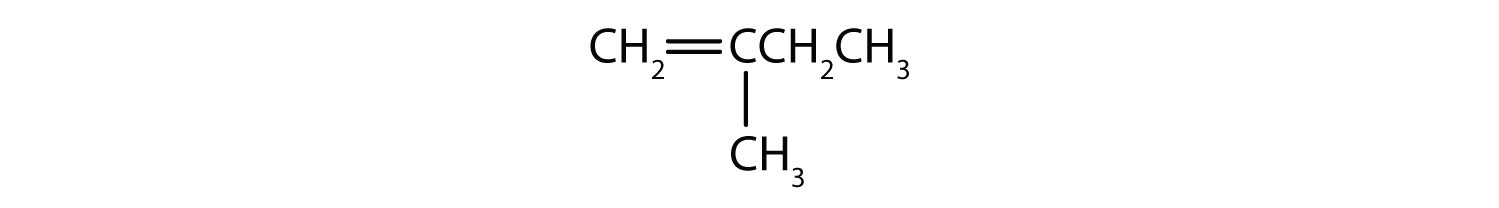
-
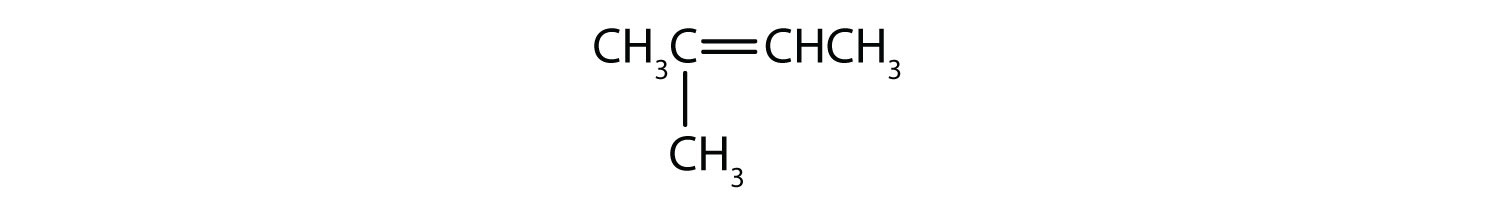
Koncepció áttekintő gyakorlatok
-
Mi az a cisz-?transz (geometriai) izomerek? Milyen kétféle vegyülettípus mutathat cisz-transz izomerizmust?
-
Besorolja az egyes vegyületeket cisz-izomer, transz-izomer vagy egyik sem.
-
Answers
-
Cis-A transz-izomerek olyan vegyületek, amelyek a molekulájukban lévő merev szerkezet miatt különböző konfigurációjúak (a térben állandóan különböző helyen lévő csoportok). Az alkének és a ciklikus vegyületek cisz-transz izomerizmust mutathatnak.
-
- trans
- cis
- cis
- neither
Key Takeaway
- Cis-transz (geometriai) izoméria akkor áll fenn, ha egy molekulában korlátozott forgás van, és minden szénatomon két különböző csoport vesz részt a kémiai kötésben.
(Vissza a tetejére)
E-Z nomenklatúra
A helyzet bonyolultabbá válik, ha a kettős kötés kialakításában részt vevő szénatomokhoz 4 különböző csoport kapcsolódik. A cisz-transz elnevezési rendszer ebben az esetben nem használható, mert nincs utalás arra, hogy mely csoportokat írja le a nómenklatúra. Például az alábbi molekulában mondhatjuk, hogy a klór transz a brómcsoporthoz, vagy mondhatjuk, hogy a klór cisz a metil (CH3) csoporthoz. Így az egyszerű cisz vagy transz írás ebben az esetben nem jelöli ki egyértelműen a csoportok térbeli orientációját a kettős kötéshez képest.
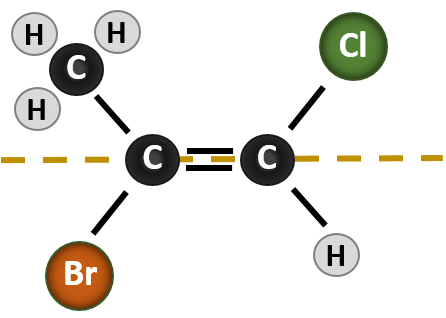
Az ebben a helyzetben kialakuló különböző sztereoizomerek megnevezéséhez a prioritási szabályok ismerete szükséges. Emlékezzünk vissza az 5. fejezetből, hogy a Cahn-Ingold-Prelog (CIP) prioritási rendszerben a királis szénhez kapcsolódó csoportok atomszámuk (Z) alapján kapnak prioritást. A magasabb atomszámú (több protont tartalmazó) atomok magasabb prioritást kapnak (azaz S > P > O > N > C > H). Ebben a nómenklatúra-rendszerben a cis/trans rendszer helyett a (Z) és (E) jelöléseket használjuk. Az (E) a német entgegen, azaz ellentétes szóból származik. Így amikor a magasabb prioritású csoportok a kettős kötés ellentétes oldalán vannak, a kötésről azt mondjuk, hogy (E) konformációban van. A (Z) viszont a német zusammen, azaz együtt szóból származik. Ha tehát a magasabb prioritású csoportok a kettős kötés azonos oldalán vannak, akkor a kötés (Z) konformációban van. A 8.14. ábra mutatja a molekula (E) vagy (Z) konformációjának hozzárendeléséhez használt lépéseket.
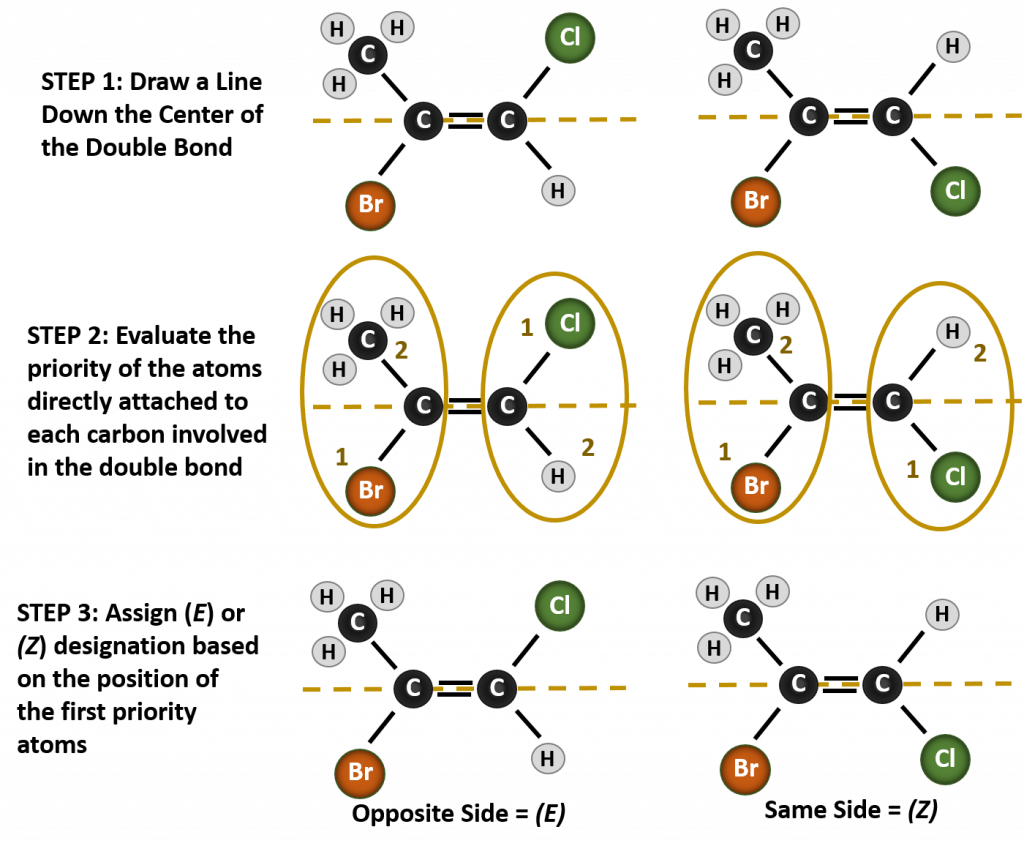
8.14. ábra Az (E) és (Z) konformáció hozzárendelésének lépései.
Kattints ide a Khan Academy E/Z izomerizációról szóló videó oktatóanyagáért.
(Megjegyzés: A Khan Academy minden tartalma ingyenesen elérhető CC-BY-NC-SA licenceléssel a www.khanacademy.org )