芳香族炭化水素は、二重結合が交互に並ぶ6員環構造である(図8.2)。
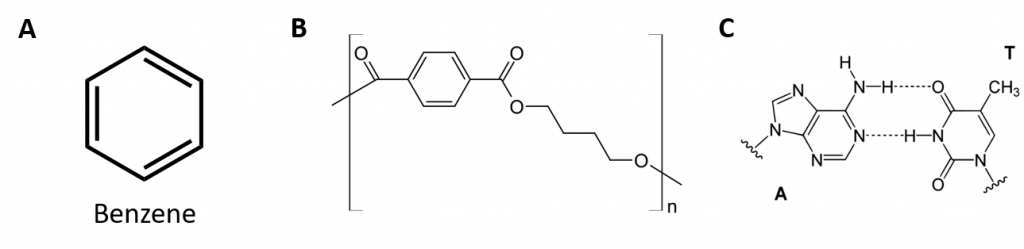
図8.2: 芳香族炭化水素。 芳香族炭化水素は6員環のベンゼン環構造(A)を持ち、二重結合が交互に並んでいるのが特徴である。 Ultradur, PBTは、芳香族官能基を持つプラスチックポリマーである。 ウルトラデュールの繰り返しモノマーを(B)に示す。 シャワーヘッド、歯ブラシの毛、光ファイバーケーブルのプラスチックハウジング、自動車の外装・内装部品などに使用されている。 DNA(C)のような生物学的に重要な分子も芳香環構造をもっており、
このように環状アルケンとして描ける式を持っているので、不飽和である。 しかし、芳香環は環状構造のため、一般に性質が大きく異なり、典型的なアルケンとして振る舞うことはない。 芳香族化合物は多くの医薬品、防腐剤、爆薬、溶剤、プラスチック(ポリエステルやポリスチレンなど)の基礎となっている。
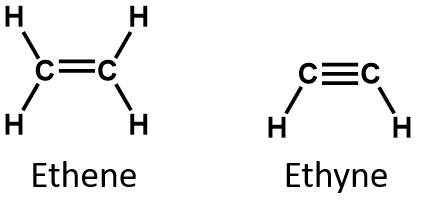
最も単純な不飽和化合物のエチレン(エテン)とアセチレン(エチレン)はかつて麻酔薬として用いられ、1924年に医学界へ導入された。 しかし、アセチレンは空気と爆発的な混合物を作ることがわかり、1925年に医療用としての使用を断念した。 エチレンはより安全性が高いと考えられたが、これも麻酔時の火災や爆発事故が多発した。 それでも1960年代まで重要な麻酔薬であり続け、ハロタン(CHBrClCF3)のような不燃性の麻酔薬に取って代わられた。
- (上に戻る)
- 8.1 アルケンとアルキンの概要
- (Back to the Top)
- 8.2 Alkenesの性質
- Looking Closer.の項参照。 環境ノート
- コンセプトレビュー演習
- 答え
- 演習
- 答え
- Concept Review Exercises
- 答え
- Key Takeaway
- 8.3 アルキン
- 注
- Concept Review Exercises
- Key Takeaway
- Exercises
- (Back to Top)
- 8.4 芳香族化合物 ベンゼン
- 注
- あなたの健康へ。 ベンゼンと私たち
- Concept Review Exercises
- 芳香族化合物を認識する
- Skill-Building Exercise
- Key Takeaway
- (上に戻る)
- 多環芳香族炭化水素
- Biologically Important Compounds with Benzene Rings
- Note
- 8.5 幾何異性体
- ここをクリックすると、アルケンの構造に関するカーンアカデミーのビデオチュートリアルがあります。
- Cis-Trans Nomenclature
- シス/トランス異性化に関するカーン アカデミー ビデオ チュートリアルはこちら
- To Your Health
- 飽和脂肪酸、不飽和脂肪酸、トランス脂肪酸に関するカーン アカデミー ビデオ チュートリアルはこちら
- Cis/Trans 異性化を決定する重要な要素
- 実例
- スキルアップ演習
- コンセプトレビュー演習
- 答え
- Key Takeaway
- Key Takeaway
- (上に戻る)
- E-Z Nomenclature
- E/Z異性化に関するカーンアカデミーのビデオチュートリアルはこちら
- (Back to the Top)
(上に戻る)
8.1 アルケンとアルキンの概要
定義によると、アルケンは炭素-炭素二重結合(R2C=CR2)を1つ以上持つ炭化水素であり、アルキンは炭素-炭素三重結合(R-C≡C-R)を1つ以上持つ炭化水素です。 これらを総称して不飽和炭化水素と呼び、炭素原子間に1つ以上の複数(二重または三重)結合を持つ炭化水素と定義される。 二重・三重結合を持つため、アルケン、アルキンは同じ炭素原子数のアルカンに比べて水素原子の数が少なくなっている。 数学的には、これは次の一般式で示されます:
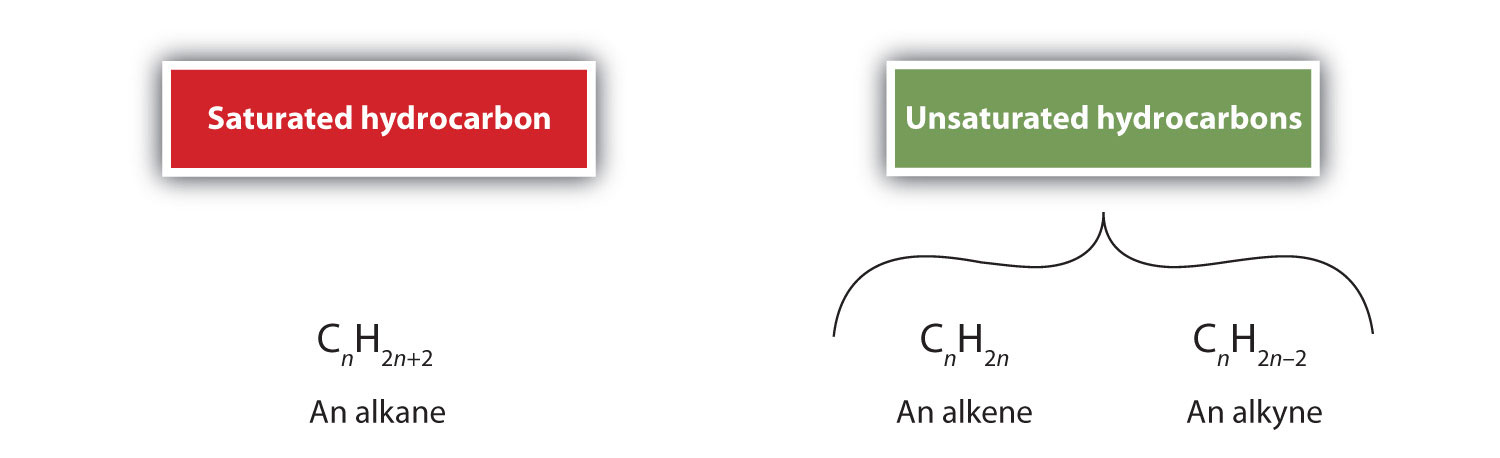
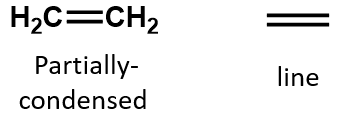
アルケンでは、二重結合は2つの炭素原子によって共有され、水素原子は関与しませんが、縮合式ではこの点は明らかではありません(たとえばエテンの縮合式はCH2CH2です)。 分子の二重結合や三重結合の性質は、分子式から見分けるのはさらに困難である。 エテンの分子式はC2H4だが、エチンの分子式はC2H2であることに注意したい。 したがって、有機化学の言語に慣れるまでは、次のように線状または部分的に縮合した構造を描くのが最も有効な場合が多い:
(Back to the Top)
8.2 Alkenesの性質
Alkenesの物性もアルカンと同様で、アルカンの場合は、分子式がC2H4である。 表8.1に示すように、直鎖アルケンの沸点はアルカンと同様、モル質量の増加とともに上昇する。 同じ数の炭素原子と同じ一般的な形状を持つ分子では、モル質量が2u(水素原子2個に相当)しか違わない物質で予想されるように、沸点は通常わずかに異なるだけである。 他の炭化水素と同様に、アルケンは水に溶けないが、有機溶媒には溶ける。
代表的なアルケンの名称、構造、物性を表8.1に示す。1 Some Selected Alkenes
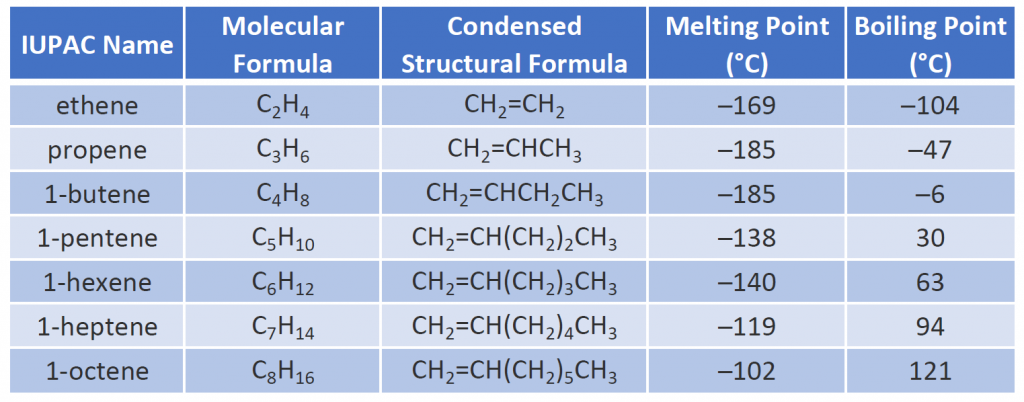
表8.1の最初の二つのアルケン-エテンとプロペンは、一般名-それぞれエチレンとプロピレンで最もよく呼ばれています。 エチレンは主要な商業化学物質である。 米国の化学産業は年間約250億キログラムのエチレンを生産しており、これは他のどの有機合成化学品よりも多い。 このエチレンの半分以上は、最も身近なプラスチックの一つであるポリエチレンの製造に使われる。 また、プロピレンは重要な工業薬品である。 プラスチックやイソプロピルアルコールなど、さまざまな製品に変換される。
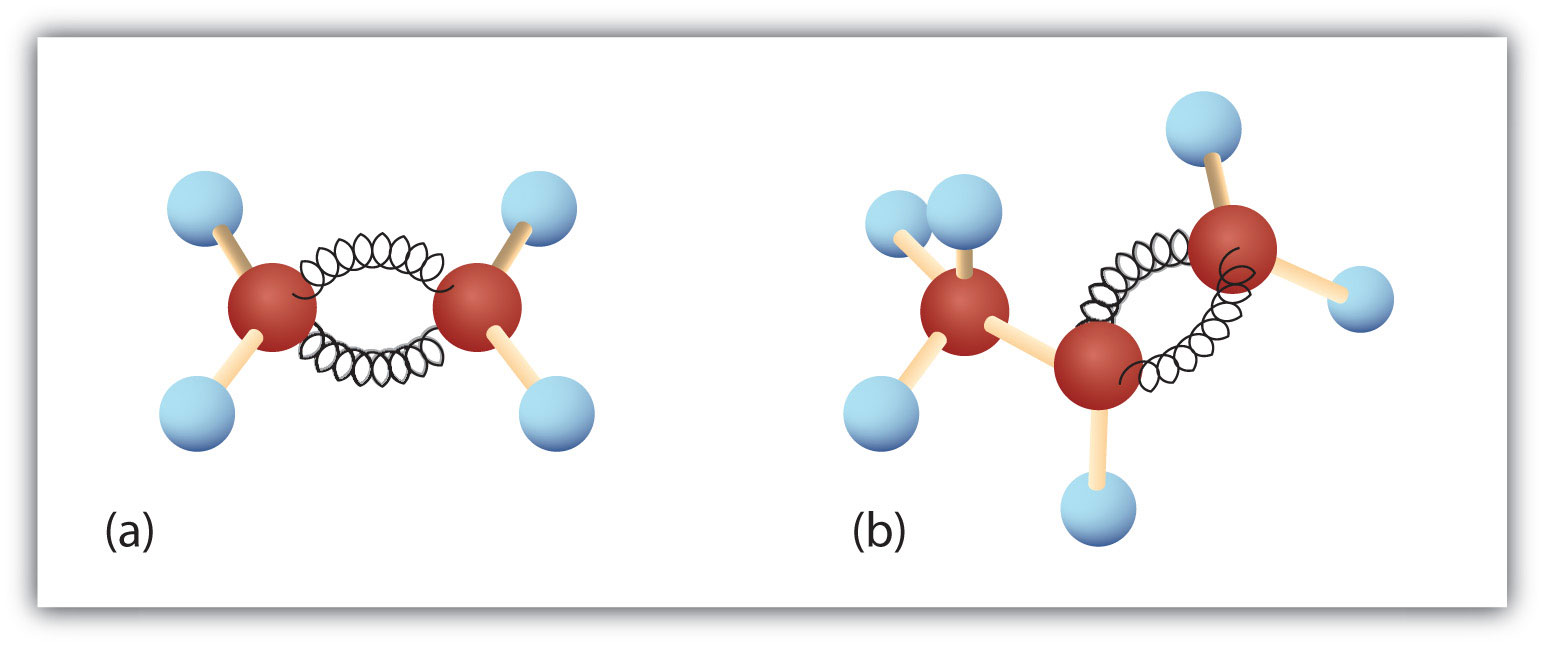
図8.3. エテンとプロペン エテン/エチレン(a)とプロペン/プロピレン(b)のボールとバネのモデルで、それぞれの形状、特に結合角を示す。
Looking Closer.の項参照。 環境ノート
アルケンは自然界に広く存在します。 熟した果物や野菜はエチレンを放出し、これがさらなる熟成の引き金となる。 果物加工業者は熟成を早めるために人工的にエチレンを導入します。わずか0.1mgのエチレンを24時間暴露するだけで、1kgのトマトを熟成させることができるのです。 残念ながら、この方法は熟成の過程を正確に再現しておらず、青く摘んだトマトをこの方法で処理しても、庭で収穫したばかりのブドウの熟したトマトの味には遠く及びません。
自然界に存在する他のアルケンとしては、レモンオイルの成分である1-オクテンや、魚の肝臓に含まれるオクタデセン(C18H36)などが挙げられます。 また、二重結合が2つあるジエンや3つ以上あるポリエンもよく見られる。 ブタジエン(CH2=CHCH=CH2)は、コーヒーに含まれる。 リコピンやカロテンは異性体のポリエン(C40H56)で、スイカ、トマト、ニンジン、その他の果物や野菜に魅力的な赤、オレンジ、黄色の色を与えている。 視力を維持するために必要なビタミンAもカロテンが原料となっている。

図8.4 トマトの鮮やかな赤色はリコピンによるものです。
写真:© Thinkstock; リコピンの構造:Jeff Dahl
コンセプトレビュー演習
-
アルケンの物性を簡単に説明する。 これらの特性はアルカンの特性と比較してどうでしょうか。
-
以下のアルケンを沸点の高い順に並べなさい:

答え
-
アルケンはそのアルカンにかなり似た性質(低い沸点、水に不溶)を持っています。
-
ethene < propene < 1-butene < 1-hexene
- アルケンはアルカンの物理特性とほぼ同じ、モル量の増加とともに沸点も上がり、また水に溶けにくい性質があります。
演習
-
表などを参考にせず、それぞれの組のどちらが沸点が高いか予想しなさい。
- 1-ペンテンまたは1-ブテン
- 3-ヘプテンまたは3-ノネン
- 1-ペンテンまたは1-ブテン
-
シクロヘキセンに対して良い溶媒はペンタンと水とどちらですか?
答え
-
- 1-ペンテン
- 3-。nonene
Concept Review Exercises
-
saturated hydrocarbon と unsaturated hydrocarbon の違いを簡単に説明しなさい。
-
アルケンとアルカンの重要な違いを簡単に説明せよ。
-
それぞれの化合物を飽和または不飽和に分類しなさい。 アルカン、アルケン、アルキンのいずれかに分類してください。
-
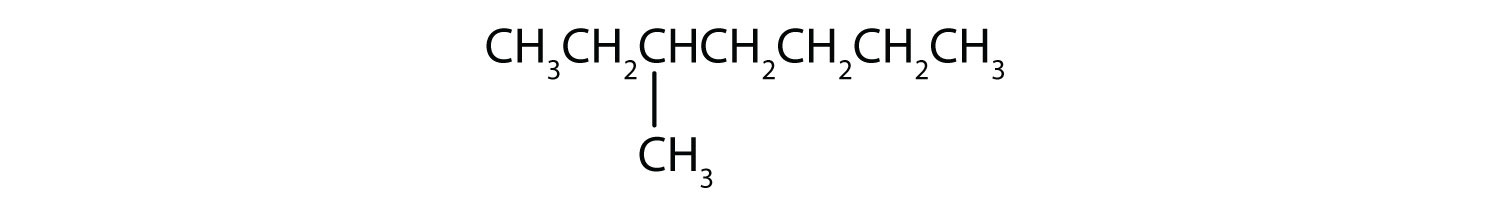
- ch3ch2c≡cch3
-

-
答え
-
不飽和炭化水素は二重または三重結合を持ち、かなり反応性が高い。 飽和炭化水素は単結合しか持たず、反応性が低い。
-
アルケンは二重結合を持ち、アルカンは単結合のみである。
-
- 飽和;アルカン
- 不飽和;アルキン
- 不飽和;アルケン
Key Takeaway
- Alkenes are hydrated carbon to carbon double bond(炭素間に2つの結合を持つ炭化水素).
8.3 アルキン
最も単純なアルキン(炭素-炭素三重結合の炭化水素)は分子式C2H2で、一般にはアセチレンと呼ばれています(図8.5)。 構造はH-C≡C-H.
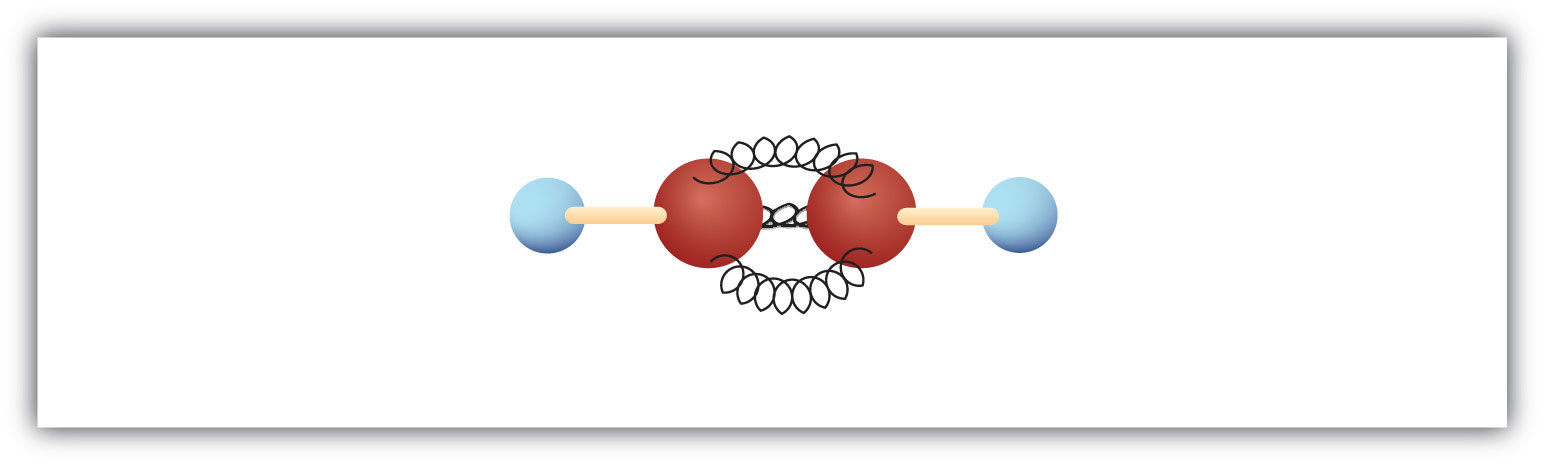
図8.5 アセチレンのボールとバネモデル。 アセチレン(エチレン)はアルキンの仲間で最も単純な物質である。
注
アセチレンは金属の切断や溶接に使う酸素アセチレントーチで使われる。 このようなトーチからの炎は非常に高温になることがある。
アルキンは物理的、化学的性質がアルケンに類似しています。 例えば、アルキンは、アルケンの典型的な付加反応の多くを経る。 国際純正応用化学連合 (IUPAC) のアルキンの名前は、語尾が-ene ではなく -yne であることを除いて、アルケンの名前と平行しています。 アセチレンのIUPAC名はエチレンである。 他のアルキンの名前は、以下の演習で説明します。
Concept Review Exercises
-
アルケンとアルキンの重要な違いを簡単に説明しなさい。
-
アルケン (CH3)2CHCH2CH=CH2 は 4-methyl-1-penten と名付けられます。 (CH3)2CHCH2C≡CHの名前は?
-
アルキンはシス-トランス異性体を示すか? 説明せよ。
回答
-
アルケンは二重結合を持ち、アルキンは三重結合を持っています。
-
4-methyl-1-pentyne
-
いいえ、三重結合の炭素原子は、他の結合を1つだけ作ることができます。 シス-トランス異性体を示すためには、2 つの基が結合していなければなりません。
Key Takeaway
- アルキンは炭素-炭素三重点とアルケンとよく似た特性を持つ炭化水素です。
Exercises
-
それぞれの化合物の構造を描いてください。
- アセチレン
- 3-メチル-1-ヘキシン
-
それぞれの化合物の構造を描いてください。
- 4-methyl-2-hexyne
- 3-octyne
-
それぞれのアルキンの名前を述べよ。
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
回答
。
-
- h-c≡c-h
-
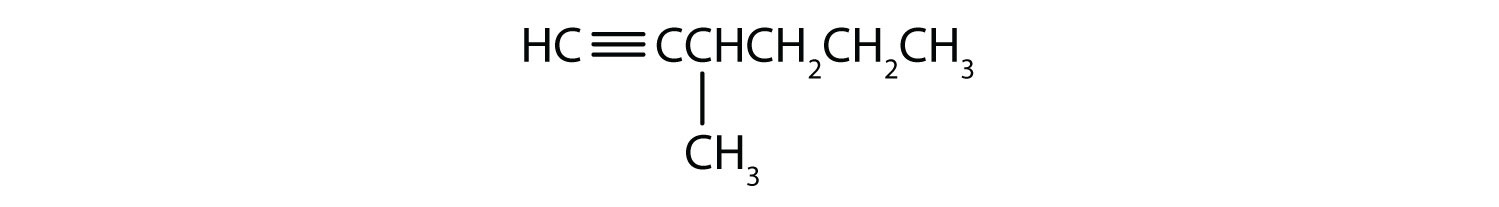
-
- 1->
- 2-hexyne
(Back to Top)
8.4 芳香族化合物 ベンゼン
次に、不飽和炭化水素と同じ分子式で、アルケンと違って付加反応を起こしにくい炭化水素の一群を考えてみます。 この化合物は芳香族炭化水素と呼ばれ、別格の存在である。 芳香族炭化水素はベンゼン環構造を持つ化合物で、最も単純な芳香族化合物はベンゼン(C6H6)であり、商業的に非常に重要であるが、健康に悪影響を及ぼすことも注目されている(「健康へ:ベンゼンと私たち」参照)。 (炭素原子6個の飽和炭化水素であるヘキサンの式はC6H14で、ベンゼンより8個多く水素原子を持つ)。 しかし、飽和度が低いように見えても、ベンゼンはむしろ不反応である。

注
ベンゼンはガソリン臭のする液体で、80℃で沸騰し、5.5℃で凍結する。 芳香族炭化水素の中で最も多く生産されている。 以前はコーヒーのカフェイン抜きに使われ、ペイントストリッパー、ゴムセメント、家庭用ドライクリーニングのシミ抜き剤など、多くの消費財の重要な構成要素だった。 1950年代に多くの製品からベンゼンが取り除かれましたが、1970年代に白血病による死亡が確認されるまで、製品にベンゼンを使用し続ける企業もありました。 ベンゼンは、プラスチック(発泡スチロールやナイロンなど)、医薬品、洗剤、合成ゴム、殺虫剤、染料を製造する際の前駆体として、現在も産業界で重要な役割を担っている。 また、印刷機器の洗浄やメンテナンス、靴底の接着剤などの溶剤としても使用されている。 ベンゼンは石油製品の天然成分ですが、発がん性が指摘されているため、現在ではガソリンの添加物としての使用は制限されています
あなたの健康へ。 ベンゼンと私たち
商業的に使用されるベンゼンのほとんどは、石油から得られるものです。 洗剤、医薬品、染料、殺虫剤、プラスチックの製造の出発物質として使用されます。 かつて有機溶剤として広く使われていたベンゼンは、現在では短期的にも長期的にも毒性があることが知られています。 大量に吸い込むと吐き気を催し、呼吸不全や心不全で死に至ることもある。また、繰り返しさらされると、骨髄が新しい血液細胞を作る能力が最終的に破壊される進行性の病気になる。
Concept Review Exercises
-
ベンゼンとアルケンの典型的な反応はどう違うのでしょうか?
-
ベンゼンの結合を簡単に説明せよ。
-
化学者がベンゼンを表現する際の円の意味は何か。
答え
-
ベンゼンはアルケンに比べて付加反応性が低い。
-
価電子は炭素原子6個全部で等しく共有(電子は非局在化)されています。
-
6個の電子は6個の炭素原子すべてによって等しく共有されている。
芳香族化合物を認識する
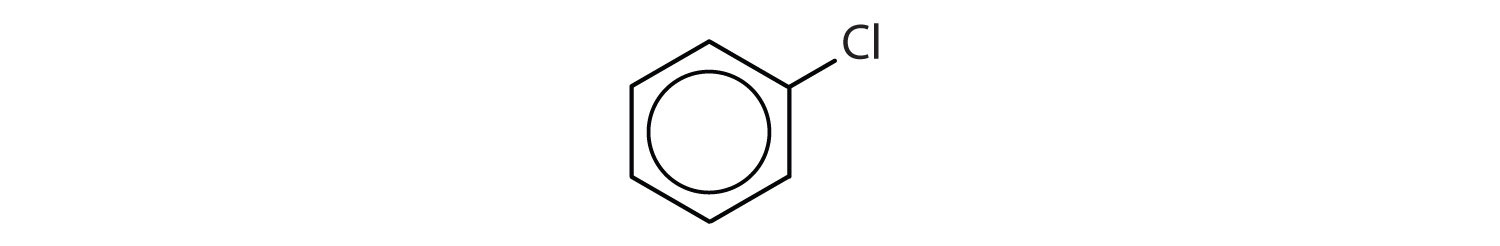
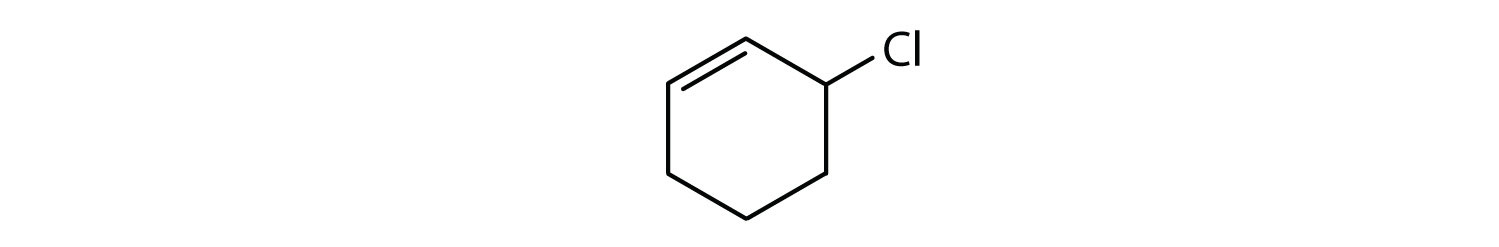
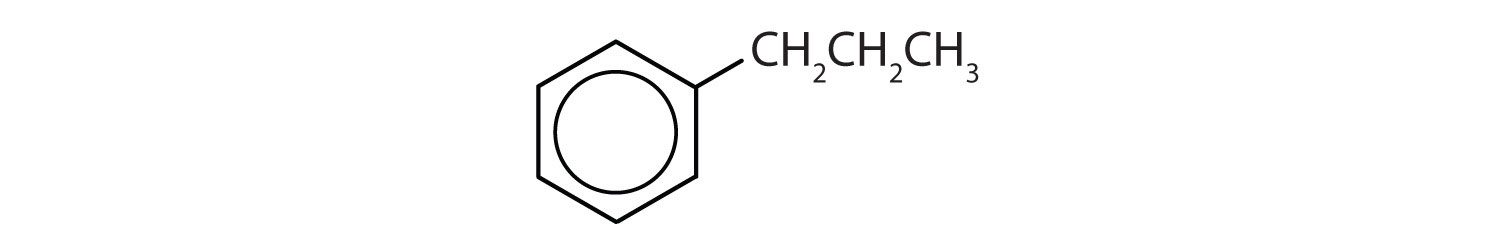
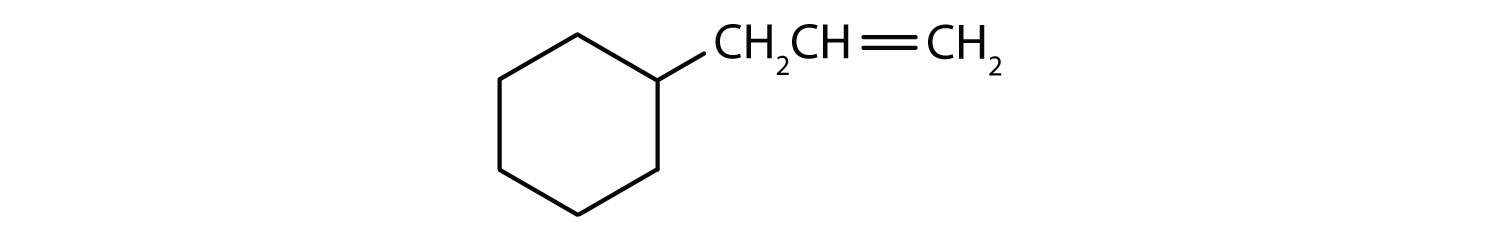
どの化合物が芳香族か?
Solution
- ベンゼン環(水素原子1個に替えて塩素原子を有する)を有する化合物の場合です。 芳香族である。
- 化合物は環状であるが、ベンゼン環を有しない;芳香族ではない
- 化合物はベンゼン環を有する(水素原子の1つはプロピル基で置換されている);芳香族である
- 化合物は環状である(水素原子の1つはプロピル基で置換されている)。
- この化合物は環状ですが、ベンゼン環を持たないので芳香族ではありません。
Skill-Building Exercise
どの化合物が芳香族か?
-
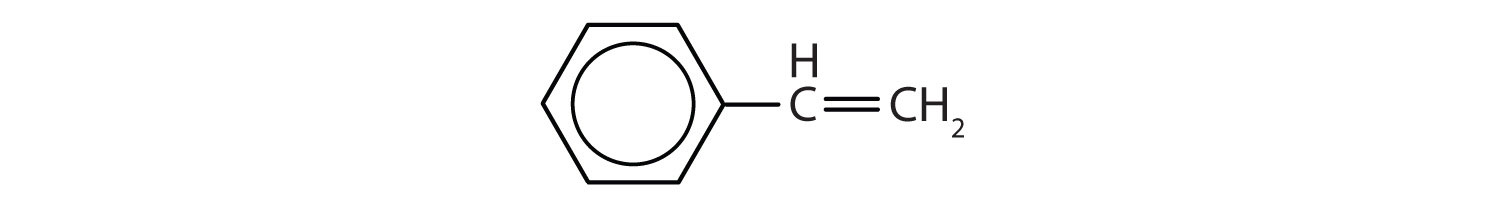
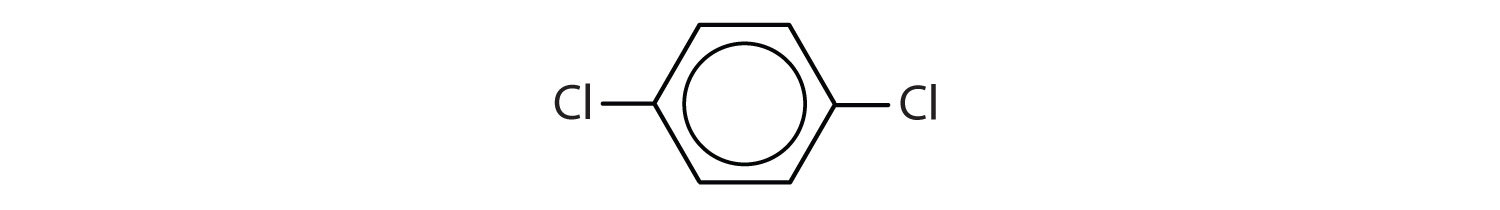
国際純正・応用化学連合(IUPAC)ではベンゼンの誘導体として芳香族炭化水素と名付けられますが、芳香族炭化水素はベンゼンの誘導体であるため、芳香族炭化水素と呼ばれます。 以下に5つの例を示す。 これらの構造では、置換基が環の上、横、下のいずれに書かれていても重要ではなく、六角形は対称なので、すべての位置が等価である。
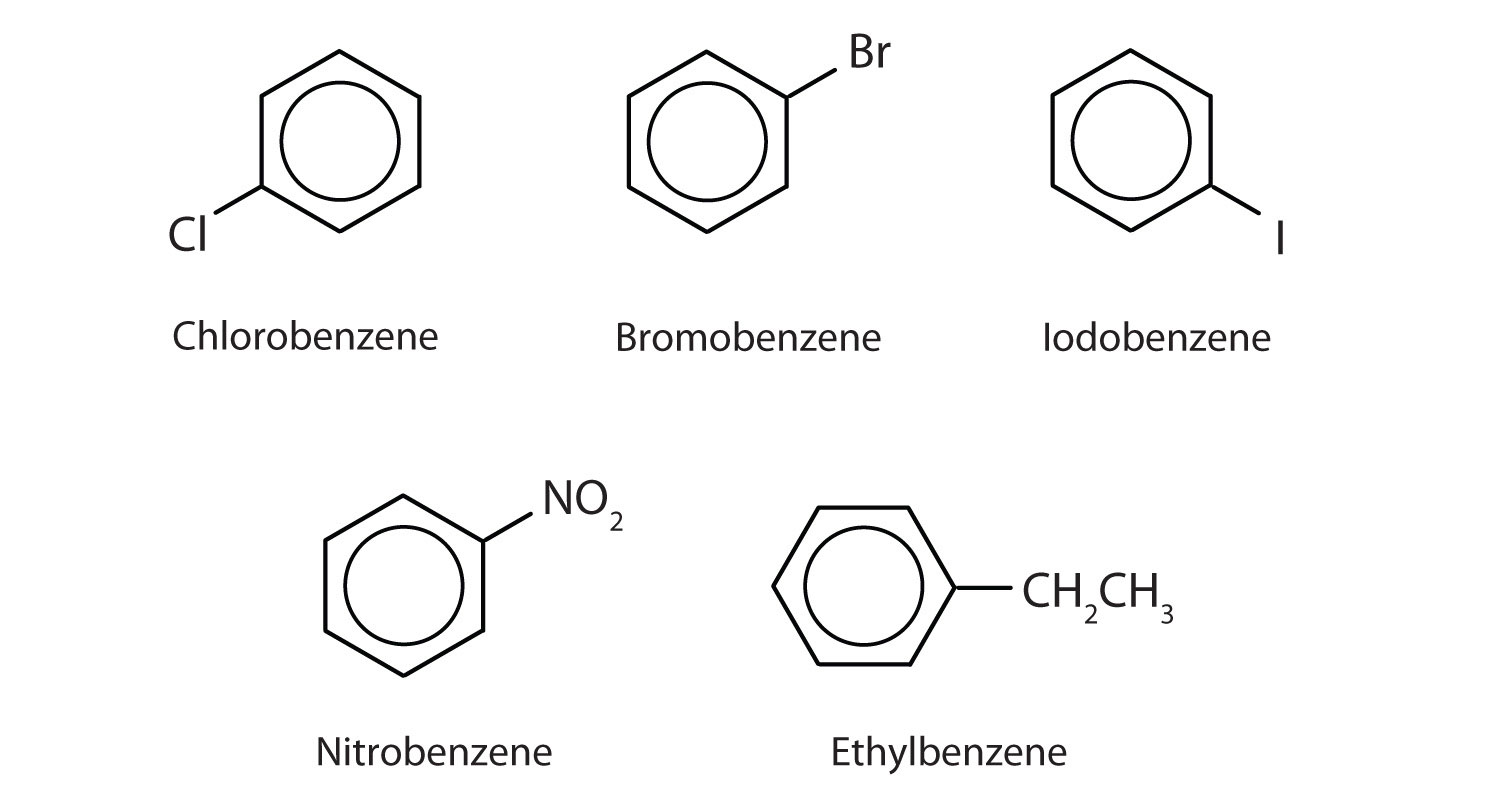
これらの化合物は、通常の方法で、水素原子を置換する基を置換基として名づけられる。 Clはクロロ、Brはブロモ、Iはヨード、NO2はニトロ、CH3CH2はエチル。
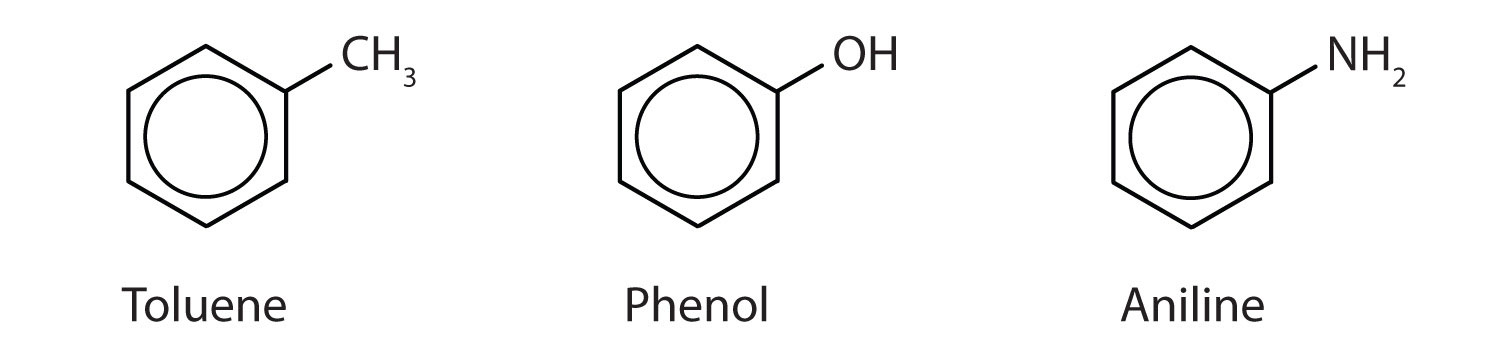
IUPAC名のみで呼ばれる化合物もあるが、以下に示すように一般名で示されることが多い化合物もある。
Key Takeaway
- 香族炭化水素は一見不飽和だが結合が特殊で付加反応が起きない。
(上に戻る)
多環芳香族炭化水素
芳香族炭化水素の中にはベンゼン環が縮合したものがあり、共通する側面を持つ環である。 8860>
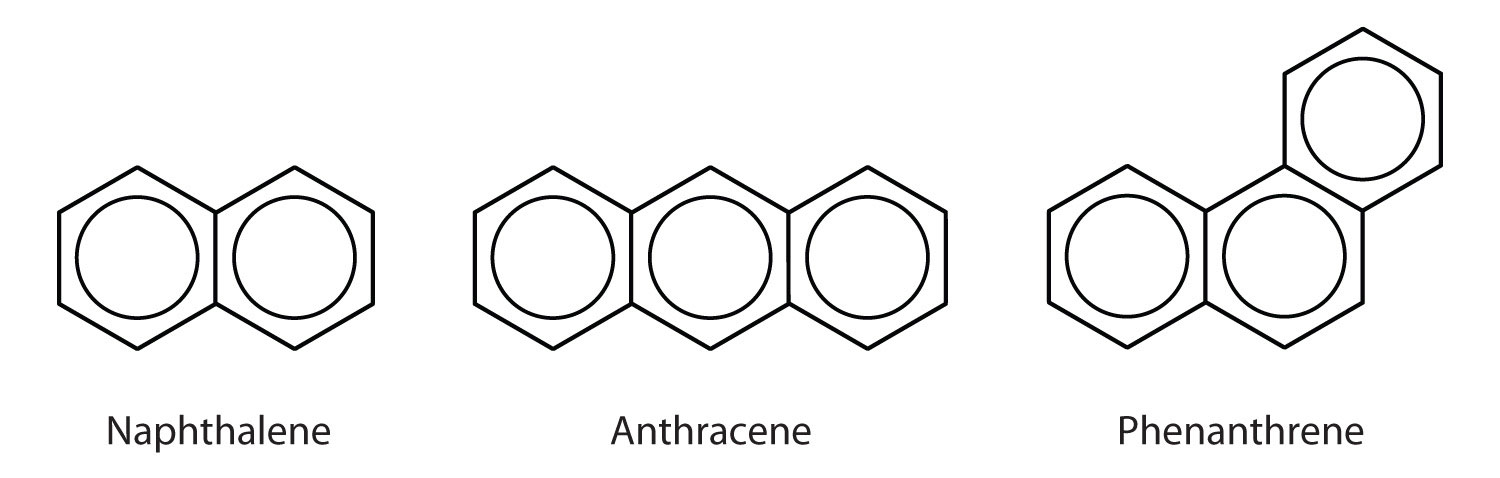
ここに示した3つの例は、一般にコールタールから得られる無色の結晶性固体である。 ナフタレンは刺激臭があり、防虫剤に使用されています。 アントラセンは染料の製造に使われる。 コレステロールやホルモンであるエストロゲン、テストステロンなどのステロイドは、フェナントレン構造を有しています。 多環芳香族炭化水素とがん
コールタールの蒸留に必要な強い加熱により、PAHsが生成されます。 コールタール精製工場で働く人は、タールガンと呼ばれる皮膚ガンになりやすいことが長年知られています。 また、PAHの中には発がん性のある物質が含まれていることもわかっている。 最も発がん性の高いベンゾピレンはコールタールに含まれるほか、タバコの煙、大麻の煙、自動車の排気ガス、炭火焼ステーキなどからも分離される。 米国では、毎年1,000トン以上のベンゾピレンが大気中に放出されていると推定される。 実験動物で癌を誘発するのに必要なベンゾピレンの量は、体重 1 kg あたりわずか数ミリグラムである
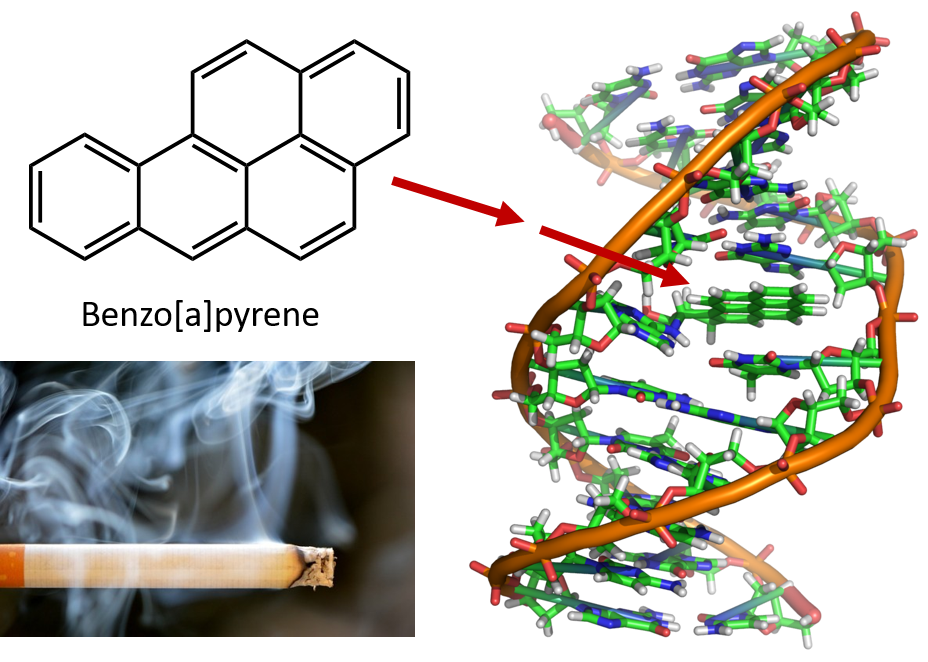
図 8.6 ベンゾピレンは、コールタール、タバコ、マリファナの煙、炭焼きステーキで副産物として生じる多環芳香族炭化水素です。 ベンゾピレンは代謝されて生物学的に活性な化合物を生成し、DNA分子に物理的な付加物を形成することがある。 これらの付加物は、癌の原因となる遺伝子変異を引き起こす可能性があります。
タバコの煙の写真
Biologically Important Compounds with Benzene Rings
ベンゼン環を含む物質は動物と植物に共通ですが、後者に多く含まれます。 植物は二酸化炭素、水、無機物からベンゼン環を合成することができる。 動物は合成できないが、生存のために特定の芳香族化合物に依存しているため、食物から摂取する必要がある。 フェニルアラニン、チロシン、トリプトファン(必須アミノ酸)、ビタミンK、B2(リボフラビン)、B9(葉酸)などはすべてベンゼン環を含んでいる。 8860>
Note
ここまでは、炭素を含む環を持つ芳香族化合物だけを調べてきた。 しかし、環状化合物の中には炭素原子以外の元素を環に持つものが多くあります。 炭素以外の原子を含む有機環状構造を複素環式化合物と呼び、.., 複素環式芳香族化合物もまた、ユニークで医学的に関連した特性を有している
表8.2 ベンゼン環を含むいくつかの薬物
名称 構造 アスピリン 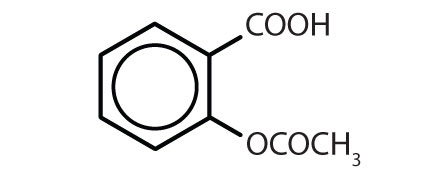
アセトアミノフェン 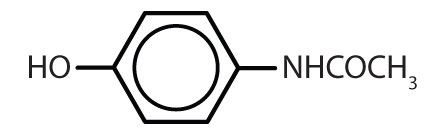
イブプロフェン 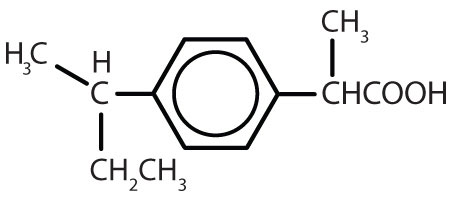
アンフェタミン 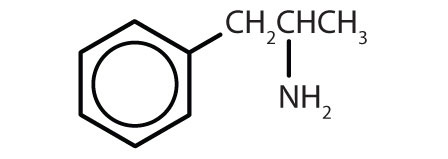
スルファニルアミド 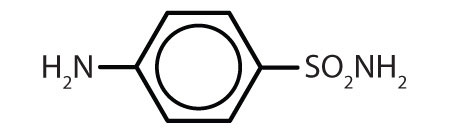
8.5 幾何異性体
アルカン構造では炭素-炭素の単結合(C-C)を中心に自由回転がある。 一方、アルケンの構造では、炭素原子が二重結合を形成していることが必要である。 元素間の二重結合は、p軌道殻(π軌道ともいう)を使って作られる。 この軌道殻は、単結合で使われる円軌道ではなく、ダンベルのような形をしている。 このため、二重結合の周囲で炭素原子が自由に回転すると、回転中に二重結合が切れてしまうので、これを防ぐことができます(図8.7)。 したがって、単結合は、2枚の板を1本の釘で打ち付けたようなものである。 板は一本の釘のまわりを自由に回転することができる。 一方、ダブルボンドは、2枚の板を2本の釘で打ち付けたようなものです。 前者は板をひねることができるが、後者はひねることができない。

図8.7 二重結合の形成にはπ結合の利用が必要である。 分子が二重結合を作るには、2つの原子の間で電子が重なり合うπ軌道を共有しなければならない。 このため、ダンベル状のπ軌道(左図)は二重結合形成中、一定のコンフォメーションに保たれる必要がある。 これにより、両原子で共有できる電子軌道(右図)が形成される。 二重結合の周りを回転させると、π軌道がずれて二重結合が切れてしまう。
Diagram provided from: JoJanderivative work – Vladsinger (talk)
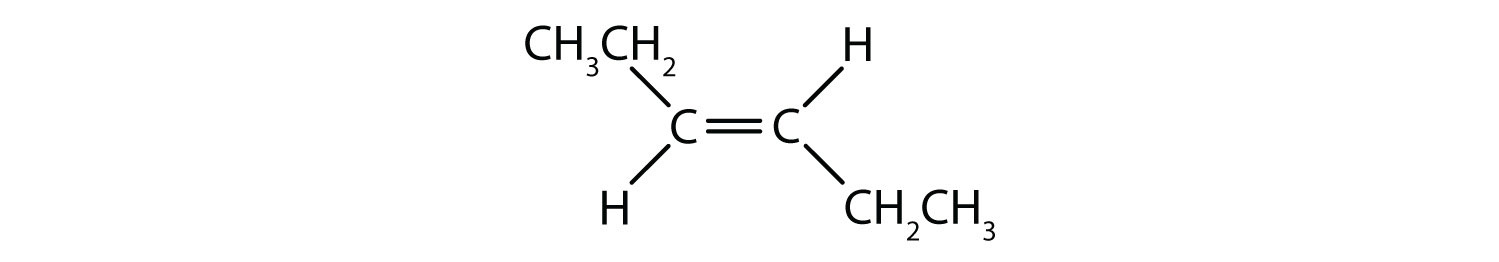
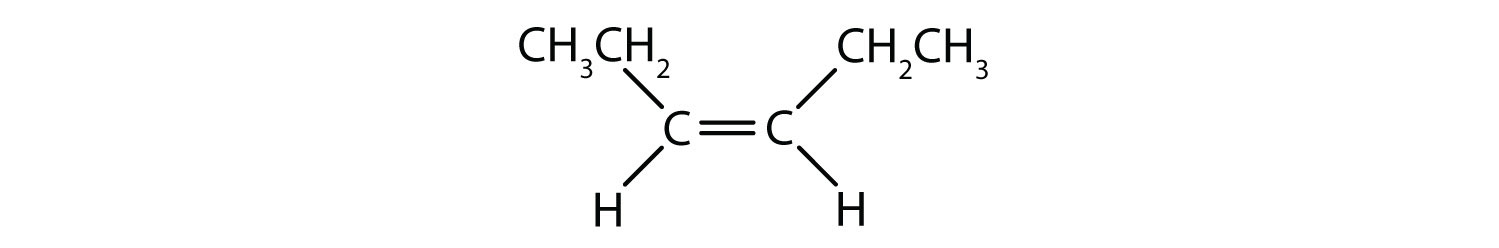
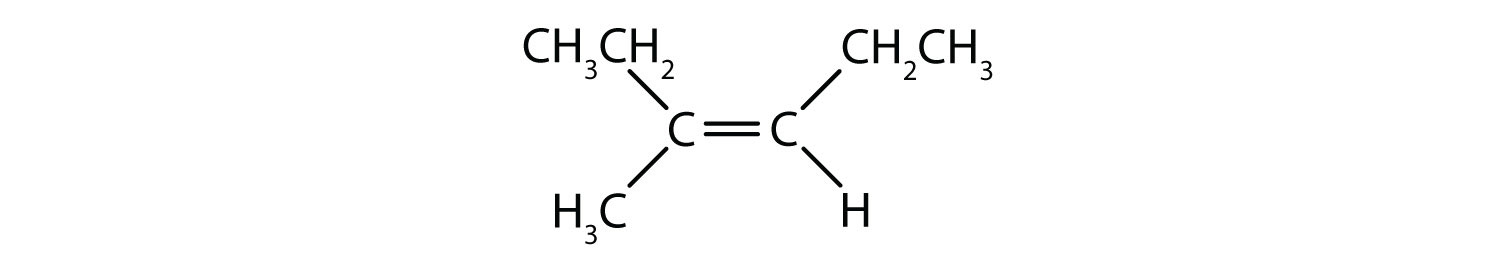
二重結合の固定的で硬い性質は、追加のキラル中心の可能性を生み出し、したがって、立体異性体の可能性を生み出します。 二重結合に関与する各炭素に2つの異なる原子または基が結合している場合、新しい立体異性体が形成されます。 例えば、図8.8の2つの塩素化炭化水素を見てください。 上の図では、ハロゲン化アルカンを示している。 この炭素-炭素結合の周りの回転は可能であり、異なる異性体のコンフォメーションになることはない。 下の図では、ハロゲン化アルケンは二重結合の周りの回転が制限されている。 また、二重結合に含まれる各炭素は、2つの異なる原子(水素と塩素)に結合していることにも注意してください。 この分子は、2つの塩素原子が二重結合の同じ側にあるものと、塩素が二重結合の反対側にあるものの2つの立体異性体を形成することができる。
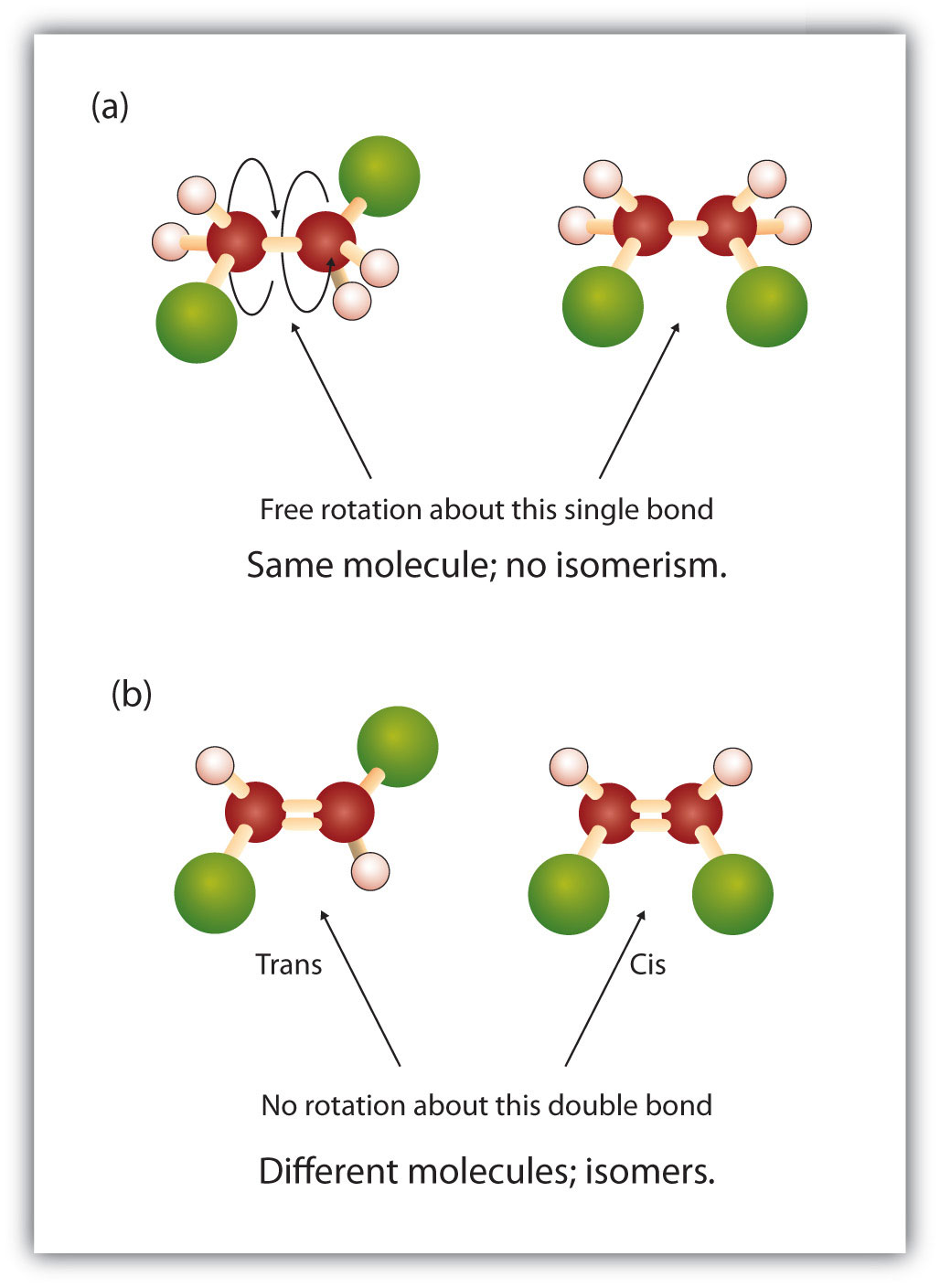
図8.8 アルケンの二重結合は幾何異性体を形成することができる。 (a)はアルカン構造における炭素-炭素単結合の周りの自由回転を示す。 (b) 炭素-炭素二重結合の固定位置を示し、幾何学的(空間的)異性体を形成する。
ここをクリックすると、アルケンの構造に関するカーンアカデミーのビデオチュートリアルがあります。
このセクションでは、このビデオチュートリアルに含まれている名前付けについては、関知しません。(注意: カーン アカデミーのコンテンツはすべて CC-BY-NC-SA ライセンスを使って無料で利用できます。www.khanacademy.org )
Cis-Trans Nomenclature
シス-トランス命名法は、二重結合の各炭素に一連の同じ基が結合した単純異性体の識別に使用することができます。 たとえば、図8.8bでは、二重結合に関与する各炭素に塩素が結合しており、さらに水素が結合しています。 シスおよびトランスシステムは、同一の基が二重結合の同じ側(シス)にあるか、反対側(トランス)にあるかを識別するものである。 例えば、水素原子が二重結合の反対側にある場合、その結合はトランスコンフォメーションであると言われています。 水素基が二重結合の同じ側にある場合、その結合はシス型コンフォメーションであると言われています。 また、塩素基の両方が二重結合の反対側にある場合、その分子はトランス型であり、二重結合の同じ側にある場合、その分子はシス型であると言うことができることに注意してください。
分子がシス型かトランス型かを判断するには、図8.9のように二重結合の中心に破線を引き、同一基を丸で囲むとよい。 図8.9に示す分子は、いずれも1,2-ジクロロエテンと命名されている。 このように、シスおよびトランスという呼称は、二重結合の周囲の立体化学を定義するだけで、分子全体の同一性を変えることはありません。 しかし、シスとトランスの異性体は、空間的に結合が固定されているため、しばしば異なる物理的、化学的性質を持ちます。
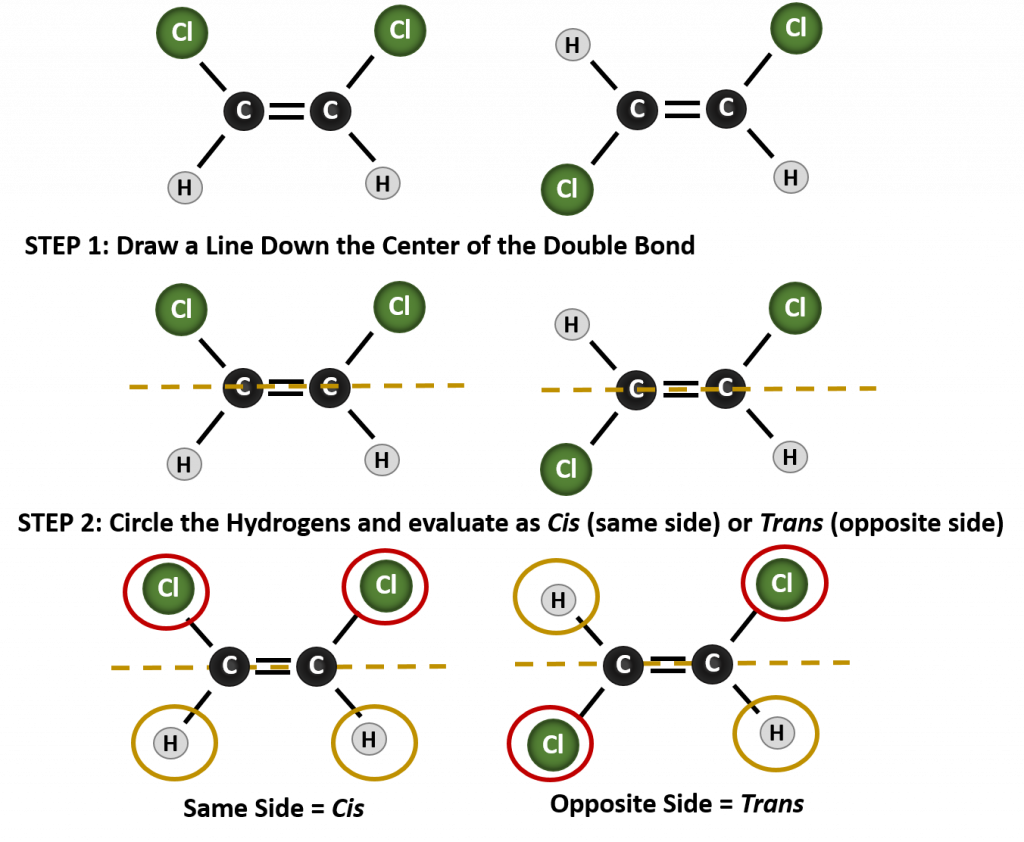
図 8.9 シスまたはトランス構造を決定するためのガイド
シス/トランス異性化に関するカーン アカデミー ビデオ チュートリアルはこちら
(Note: All Khan Academy content is available for free using CC-BY-NC-SA licensing at www.khanacademy.org )
Cis-trans isomerism also occurs in cyclic compounds.これは環状化合物でも起こることです。 環構造では、基は環の炭素-炭素結合のいずれに対しても回転することができない。 したがって、基は環の同じ側にあるか(シス)、反対側にある(トランス)かのどちらかである。

To Your Health
Cis-trans conformation について日常生活で最もよく耳にするのは、スーパーや医者のところでしょう。 これは、私たちの食事性脂肪の消費量に関連するものです。 食事脂肪の不適切または過剰な摂取は、糖尿病や動脈硬化、冠状動脈性心臓病など、多くの健康障害に関連しています。 では、飽和脂肪と不飽和脂肪の違いは何か、トランス脂肪とは何か、なぜ健康上の懸念があるのか。

Figure 8.10 Common Sources of Dietary Fats.
写真提供:TymaHe
食事脂肪のもっとも多い形、およびヒトや他の動物の体脂肪の主成分は中性脂肪 (TAGs) であり、このトリグリセリドは体脂肪の主成分です。 TAGは図8.10に示すように、1分子のグリセロールと3分子の脂肪酸がエステル結合で結合したものである。 ここでは、アルカン構造あるいはアルケン構造からなる長い脂肪酸の尾部の構造に注目する。 第10章ではエステル結合の形成にもっと焦点を当てる。

図8.11. トリグリセリド(TAG)の構造例。 各トリグリセリドにはグリセロール骨格から伸びる3つの長鎖脂肪酸があることに注目されたい。 各脂肪酸は異なる飽和度と不飽和度を持つことができる。
Structure adapted from: Wolfgang Schaefer
完全飽和の脂肪は、長鎖アルカンの尾を持つ脂肪酸のみを持つことになる。 それらは水素原子で「飽和」していると言われる。 飽和脂肪は、アメリカの食生活では一般的で、赤身の肉、牛乳、チーズ、バターなどの乳製品、ココナッツオイルに含まれ、多くの焼き菓子に含まれています。 飽和脂肪酸は通常、室温で固体である。 これは、長鎖アルカンがより多くの分子間ロンドン分散力を持って一緒に積み重ねることができるためです。 このため、飽和脂肪は多くの植物油に含まれる不飽和脂肪よりも融点や沸点が高い。
自然界にある不飽和脂肪のほとんどは、図8.11に示すように、シス型である。 図8.11に示した脂肪酸は、見やすく、紙の上で場所を取らないように便宜上描いたもので、書かれた結合角は分子の真の空間配向を十分に表現していないことに注意してください。 図8.11に示したTAGの脂肪酸を正しい結合角で描くと、シス二重結合がアルケン鎖の曲がりを引き起こしていることが容易にわかる(図8.12)。
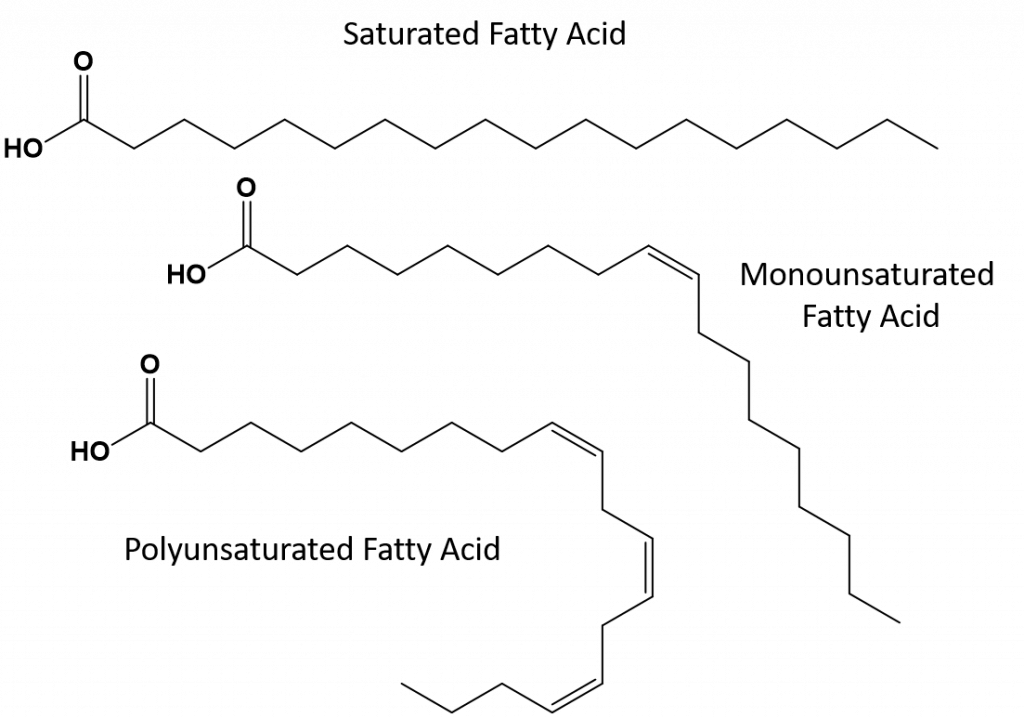
図8.12 シス型二重結合は脂肪酸構造の屈曲を引き起こす
したがって、一価および多価不飽和脂肪は飽和脂肪と比較して、容易に積み重ねることができず、分子間引力もそれほど大きくはない。 その結果、融点や沸点が低くなり、室温では液体になりやすい。 食事で飽和脂肪酸を減らし、一価および多価不飽和脂肪酸に置き換えることで、冠動脈疾患の危険因子である低密度リポタンパク質(LDL)のレベルを下げることができることが分かっています。 したがって、脂肪酸の形状は飽和脂肪酸と同様に直線的である。 また、トランス脂肪酸は、飽和脂肪酸と比較すると、融点や沸点が似ています。 しかし、飽和脂肪酸とは異なり、トランス脂肪酸は自然界にあまり存在せず、健康への悪影響が懸念されています。 トランス脂肪酸は、主に食品加工(主にマーガリンやショートニングを作るための水素添加工程)または調理中、特に揚げ物の際に副産物として発生します。 実際、多くのファーストフード店では、揚げ物の工程でトランス脂肪酸を使用しています。トランス脂肪酸は、交換するまでに何度も使用できるためです。 トランス脂肪酸を摂取すると、体内のLDLコレステロール(冠動脈性心疾患に関連する悪玉コレステロール)値が上昇し、高密度リポタンパク質(HDL)コレステロール(体内の善玉コレステロール)が低下する傾向があります。 トランス脂肪酸の摂取は、心臓病や脳卒中、II型糖尿病の発症リスクを高めると言われています。 そのリスクは非常に高い相関性を持っており、ノルウェー、スウェーデン、オーストリア、スイスなど多くの国がトランス脂肪酸の使用を禁止しています。 米国内では、最近、食品医薬品局(FDA)が、2018年までに食品中のトランス脂肪酸の使用を段階的に廃止する措置を可決しました。 この措置により、年間2万人の心臓発作と7千人の死亡を防ぐことができると推定されています。
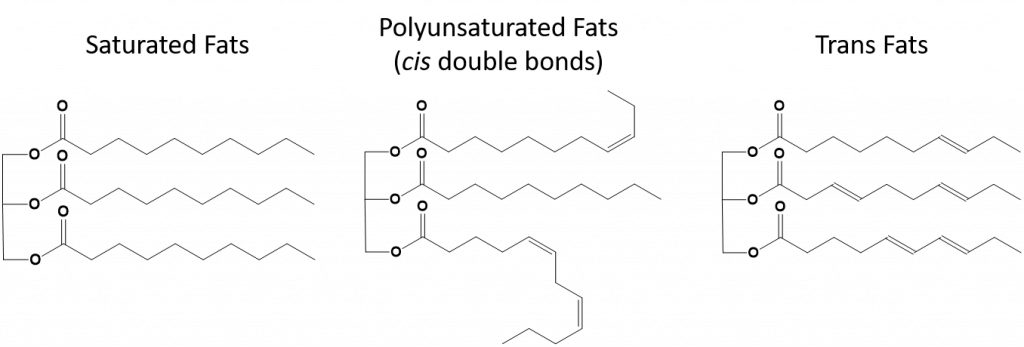
図 8.13 飽和脂肪、多価不飽和脂肪およびトランス脂肪の構造上の違い。
飽和脂肪酸、不飽和脂肪酸、トランス脂肪酸に関するカーン アカデミー ビデオ チュートリアルはこちら
(注:カーン アカデミーのすべてのコンテンツは、www.khanacademy.com で CC-BY-NC-SA ライセンスを使って無料で利用できます)。org )
Cis/Trans 異性化を決定する重要な要素
- 化合物は二重または三重結合を含むか、炭素-炭素結合の周りを自由に回転できないような環状構造を持っている必要があります。
- 化合物は、炭素-炭素二重結合または三重結合に関与する各炭素に結合した2つの非同一基を持つ必要があります。
実例
シス-トランス(幾何)異性体として存在できる化合物は何でしょうか。 8860>
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CH2CH3
- CH3CH=CH2CH3
Solution
4つの構造は全て2重結合を持っているのでシス・トランス異性体の規則1を満たしています。
-
この化合物はルール2を満たしており、各炭素原子上に2つの非同一基(一方はHとCl、もう一方はHとBr)を持っています。

- この化合物は、二重結合した炭素原子の1つに2つの水素原子を持つ;ルール2を満たさず、シスおよびトランス異性体として存在しない。 ルール2は不成立で、シス型とトランス型の異性体は存在しません。

-
この化合物はルール2を満たしています。各炭素原子に2つの非同一基があり、シスおよびトランス異性体として存在します:

スキルアップ演習
-
シスとトランス異性体として存在できる化合物は何でしょうか。 描いてみてください。
- ch2=ch2ch2
- ch3=ch2ch3
- ch3ch2=ch2ch3
-
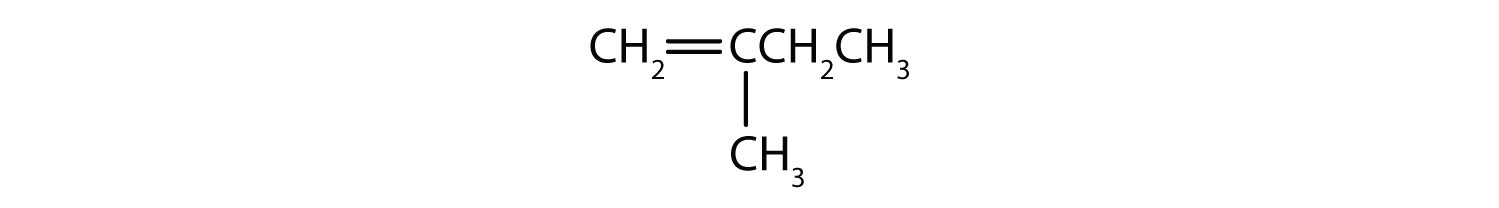
-
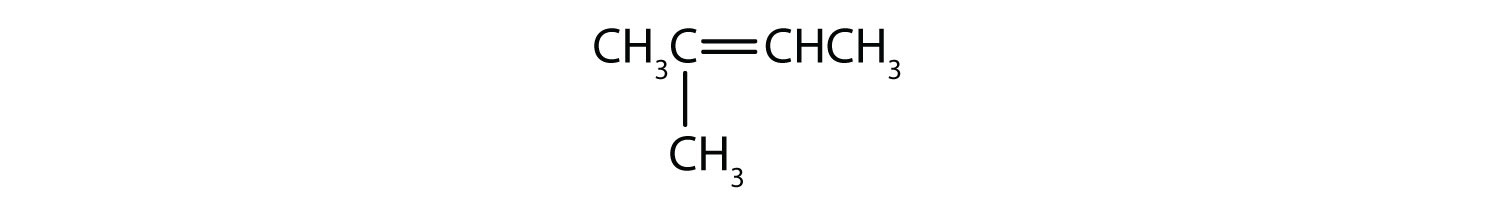
コンセプトレビュー演習
-
cis- とは何か?トランス(幾何)異性体? シス-トランス異性体を示す2種類の化合物は何か?
-
それぞれの化合物をシス異性体、トランス異性体、あるいはどちらでもないと分類してください。
答え
-
Cis-…トランス異性体は、分子内に剛直な構造が存在するために、異なる配置(基が空間内の異なる場所に永久に存在すること)を持つ化合物である。 アルケンや環状化合物はシス・トランス異性体を示すことがある。
-
- trans
- cis
- neither
Key Takeaway
- Cis->
-
- cis
- cis
- nither
- neither
Key Takeaway
(上に戻る)
E-Z Nomenclature
状況は、二重結合の形成に関与する炭素原子に結合した4種類の基がある場合により複雑になってきます。 この場合、どの基が命名法で記述されているかという言及がないため、cis-trans命名法は使用できません。 例えば、下の分子では、塩素が臭素基に対してトランスであると言うこともできるし、塩素がメチル(CH3)基に対してシスであると言うこともできる。 したがって、この場合、単にシスまたはトランスと書いても、二重結合に対する基の空間的な向きを明確に示すことはできません。
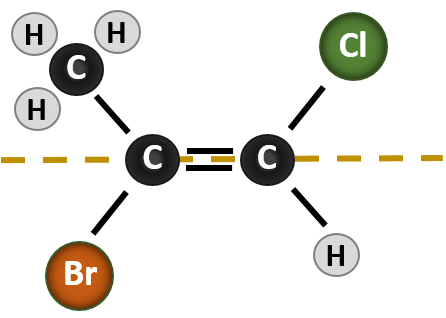
この状況で形成される異なる立体異性体の名前を付けるには、優先順位の規則に関する知識が必要です。 第5章を思い出してください。Cahn-Ingold-Prelog(CIP)優先システムにおいて、キラル炭素に結合する基は、その原子番号(Z)に基づいて優先的に扱われるのです。 原子番号が大きい(陽子が多い)原子ほど優先度が高い(すなわち、S > P > O > N > C > H)。 この命名法では、シス/トランス系の代わりに(Z)と(E)の呼称が使用されています。 (E)はドイツ語のentgegen(反対)に由来する。 従って、優先順位の高い基が二重結合の反対側にある場合、その結合は(E)コンフォメーションであるという。 一方、(Z)はドイツ語のzusammen(一緒に)が語源である。 したがって、優先順位の高い基が二重結合の同じ側にある場合、その結合は(Z)コンフォメーションであると言われます。 図8.14に分子の(E)または(Z)コンフォメーションの割り当てに使用する手順を示します。
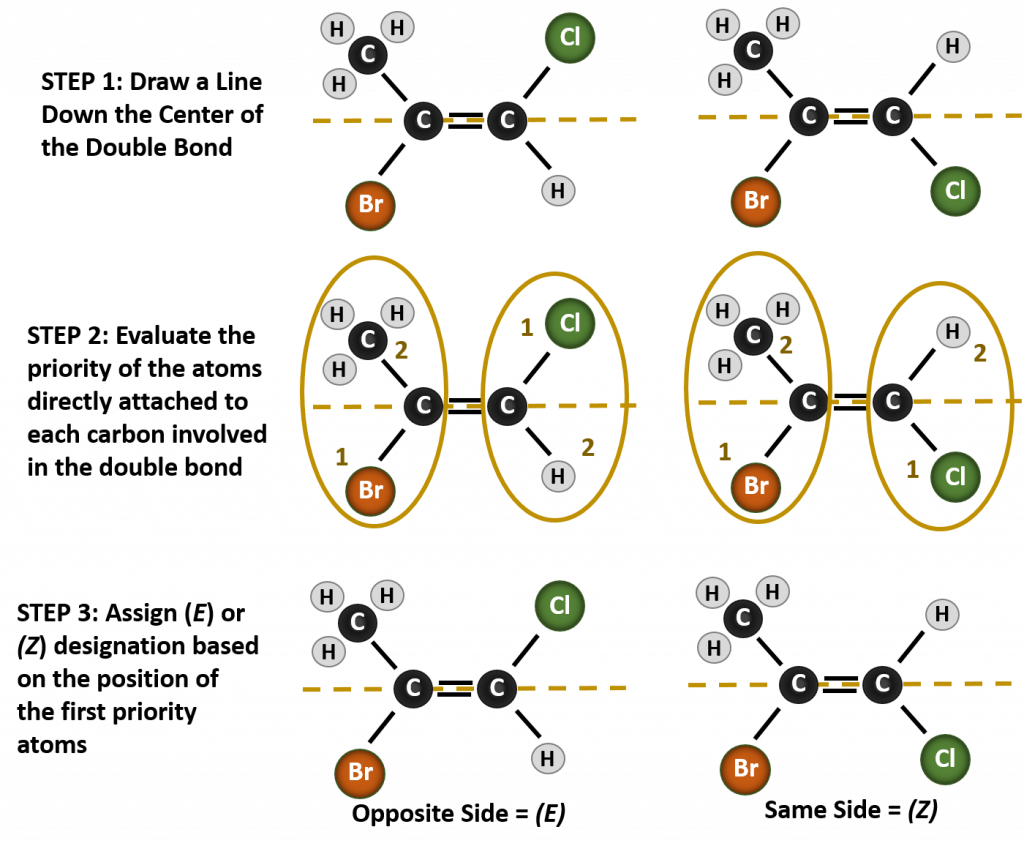
Figure 8.14 Steps used to assign the (E) and (Z) Conformations.
E/Z異性化に関するカーンアカデミーのビデオチュートリアルはこちら
(Note: Khan Academy のコンテンツはすべて CC-BY-NC-SA ライセンスを使って無料で利用できます。www.khanacademy.org )
(Back to the Top)
-