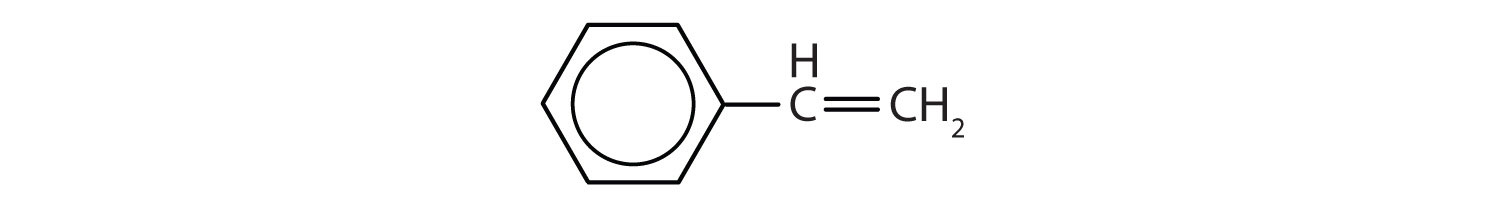
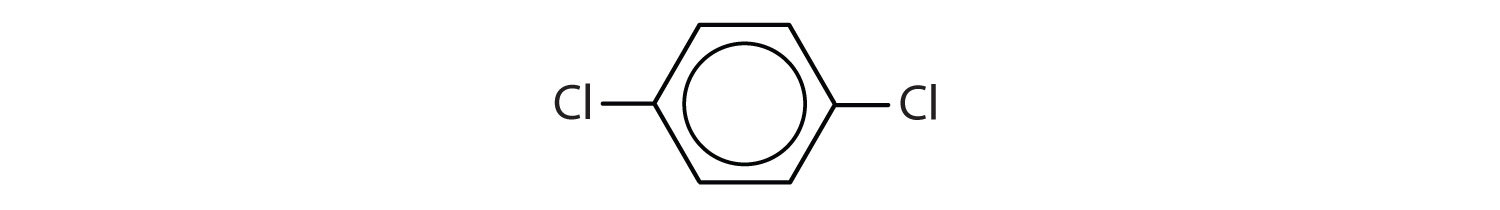
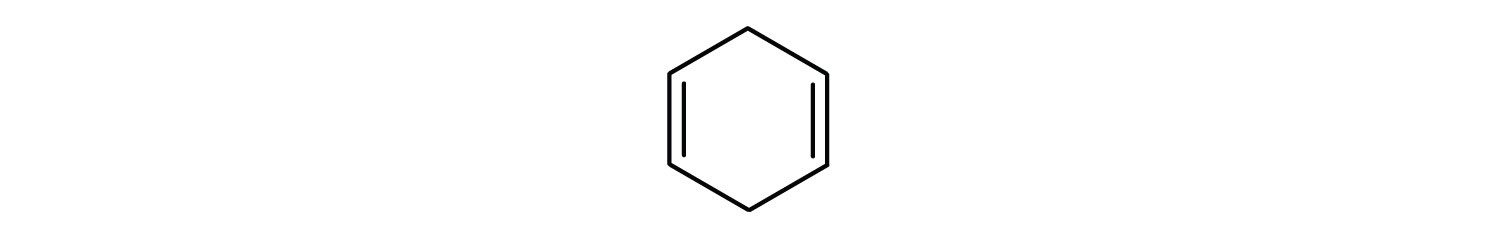
Aromatische koolwaterstoffen worden gedefinieerd door het hebben van 6-ledige ringstructuren met afwisselend dubbele bindingen (fig 8.2).
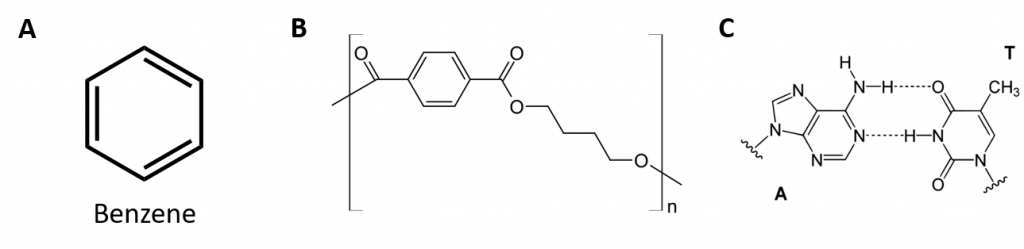
Figuur 8.2: Aromatische koolwaterstoffen. Aromatische koolwaterstoffen bevatten de 6-ledige benzeenringstructuur (A) die wordt gekenmerkt door afwisselende dubbele bindingen. Ultradur, PBT is een kunststof polymeer dat een aromatische functionele groep bevat. Het repeterende monomeer van Ultradur is weergegeven in (B). Ultradur is te vinden in douchekoppen, tandenborstelharen, kunststofbehuizingen voor glasvezelkabels en in onderdelen voor het exterieur en interieur van auto’s. Biologisch belangrijke moleculen, zoals desoxyribonucleïnezuur, DNA (C) bevatten ook een aromatische ringstructuur.
Zo hebben zij formules die kunnen worden opgevat als cyclische alkenen, waardoor zij onverzadigd zijn. Maar door de cyclische structuur zijn de eigenschappen van aromatische ringen over het algemeen heel anders, en gedragen zij zich niet als typische alkenen. Aromatische verbindingen dienen als basis voor vele geneesmiddelen, antiseptica, explosieven, oplosmiddelen en kunststoffen (b.v. polyesters en polystyreen).
De twee eenvoudigste onverzadigde verbindingen – ethyleen (etheen) en acetyleen (etheen) – werden ooit gebruikt als anesthetica en werden in 1924 in de medische wereld geïntroduceerd. Men ontdekte echter dat acetyleen explosieve mengsels vormt met lucht, zodat het medische gebruik ervan in 1925 werd gestaakt. Ethyleen werd veiliger geacht, maar was ook betrokken bij talrijke dodelijke branden en explosies tijdens anesthesie. Toch bleef het een belangrijk anestheticum tot in de jaren 1960, toen het werd vervangen door niet-ontvlambare anesthetica zoals halothaan (CHBrClCF3).
- (Terug naar het begin)
- 8.1 Overzicht Alkenen en Alkynen
- (Terug naar het begin)
- 8.2 Eigenschappen van Alkenen
- Looking Closer: Milieu Notitie
- Concept Review Exercises
- Antwoorden
- Key Takeaway
- Oefeningen
- Antwoord
- Oefeningen voor begripsherziening
- Antwoorden
- Key Takeaway
- 8.3 Alkynen
- Noot
- Oefeningen voor begripsherziening
- Key Takeaway
- Oefeningen
- (Terug naar het begin)
- 8.4 Aromatische Verbindingen: Benzeen
- Noot
- To Your Health: Benzene and Us
- Concept Herzieningsoefeningen
- Herkennen van aromatische verbindingen
- Skill-Building Exercise
- Key Takeaway
- (Terug naar het begin)
- Polycyclische aromatische koolwaterstoffen
- Voor uw gezondheid: Polycyclische Aromatische Koolwaterstoffen en Kanker
- Biologisch belangrijke verbindingen met benzeenringen
- Noot
- 8.5 Geometrische Isomeren
- Klik hier voor een Kahn Academy Video Tutorial over de structuur van Alkenen.
- Cis-Trans-nomenclatuur
- Klik hier voor een Kahn Academy-video over Cis/Trans-isomerisatie
- To Your Health
- Klik hier voor een Kahn Academy Video Tutorial over verzadigde vetten, onverzadigde vetten en transvetten
- Key Factors for Determining Cis/Trans Isomerization
- Worked Example
- Skill-Building Exercise
- Concept Herhalingsoefeningen
- Antwoorden
- Key Takeaway
- (Terug naar het begin)
- E-Z Nomenclatuur
- Klik hier voor een Kahn Academy Video Tutorial over E/Z-isomerisatie.
- (Terug naar het begin)
(Terug naar het begin)
8.1 Overzicht Alkenen en Alkynen
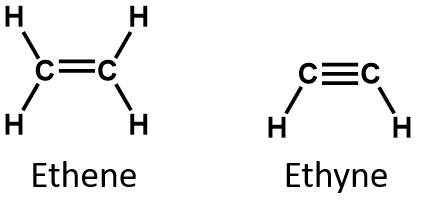
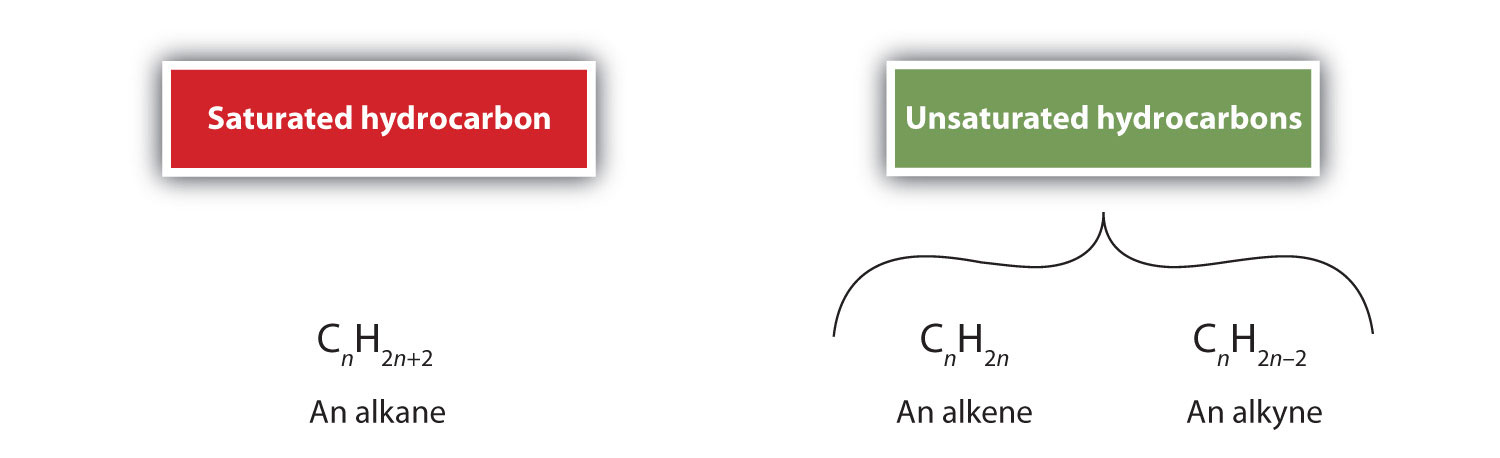
Per definitie zijn alkenen koolwaterstoffen met een of meer dubbele koolstof-koolstofbindingen (R2C=CR2), terwijl alkynen koolwaterstoffen zijn met een of meer drievoudige koolstof-koolstofbindingen (R-C≡C-R). Gezamenlijk worden zij onverzadigde koolwaterstoffen genoemd, die worden gedefinieerd als koolwaterstoffen met één of meer meervoudige (dubbele of drievoudige) bindingen tussen koolstofatomen. Als gevolg van de dubbele of drievoudige binding hebben alkenen en alkynen minder waterstofatomen dan vergelijkbare alkanen met hetzelfde aantal koolstofatomen. Wiskundig kan dit worden aangegeven met de volgende algemene formules:
In een alkeen wordt de dubbele binding gedeeld door de twee koolstofatomen en zijn de waterstofatomen er niet bij betrokken, hoewel de gecondenseerde formule dit punt niet duidelijk maakt, d.w.z. de gecondenseerde formule voor etheen is CH2CH2. De aard van de dubbele of drievoudige binding van een molecuul is nog moeilijker af te leiden uit de molecuulformules. Merk op dat de molecuulformule voor etheen C2H4 is, terwijl die voor etheen C2H2 is. Totdat je meer vertrouwd bent met de taal van de organische chemie, is het dus vaak het handigst om lijn- of gedeeltelijk gecondenseerde structuren uit te tekenen, zoals hieronder:
(Terug naar het begin)
8.2 Eigenschappen van Alkenen
De fysische eigenschappen van alkenen zijn vergelijkbaar met die van de alkanen. Tabel 8.1 laat zien dat de kookpunten van rechte-keten alkenen toenemen met toenemende molaire massa, net als bij alkanen. Voor moleculen met hetzelfde aantal koolstofatomen en dezelfde algemene vorm verschillen de kookpunten meestal slechts in geringe mate, zoals we zouden verwachten voor stoffen waarvan de molaire massa slechts 2 u (overeenkomend met twee waterstofatomen) verschilt. Evenals andere koolwaterstoffen zijn de alkenen onoplosbaar in water, maar oplosbaar in organische oplosmiddelen.
Enkele representatieve alkenen – hun namen, structuren en fysische eigenschappen – zijn gegeven in tabel 8.1.
Tabel 8.1 Fysische eigenschappen van enkele geselecteerde alkenen
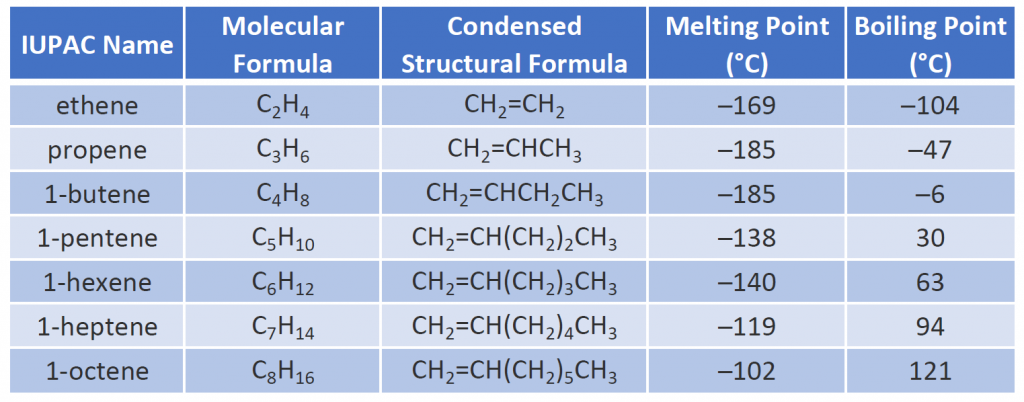
De eerste twee alkenen in tabel 8.1 – etheen en propeen, worden meestal aangeduid met hun gewone namen – respectievelijk ethyleen en propeen. Etheen is een belangrijke commerciële chemische stof. De chemische industrie van de VS produceert jaarlijks ongeveer 25 miljard kilogram ethyleen, meer dan enige andere synthetische organische chemische stof. Meer dan de helft van dit ethyleen wordt gebruikt voor de vervaardiging van polyethyleen, een van de meest bekende kunststoffen. Propyleen is ook een belangrijke industriële chemische stof. Het wordt omgezet in kunststoffen, isopropylalcohol, en een verscheidenheid van andere producten.
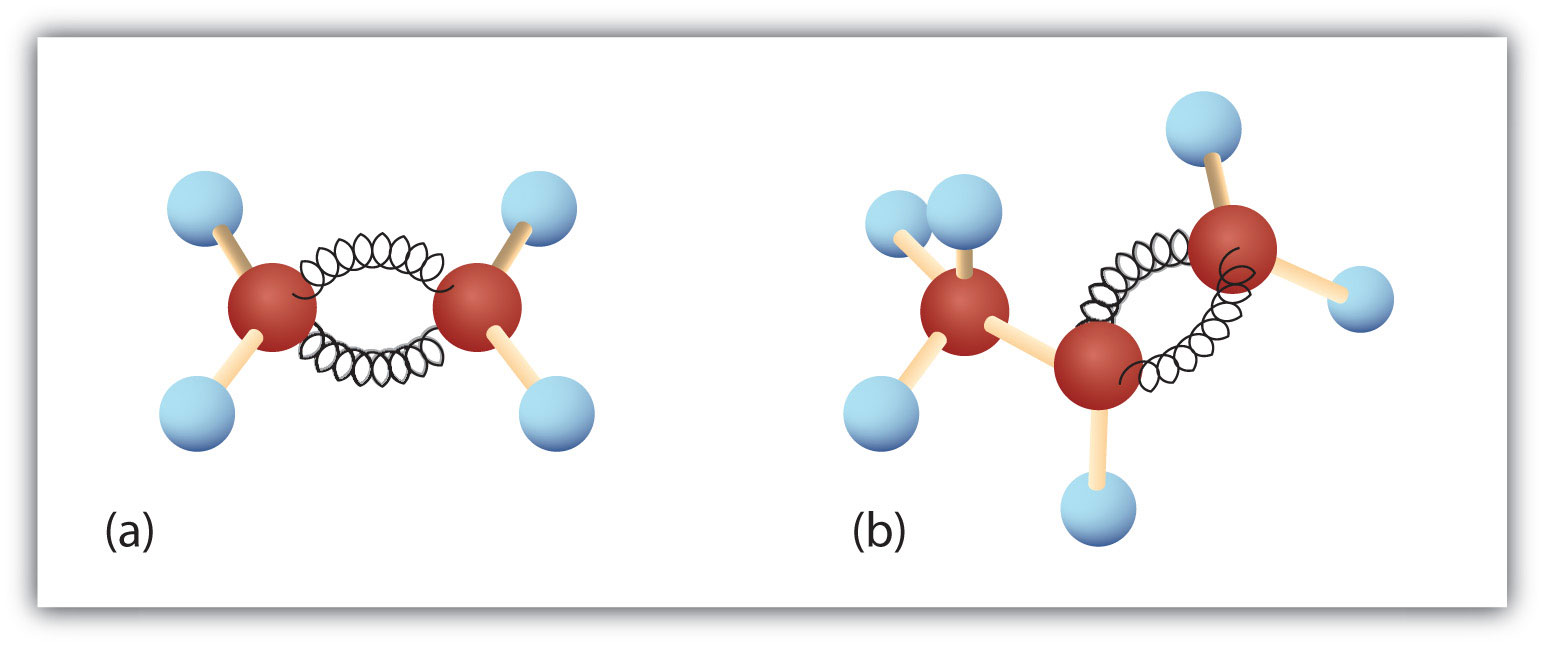
Figuur 8.3. Etheen en propeen. De bal-en-veer modellen van etheen/ethyleen (a) en propeen/propyleen (b) tonen hun respectievelijke vormen, vooral de bindingshoeken.
Looking Closer: Milieu Notitie
Alkenen komen veel voor in de natuur. Rijpende vruchten en groenten geven ethyleen af, dat verdere rijping op gang brengt. Fruitverwerkers brengen ethyleen kunstmatig in om het rijpingsproces te versnellen; blootstelling aan slechts 0,1 mg ethyleen gedurende 24 uur kan 1 kg tomaten doen rijpen. Helaas bootst dit proces het rijpingsproces niet precies na, en tomaten die groen worden geplukt en op deze manier worden behandeld, smaken niet veel als wijngerijpte tomaten vers uit de tuin.
Andere alkenen die in de natuur voorkomen zijn 1-octeen, een bestanddeel van citroenolie, en octadeceen (C18H36) dat in vislever wordt aangetroffen. Dienen (twee dubbele bindingen) en polyeen (drie of meer dubbele bindingen) komen ook veel voor. Butadieen (CH2=CHCH=CH2) wordt aangetroffen in koffie. Lycopeen en de carotenen zijn isomere polyenen (C40H56) die de aantrekkelijke rode, oranje en gele kleuren geven aan watermeloenen, tomaten, wortelen en andere vruchten en groenten. Vitamine A, essentieel voor een goed gezichtsvermogen, is afgeleid van een caroteen. De wereld zou veel minder kleurrijk zijn zonder alkenen.

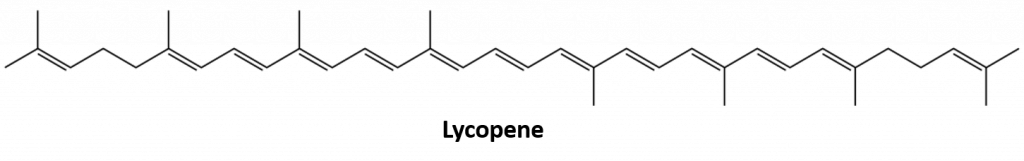
Figuur 8.4 De helderrode kleur van tomaten is te danken aan lycopeen.
Foto van : © Thinkstock; Lycopeenstructuur van: Jeff Dahl
Concept Review Exercises
-
Beschrijf in het kort de fysische eigenschappen van alkenen. Hoe verhouden deze eigenschappen zich tot die van de alkanen?
-
Rangschik, zonder tabellen te raadplegen, de volgende alkenen in volgorde van oplopend kookpunt:

Antwoorden
-
Alkenen hebben fysische eigenschappen (laag kookpunt, onoplosbaar in water) die vrij veel lijken op die van hun overeenkomstige alkanen.
-
etheen < propeen < 1-buteen < 1-hexeen
Key Takeaway
- De fysische eigenschappen van alkenen lijken veel op die van de alkanen: hun kookpunten nemen toe met toenemende molaire massa, en ze zijn onoplosbaar in water.
Oefeningen
-
Voorspel, zonder een tabel of andere referentie te raadplegen, welk lid van elk paar het hoogste kookpunt heeft.
- 1-penteen of 1-buteen
- 3-heptene of 3-noneen
- 1-penteen of 1-buteen
-
Wat is een goed oplosmiddel voor cyclohexeen? pentaan of water?
Antwoord
-
- 1-penteen
- 3-noneen
Oefeningen voor begripsherziening
-
Benoem kort de belangrijke verschillen tussen een verzadigde koolwaterstof en een onverzadigde koolwaterstof.
-
Benoem kort de belangrijke verschillen tussen een alkeen en een alkaan.
-
Klasseer elke verbinding als verzadigd of onverzadigd. Identificeer elke verbinding als een alkaan, een alkeen of een alkyne.
-
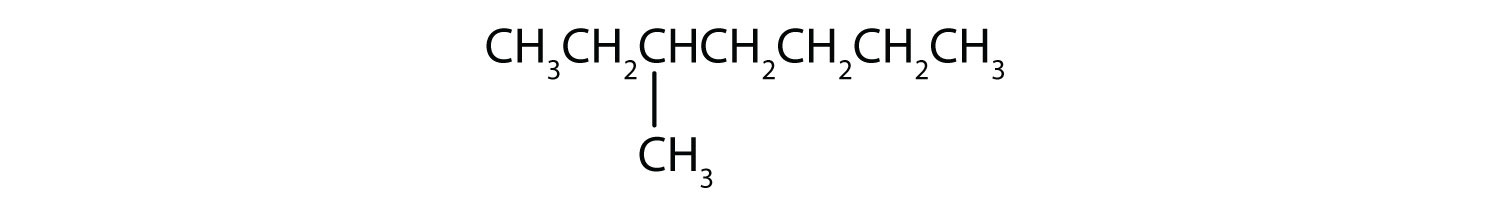
- CH3CH2C≡CCH3
-

-
Antwoorden
-
Onverzadigde koolwaterstoffen hebben dubbele of drievoudige bindingen en zijn vrij reactief; verzadigde koolwaterstoffen hebben slechts enkele bindingen en zijn weinig reactief.
-
Een alkeen heeft een dubbele binding; een alkaan heeft alleen enkele bindingen.
-
- verzadigd; alkaan
- onverzadigd; alkyne
- onverzadigd; alkeen
Key Takeaway
- Alkenen zijn koolwaterstoffen met een koolstof-op-koolstof-dubbele binding.
8.3 Alkynen
De eenvoudigste alkyne – een koolwaterstof met een drievoudige koolstof-koolstofbinding – heeft de molecuulformule C2H2 en is bekend onder zijn gewone naam acetyleen (fig. 8.5). De structuur is H-C≡C-H.
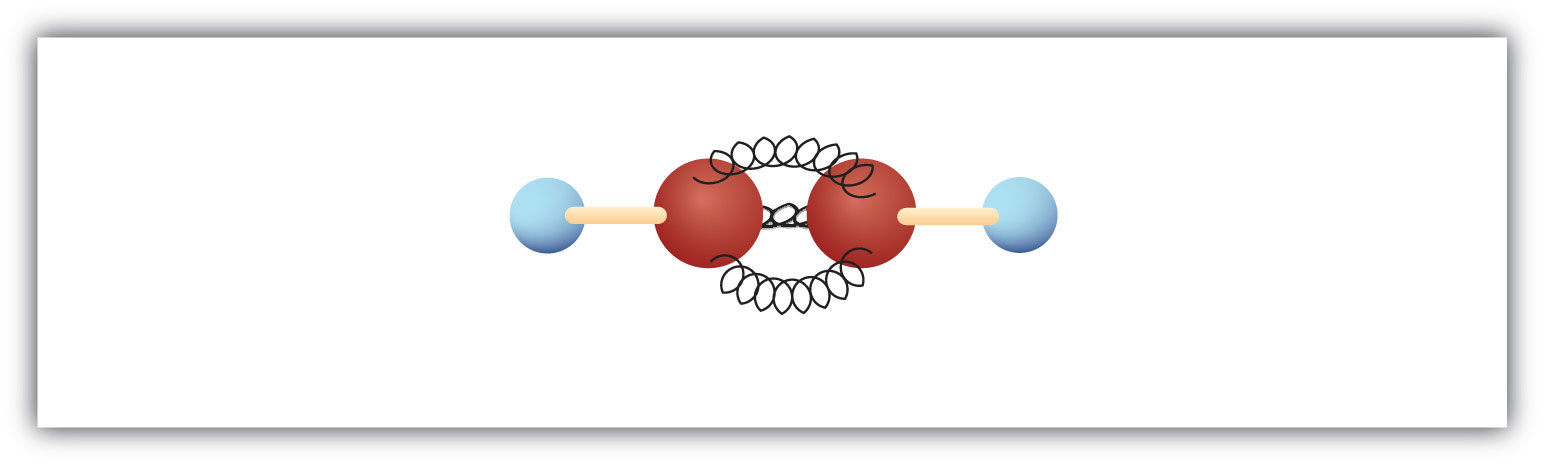
Figuur 8.5 Bal-en-veer-model van acetyleen. Acetyleen (ethyne) is het eenvoudigste lid van de alkyne-familie.
Noot
Acetyleen wordt gebruikt in oxyacetyleentoortsen voor het snijden en lassen van metalen. De vlam van zo’n toorts kan zeer heet zijn. Het meeste acetyleen wordt echter omgezet in chemische tussenproducten die worden gebruikt om vinyl- en acrylplastics, vezels, harsen en een verscheidenheid van andere producten te maken.
Alkynen zijn vergelijkbaar met alkenen in zowel fysische als chemische eigenschappen. Zo ondergaan alkynen veel van de typische additiereacties van alkenen. De namen van de Internationale Unie voor Zuivere en Toegepaste Chemie (IUPAC) voor alkynen komen overeen met die van alkenen, behalve dat de familie-einde -yne is in plaats van -ene. De IUPAC-naam voor acetyleen is ethyne. De namen van andere alkynen worden in de volgende oefeningen geïllustreerd.
Oefeningen voor begripsherziening
-
Benoem kort de belangrijke verschillen tussen een alkeen en een alkyne. Hoe lijken ze op elkaar?
-
Het alkeen (CH3)2CHCH2CH=CH2 wordt 4-methyl-1-penteen genoemd. Wat is de naam van (CH3)2CHCH2C≡CH?
-
Vertonen alkynen cis-trans-isomerisme? Leg uit.
Answers
-
Alkenen hebben dubbele bindingen; alkynen hebben drievoudige bindingen. Beide ondergaan additiereacties.
-
4-methyl-1-pentyne
-
Nee; een drievoudig gebonden koolstofatoom kan maar één andere binding vormen. Er zouden twee groepen aan vast moeten zitten om cis-trans-isomerisme te vertonen.
Key Takeaway
- Alkynen zijn koolwaterstoffen met drievoudige koolstofverbindingen en eigenschappen die veel lijken op die van alkenen.
Oefeningen
-
Teken voor elke verbinding de structuur.
- acetylene
- 3-methyl-1-hexyne
-
Teken voor elke verbinding de structuur.
- 4-methyl-2-hexyne
- 3-octyne
-
Noem elke alkyne.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Antwoorden
-
- H-C≡C-H
-
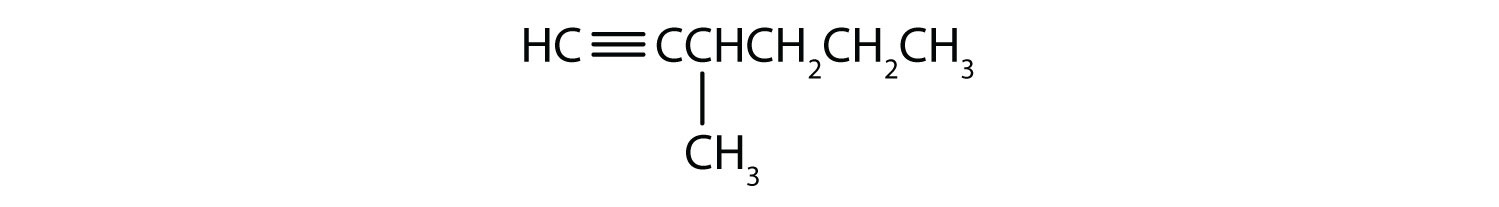
-
- 1-pentyne
- 2-hexyne
(Terug naar het begin)
8.4 Aromatische Verbindingen: Benzeen
Naast beschouwen we een klasse koolwaterstoffen met molecuulformules als die van onverzadigde koolwaterstoffen, maar die, in tegenstelling tot de alkenen, niet gemakkelijk additiereacties ondergaan. Deze verbindingen vormen een aparte klasse, de aromatische koolwaterstoffen. Aromatische koolwaterstoffen zijn verbindingen die een benzeenringstructuur bevatten.De eenvoudigste aromatische verbinding is benzeen (C6H6) en het is van groot commercieel belang, maar het heeft ook opmerkelijke schadelijke gevolgen voor de gezondheid (zie “Voor uw gezondheid: Benzeen en ons”).
De formule C6H6 lijkt aan te geven dat benzeen een hoge graad van onverzadiging heeft. (Hexaan, de verzadigde koolwaterstof met zes koolstofatomen heeft de formule C6H14 – acht waterstofatomen meer dan benzeen). Ondanks de schijnbaar lage verzadigingsgraad is benzeen echter vrij onreactief. Dit is te danken aan de resonantiestructuur die wordt gevormd door de alternerende dubbele bindingstructuur van de aromatische ring.

Noot
Benzeen is een vloeistof die ruikt naar benzine, kookt bij 80°C, en bevriest bij 5,5°C. Het is de aromatische koolwaterstof die in het grootste volume wordt geproduceerd. Vroeger werd het gebruikt om koffie cafeïnevrij te maken en het was een belangrijk bestanddeel van veel consumentenproducten, zoals verfafbijtmiddelen, rubbercement en vlekkenverwijderaars voor de stomerij. In de jaren 1950 werd het uit veel productformules verwijderd, maar anderen bleven benzeen gebruiken in producten tot de jaren 1970, toen het in verband werd gebracht met dodelijke leukemiegevallen. Benzeen is nog steeds belangrijk in de industrie als een precursor bij de productie van kunststoffen (zoals piepschuim en nylon), geneesmiddelen, detergenten, synthetisch rubber, pesticiden en kleurstoffen. Het wordt gebruikt als oplosmiddel voor bijvoorbeeld het reinigen en onderhouden van drukapparatuur en voor kleefstoffen zoals die welke worden gebruikt om schoenzolen aan elkaar te bevestigen. Benzeen is een natuurlijk bestanddeel van aardolieproducten, maar omdat het een bekend carcinogeen is, is het gebruik ervan als additief in benzine nu beperkt.
To Your Health: Benzene and Us
Het grootste deel van het commercieel gebruikte benzeen is afkomstig uit aardolie. Het wordt gebruikt als uitgangsmateriaal voor de productie van detergenten, geneesmiddelen, kleurstoffen, insecticiden en kunststoffen. Ooit werd benzeen op grote schaal gebruikt als een organisch oplosmiddel, maar nu is bekend dat het zowel op korte als op lange termijn toxische effecten heeft. Het inademen van grote concentraties kan misselijkheid veroorzaken en zelfs de dood door ademhalings- of hartfalen, terwijl herhaalde blootstelling leidt tot een progressieve ziekte waarbij het vermogen van het beenmerg om nieuwe bloedcellen aan te maken uiteindelijk wordt vernietigd. Dit resulteert in een aandoening die aplastische anemie wordt genoemd, waarbij het aantal rode en witte bloedcellen afneemt.
Concept Herzieningsoefeningen
-
Waarin verschillen de typische reacties van benzeen van die van de alkenen?
-
Beschrijf in het kort de bindingen in benzeen.
-
Wat betekent de cirkel in de scheikundige voorstelling van benzeen?
Antwoorden
-
Benzeen is in vergelijking met een alkeen tamelijk onreactief bij additiereacties.
-
De valentie-elektronen worden gelijkelijk gedeeld door alle zes koolstofatomen (dat wil zeggen dat de elektronen gedelokaliseerd zijn).
-
De zes elektronen worden gelijkelijk gedeeld door alle zes koolstofatomen.
Herkennen van aromatische verbindingen
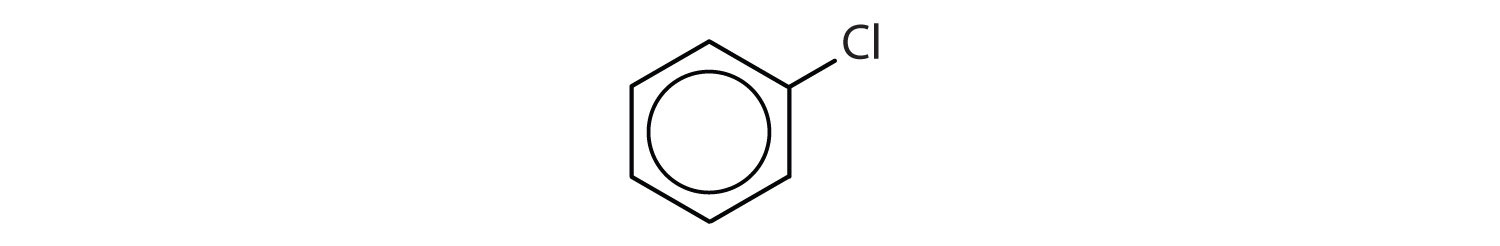
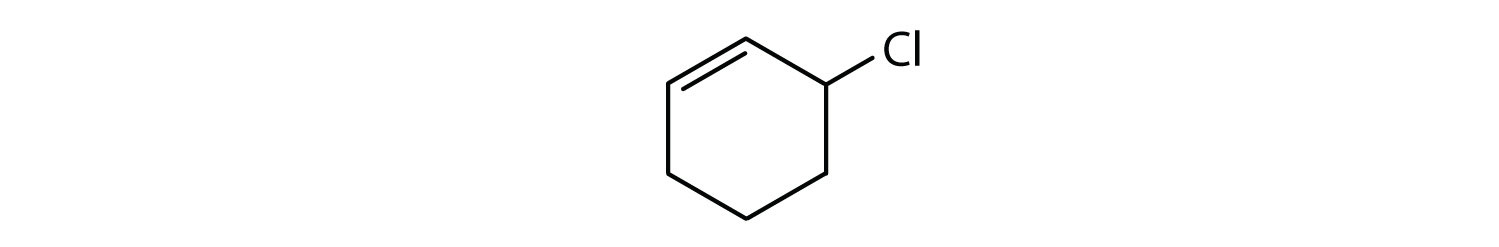
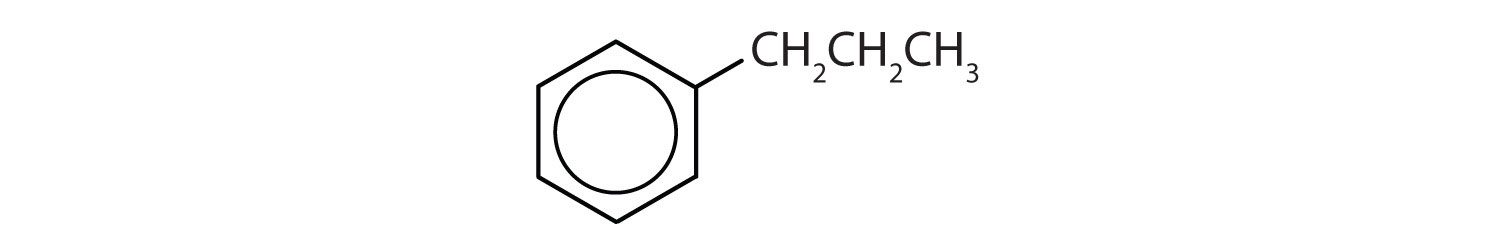
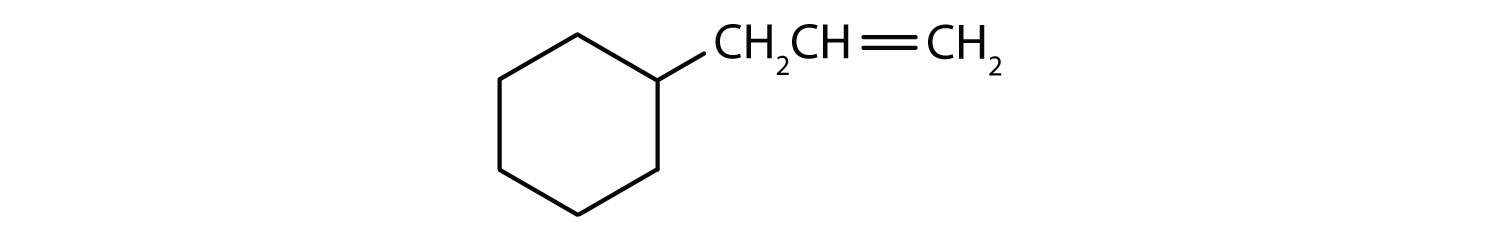
Welke verbindingen zijn aromatisch?
Oplossing
- De verbinding heeft een benzeenring (met een chlooratoom gesubstitueerd voor één van de waterstofatomen); het is aromatisch.
- De verbinding is cyclisch, maar heeft geen benzeenring; zij is niet aromatisch.
- De verbinding heeft een benzeenring (met een propylgroep gesubstitueerd voor een van de waterstofatomen); zij is aromatisch.
- De verbinding is cyclisch, maar heeft geen benzeenring; zij is niet aromatisch.
Skill-Building Exercise
Welke verbindingen zijn aromatisch?
In het systeem van de Internationale Unie voor Zuivere en Toegepaste Scheikunde (IUPAC) worden aromatische koolwaterstoffen genoemd als derivaten van benzeen. Hieronder worden vijf voorbeelden gegeven. In deze structuren maakt het niet uit of het enkele substituent aan de boven-, zij- of onderkant van de ring wordt geschreven: een zeshoek is symmetrisch, en daarom zijn alle posities gelijkwaardig.
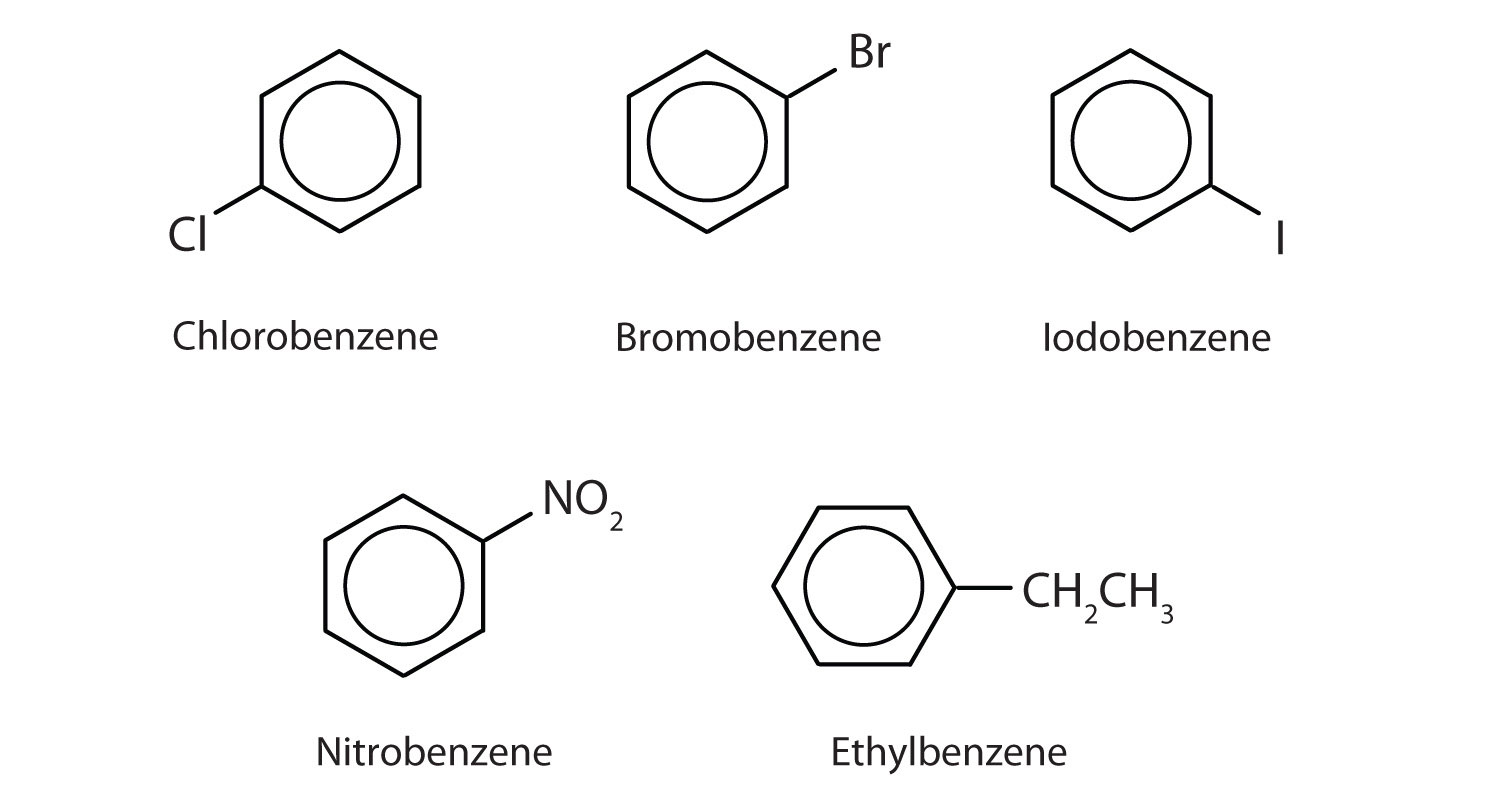
Deze verbindingen worden op de gebruikelijke manier genoemd, waarbij de groep die een waterstofatoom vervangt, als substituentgroep wordt genoemd: Cl als chloro, Br als bromo, I als iodo, NO2 als nitro, en CH3CH2 als ethyl.
Hoewel sommige verbindingen uitsluitend met IUPAC-namen worden aangeduid, worden sommige vaker aangeduid met gewone namen, zoals hieronder is aangegeven.
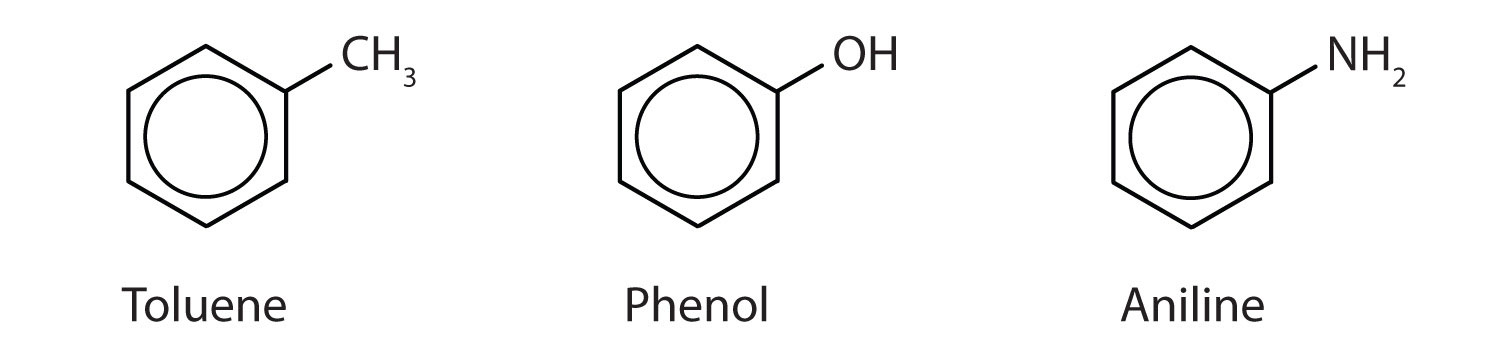
-
Key Takeaway
- Aromatische koolwaterstoffen lijken onverzadigd te zijn, maar ze hebben een speciaal type binding en ondergaan geen additiereacties.
(Terug naar het begin)
Polycyclische aromatische koolwaterstoffen
Sommige gewone aromatische koolwaterstoffen bestaan uit vergroeide benzeenringen-ringen die een gemeenschappelijke zijde hebben. Deze verbindingen worden polycyclische aromatische koolwaterstoffen (PAK’s genoemd)Een aromatische koolwaterstof die bestaat uit gesmolten benzeenringen die een gemeenschappelijke zijde delen..
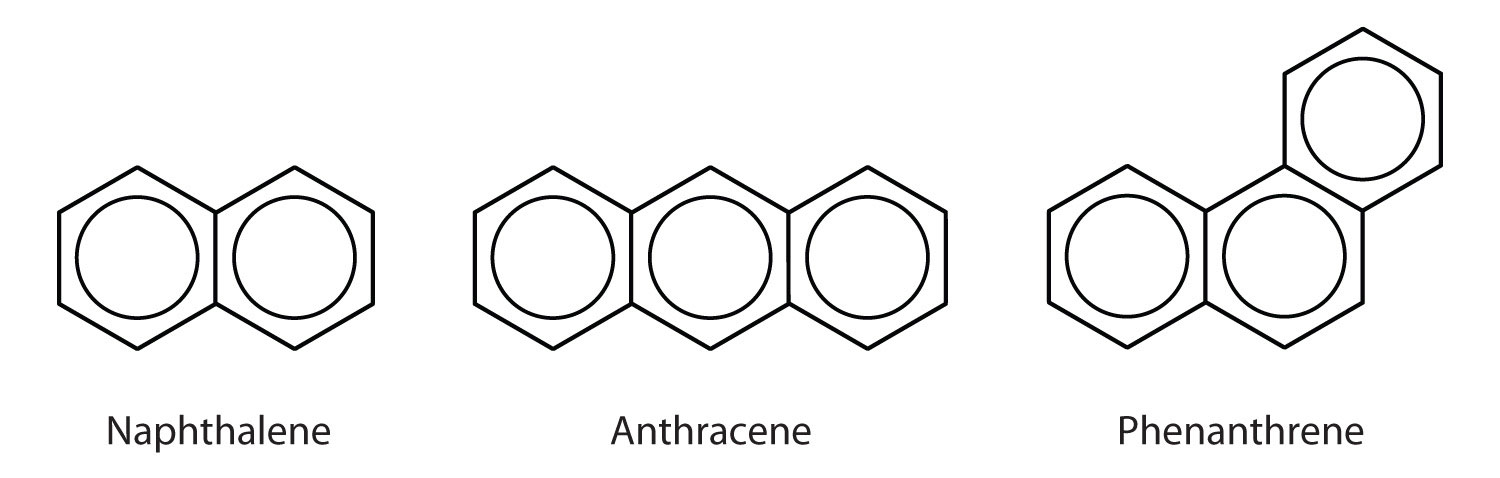
De drie hier getoonde voorbeelden zijn kleurloze, kristallijne vaste stoffen die over het algemeen worden verkregen uit koolteer. Naftaleen heeft een doordringende geur en wordt gebruikt in mottenballen. Antraceen wordt gebruikt bij de vervaardiging van bepaalde kleurstoffen. Steroïden, waaronder cholesterol en de hormonen oestrogeen en testosteron, bevatten de fenantreenstructuur.
Voor uw gezondheid: Polycyclische Aromatische Koolwaterstoffen en Kanker
De intense verhitting die nodig is voor het destilleren van koolteer leidt tot de vorming van PAK’s. Het is al vele jaren bekend dat werknemers in steenkoolteerraffinaderijen vatbaar zijn voor een vorm van huidkanker die bekend staat als teerkanker. Uit onderzoek is gebleken dat een aantal PAK’s carcinogenen zijn. Een van de meest actieve kankerverwekkende verbindingen, benzopyreen, komt voor in koolteer en is ook geïsoleerd uit sigarettenrook, marihuanarook, uitlaatgassen van auto’s en op houtskool geroosterde steaks. Naar schatting wordt in de Verenigde Staten jaarlijks meer dan 1.000 ton benzopyreen in de lucht uitgestoten. Er is slechts een paar milligram benzopyreen per kilogram lichaamsgewicht nodig om kanker te induceren bij proefdieren.
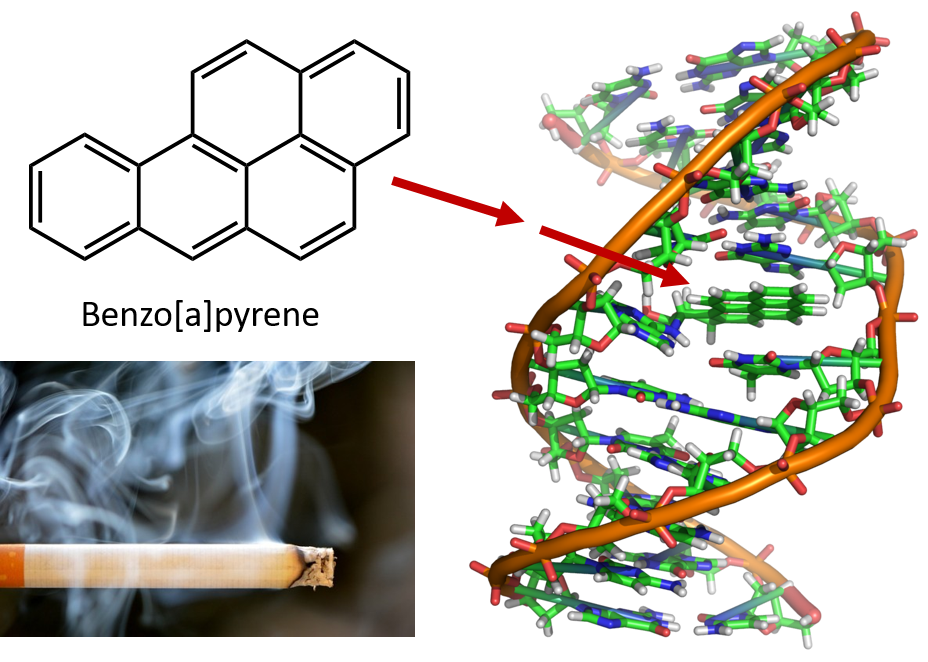
Figuur 8.6 Benzopyreen is een polycyclische aromatische koolwaterstof die als bijproduct ontstaat in koolteer, sigaretten- en marihuanarook en in op houtskool geroosterde biefstukken. Benzopyreen wordt gemetaboliseerd om biologisch actieve verbindingen te produceren die fysische adducten kunnen vormen op DNA-moleculen. Deze adducten kunnen genetische mutaties veroorzaken die kanker veroorzaken.
Foto van sigarettenrook
Biologisch belangrijke verbindingen met benzeenringen
Stoffen die de benzeenring bevatten, komen zowel bij dieren als planten voor, hoewel ze bij de laatste overvloediger aanwezig zijn. Planten kunnen de benzeenring synthetiseren uit kooldioxide, water en anorganische stoffen. Dieren kunnen het niet synthetiseren, maar zij zijn afhankelijk van bepaalde aromatische verbindingen om te overleven en moeten deze daarom uit voedsel halen. Fenylalanine, tyrosine en tryptofaan (essentiële aminozuren) en de vitamines K, B2 (riboflavine), en B9 (foliumzuur) bevatten allemaal de benzeenring. Veel belangrijke geneesmiddelen, waarvan er enkele in tabel 8.2 staan, hebben ook een benzeenring.
Noot
Tot nu toe hebben we alleen aromatische verbindingen met koolstofhoudende ringen bestudeerd. Veel cyclische verbindingen hebben echter een ander element dan koolstofatomen in de ring. Organische ringstructuren die een ander atoom dan koolstof bevatten, worden heterocyclische verbindingen genoemd, Heterocyclische aromatische verbindingen hebben ook unieke en medisch relevante eigenschappen.
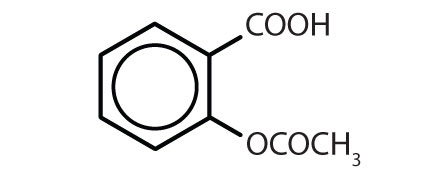
Tabel 8.2 Some Drugs That Contain a Benzene Ring
| Name | Structure |
|---|---|
| aspirine |
 |
| acetaminofen |
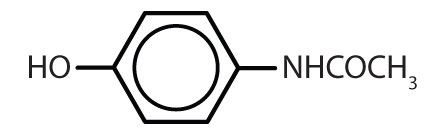 |
| ibuprofen |
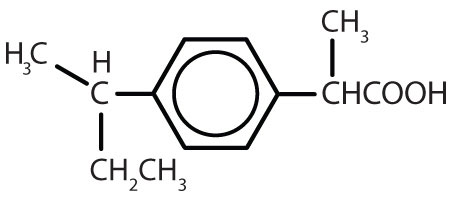 |
| amfetamine |
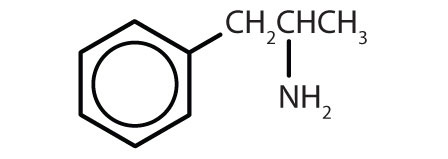 |
| sulfanilamide |
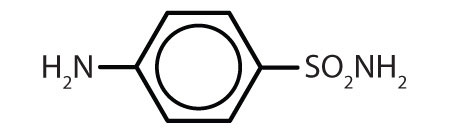 |
8.5 Geometrische Isomeren
In de structuur van alkanen is er vrije rotatie rond de koolstof-op-koolstof enkelvoudige bindingen (C-C). Daarentegen vereist de structuur van alkenen dat de koolstofatomen een dubbele binding vormen. Dubbele bindingen tussen elementen worden gecreëerd met behulp van p-baanschillen (ook pi orbitalen genoemd). Deze orbitalen hebben de vorm van halters in plaats van de cirkelvormige banen die bij enkele bindingen worden gebruikt. Dit voorkomt de vrije rotatie van de koolstofatomen rond de dubbele binding, omdat de dubbele binding dan tijdens de rotatie zou breken (figuur 8.7). Een enkele binding is dus te vergelijken met twee planken die met één spijker aan elkaar zijn gespijkerd. De planken zijn vrij om rond de enkele spijker te draaien. Een dubbele binding daarentegen is te vergelijken met twee planken die met twee spijkers aan elkaar zijn gespijkerd. In het eerste geval kun je de planken draaien, terwijl je ze in het tweede geval niet kunt draaien.

Figuur 8.7 Voor de vorming van dubbele bindingen is het gebruik van pi-bindingen nodig. Om moleculen dubbele bindingen te laten vormen, moeten elektronen overlappende pi-orbitalen delen tussen de twee atomen. Dit vereist dat de haltervormige pi-orbitalen (links afgebeeld) tijdens de vorming van de dubbele binding in een vaste conformatie blijven. Hierdoor kunnen elektronenbanen worden gevormd die door beide atomen kunnen worden gedeeld (zie rechts). Rotatie rond de dubbele binding zou ertoe leiden dat de pi orbitalen niet meer op één lijn liggen, waardoor de dubbele binding verbroken wordt.
Diagram afkomstig van: JoJanderivative work – Vladsinger (talk)
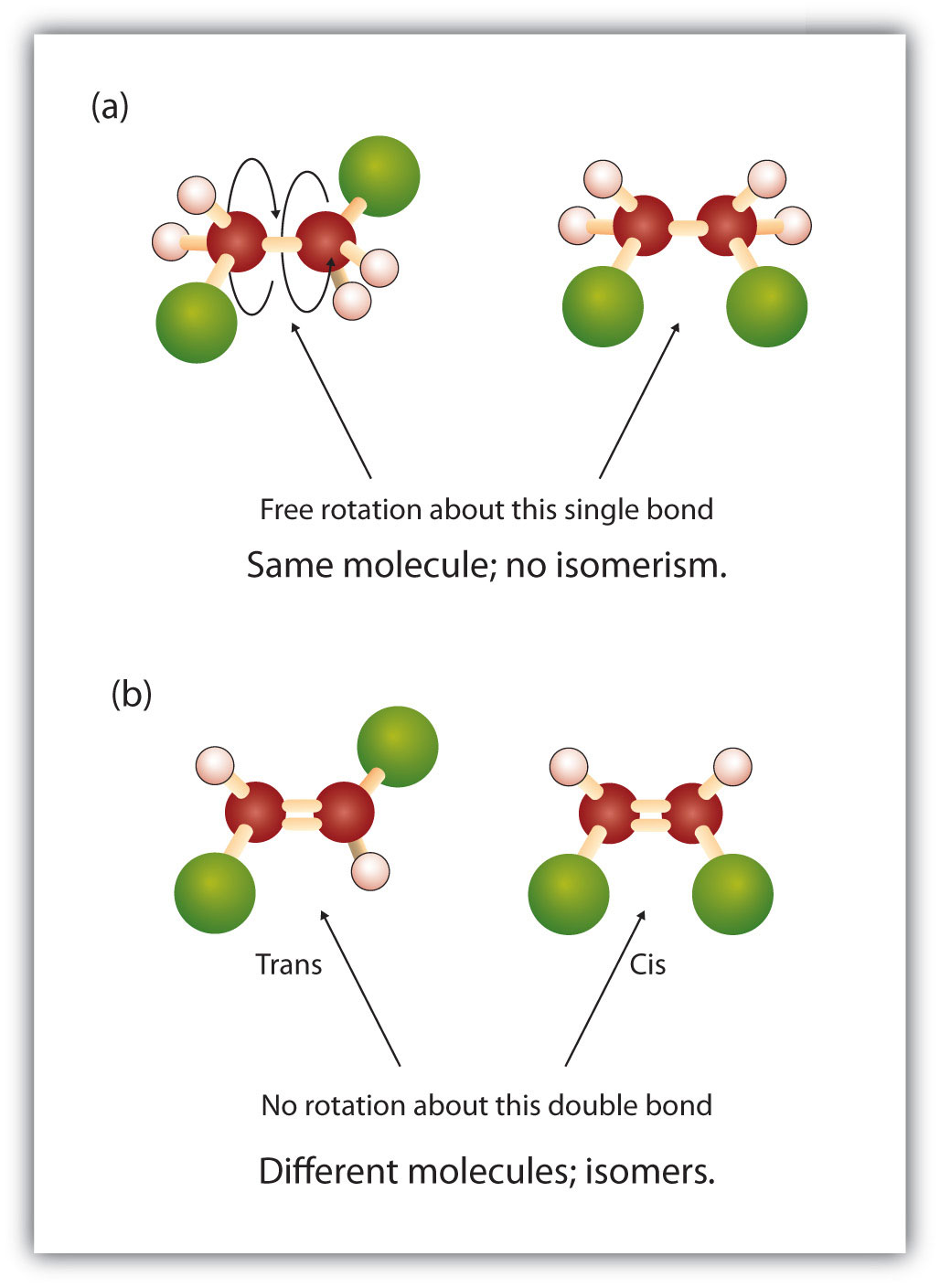
De vaste en starre aard van de dubbele binding creëert de mogelijkheid van een extra chiraal centrum, en dus de mogelijkheid van stereoisomeren. Nieuwe stereoisomeren ontstaan als aan elk van de in de dubbele binding betrokken carbons twee verschillende atomen of groepen vastzitten. Kijk bijvoorbeeld eens naar de twee gechloreerde koolwaterstoffen in figuur 8.8. In de bovenste figuur is het gehalogeneerde alkaan te zien. Rotatie rond deze koolstof-koolstof binding is mogelijk en resulteert niet in verschillende isomeerconformatie. In de onderste figuur heeft het gehalogeneerde alkeen beperkte rotatie rond de dubbele binding. Merk ook op dat elke koolstof die betrokken is bij de dubbele binding ook vastzit aan twee verschillende atomen (een waterstof en een chloor). Deze moleculen kunnen dus twee stereoisomeren vormen: een met de twee chlooratomen aan dezelfde kant van de dubbele binding, en een waarbij de chlooratomen aan tegenoverliggende kanten van de dubbele binding zitten.
Figuur 8.8 Alkeen dubbele bindingen kunnen geometrische isomeren vormen. (a) Toont de vrije rotatie rond een enkelvoudige koolstof-koolstof binding in de alkaanstructuur. (b) Toont de vaste positie van de koolstof-koolstof dubbele binding die leidt tot geometrische (ruimtelijke) isomeren.
Klik hier voor een Kahn Academy Video Tutorial over de structuur van Alkenen.
Voor dit gedeelte houden we ons niet bezig met de naamgeving die ook in deze video tutorial is opgenomen.(Opmerking: Alle Khan Academy-inhoud is gratis beschikbaar met gebruikmaking van CC-BY-NC-SA-licenties op www.khanacademy.org )
Cis-Trans-nomenclatuur
Het cis-trans-naamgevingssysteem kan worden gebruikt om eenvoudige isomeren te onderscheiden, waarbij elke koolstof van de dubbele binding een set identieke groepen aan zich heeft. Bijvoorbeeld, in figuur 8.8b zit aan elke koolstof van de dubbele binding een chloor vast, en ook waterstof. Het cis- en trans-systeem geeft aan of identieke groepen zich aan dezelfde kant (cis) van de dubbele binding bevinden of aan de tegenovergestelde kant (trans) van de dubbele binding. Bijvoorbeeld, als de waterstofatomen aan de tegenovergestelde kant van de dubbele binding zijn, wordt gezegd dat de binding in de trans-conformatie is. Als de waterstofgroepen aan dezelfde kant van de dubbele binding zitten, zegt men dat de binding zich in de cis-conformatie bevindt. Merk op dat je ook zou kunnen zeggen dat als beide chloorgroepen aan de tegenovergestelde kant van de dubbele binding zitten, dat het molecuul in de trans-conformatie zit of als ze aan dezelfde kant van de dubbele binding zitten, dat het molecuul in de cis-conformatie zit.
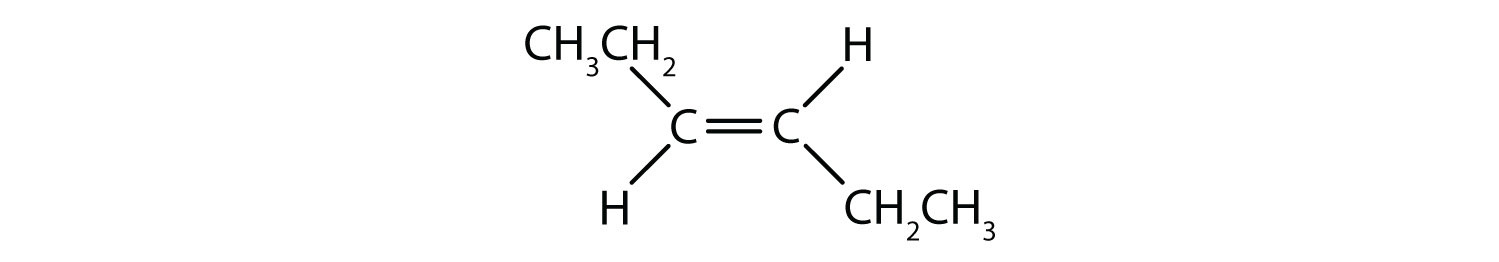
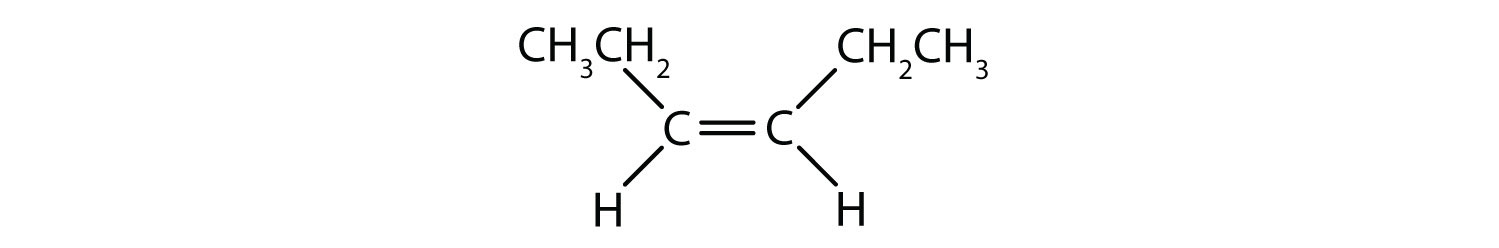
Om te bepalen of een molecuul cis of trans is, is het handig om een stippellijn te trekken langs het midden van de dubbele binding en dan de identieke groepen te omcirkelen, zoals te zien is in figuur 8.9. De beide moleculen in figuur 8.9 worden 1,2-dichlooretheen genoemd. De cis- en transaanduiding geeft dus alleen de stereochemie rond de dubbele binding aan, maar verandert niets aan de algemene identiteit van het molecuul. Cis- en trans-isomeren hebben echter vaak verschillende fysische en chemische eigenschappen, als gevolg van de vaste aard van de bindingen in de ruimte.
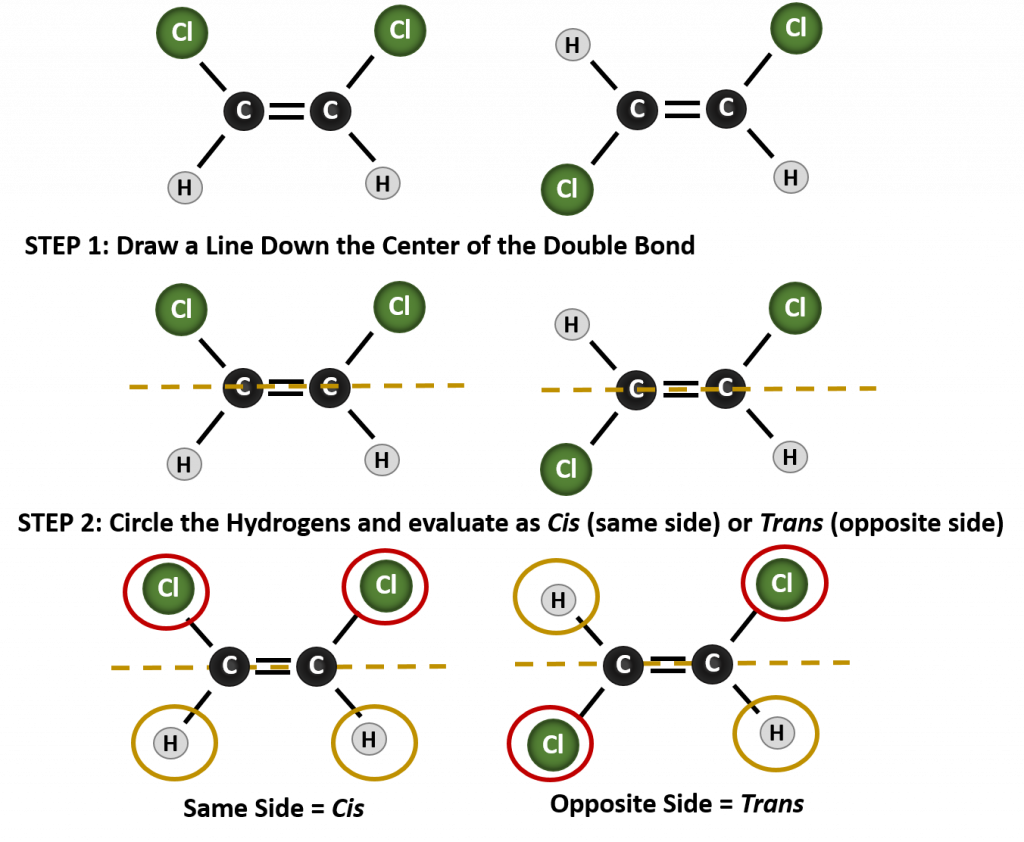
Figuur 8.9 Een gids voor het bepalen van Cis- of Transconformatie.
Klik hier voor een Kahn Academy-video over Cis/Trans-isomerisatie
(Opmerking: alle inhoud van de Khan Academy is gratis beschikbaar met gebruikmaking van CC-BY-NC-SA-licenties op www.khanacademy.org )
Cis-trans-isomerisme komt ook voor in cyclische verbindingen. In ringstructuren kunnen groepen niet roteren om een van de koolstof-koolstofbindingen in de ring. Daarom kunnen groepen ofwel aan dezelfde kant van de ring (cis) ofwel aan tegenovergestelde kanten van de ring (trans) staan. Voor ons doel stellen we alle cycloalkanen voor als vlakke structuren, en geven we de posities van de groepen aan, boven of onder het vlak van de ring.

To Your Health
Waarschijnlijk is de meest voorkomende plaats waar u in het dagelijks leven een verwijzing naar cis-transconformatie zult horen, de supermarkt of uw dokterspraktijk. Het heeft te maken met onze consumptie van voedingsvetten. Onjuiste of overmatige consumptie van voedingsvetten is in verband gebracht met veel gezondheidsaandoeningen, zoals diabetes en atherosclerose, en coronaire hartziekten. Wat zijn de verschillen tussen verzadigde en onverzadigde vetten en wat zijn transvetten en waarom zijn ze zo’n gezondheidsrisico?

Figuur 8.10 Veel voorkomende bronnen van voedingsvetten.
Foto van: TyMaHe
De meest voorkomende vorm van voedingsvetten en het belangrijkste bestanddeel van lichaamsvet bij mensen en andere dieren zijn de triglyceriden (TAG’s). TAGs, zoals weergegeven in figuur 8.10, zijn opgebouwd uit één molecuul glycerol en drie moleculen vetzuren die door een esterbinding aan elkaar zijn gekoppeld. In dit hoofdstuk zullen we ons richten op de structuur van de lange vetzuurstaarten, die kunnen bestaan uit alkaan- of alkeenstructuren. In hoofdstuk 10 zal meer aandacht worden besteed aan de vorming van de esterbindingen.

Figuur 8.11. Voorbeeld van de structuur van een triglyceride (TAG). Merk op dat elke triglyceride drie lange keten vetzuren heeft die uit de glycerolruggengraat steken. Elk vetzuur kan verschillende verzadigings- en onverzadigingsgraden hebben.
Structuur aangepast van: Wolfgang Schaefer
Vetten die volledig verzadigd zijn, hebben alleen vetzuren met lange alkaanketens. Men zegt dat ze ‘verzadigd’ zijn met waterstofatomen. Verzadigde vetten komen veel voor in het Amerikaanse dieet en zitten in rood vlees, zuivelproducten zoals melk, kaas en boter, kokosolie, en in veel gebakken producten. Verzadigde vetten zijn bij kamertemperatuur meestal vaste stoffen. Dit komt doordat de lange keten alkanen op elkaar kunnen stapelen met meer intermoleculaire Londense dispersiekrachten. Hierdoor hebben verzadigde vetten een hoger smelt- en kookpunt dan de onverzadigde vetten die in veel plantaardige oliën worden aangetroffen.
De meeste onverzadigde vetten die in de natuur worden aangetroffen, hebben de cis-conformatie, zoals weergegeven in figuur 8.11. Merk op dat de vetzuren in figuur 8.11 voor het gemak zijn getekend, zodat ze gemakkelijk te bekijken zijn en niet te veel ruimte op het papier innemen, maar de vermelde bindingshoeken geven de werkelijke ruimtelijke oriëntatie van de moleculen niet adequaat weer. Wanneer de vetzuren uit de TAG van figuur 8.11 met de juiste bindingshoeken worden getekend, is goed te zien dat cis-dubbele bindingen bochten in de alkenenketen veroorzaken (figuur 8.12).
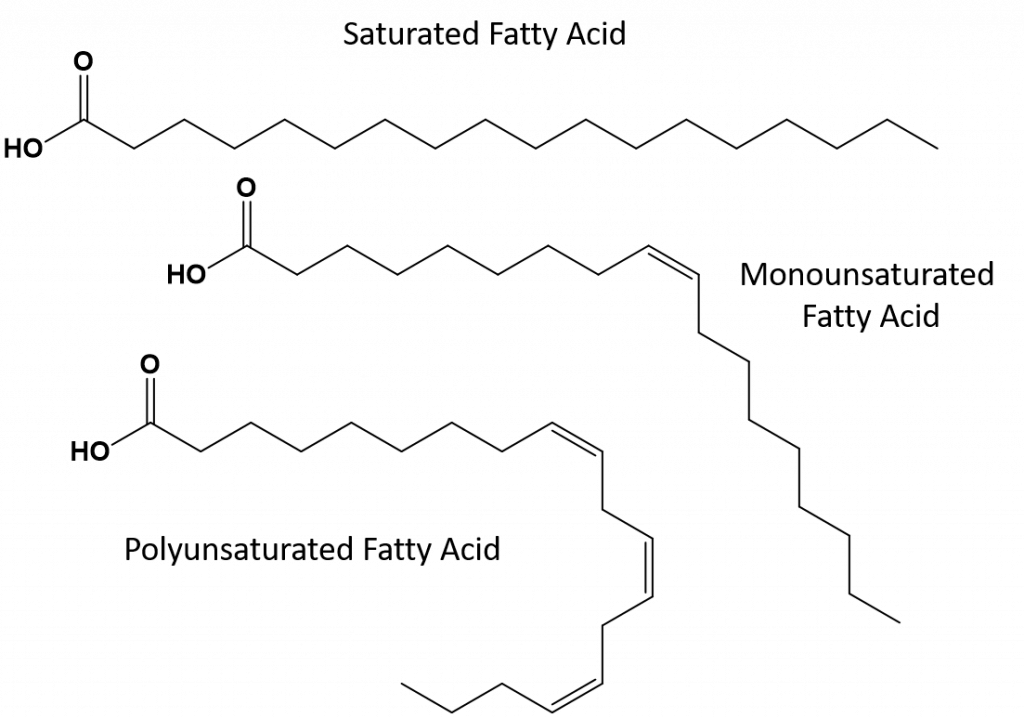
Figuur 8..12 Cis-dubbele bindingen veroorzaken krommingen in de vetzuurstructuur
Zo kunnen enkelvoudig en meervoudig onverzadigde vetten niet zo gemakkelijk op elkaar stapelen en hebben ze in vergelijking met verzadigde vetten niet zoveel intermoleculaire aantrekkingskrachten. Als gevolg daarvan hebben zij lagere smelt- en kookpunten en neigen zij ertoe bij kamertemperatuur vloeibaar te zijn. Het is aangetoond dat de vermindering of vervanging van verzadigde vetten door enkelvoudig en meervoudig onverzadigde vetten in de voeding bijdraagt tot een verlaging van het cholesterolgehalte in de vorm van lagedichtheid-lipoproteïnen (LDL), een risicofactor voor coronaire hartziekten.
Transvetten daarentegen bevatten dubbele bindingen die in de trans-conformatie zijn. De vorm van de vetzuren is dus lineair, vergelijkbaar met die van verzadigde vetten. Transvetten hebben ook een vergelijkbaar smelt- en kookpunt als verzadigde vetten. Transvetten komen echter, in tegenstelling tot verzadigde vetten, niet algemeen voor in de natuur en hebben negatieve gevolgen voor de gezondheid. Transvetten komen voornamelijk voor als bijproduct bij de verwerking van voedsel (voornamelijk het hydrogeneringsproces om margarine en shortening te maken) of tijdens het koken, vooral bij frituren. Veel fastfoodbedrijven gebruiken transvetten in hun frituurproces, omdat transvetten vele malen kunnen worden gebruikt voordat ze moeten worden vervangen. Consumptie van transvetten verhoogt het LDL-cholesterolgehalte in het lichaam (het slechte cholesterol dat in verband wordt gebracht met coronaire hartziekten) en heeft de neiging het HDL-cholesterol (High Density Lipoprotein) (het goede cholesterol in het lichaam) te verlagen. Transvetconsumptie verhoogt het risico op hartaandoeningen en beroerten, en op de ontwikkeling van diabetes type II. Het risico is zo groot dat veel landen het gebruik van transvetten hebben verboden, waaronder Noorwegen, Zweden, Oostenrijk en Zwitserland. In de Verenigde Staten heeft de Food and Drug Administration (FDA) onlangs een maatregel goedgekeurd om het gebruik van transvetten in levensmiddelen tegen 2018 geleidelijk af te schaffen. Deze maatregel zou naar schatting 20.000 hartaanvallen en 7.000 sterfgevallen per jaar voorkomen.
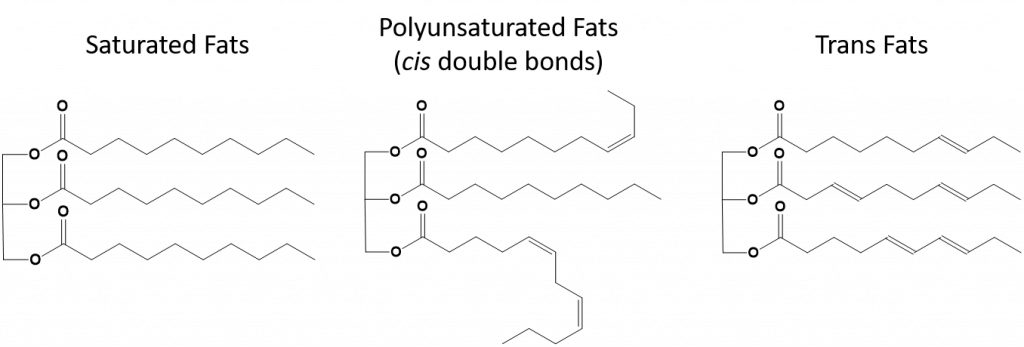
Figuur 8.13 Structurele verschillen in verzadigde, meervoudig onverzadigde en transvetten.
Klik hier voor een Kahn Academy Video Tutorial over verzadigde vetten, onverzadigde vetten en transvetten
(Opmerking: alle inhoud van de Khan Academy is gratis beschikbaar met gebruikmaking van CC-BY-NC-SA-licenties op www.khanacademy.org )
Key Factors for Determining Cis/Trans Isomerization
- De verbinding moet een dubbele of drievoudige binding bevatten, of een ringstructuur hebben die geen vrije rotatie rond de koolstof-koolstof binding toestaat.
- De verbinding moet twee niet-identieke groepen hebben aan elke koolstof die betrokken is bij de dubbele of drievoudige koolstof-koolstofbinding.
Worked Example
Welke verbindingen kunnen bestaan als cis-trans (geometrische) isomeren? Teken ze.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CHCH2CH3
Oplossing
Alle vier de structuren hebben een dubbele binding en voldoen dus aan regel 1 voor cis-trans isomerisme.
-
Deze verbinding voldoet aan regel 2; zij heeft twee niet-identieke groepen op elk koolstofatoom (H en Cl op de ene en H en Br op de andere). Het bestaat als cis- en trans-isomeer:

- Deze verbinding heeft twee waterstofatomen op een van de dubbel gebonden koolstofatomen; het voldoet niet aan regel 2 en bestaat niet als cis- en trans-isomeer.

- Deze verbinding heeft twee methyl (CH3) groepen op een van de dubbel gebonden koolstofatomen. Het faalt regel 2 en bestaat niet als cis en trans isomeren.

-
Deze verbinding voldoet aan regel 2; ze heeft twee niet-identieke groepen op elk koolstofatoom en bestaat zowel als cis- als trans-isomeer:

Skill-Building Exercise
-
Welke verbindingen kunnen bestaan als cis-trans-isomeer? Teken ze.
- CH2=CH2CH2CH3
- CH3CH=CH2CH3
- CH3CH2CH=CHCH2CH3
-
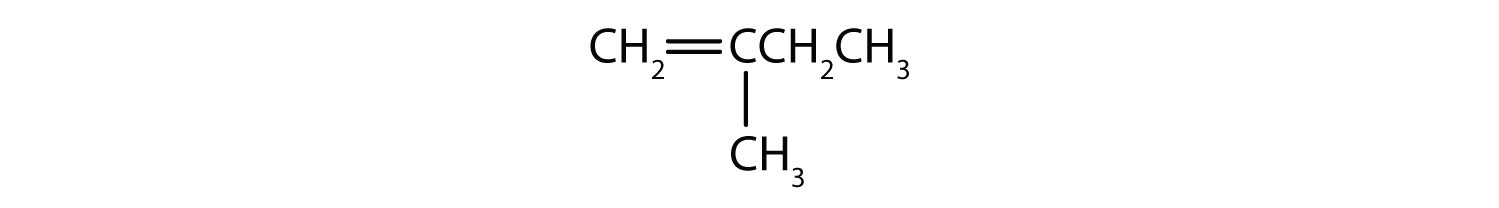
-
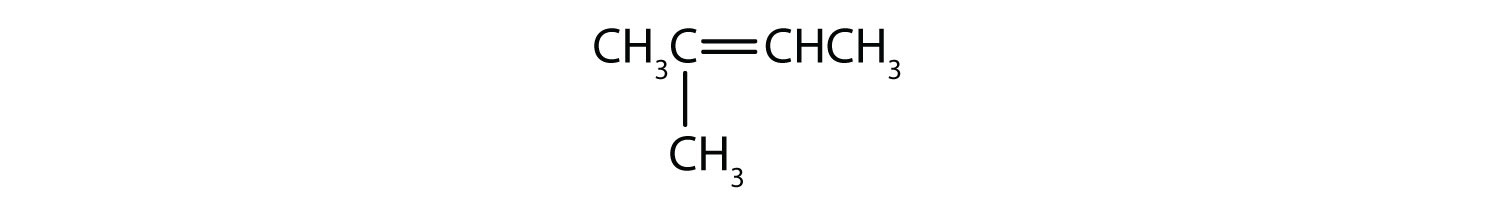
Concept Herhalingsoefeningen
-
Wat zijn cis-trans (geometrische) isomeren? Welke twee soorten verbindingen kunnen cis-trans-isomeren vertonen?
-
Kwalificeer elke verbinding als een cis-isomeer, een trans-isomeer, of geen van beide.
-
Antwoorden
-
Cis-trans-isomeren zijn verbindingen die verschillende configuraties hebben (groepen die permanent op verschillende plaatsen in de ruimte zitten) door de aanwezigheid van een starre structuur in hun molecuul. Alkenen en cyclische verbindingen kunnen cis-trans-isomerisme vertonen.
-
- trans
- cis
- geen van beide
Key Takeaway
- Cis-trans (geometrisch) isomerisme bestaat wanneer er een beperkte rotatie in een molecuul is en er twee verschillende groepen op elk koolstofatoom betrokken zijn bij de chemische binding.
(Terug naar het begin)
E-Z Nomenclatuur
De situatie wordt ingewikkelder wanneer er 4 verschillende groepen aan de koolstofatomen zijn verbonden die bij de vorming van de dubbele binding zijn betrokken. Het cis-trans naamgevingssysteem kan in dit geval niet worden gebruikt, omdat niet wordt aangegeven welke groepen door de nomenclatuur worden beschreven. In het onderstaande molecuul zou je bijvoorbeeld kunnen zeggen dat het chloor trans is aan de broomgroep, of je zou kunnen zeggen dat het chloor cis is aan de methylgroep (CH3). Het eenvoudigweg schrijven van cis of trans geeft in dit geval dus niet duidelijk de ruimtelijke oriëntatie van de groepen ten opzichte van de dubbele binding aan.
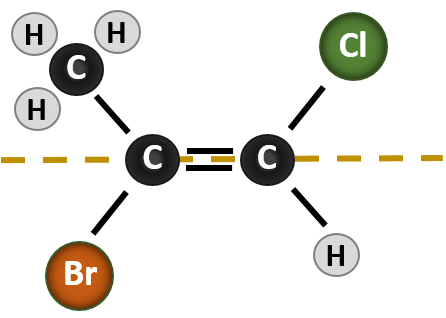
Voor het benoemen van de verschillende stereoisomeren die in deze situatie ontstaan, is kennis van de voorrangsregels nodig. Herinner u uit hoofdstuk 5 dat in het Cahn-Ingold-Prelog (CIP) prioriteitssysteem de groepen die aan de chirale koolstof vastzitten prioriteit krijgen op basis van hun atoomnummer (Z). Atomen met een hoger atoomnummer (meer protonen) krijgen een hogere prioriteit (d.w.z. S > P > O > N > C > H). Voor dit nomenclatuursysteem worden de benamingen (Z) en (E) gebruikt in plaats van het cis/trans-systeem. (E) komt van het Duitse woord entgegen, of tegenovergesteld. Wanneer de hogere prioriteitsgroepen zich dus aan de tegenovergestelde kant van de dubbele binding bevinden, wordt gezegd dat de binding zich in de (E) conformatie bevindt. (Z) daarentegen komt van het Duitse woord zusammen, of samen. Dus als de hogere prioriteitsgroepen zich aan dezelfde kant van de dubbele binding bevinden, heeft de binding de (Z) conformatie. Figuur 8.14 toont de stappen die worden gebruikt bij het toewijzen van de (E) of (Z) conformatie van een molecuul.
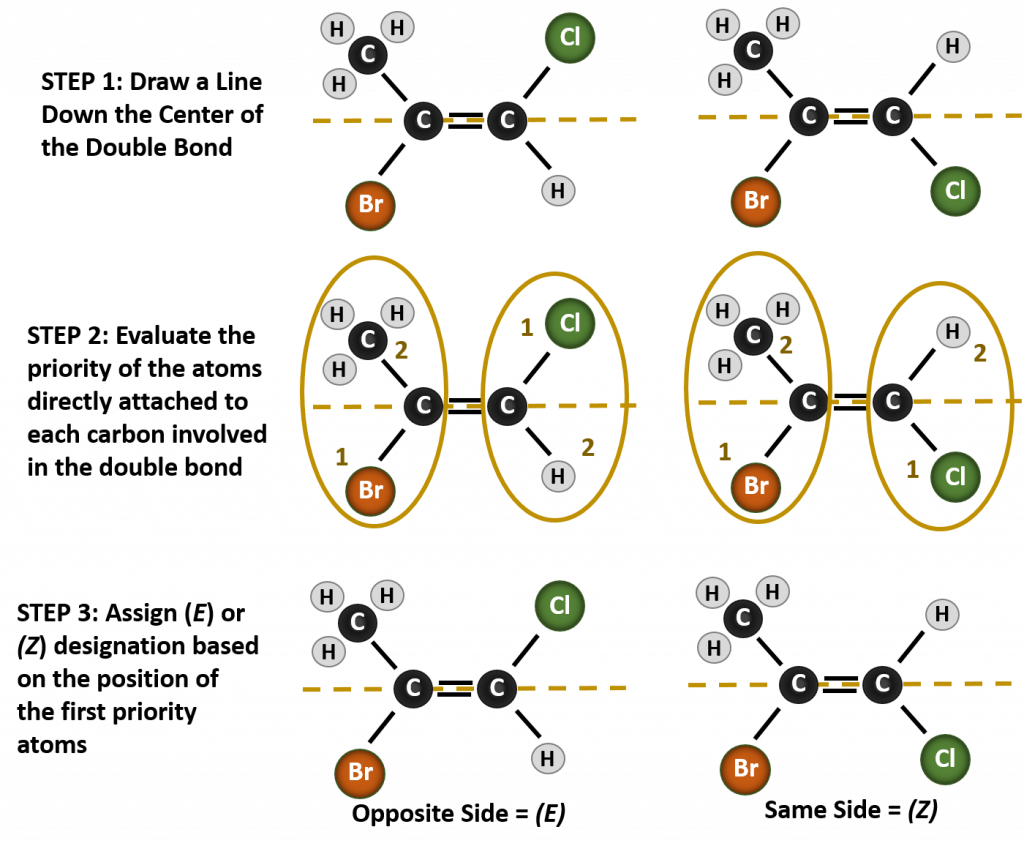
Figuur 8.14 Stappen die worden gebruikt om de (E) en (Z) conformatie toe te wijzen.
Klik hier voor een Kahn Academy Video Tutorial over E/Z-isomerisatie.
(Opmerking: alle inhoud van de Khan Academy is gratis beschikbaar met gebruikmaking van CC-BY-NC-SA-licenties op www.khanacademy.org )