Lärandemål
- Förklara uppbyggnaden och användningen av ett typiskt fasdiagram
- Använda fasdiagram för att identifiera stabila faser vid givna temperaturer och tryck, och för att beskriva fasövergångar till följd av förändringar i dessa egenskaper
- Beskriv materiens superkritiska vätskefas
I föregående modul beskrevs variationen av en vätskas jämviktsångtryck med temperaturen. Med tanke på definitionen av kokpunkt representerar plottar av ångtrycket mot temperaturen hur vätskans kokpunkt varierar med trycket. Dessutom beskrivs användningen av uppvärmnings- och avkylningskurvor för att bestämma ett ämnes smält- (eller fryspunkt). Genom att göra sådana mätningar över ett brett tryckintervall erhålls data som kan presenteras grafiskt som ett fasdiagram. I ett fasdiagram kombineras tryck- och temperaturdiagram för ett ämnes fasövergångsjämvikter mellan vätska och gas, fast och flytande samt fast och gas. Dessa diagram visar de fysikaliska tillstånd som existerar under specifika tryck- och temperaturförhållanden och visar även tryckberoendet för fasövergångstemperaturerna (smältpunkter, sublimeringspunkter, kokpunkter). Ett typiskt fasdiagram för ett rent ämne visas i figur 1.
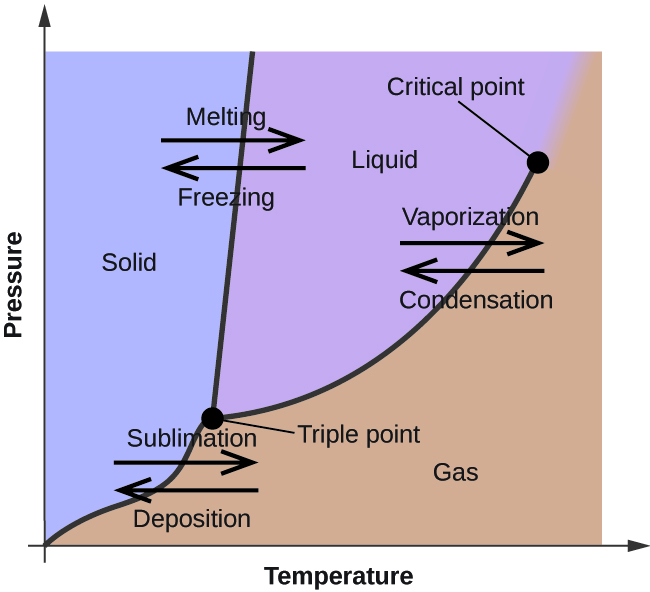
För att illustrera användbarheten av dessa diagram kan man betrakta fasdiagrammet för vatten som visas i figur 2.
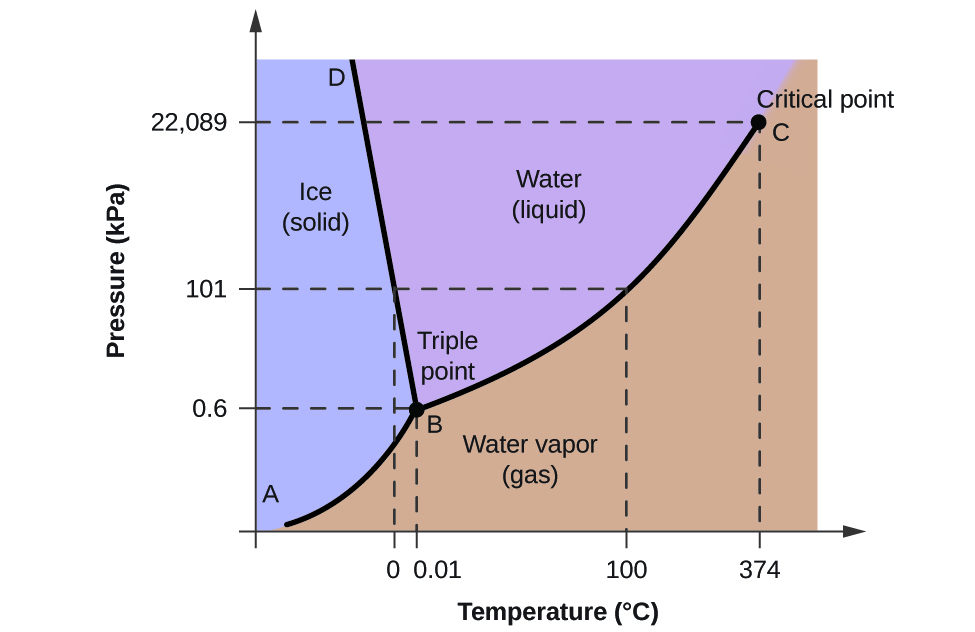
Vi kan använda fasdiagrammet för att identifiera det fysikaliska tillståndet hos ett vattenprov under angivna tryck- och temperaturförhållanden. Exempelvis motsvarar ett tryck på 50 kPa och en temperatur på -10 °C det område i diagrammet som är märkt ”is”. Under dessa förhållanden existerar vatten endast i fast form (is). Ett tryck på 50 kPa och en temperatur på 50 °C motsvarar området ”vatten” – här existerar vatten endast som vätska. Vid 25 kPa och 200 °C existerar vatten endast i gasform. Observera att i H2O-fasdiagrammet är tryck- och temperaturaxlarna inte ritade i en konstant skala för att möjliggöra en illustration av flera viktiga egenskaper som beskrivs här.
Kurvan BC i figur 2 är en kurva över ångtrycket i förhållande till temperaturen enligt beskrivningen i den föregående modulen i detta kapitel. Denna ”vätske-damp”-kurva skiljer de flytande och gasformiga områdena i fasdiagrammet åt och ger kokpunkten för vatten vid alla tryck. Vid 1 atm är kokpunkten till exempel 100 °C. Observera att vätske-damp-kurvan slutar vid en temperatur på 374 °C och ett tryck på 218 atm, vilket visar att vatten inte kan existera som vätska över denna temperatur, oavsett tryck. De fysikaliska egenskaperna hos vatten under dessa förhållanden ligger mellan de flytande och gasformiga faserna. Detta unika tillstånd kallas en superkritisk vätska, ett ämne som kommer att beskrivas i nästa avsnitt av denna modul.
Fasta-damp-kurvan, märkt AB i figur 2, anger de temperaturer och tryck vid vilka is och vattenånga befinner sig i jämvikt. Dessa temperatur- och tryckdatapar motsvarar sublimeringspunkterna, eller avlagringspunkterna, för vatten. Om vi kunde zooma in på fast-gaslinjen i figur 2 skulle vi se att is har ett ångtryck på cirka 0,20 kPa vid -10 °C. Om vi placerar ett fruset prov i ett vakuum med ett tryck som är lägre än 0,20 kPa kommer isen alltså att sublimera. Detta är grunden för den ”frystorkningsprocess” som ofta används för att konservera livsmedel, t.ex. den glass som visas i figur 3.

Den fast-vätskekurva som är märkt BD visar de temperaturer och tryck vid vilka is och flytande vatten är i jämvikt, vilket representerar smält- och fryspunkterna för vatten. Observera att denna kurva uppvisar en lätt negativ lutning (kraftigt överdriven för tydlighetens skull), vilket indikerar att smältpunkten för vatten sjunker något när trycket ökar. Vatten är ett ovanligt ämne i detta avseende, eftersom de flesta ämnen uppvisar en ökning av smältpunkten med ökande tryck. Detta beteende är delvis orsaken till att glaciärer rör sig, som den som visas i figur 4. Botten av en glaciär upplever ett enormt tryck på grund av dess vikt som kan smälta en del av isen och bilda ett lager flytande vatten på vilket glaciären lättare kan glida.

Skärningspunkten för alla tre kurvorna är markerad med B i figur 2. Vid det tryck och den temperatur som representeras av denna punkt samexisterar alla tre vattenfaserna i jämvikt. Detta temperatur- och tryckdatapar kallas trippelpunkten. Vid tryck lägre än trippelpunkten kan vatten inte existera som vätska, oavsett temperatur.
Exempel 1
Bestämning av vattnets tillstånd
Med hjälp av fasdiagrammet för vatten i figur 2, bestäm vattnets tillstånd vid följande temperaturer och tryck:
(a) -10 °C och 50 kPa
(b) 25 °C och 90 kPa
(c) 50 °C och 40 kPa
(d) 80 °C och 5 kPa
(e) -10 °C och 0.3 kPa
(f) 50 °C och 0,3 kPa
Lösning
Med hjälp av fasdiagrammet för vatten kan vi bestämma att vattnets tillstånd vid varje given temperatur och tryck är följande: (a) fast, (b) flytande, (c) flytande, (d) gas, (e) fast, (f) gas.
Kontrollera din inlärning
Vilka fasförändringar kan vatten genomgå när temperaturen ändras om trycket hålls på 0,3 kPa? Om trycket hålls vid 50 kPa?
Svar:
Vid 0,3 kPa: \text{s}\;{\longrightarrow}\;\text{g} vid -58 °C. Vid 50 kPa: \text{s}\\;{\longrightarrow}\;\text{l} vid 0 °C, \text{l}\;{\longrightarrow}\;\text{g} vid 78 °C
Konsultera fasdiagrammet för koldioxid som visas i figur 5 som ett annat exempel. Kurvan för fast-vätska uppvisar en positiv lutning, vilket tyder på att smältpunkten för koldioxid ökar med trycket, vilket den gör för de flesta ämnen (vatten är ett anmärkningsvärt undantag som beskrivits tidigare). Lägg märke till att trippelpunkten ligger långt över 1 atm, vilket tyder på att koldioxid inte kan existera som vätska under omgivande tryckförhållanden. Istället leder nedkylning av gasformig koldioxid vid 1 atm till att den övergår till fast form. På samma sätt smälter inte fast koldioxid vid ett tryck på 1 atm utan sublimerar i stället till gasformig koldioxid. Lägg slutligen märke till att den kritiska punkten för koldioxid observeras vid en relativt blygsam temperatur och tryck i jämförelse med vatten.
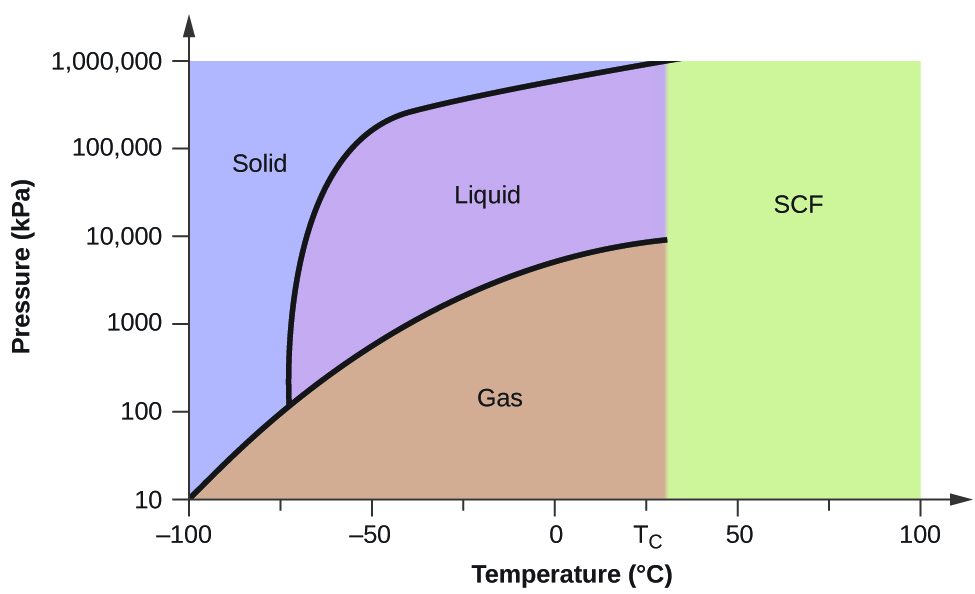
Exempel 2
Bestämning av koldioxidens tillstånd
Med hjälp av fasdiagrammet för koldioxid som visas i figur 5, bestäm koldioxidens tillstånd vid följande temperaturer och tryck:
(a) -30 °C och 2000 kPa
(b) -60 °C och 1000 kPa
(c) -60 °C och 100 kPa
(d) 20 °C och 1500 kPa
(d) 20 °C och 1500 kPa. kPa
(e) 0 °C och 100 kPa
(f) 20 °C och 100 kPa
Lösning
Med hjälp av det tillhandahållna fasdiagrammet för koldioxid, kan vi bestämma att koldioxidens tillstånd vid varje given temperatur och tryck är följande: (a) flytande, (b) fast, (c) gas, (d) flytande, (e) gas, (f) gas.
Kontrollera din inlärning
Bestäm vilka fasförändringar koldioxid genomgår när dess temperatur varieras och trycket hålls konstant på 1500 kPa? Vid 500 kPa? Vid vilka ungefärliga temperaturer sker dessa fasförändringar?
Svar:
vid 1500 kPa: \text{s}\\;{\longrightarrow}\;\text{l} vid -45 °C, \text{l}\;{\longrightarrow}\;\text{g} vid -10 °C;
vid 500 kPa: \text{s}\;{\longrightarrow}\;\text{g} vid -58 °C
Om vi placerar ett vattenprov i en förseglad behållare vid 25 °C, tar bort luften och låter jämvikten mellan förångning och kondensation etableras, får vi en blandning av flytande vatten och vattenånga vid ett tryck på 0,03 atm. En tydlig gräns mellan den tätare vätskan och den mindre täta gasen kan tydligt observeras. När vi ökar temperaturen ökar trycket i vattenångan, vilket beskrivs av vätske-gas-kurvan i fasdiagrammet för vatten (figur 2), och en tvåfasig jämvikt mellan flytande och gasformiga faser kvarstår. Vid en temperatur på 374 °C har ångtrycket stigit till 218 atm, och varje ytterligare temperaturökning leder till att gränsen mellan vätske- och ångfaserna försvinner. Allt vatten i behållaren finns nu i en enda fas vars fysikaliska egenskaper ligger mellan gasformiga och flytande tillstånd. Denna fas av materia kallas superkritisk vätska, och den temperatur och det tryck över vilka denna fas existerar är den kritiska punkten (figur 6). Över den kritiska temperaturen kan en gas inte göras flytande oavsett hur mycket tryck som tillämpas. Det tryck som krävs för att göra en gas flytande vid dess kritiska temperatur kallas det kritiska trycket. De kritiska temperaturerna och kritiska trycken för några vanliga ämnen anges i tabell 6.
| Substans | Kritisk temperatur (K) | Kritiskt tryck (atm) |
|---|---|---|
| Vätgas | 33.2 | 12.8 |
| kväve | 126.0 | 33.5 |
| oxygen | 154.3 | 49.7 |
| koldioxid | 304.2 | 73.0 |
| ammoniak | 405.5 | 111.5 |
| svaveldioxid | 430.3 | 77.7 |
| vatten | 647.1 | 217.7 |
| Tabell 6. | ||

Observera övergången från flytande till superkritisk vätska för koldioxid.
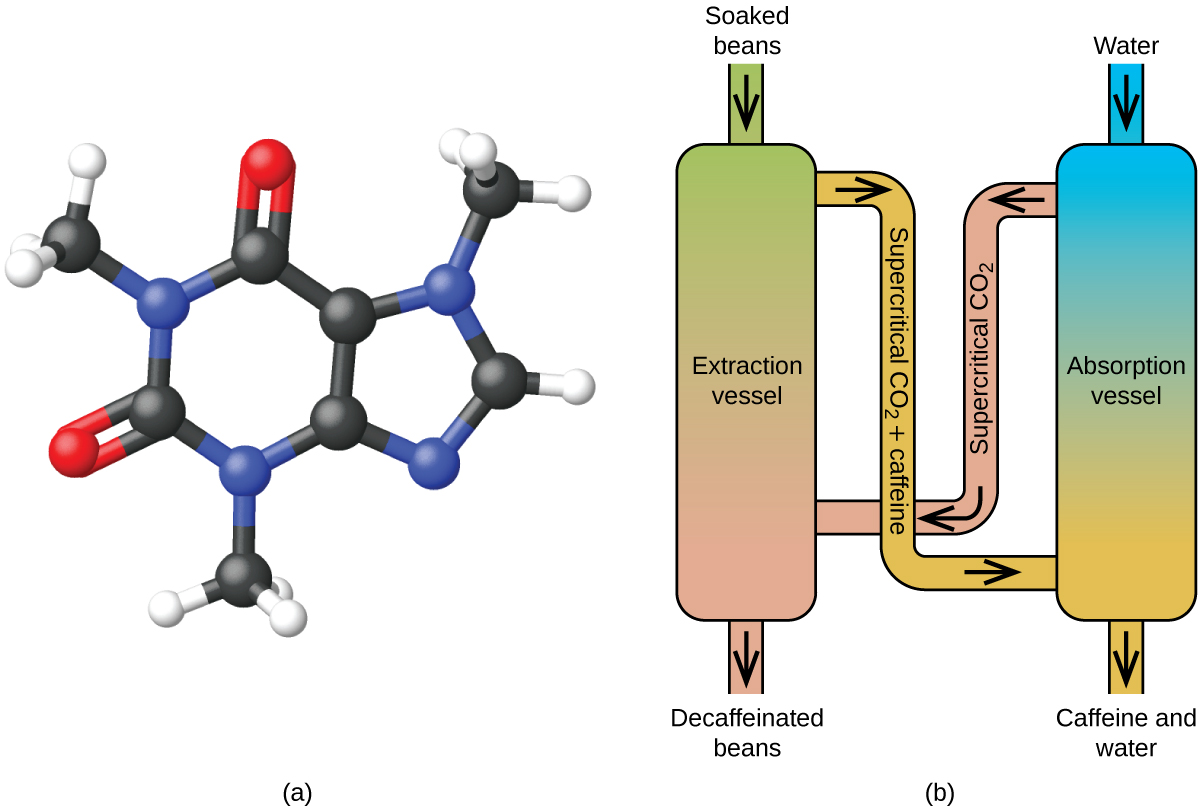
Likt en gas kommer en superkritisk vätska att expandera och fylla en behållare, men dess densitet är mycket större än typiska gastätheter, och ligger vanligtvis nära densiteten för vätskor. I likhet med vätskor kan dessa vätskor lösa upp icke-flyktiga lösningsmedel. De uppvisar dock i stort sett ingen ytspänning och mycket låg viskositet, vilket gör att de mer effektivt kan tränga igenom mycket små öppningar i en fast blandning och avlägsna lösliga komponenter. Dessa egenskaper gör superkritiska vätskor till extremt användbara lösningsmedel för ett stort antal tillämpningar. Till exempel har superkritisk koldioxid blivit ett mycket populärt lösningsmedel inom livsmedelsindustrin och används för att avkoffeinera kaffe, avlägsna fett från potatischips och extrahera smak- och doftföreningar från citrusoljor. Det är giftfritt, relativt billigt och anses inte vara förorenande. Efter användning kan CO2 lätt återvinnas genom att minska trycket och samla upp den resulterande gasen.
Exempel 3
Koldioxidens kritiska temperatur
Om vi skakar en koldioxidhaltig brandsläckare en kylig dag (18 °C) kan vi höra flytande CO2 skvalpa runt i flaskan. Samma flaska verkar dock inte innehålla någon vätska en varm sommardag (35 °C). Förklara dessa observationer.
Lösning
På den kalla dagen är koldioxidens temperatur lägre än koldioxidens kritiska temperatur, 304 K eller 31 °C (tabell 6), så det finns flytande koldioxid i flaskan. Under den varma dagen är koldioxidens temperatur högre än dess kritiska temperatur på 31 °C. Över denna temperatur kan ingen tryckmängd göra CO2 flytande, så det finns ingen flytande CO2 i brandsläckaren.
Kontrollera din inlärning
Ammoniak kan göras flytande genom kompression vid rumstemperatur; syre kan inte göras flytande under dessa förhållanden. Varför uppvisar de två gaserna olika beteende?
Svar:
Den kritiska temperaturen för ammoniak är 405,5 K, vilket är högre än rumstemperaturen. Den kritiska temperaturen för syre är lägre än rumstemperatur; syre kan därför inte göras flytande vid rumstemperatur.
Dekoffeinering av kaffe med hjälp av superkritisk CO2
Koffe är världens näst mest handlade råvara, efter olja. Över hela världen älskar människor kaffets arom och smak. Många av oss är också beroende av en av kaffets beståndsdelar – koffein – för att komma igång på morgonen eller för att hålla oss alerta på eftermiddagen. Men sent på dagen kan kaffets stimulerande effekt hindra dig från att sova, så du kan välja att dricka koffeinfritt kaffe på kvällen.
Sedan början av 1900-talet har många metoder använts för att avkoffeinera kaffe. Alla har för- och nackdelar och alla beror på koffeinets fysikaliska och kemiska egenskaper. Eftersom koffein är en något polär molekyl löser det sig bra i vatten, en polär vätska. Men eftersom många av de drygt 400 andra föreningar som bidrar till kaffets smak och arom också löser sig i H2O, kan avkoffeineringsprocesser med varmt vatten också avlägsna en del av dessa föreningar, vilket påverkar doften och smaken av det koffeinfria kaffet negativt. Diklormetan (CH2Cl2) och etylacetat (CH3CO2C2H5) har liknande polaritet som koffein och är därför mycket effektiva lösningsmedel för extraktion av koffein, men båda avlägsnar också vissa smak- och aromkomponenter, och användningen av dem kräver långa extraktions- och rengöringstider. Eftersom båda dessa lösningsmedel är giftiga har hälsorisker väckts angående effekten av rester av lösningsmedel i det koffeinfria kaffet.
Superkritisk vätskeextraktion med hjälp av koldioxid används nu i stor utsträckning som en effektivare och miljövänligare avkoffeineringsmetod (figur 7). Vid temperaturer över 304,2 K och tryck över 7376 kPa är koldioxid en superkritisk vätska med egenskaper som både gas och vätska. Som gas tränger den djupt in i kaffebönorna och som vätska löser den effektivt upp vissa ämnen. Vid superkritisk koldioxidextraktion av ångade kaffebönor avlägsnas 97-99 % av koffeinet, medan kaffets smak- och aromföreningar förblir intakta. Eftersom koldioxid är en gas under standardförhållanden är det lätt att avlägsna den från de extraherade kaffebönorna, liksom att återvinna koffeinet från extraktet. Det koffein som återvinns från kaffebönor genom denna process är en värdefull produkt som senare kan användas som tillsats i andra livsmedel eller läkemedel.
Nyckelbegrepp och sammanfattning
Temperatur- och tryckförhållandena vid vilka ett ämne existerar i fast, flytande och gasformigt tillstånd sammanfattas i ett fasdiagram för det ämnet. Fasdiagram är kombinerade plottar av tre tryck-temperatur jämviktskurvor: fast-flytande, flytande-gas och fast-gas. Dessa kurvor representerar förhållandet mellan fasövergångstemperaturer och tryck. Skärningspunkten mellan de tre kurvorna representerar ämnets trippelpunkt – den temperatur och det tryck vid vilka alla tre faserna är i jämvikt. Vid tryck under trippelpunkten kan ett ämne inte existera i flytande tillstånd, oavsett temperatur. Slutpunkten på vätske-gas-kurvan representerar ämnets kritiska punkt, dvs. det tryck och den temperatur över vilka en flytande fas inte kan existera.
Kemi övningar i slutet av kapitlet
- Utifrån fasdiagrammet för vatten (figur 2), bestäm vattnets tillstånd vid:
(a) 35 °C och 85 kPa
(b) -15 °C och 40 kPa
(c) -15 °C och 0.1 kPa
(d) 75 °C och 3 kPa
(e) 40 °C och 0,1 kPa
(f) 60 °C och 50 kPa
- Vilka fasförändringar kommer att äga rum när vatten utsätts för varierande tryck vid en konstant temperatur på 0,005 °C? Vid 40 °C? Vid -40 °C?
- Med tryckkokare kan maten tillagas snabbare eftersom det högre trycket i tryckkokaren ökar vattnets kokpunktstemperatur. En särskild tryckkokare har en säkerhetsventil som är inställd så att ånga släpps ut om trycket överstiger 3,4 atm. Vilken är den ungefärliga högsta temperatur som kan uppnås i denna tryckkokare? Förklara ditt resonemang.
- Utifrån fasdiagrammet för koldioxid i figur 5, bestäm tillståndet för koldioxid vid:
(a) 20 °C och 1000 kPa
(b) 10 °C och 2000 kPa
(c) 10 °C och 100 kPa
(d) -40 °C och 500 kPa
(e) -80 °C och 1500 kPa
(f) -80 °C och 10 kPa
- Bestäm de fasförändringar som koldioxid genomgår när trycket ändras om temperaturen hålls på -50 °C? Om temperaturen hålls vid -40 °C? Vid 20 °C? (Se fasdiagrammet i figur 5.)
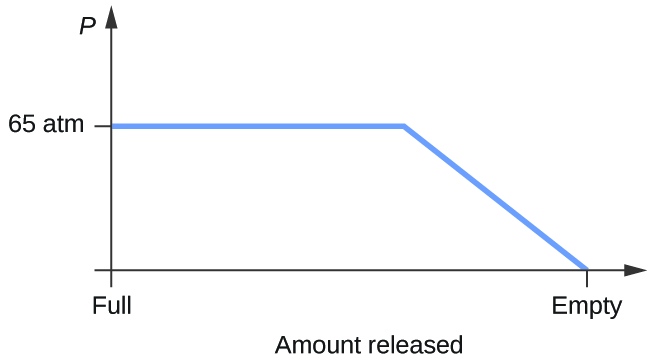
- Bedöm en cylinder som innehåller en blandning av flytande koldioxid i jämvikt med gasformig koldioxid vid ett ursprungligt tryck på 65 atm och en temperatur på 20 °C. Skissa en ritning som visar förändringen av cylinderns tryck med tiden när gasformig koldioxid släpps ut vid konstant temperatur.
- Torris, CO2(s), smälter inte vid atmosfäriskt tryck. Den sublimerar vid en temperatur på -78 °C. Vilket är det lägsta trycket vid vilket CO2(s) smälter och ger CO2(l)? Vid ungefär vilken temperatur kommer detta att ske? (Se figur 5 för fasdiagrammet.)
- Om en allvarlig storm leder till elavbrott kan det bli nödvändigt att använda en tvättlina för att torka tvätten. I många delar av landet mitt i vintern kommer kläderna snabbt att frysa när de hängs på linan. Om det inte snöar, kommer de att torka ändå? Förklara ditt svar.
- Är det möjligt att göra kväve flytande vid rumstemperatur (ca 25 °C)? Är det möjligt att göra svaveldioxid flytande vid rumstemperatur? Förklara dina svar.
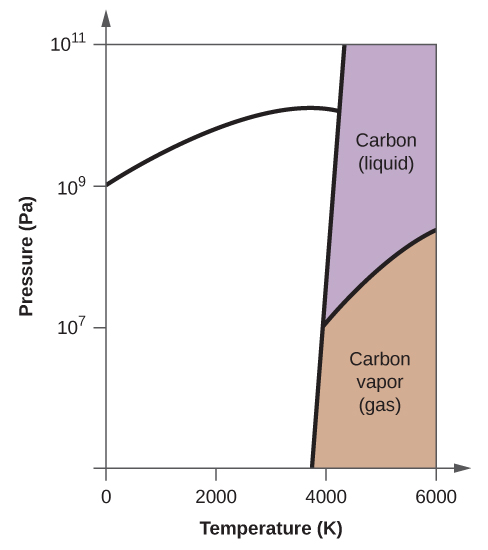
- Elementärt kol har en gasfas, en vätskefas och två olika fasta faser, enligt fasdiagrammet:
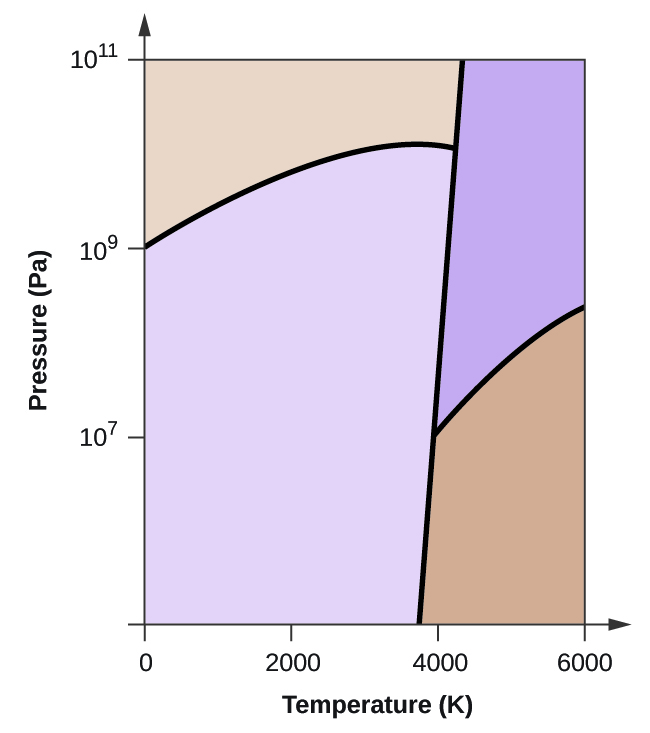
(a) Märk gas- och vätskeområdena på fasdiagrammet.
(b) Grafit är kolets mest stabila fas vid normala förhållanden. Märk grafitfasen på fasdiagrammet.
(c) Om grafit vid normala förhållanden värms upp till 2500 K samtidigt som trycket ökas till 1010 Pa omvandlas den till diamant. Märk diamantfasen.
(d) Ringa in varje trippelpunkt på fasdiagrammet.
(e) I vilken fas existerar kol vid 5000 K och 108 Pa?
(f) Om temperaturen i ett kolprov ökar från 3000 K till 5000 K vid ett konstant tryck på 106 Pa, vilken fasövergång inträffar då, om någon?
Glossar
kritisk punkt temperatur och tryck över vilken en gas inte kan kondenseras till en vätska fasdiagram tryck-temperaturdiagram som sammanfattar de förhållanden under vilka faserna i ett ämne kan existera superkritisk vätska ämne vid en temperatur och ett tryck högre än dess kritiska punkt; uppvisar egenskaper som ligger mellan gasformiga och flytande tillstånd trippelpunkt temperatur och tryck där ett ämnes ång-, vätske- och fasta faser är i jämvikt
Lösningar
Svar på övningar i slutet av kapitlet i kemi
2. Vid låga tryck och 0,005 °C är vattnet en gas. När trycket ökar till 4,6 torr blir vattnet ett fast ämne; när trycket ökar ännu mer blir det en vätska. Vid 40 °C är vatten vid lågt tryck en ånga; vid tryck högre än ca 75 torr omvandlas det till en vätska. Vid -40 °C övergår vatten från gas till fast form när trycket ökar över mycket låga värden.
4. a) vätska; b) fast form; c) gas; d) gas; e) gas; f) gas
8. Ja, is kommer att sublimeras, även om det kan ta flera dagar. Isen har ett litet ångtryck, och vissa ismolekyler bildar gas och flyr från iskristallerna. Med tiden omvandlas mer och mer fast substans till gas tills kläderna till slut är torra.
10. (a)
(b)
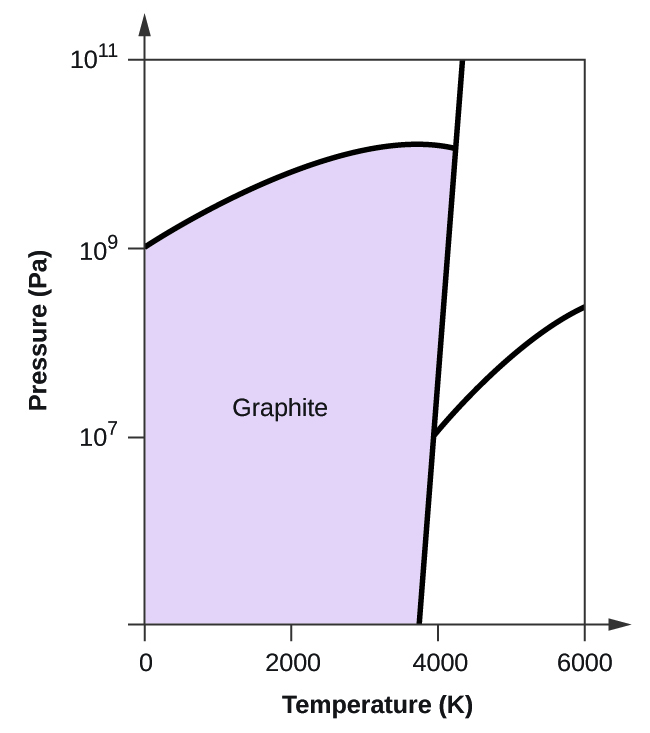
(c)
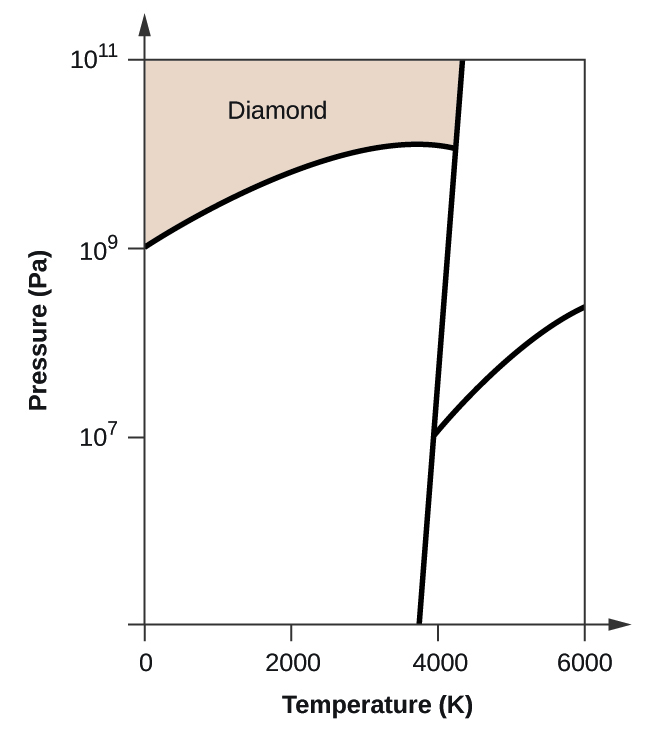
(d)
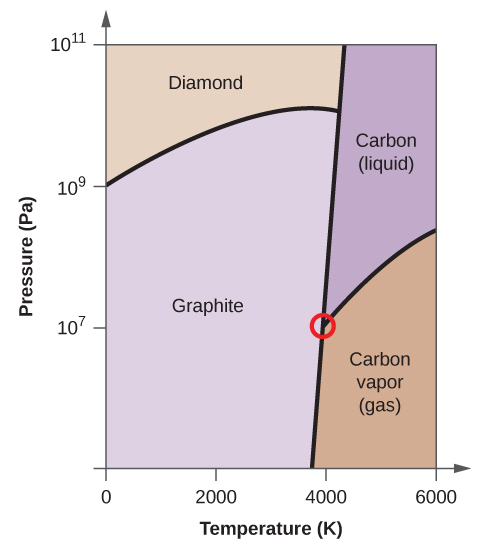
(e) vätskefasen (f) sublimering
.
