Obiettivi di apprendimento
- spiegare la costruzione e l’uso di un tipico diagramma di fase
- Utilizzare i diagrammi di fase per identificare fasi stabili a date temperature e pressioni, e per descrivere le transizioni di fase risultanti dai cambiamenti di queste proprietà
- Descrivere la fase fluida supercritica della materia
Nel modulo precedente, è stata descritta la variazione della tensione di vapore di equilibrio di un liquido con la temperatura. Considerando la definizione di punto di ebollizione, i grafici della pressione di vapore rispetto alla temperatura rappresentano come varia il punto di ebollizione del liquido con la pressione. È stato anche descritto l’uso delle curve di riscaldamento e raffreddamento per determinare il punto di fusione (o congelamento) di una sostanza. Effettuando tali misurazioni su un’ampia gamma di pressioni si ottengono dati che possono essere presentati graficamente come un diagramma di fase. Un diagramma di fase combina i grafici della pressione contro la temperatura per gli equilibri di transizione di fase liquido-gas, solido-liquido e solido-gas di una sostanza. Questi diagrammi indicano gli stati fisici che esistono in condizioni specifiche di pressione e temperatura, e forniscono anche la dipendenza dalla pressione delle temperature di transizione di fase (punti di fusione, punti di sublimazione, punti di ebollizione). Un tipico diagramma di fase per una sostanza pura è mostrato nella figura 1.
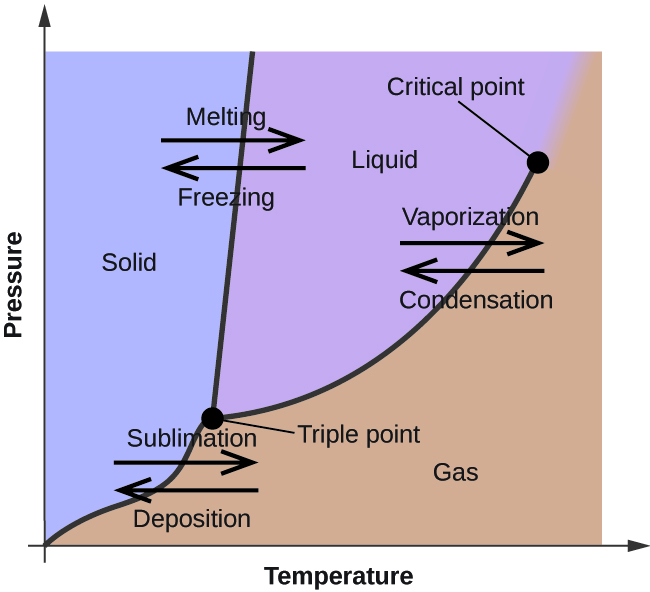
Per illustrare l’utilità di questi grafici, consideriamo il diagramma di fase per l’acqua mostrato nella Figura 2.
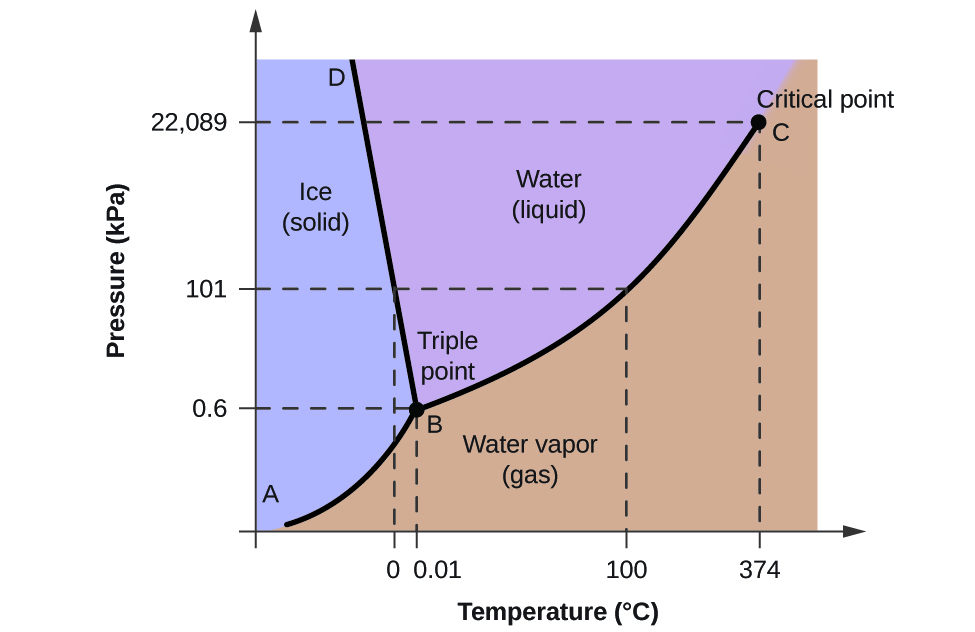
Possiamo usare il diagramma di fase per identificare lo stato fisico di un campione di acqua in determinate condizioni di pressione e temperatura. Per esempio, una pressione di 50 kPa e una temperatura di -10 °C corrispondono alla regione del diagramma etichettata come “ghiaccio”. In queste condizioni, l’acqua esiste solo come solido (ghiaccio). Una pressione di 50 kPa e una temperatura di 50 °C corrispondono alla regione “acqua” – qui l’acqua esiste solo come liquido. A 25 kPa e 200 °C, l’acqua esiste solo allo stato gassoso. Si noti che sul diagramma di fase dell’H2O, gli assi della pressione e della temperatura non sono disegnati su una scala costante per permettere l’illustrazione di diverse caratteristiche importanti come descritto qui.
La curva BC nella figura 2 è il grafico della pressione di vapore rispetto alla temperatura come descritto nel modulo precedente di questo capitolo. Questa curva “liquido-vapore” separa le regioni liquide e gassose del diagramma di fase e fornisce il punto di ebollizione dell’acqua a qualsiasi pressione. Per esempio, a 1 atm, il punto di ebollizione è 100 °C. Si noti che la curva liquido-vapore termina a una temperatura di 374 °C e una pressione di 218 atm, indicando che l’acqua non può esistere come liquido sopra questa temperatura, indipendentemente dalla pressione. Le proprietà fisiche dell’acqua in queste condizioni sono intermedie tra quelle delle sue fasi liquida e gassosa. Questo stato unico della materia è chiamato fluido supercritico, un argomento che sarà descritto nella prossima sezione di questo modulo.
La curva solido-vapore, etichettata AB nella Figura 2, indica le temperature e le pressioni alle quali il ghiaccio e il vapore acqueo sono in equilibrio. Queste coppie di dati temperatura-pressione corrispondono ai punti di sublimazione, o deposizione, dell’acqua. Se potessimo ingrandire la linea solido-gas nella figura 2, vedremmo che il ghiaccio ha una pressione di vapore di circa 0,20 kPa a -10 °C. Quindi, se mettiamo un campione congelato in un vuoto con una pressione inferiore a 0,20 kPa, il ghiaccio sublimerà. Questa è la base del processo di “liofilizzazione” spesso usato per conservare gli alimenti, come il gelato mostrato nella Figura 3.

La curva solido-liquido etichettata BD mostra le temperature e le pressioni alle quali il ghiaccio e l’acqua liquida sono in equilibrio, rappresentando i punti di fusione/congelamento dell’acqua. Si noti che questa curva presenta una leggera pendenza negativa (molto esagerata per chiarezza), che indica che il punto di fusione dell’acqua diminuisce leggermente all’aumentare della pressione. L’acqua è una sostanza insolita in questo senso, poiché la maggior parte delle sostanze mostra un aumento del punto di fusione con l’aumentare della pressione. Questo comportamento è in parte responsabile del movimento dei ghiacciai, come quello mostrato nella figura 4. Il fondo di un ghiacciaio sperimenta un’immensa pressione dovuta al suo peso che può sciogliere parte del ghiaccio, formando uno strato di acqua liquida su cui il ghiacciaio può scivolare più facilmente.

Il punto di intersezione di tutte e tre le curve è etichettato B nella Figura 2. Alla pressione e alla temperatura rappresentate da questo punto, tutte e tre le fasi dell’acqua coesistono in equilibrio. Questa coppia di dati temperatura-pressione è chiamata punto triplo. A pressioni inferiori al punto triplo, l’acqua non può esistere come liquido, indipendentemente dalla temperatura.
Esempio 1
Determinazione dello stato dell’acqua
Utilizzando il diagramma di fase dell’acqua riportato nella Figura 2, determina lo stato dell’acqua alle seguenti temperature e pressioni:
(a) -10 °C e 50 kPa
(b) 25 °C e 90 kPa
(c) 50 °C e 40 kPa
(d) 80 °C e 5 kPa
(e) -10 °C e 0.3 kPa
(f) 50 °C e 0,3 kPa
Soluzione
Utilizzando il diagramma di fase dell’acqua, possiamo determinare che lo stato dell’acqua ad ogni temperatura e pressione data sono i seguenti: (a) solido; (b) liquido; (c) liquido; (d) gas; (e) solido; (f) gas.
Verifica il tuo apprendimento
Quali cambiamenti di fase può subire l’acqua al variare della temperatura se la pressione è tenuta a 0,3 kPa? Se la pressione è tenuta a 50 kPa?
Risposta:
A 0,3 kPa: \A 0,3 kPa: \testo{s};\lunghezza della freccia};\testo{g} a -58 °C. A 50 kPa: \testo{s};\testo{s};\testo{destra};\testo{l} a 0 °C, \testo{l};\testo{g} a 78 °C
Consideriamo il diagramma di fase per l’anidride carbonica mostrato in Figura 5 come altro esempio. La curva solido-liquido mostra una pendenza positiva, indicando che il punto di fusione per il CO2 aumenta con la pressione come per la maggior parte delle sostanze (l’acqua è una notevole eccezione come descritto in precedenza). Si noti che il punto triplo è ben al di sopra di 1 atm, indicando che l’anidride carbonica non può esistere come liquido in condizioni di pressione ambiente. Invece, il raffreddamento dell’anidride carbonica gassosa a 1 atm provoca la sua deposizione allo stato solido. Allo stesso modo, l’anidride carbonica solida non si scioglie a 1 atm di pressione, ma sublima per produrre CO2 gassosa. Infine, si noti che il punto critico per l’anidride carbonica è osservato a una temperatura e pressione relativamente modeste in confronto all’acqua.
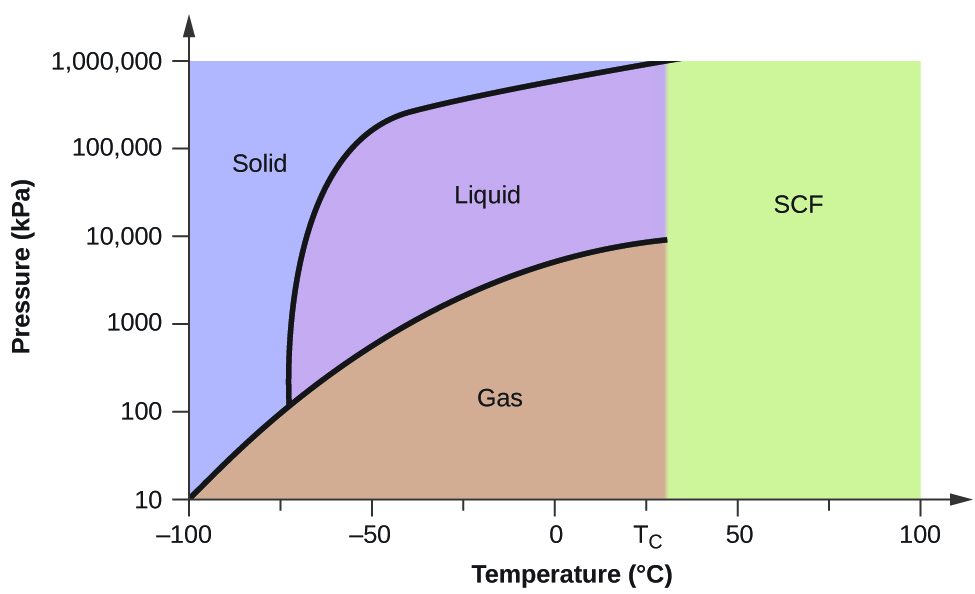
Esempio 2
Determinare lo stato dell’anidride carbonica
Utilizzando il diagramma di fase dell’anidride carbonica mostrato nella Figura 5, determina lo stato della CO2 alle seguenti temperature e pressioni:
(a) -30 °C e 2000 kPa
(b) -60 °C e 1000 kPa
(c) -60 °C e 100 kPa
(d) 20 °C e 1500 kPa
(e) 0 °C e 100 kPa
(f) 20 °C e 100 kPa
Soluzione
Utilizzando il diagramma di fase dell’anidride carbonica fornito, possiamo determinare che lo stato del CO2 ad ogni temperatura e pressione data sono i seguenti: (a) liquido; (b) solido; (c) gas; (d) liquido; (e) gas; (f) gas.
Verifica il tuo apprendimento
Determina i cambiamenti di fase che l’anidride carbonica subisce quando la sua temperatura viene variata, mantenendo la pressione costante a 1500 kPa? A 500 kPa? A quali temperature approssimative avvengono questi cambiamenti di fase?
Risposta:
a 1500 kPa: \a -45 °C, a -10 °C;
a 500 kPa: \Se mettiamo un campione di acqua in un contenitore sigillato a 25 °C, rimuoviamo l’aria e lasciamo che l’equilibrio di vaporizzazione-condensazione si stabilisca, ci ritroviamo con una miscela di acqua liquida e vapore acqueo ad una pressione di 0,03 atm. Si osserva chiaramente un confine distinto tra il liquido più denso e il gas meno denso. Aumentando la temperatura, la pressione del vapore acqueo aumenta, come descritto dalla curva liquido-gas nel diagramma di fase dell’acqua (Figura 2), e rimane un equilibrio bifase di fasi liquide e gassose. Ad una temperatura di 374 °C, la pressione del vapore è salita a 218 atm, e qualsiasi ulteriore aumento di temperatura porta alla scomparsa del confine tra le fasi liquida e gassosa. Tutta l’acqua nel contenitore è ora presente in un’unica fase le cui proprietà fisiche sono intermedie tra quelle degli stati gassoso e liquido. Questa fase della materia è chiamata fluido supercritico, e la temperatura e la pressione al di sopra delle quali questa fase esiste è il punto critico (Figura 6). Al di sopra della sua temperatura critica, un gas non può essere liquefatto, non importa quanta pressione venga applicata. La pressione richiesta per liquefare un gas alla sua temperatura critica è chiamata pressione critica. Le temperature critiche e le pressioni critiche di alcune sostanze comuni sono date nella tabella 6.
| Sostanza | Temperatura critica (K) | Pressione critica (atm) |
|---|---|---|
| idrogeno | 33.2 | 12,8 |
| azoto | 126,0 | 33,5 |
| ossigeno | 154.3 | 49.7 |
| diossido di carbonio | 304.2 | 73.0 |
| ammonia | 405.5 | 111.5 |
| diossido di zolfo | 430.3 | 77.7 |
| acqua | 647.1 | 217.7 |
| Tabella 6. | ||
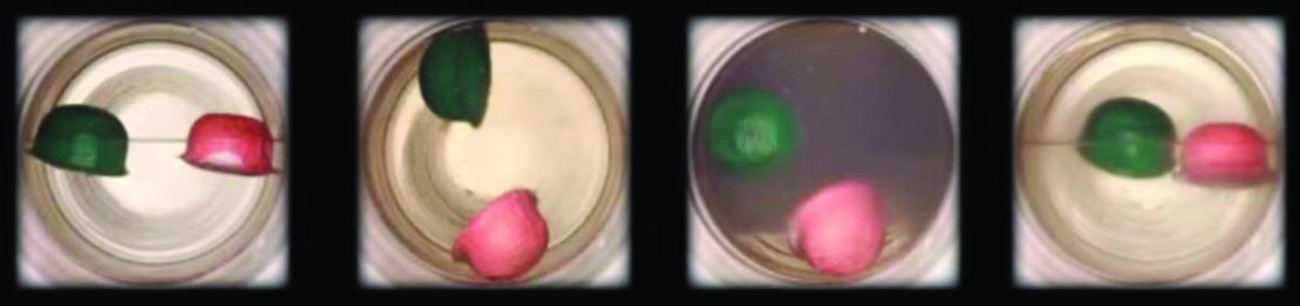

Osserva la transizione da liquido a fluido supercritico per l’anidride carbonica.
Come un gas, un fluido supercritico si espanderà e riempirà un contenitore, ma la sua densità è molto maggiore di quella tipica dei gas, essendo tipicamente vicina a quella dei liquidi. Simili ai liquidi, questi fluidi sono in grado di dissolvere soluti non volatili. Tuttavia, non presentano essenzialmente alcuna tensione superficiale e viscosità molto basse, quindi possono penetrare più efficacemente in aperture molto piccole in una miscela solida e rimuovere i componenti solubili. Queste proprietà rendono i fluidi supercritici solventi estremamente utili per una vasta gamma di applicazioni. Per esempio, l’anidride carbonica supercritica è diventata un solvente molto popolare nell’industria alimentare, essendo usata per decaffeinare il caffè, rimuovere i grassi dalle patatine, ed estrarre i composti di sapore e fragranza dagli oli di agrumi. Non è tossico, relativamente poco costoso e non è considerato un inquinante. Dopo l’uso, la CO2 può essere facilmente recuperata riducendo la pressione e raccogliendo il gas risultante.
Esempio 3
La temperatura critica dell’anidride carbonica
Se agitiamo un estintore ad anidride carbonica in una giornata fredda (18 °C), possiamo sentire la CO2 liquida sbattere all’interno della bombola. Tuttavia, lo stesso cilindro sembra non contenere liquido in una calda giornata estiva (35 °C). Spiega queste osservazioni.
Soluzione
Nel giorno fresco, la temperatura della CO2 è sotto la temperatura critica della CO2, 304 K o 31 °C (tabella 6), quindi la CO2 liquida è presente nel cilindro. Nel giorno caldo, la temperatura della CO2 è superiore alla sua temperatura critica di 31 °C. Al di sopra di questa temperatura nessuna quantità di pressione può liquefare la CO2, quindi non esiste CO2 liquida nell’estintore.
Verifica il tuo apprendimento
L’ammoniaca può essere liquefatta per compressione a temperatura ambiente; l’ossigeno non può essere liquefatto in queste condizioni. Perché i due gas hanno un comportamento diverso?
Risposta:
La temperatura critica dell’ammoniaca è 405,5 K, che è superiore alla temperatura ambiente. La temperatura critica dell’ossigeno è inferiore alla temperatura ambiente; quindi l’ossigeno non può essere liquefatto a temperatura ambiente.
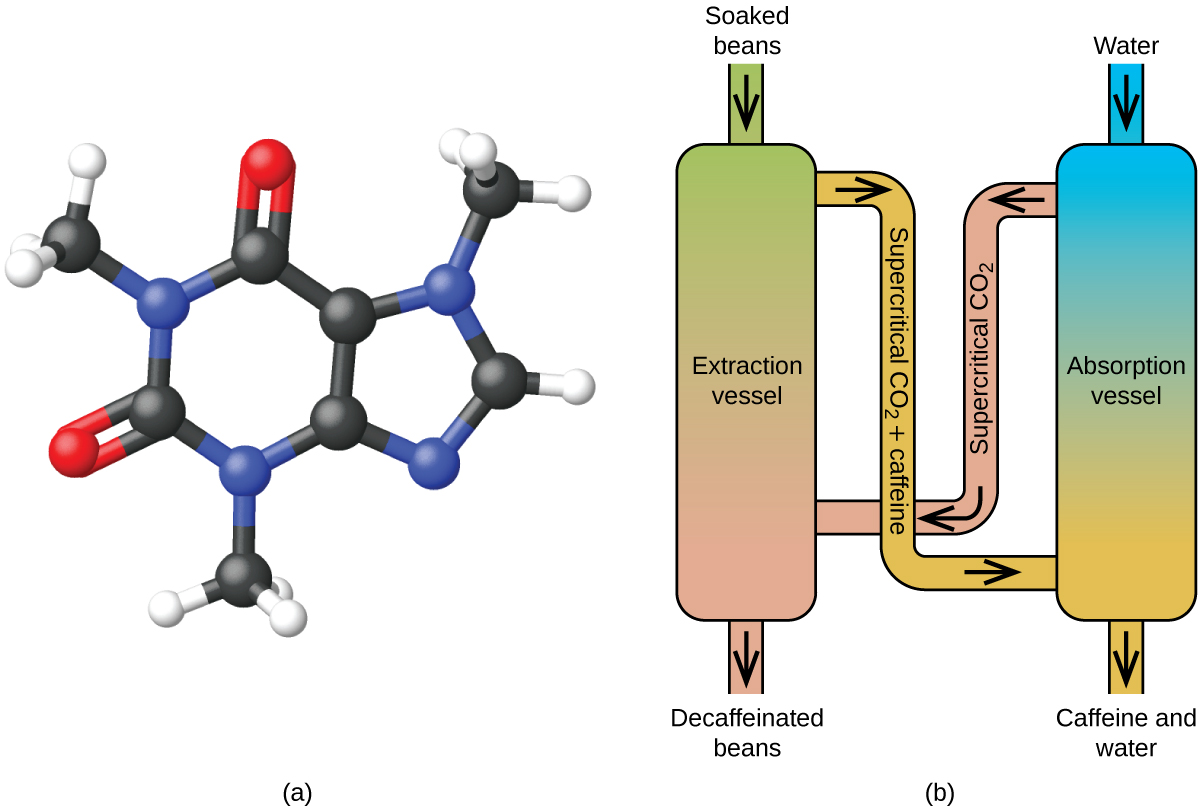
Decaffeinizzare il caffè usando la CO2 supercritica
Il caffè è la seconda merce più scambiata al mondo, dopo solo il petrolio. In tutto il mondo, la gente ama l’aroma e il gusto del caffè. Molti di noi dipendono anche da un componente del caffè – la caffeina – per aiutarci ad andare avanti la mattina o a rimanere vigili nel pomeriggio. Ma alla fine della giornata, l’effetto stimolante del caffè può impedirti di dormire, quindi puoi scegliere di bere caffè decaffeinato la sera.
Dai primi anni del 1900, sono stati usati molti metodi per decaffeinare il caffè. Tutti hanno vantaggi e svantaggi, e tutti dipendono dalle proprietà fisiche e chimiche della caffeina. Poiché la caffeina è una molecola un po’ polare, si dissolve bene in acqua, un liquido polare. Tuttavia, poiché molti degli altri 400 e più composti che contribuiscono al gusto e all’aroma del caffè si dissolvono anche in H2O, i processi di decaffeinizzazione in acqua calda possono anche rimuovere alcuni di questi composti, influenzando negativamente l’odore e il gusto del caffè decaffeinato. Il diclorometano (CH2Cl2) e l’acetato di etile (CH3CO2C2H5) hanno una polarità simile alla caffeina, e sono quindi solventi molto efficaci per l’estrazione della caffeina, ma entrambi rimuovono anche alcuni componenti di sapore e aroma, e il loro uso richiede lunghi tempi di estrazione e pulizia. Poiché entrambi questi solventi sono tossici, sono state sollevate preoccupazioni per la salute riguardo all’effetto del solvente residuo che rimane nel caffè decaffeinato.
L’estrazione con fluido supercritico utilizzando l’anidride carbonica è ora ampiamente utilizzata come metodo di decaffeinizzazione più efficace ed ecologico (Figura 7). A temperature superiori a 304,2 K e pressioni superiori a 7376 kPa, la CO2 è un fluido supercritico, con proprietà sia di gas che di liquido. Come un gas, penetra in profondità nei chicchi di caffè; come un liquido, dissolve efficacemente alcune sostanze. L’estrazione supercritica di anidride carbonica dai chicchi di caffè cotti a vapore rimuove il 97-99% della caffeina, lasciando intatti i composti di sapore e aroma del caffè. Poiché la CO2 è un gas in condizioni standard, la sua rimozione dai chicchi di caffè estratti è facilmente realizzabile, così come il recupero della caffeina dall’estratto. La caffeina recuperata dai chicchi di caffè con questo processo è un prodotto prezioso che può essere usato successivamente come additivo per altri alimenti o farmaci.
Concetti chiave e riassunto
Le condizioni di temperatura e pressione in cui una sostanza esiste negli stati solido, liquido e gassoso sono riassunte in un diagramma di fase per quella sostanza. I diagrammi di fase sono diagrammi combinati di tre curve di equilibrio pressione-temperatura: solido-liquido, liquido-gas e solido-gas. Queste curve rappresentano le relazioni tra le temperature di transizione di fase e le pressioni. Il punto di intersezione di tutte e tre le curve rappresenta il punto triplo della sostanza – la temperatura e la pressione a cui tutte e tre le fasi sono in equilibrio. A pressioni inferiori al punto triplo, una sostanza non può esistere allo stato liquido, indipendentemente dalla sua temperatura. L’estremità della curva liquido-gas rappresenta il punto critico della sostanza, la pressione e la temperatura oltre le quali non può esistere una fase liquida.
Chemistry End of Chapter Exercises
- Dal diagramma di fase dell’acqua (Figura 2), determinare lo stato dell’acqua a:
(a) 35 °C e 85 kPa
(b) -15 °C e 40 kPa
(c) -15 °C e 0.1 kPa
(d) 75 °C e 3 kPa
(e) 40 °C e 0,1 kPa
(f) 60 °C e 50 kPa
- Quali cambiamenti di fase avvengono quando l’acqua è sottoposta a pressione variabile a una temperatura costante di 0,005 °C? A 40 °C? A -40 °C?
- Le pentole a pressione permettono al cibo di cuocere più velocemente perché la maggiore pressione all’interno della pentola a pressione aumenta la temperatura di ebollizione dell’acqua. Una particolare pentola a pressione ha una valvola di sicurezza che è impostata per far fuoriuscire il vapore se la pressione supera le 3,4 atm. Qual è la temperatura massima approssimativa che può essere raggiunta in questa pentola a pressione? Spiega il tuo ragionamento.
- Dal diagramma di fase dell’anidride carbonica in figura 5, determina lo stato della CO2 a:
(a) 20 °C e 1000 kPa
(b) 10 °C e 2000 kPa
(c) 10 °C e 100 kPa
(d) -40 °C e 500 kPa
(e) -80 °C e 1500 kPa
(f) -80 °C e 10 kPa
- Determina i cambiamenti di fase che l’anidride carbonica subisce al variare della pressione se la temperatura è tenuta a -50 °C? Se la temperatura è tenuta a -40 °C? A 20 °C? (Vedi il diagramma di fase in figura 5.)
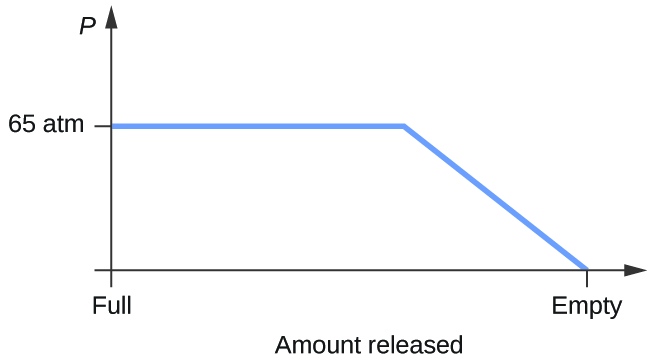
- Considera un cilindro contenente una miscela di anidride carbonica liquida in equilibrio con l’anidride carbonica gassosa ad una pressione iniziale di 65 atm e una temperatura di 20 °C. Disegna un grafico che rappresenti il cambiamento nella pressione del cilindro con il tempo mentre l’anidride carbonica gassosa viene rilasciata a temperatura costante.
- Il ghiaccio secco, CO2(s), non si scioglie a pressione atmosferica. Sublima ad una temperatura di -78 °C. Qual è la pressione più bassa alla quale il CO2(s) si scioglie per dare CO2(l)? A quale temperatura approssimativamente questo avverrà? (Vedere la figura 5 per il diagramma di fase.)
- Se un forte temporale provoca la perdita di elettricità, può essere necessario usare uno stendibiancheria per asciugare il bucato. In molte parti del paese, in pieno inverno, i vestiti si congelano rapidamente quando vengono appesi al filo. Se non nevica, si asciugheranno comunque? Spiega la tua risposta.
- È possibile liquefare l’azoto a temperatura ambiente (circa 25 °C)? È possibile liquefare l’anidride solforosa a temperatura ambiente? Spiega le tue risposte.
- Il carbonio elementare ha una fase gassosa, una fase liquida e due diverse fasi solide, come mostrato nel diagramma di fase:
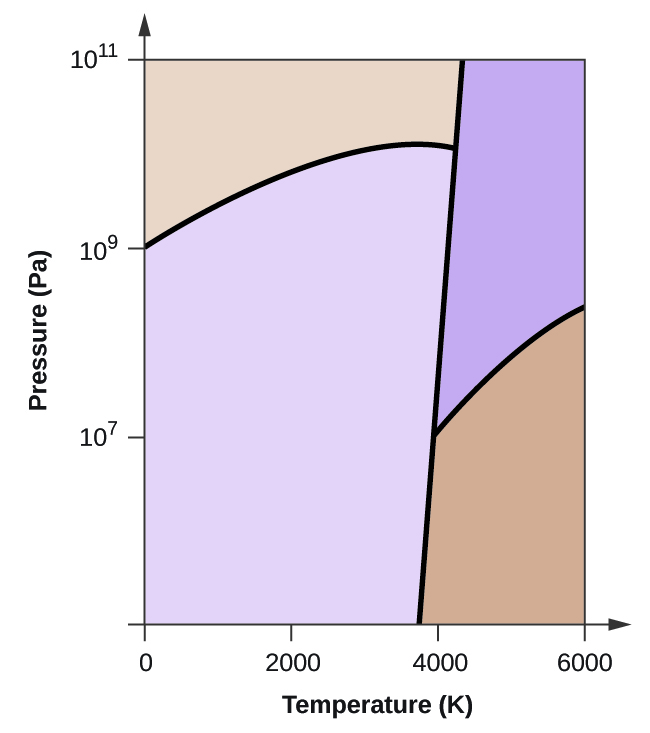
(a) Sul diagramma di fase, etichetta le regioni del gas e del liquido.
(b) La grafite è la fase più stabile del carbonio in condizioni normali. Sul diagramma di fase, etichetta la fase della grafite.
(c) Se la grafite in condizioni normali viene riscaldata a 2500 K mentre la pressione viene aumentata a 1010 Pa, si trasforma in diamante. Etichetta la fase del diamante.
(d) Cerchia ogni punto triplo sul diagramma di fase.
(e) In quale fase esiste il carbonio a 5000 K e 108 Pa?
(f) Se la temperatura di un campione di carbonio aumenta da 3000 K a 5000 K a una pressione costante di 106 Pa, quale transizione di fase avviene, se c’è?
Glossario
punto critico temperatura e pressione oltre le quali un gas non può essere condensato in un liquido diagramma di fase grafico pressione-temperatura che riassume le condizioni in cui le fasi di una sostanza possono esistere sostanza fluida supercritica a temperatura e pressione superiori al suo punto critico; esibisce proprietà intermedie tra quelle degli stati gassoso e liquido punto triplo temperatura e pressione in cui le fasi di vapore, liquido e solido di una sostanza sono in equilibrio
Soluzioni
Risposte agli esercizi di fine capitolo di chimica
2. A basse pressioni e a 0,005 °C, l’acqua è un gas. Quando la pressione aumenta fino a 4,6 torr, l’acqua diventa un solido; quando la pressione aumenta ancora, diventa un liquido. A 40 °C, l’acqua a bassa pressione è un vapore; a pressioni superiori a circa 75 torr, si trasforma in un liquido. A -40 °C, l’acqua passa da un gas a un solido man mano che la pressione aumenta oltre valori molto bassi.
4. (a) liquido; (b) solido; (c) gas; (d) gas; (e) gas; (f) gas
8. Sì, il ghiaccio sublimerà, sebbene possa impiegare diversi giorni. Il ghiaccio ha una piccola pressione di vapore, e alcune molecole di ghiaccio formano gas e fuoriescono dai cristalli di ghiaccio. Col passare del tempo, sempre più solido si converte in gas finché alla fine i vestiti sono asciutti.
10. (a)
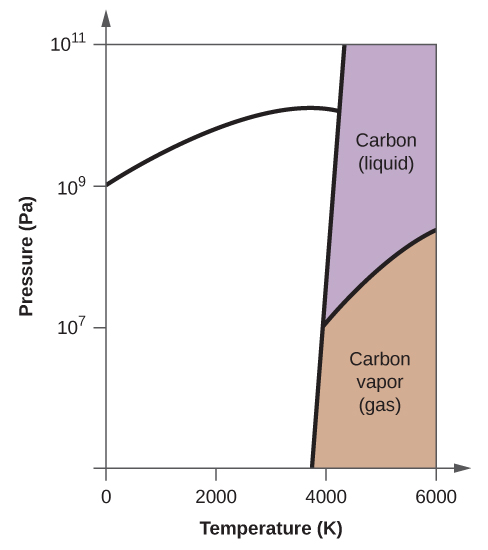
(b)
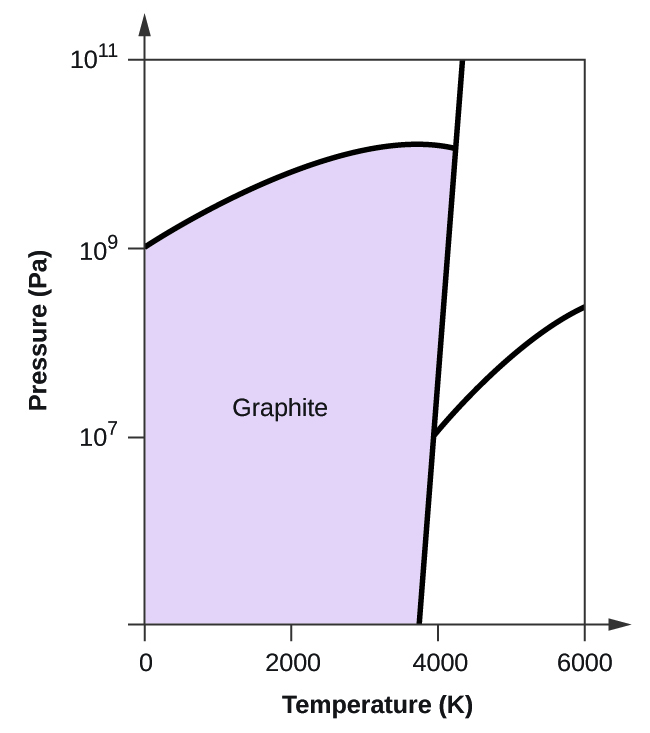
(c)
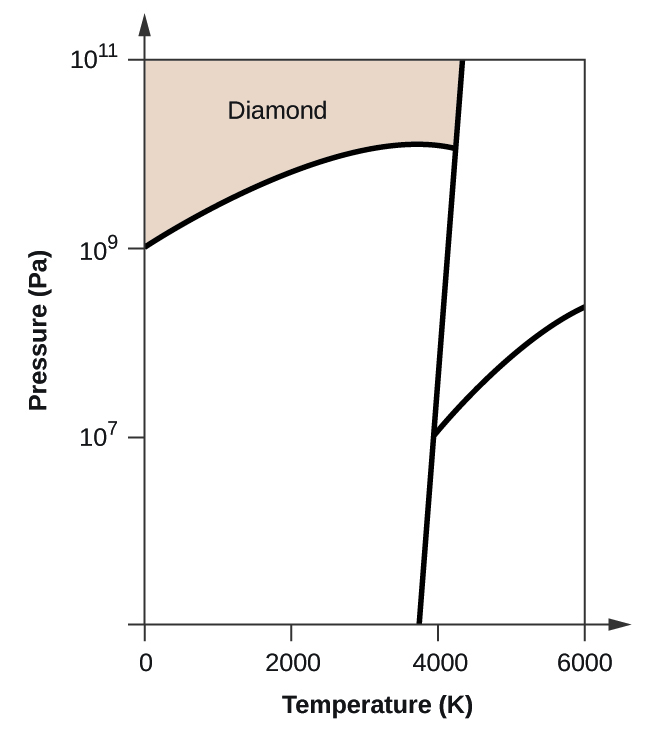
(d)
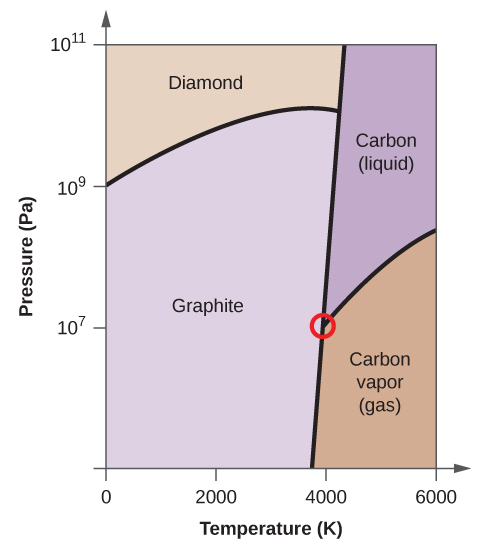
(e) fase liquida (f) sublimazione
