学習目標
- 典型的な相図の構築と使用について説明できる
- 与えられた温度と圧力で安定な相を特定するために相図を使用する。 5309>
- 物質の超臨界流体相を記述する
前のモジュールで、液体の平衡蒸気圧の温度による変化について説明した。 沸点の定義を考慮し、蒸気圧の温度に対するプロットは、液体の沸点が圧力によってどのように変化するかを表している。 また、物質の融点(または凝固点)を求めるための加熱・冷却曲線についても説明した。 このような測定を広い圧力範囲で行うと、データが得られ、それをグラフ化したものが相図である。 相図は、物質の気液、固液、固気の相転移の平衡状態を圧力と温度でプロットしたものである。 この図は、特定の圧力と温度の条件下で存在する物理的状態を示しており、相転移温度(融点、昇華点、沸点)の圧力依存性も示している。 純物質の典型的な相図を図1に示す。
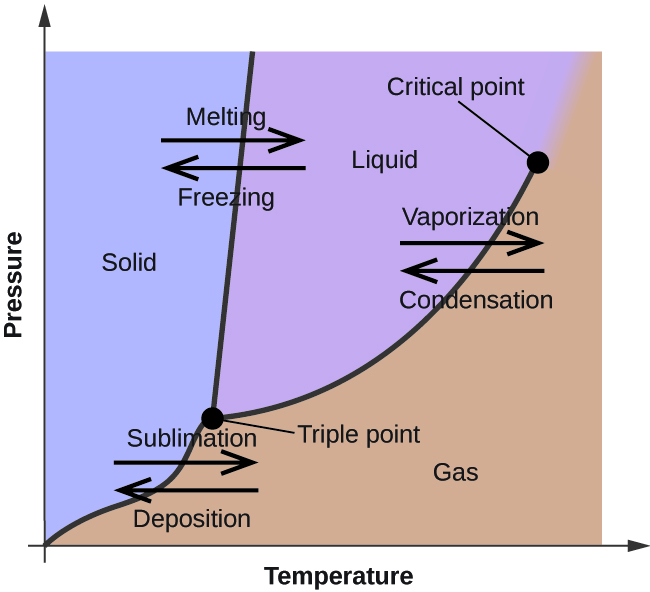
これらのプロットの有用性を説明するために、図2に示す水の相図を考える。
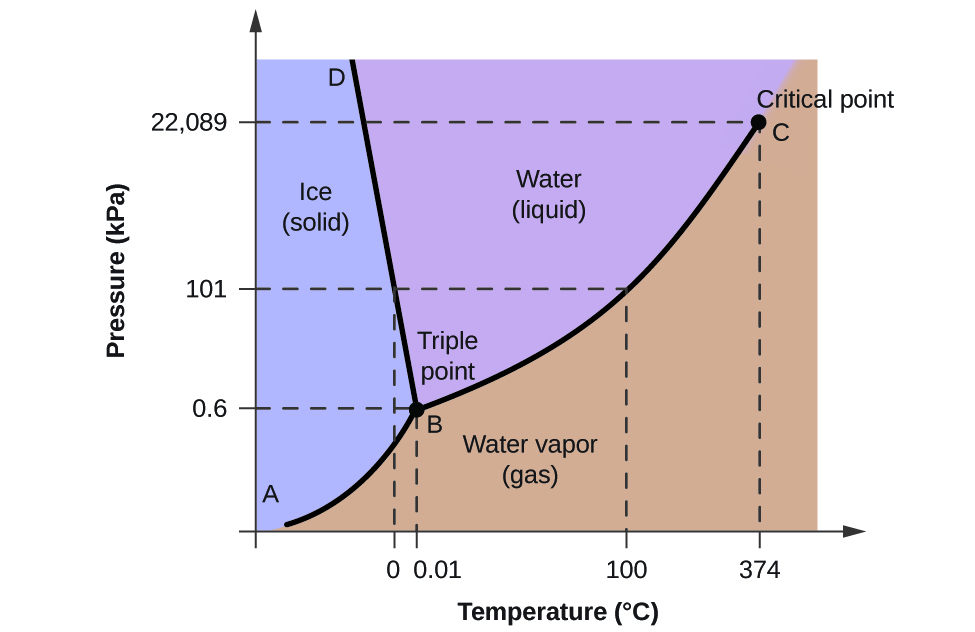
私たちは、圧力と温度の特定条件下における水のサンプルの物理的状態を特定するために、この相図を使用することができます。 たとえば、圧力50 kPa、温度-10 °Cは、図の「氷」と書かれた領域に相当します。 この条件下では、水は固体(氷)としてのみ存在する。 圧力50kPa、温度50℃は「水」の領域に相当し、水は液体としてのみ存在する。 25kPa、200℃の条件では、水は気体としてのみ存在する。 7708>
図2の曲線BCは、この章の前のモジュールで説明した蒸気圧と温度のプロットである。 この「液体-蒸気」曲線は、相図において液体と気体の領域を分離し、任意の圧力における水の沸点を提供する。 例えば、1気圧の場合、沸点は100℃である。 液体-蒸気曲線は、温度374 ℃、圧力218 atmで終点となり、圧力に関係なく、この温度以上では水は液体として存在できないことを示していることに注意。 この条件下での水の物理的性質は、液相と気相の中間的なものである。
図2にABと書かれた固体-蒸気曲線は、氷と水蒸気が平衡状態にある温度と圧力を示している。 この温度と圧力の組が水の昇華点、すなわち沈殿点に相当する。 図2の固体-気体線を拡大すると、氷は-10℃において約0.20kPaの蒸気圧を持つことがわかる。 したがって、0.20kPa以下の真空中に凍結した試料を置くと、氷は昇華することになる。 これが、図3のアイスクリームのような食品の保存によく使われる「フリーズドライ」の基本である

BDと書かれた固液曲線は、氷と水の平衡状態にある温度と圧力で、水の融点/凝固点を表しています。 この曲線はわずかに負の勾配を示し(わかりやすくするために大きく誇張されている)、圧力が高くなると水の融点がわずかに下がることを示している。 ほとんどの物質は圧力が高くなると融点が上昇するので、この点では水は珍しい物質といえる。 図4のような氷河の動きも、このような挙動が一因となっている。 氷河の底には、その重さによって巨大な圧力がかかり、氷の一部が溶けて、氷河が滑りやすい液体の水の層ができる。 氷河の下にある巨大な圧力により、氷河の一部が溶けて水の層ができ、氷河の動きを助ける潤滑油となる。 この衛星写真は、アルゼンチンのペリト・モレノ氷河の端が前進している様子を示しています。 (出典:NASA)
3つの曲線の交点は、図2のBと書かれています。 この点で表される圧力と温度では、水の3つの相がすべて平衡に共存していることになる。 この温度と圧力の組を三重点と呼ぶ。 三重点より低い圧力では、温度に関係なく、水は液体として存在することができない。
例題1
水の状態の決定
図2に示した水の相図を用いて、次の温度と圧力における水の状態を決定しなさい。
(a) -10℃、50kPa
(b) 25℃、90kPa
(c) 50℃、40kPa
(d) 80℃、5kPa
(e) -10℃、0.5kPa
(a) -10℃、50kPa
(b) 25℃、50kPa3 kPa
(f) 50 ℃、0.3 kPa
溶液
水の相図を用いて、与えられた各温度と圧力での水の状態は以下のように決定される。 (a) 固体 (b) 液体 (c) 液体 (d) 気体 (e) 固体 (f) 気体
Check Your Learning
0.3kPaの圧力で、温度が変わると水はどのような相変化を起こすか。 50kPaに保った場合?
答え:
0.3kPaのとき。 \text{s}} {longrightarrow} {g} at -58 °C. 50kPa時。 \50kPa時: \text{s} {{l}} at 0 ℃, \text{g} at 78 ℃
別の例として、図5に示す二酸化炭素の相図を見てみよう。 固液曲線は正の勾配を示し、ほとんどの物質がそうであるように、二酸化炭素の融点も圧力とともに上昇することがわかる(水は前述したように例外である)。 また、三重点は1気圧をはるかに超えており、常圧下では二酸化炭素は液体として存在できないことがわかる。 気体である二酸化炭素を1気圧で冷却すると、固体になる。 同様に、固体の二酸化炭素も1気圧では融解せず、昇華して気体の二酸化炭素になる。 最後に、二酸化炭素の臨界点は水に比べて比較的穏やかな温度と圧力で観測されることに注目したい
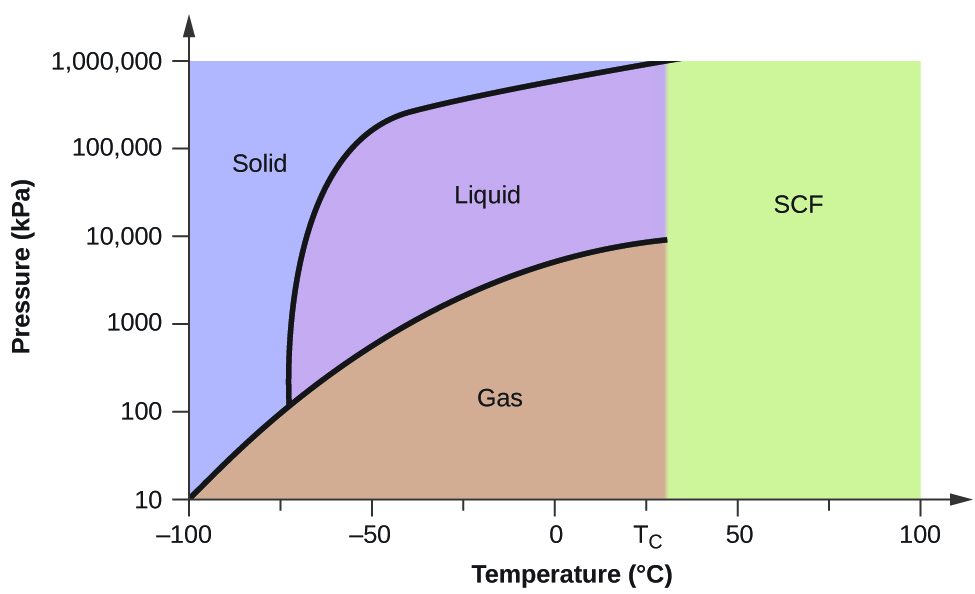
例題2
二酸化炭素の状態を決定する
図5の二酸化炭素の相図を用いて、次の温度と圧力における二酸化炭素の状態を決定しなさい。
(a) -30℃、2000kPa
(b) -60℃、1000kPa
(c) -60℃、100kPa
(d) 20℃、1500 kPa
(e) 0℃、100kPa
(f) 20℃、100kPa
解答
与えられた二酸化炭素の相図から、以下のように考える。 は、それぞれの温度と圧力におけるCO2の状態が次のようになることがわかる。 (a) 液体 (b) 固体 (c) 気体 (d) 液体 (e) 気体 (f) 気体
Check Your Learning
1500 kPaで圧力を一定にして、温度を変化させたときに二酸化炭素が受ける相変化を決定しなさい? 500kPaでは?
答え:
1500 kPaのとき、これらの相変化はおおよそ何度で起こりますか? \text{s}} at -45 ℃, \text{l}};{{longrightarrow}} at -10 ℃;
at 500 kPa: \text{s}} at -45 ℃, \text{g} at -10 ℃: \7708>
25℃の密閉容器に水を入れ、空気を抜いて気化-凝縮平衡をとると、圧力0.03気圧で液体の水と水蒸気の混合物ができる。 密度の高い液体と密度の低い気体の境界がはっきりと観察される。 温度を上げると、水の相図(図2)の液体-気体曲線で表されるように水蒸気の圧力が上昇し、液体と気体の二相の平衡が保たれる。 温度374℃では、蒸気圧は218気圧まで上昇しており、これ以上温度を上げると液相と気相の境界がなくなってしまう。 容器内の水はすべて、気相と液相の中間の物性を持つ単一相に存在することになる。 このような物質の相を超臨界流体と呼び、この相が存在する温度と圧力を臨界点と呼ぶ(図6)。 臨界温度以上では、どんなに圧力をかけても気体を液化することはできない。 この臨界温度で気体を液化させるのに必要な圧力を臨界圧力という。 いくつかの一般的な物質の臨界温度と臨界圧力を表6に示す。
| 物質 | 臨界圧力(気圧) | ||||
|---|---|---|---|---|---|
| 水素 | 33.2 | 12.8 | |||
| 窒素 | 33.5 | ||||
| 酸素 | 154.3 | 49.7 | |||
| 二酸化炭素 | 304.2 | 73.0 | |||
| アンモニア | 405.5 | 111.5 | |||
| 二酸化炭素 | 430.3 | 二酸化炭素> | 430.1 | 405.10.1 | 77.7 |
| 水 | 647.1 | 217.7 | |||
| 表6. | |||||
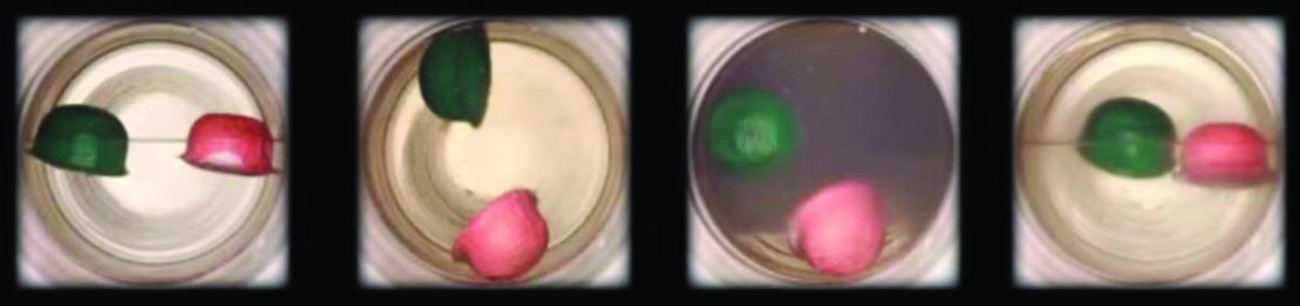

二酸化炭素の液体から超臨界流体への転移を観察する。
気体と同様に、超臨界流体は拡張して容器内に満たされますが、その密度は通常の気体の密度よりはるかに大きく、通常は液体の密度に近くなっています。 液体と同様に、不揮発性の溶質を溶かすことができる。 しかし、表面張力がほとんどなく、粘性も低いため、固体混合物の微小な隙間に入り込み、可溶成分をより効果的に除去することができる。 このような性質から、超臨界流体はさまざまな用途で非常に有用な溶媒となっている。 例えば、超臨界二酸化炭素は、コーヒーの脱カフェイン、ポテトチップスの油脂除去、柑橘類オイルの香味成分抽出など、食品産業で非常によく使われる溶媒となっている。 超臨界二酸化炭素は無毒で、比較的安価であり、汚染物質とみなされることもない。
例3
二酸化炭素の臨界温度
涼しい日(18℃)に二酸化炭素消火器を振ると、ボンベの中で液体の二酸化炭素がドロドロと動く音が聞こえます。 しかし、夏の暑い日(35℃)には、同じボンベの中に液体が入っていないように見えます。
解答
涼しい日、CO2の温度はCO2の臨界温度304K、31℃以下なので(表6)、シリンダー内には液体のCO2が存在することになります。 暑い日、CO2の温度は臨界温度31℃より高くなる。
Check Your Learning
アンモニアは室温で圧縮すると液化しますが、酸素はこの条件下では液化しません。 なぜこの2つの気体は異なる挙動を示すのでしょうか?
答え:
アンモニアの臨界温度は405.5Kで、室温より高いです。 酸素の臨界温度は室温より低いので、室温では液化できません。
超臨界CO2を用いたコーヒーのカフェイン除去
コーヒーは石油に次いで世界で2番目に多く取引されている商品です。 世界中で、人々はコーヒーの香りと味を愛しています。 また、朝の目覚めや午後の眠気覚ましに、コーヒーの成分のひとつであるカフェインに頼っている人も多いのではないでしょうか。 しかし、1日の終わりになると、コーヒーの刺激作用で眠れなくなるため、夜にはカフェイン抜きのコーヒーを飲むようにしましょう。 1900年代初頭から、コーヒーをカフェイン除去するために多くの方法が使用されてきました。すべてに利点と欠点があり、カフェインの物理的および化学的特性に依存します。 カフェインはやや極性のある分子であるため、極性のある液体である水によく溶けるのです。 しかし、コーヒーの味と香りに寄与する400種類以上の化合物の多くも水に溶けるため、熱水脱カフェイン処理によってこれらの化合物の一部も除去され、脱カフェインコーヒーの香りと味に悪影響を及ぼす可能性がある。 ジクロロメタン(CH2Cl2)や酢酸エチル(CH3CO2C2H5)はカフェインと極性が似ているため、カフェイン抽出に非常に有効な溶媒ですが、どちらも味や香りの成分の一部を除去してしまい、抽出や洗浄に長い時間を要するという問題があります。 7708>
現在、より効果的で環境にやさしい脱カフェイン法として、二酸化炭素を用いた超臨界流体抽出が広く用いられている(図7)。 304.2K以上の温度と7376kPa以上の圧力で、二酸化炭素は気体と液体の両方の性質を持つ超臨界流体となる。 気体のようにコーヒー豆の奥深くまで浸透し、液体のように特定の物質を効果的に溶かす。 蒸したコーヒー豆を超臨界二酸化炭素で抽出すると、カフェインが97~99%除去され、コーヒーの味と香りの成分はそのまま残ります。 二酸化炭素は標準的な条件下では気体であるため、抽出されたコーヒー豆からの除去は容易であり、抽出液からカフェインを回収することも可能である。 このプロセスでコーヒー豆から回収されたカフェインは貴重な製品であり、その後、他の食品や医薬品への添加物として使用することができる。 (a)カフェイン分子には極性領域と非極性領域があり、様々な極性の溶媒に溶ける。 (b)超臨界二酸化炭素を用いた典型的な脱カフェインプロセスを示す。
主要概念と要約
ある物質が固体、液体、気体の状態で存在する温度と圧力条件は、その物質の相図に要約されます。 相図は固液、液気、固気の3つの圧力-温度平衡曲線の複合プロットである。 これらの曲線は、相転移温度と圧力の関係を表している。 3つの曲線の交点は、物質の三重点(3つの相がすべて平衡となる温度と圧力)を表している。 三重点以下の圧力では、温度に関係なく、物質は液体状態で存在することができない。 液体-気体曲線の終点は物質の臨界点を表し、それ以上では液相が存在できない圧力と温度である。
化学 終章演習
- 水の相図(図2)から、
(a)35℃、85kPa
(b)-15℃、40kPa
(c)-15℃ 、0.8℃での水の状態を決定する。1 kPa
(d) 75 ℃と 3 kPa
(e) 40 ℃と 0.1 kPa
(f) 60 ℃と 50 kPa
- 0.005 ℃の温度で水が圧力を変えるとどんな状態変化が起こるでしょうか。 40 °Cのとき? At -40 °C?
- 圧力鍋は、圧力鍋内の圧力が高いほど水の沸点が高くなるため、食品を早く調理することができます。 ある圧力鍋には安全弁がついていて、圧力が3.4気圧を超えると蒸気が抜けるように設定されています。 この圧力鍋の内部で到達可能な最高温度はおおよそいくらですか? その理由を説明しなさい。
- 図5の二酸化炭素の相図から、二酸化炭素の状態を求めよ。
(a) 20℃、1000kPa
(b) 10℃、2000kPa
(c) 10℃、100kPa
(d) -40℃、500kPa
(e) -80℃、1500kPa
における二酸化炭素の状態を求めよ。
(f) -80 ℃、10 kPa
- 温度を-50 ℃に保った場合、二酸化炭素が圧力変化に伴って起こす相変化を求めよ。 温度が-40 °Cに保たれている場合? 20 °Cに保たれた場合? (図5の相図参照)
- 初期圧力65 atm、温度20 °Cで気体の二酸化炭素と平衡にある液体の二酸化炭素の混合物を入れた円筒を考えなさい。 一定温度で気体の二酸化炭素を放出したときのシリンダー圧力の時間変化をプロットせよ。
- ドライアイス(CO2(s))は大気圧では溶けない。 それは-78℃の温度で昇華する。 CO2(s)が溶けてCO2(l)になる最低圧力は何度ですか。 また、その温度は何度くらいでしょうか? (相図は図5参照)
- 激しい嵐で電気が使えなくなると、洗濯物を干すのに物干し竿が必要になることがある。 真冬の全国各地では、洗濯物を干すとすぐに凍ってしまいます。 雪が降らなければ、いずれにしても乾くのでしょうか? 5309>
- 室温(約25℃)で窒素を液化することは可能でしょうか? 二酸化硫黄を常温で液化することは可能でしょうか?
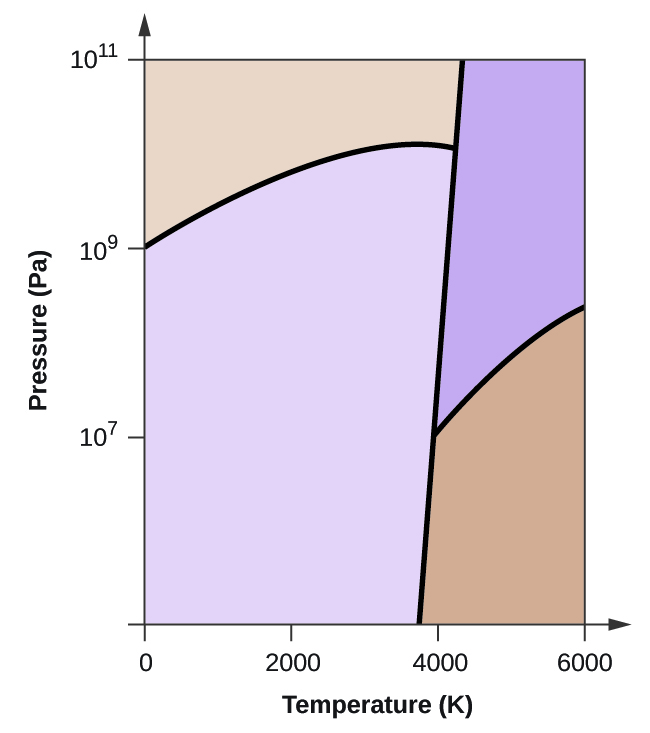
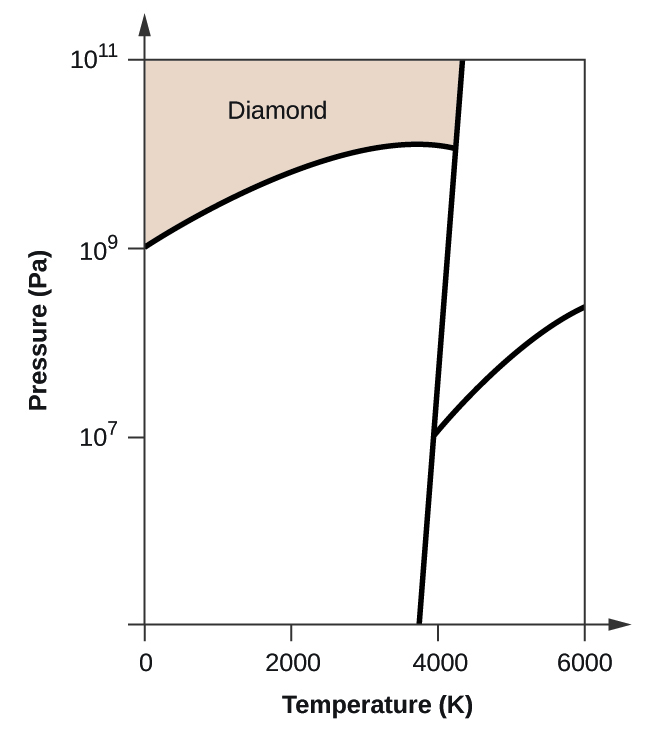
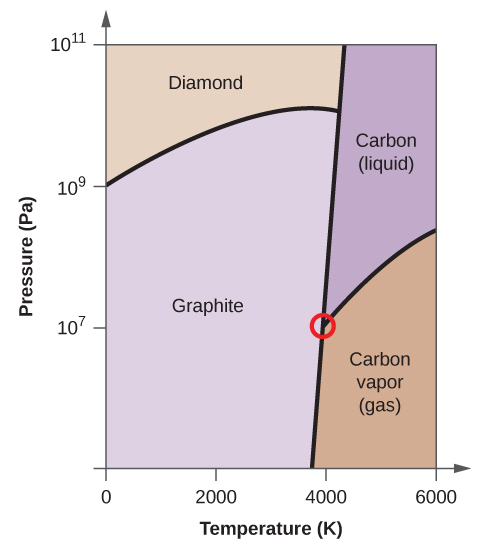
(a) 相図に、気相と液相の領域を書き入れなさい。
(b) 黒鉛は通常の状態では炭素の最も安定な相である。
(c) 通常の状態の黒鉛を2500Kに加熱し、圧力を1010Paにすると、ダイヤモンドに変化する。 7708>
(d) 相図上の各三重点に丸印をつける。
(e) 5000K、108Paで炭素は何相で存在するか?
(f) 106Paの一定圧力で炭素の試料の温度を3000Kから5000Kに上げると、どの相転移が起こるか。
用語解説
臨界点気体が液体に凝縮できない温度と圧力相図物質の相が存在できる条件をまとめた圧力-温度グラフ臨界点より高い温度と圧力にある物質超臨界流体。 気体と液体の中間の性質を示すもの 三重点 物質の気相、液相、固相が平衡する温度と圧力
Solutions
Answers to Chemistry End of Chapter Exercises
2. 低圧で0.005℃のとき、水は気体である。 圧力が4.6torrまで上がると、水は固体になり、さらに圧力が上がると液体になる。 40℃では、低圧の水は蒸気であり、約75torr以上の圧力になると液体に変化する。 40℃では、水は気体から固体になる。
4. (a)liquid; (b)solid; (c)gas; (d)gas; (e)gas; (f)gas
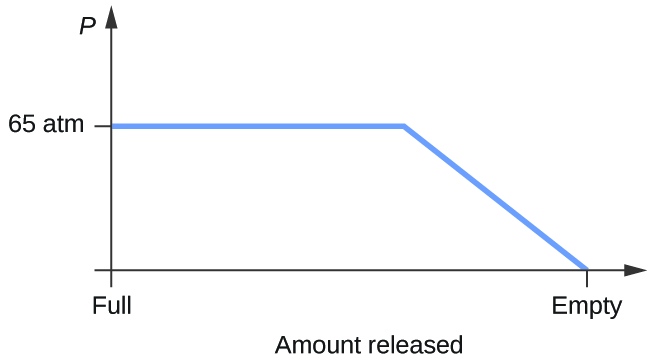
8. そう、数日かかるかもしれないが、氷は昇華してしまう。 氷は蒸気圧が小さく、一部の氷の分子は気体を形成して氷の結晶から逃げ出す。 時間が経つにつれて、固体がどんどん気体に変わり、最終的には衣類が乾いてしまいます
10. (a)
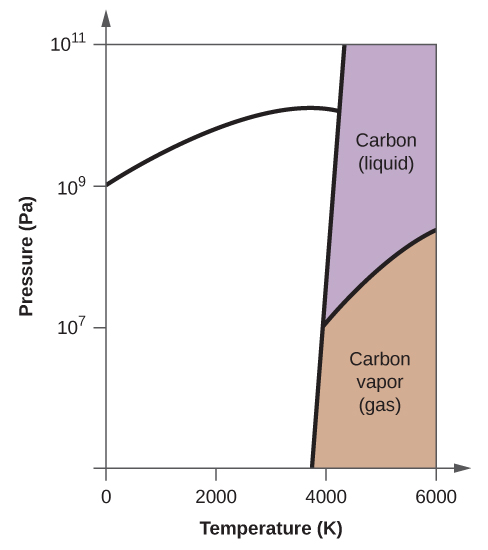
(b)
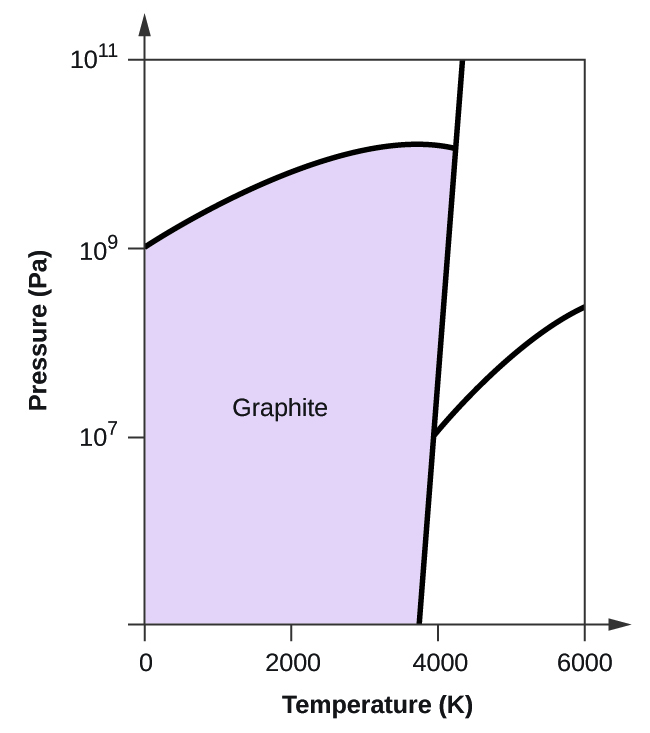
(c)
(d)
(e)liquid phase (f)sublimation
