Objectifs d’apprentissage
- Expliquer la construction et l’utilisation d’un diagramme de phase typique
- Utiliser les diagrammes de phase pour identifier les phases stables à des températures et des pressions données, et pour décrire les transitions de phase résultant des changements de ces propriétés
- Décrire la phase fluide supercritique de la matière
Dans le module précédent, on a décrit la variation de la pression de vapeur d’équilibre d’un liquide avec la température. Compte tenu de la définition du point d’ébullition, les tracés de la pression de vapeur en fonction de la température représentent la façon dont le point d’ébullition du liquide varie avec la pression. L’utilisation des courbes de chauffage et de refroidissement pour déterminer le point de fusion (ou de congélation) d’une substance a également été décrite. En effectuant ces mesures sur une large gamme de pressions, on obtient des données qui peuvent être présentées graphiquement sous forme de diagramme de phase. Un diagramme de phase combine les tracés de la pression en fonction de la température pour les équilibres de transition de phase liquide-gaz, solide-liquide et solide-gaz d’une substance. Ces diagrammes indiquent les états physiques qui existent dans des conditions spécifiques de pression et de température, et fournissent également la dépendance à la pression des températures de transition de phase (points de fusion, points de sublimation, points d’ébullition). Un diagramme de phase typique pour une substance pure est présenté dans la figure 1.
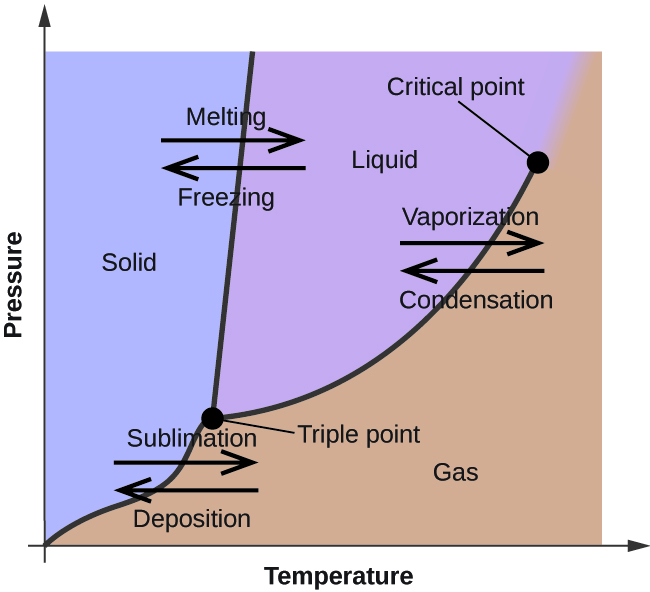
Pour illustrer l’utilité de ces graphiques, considérons le diagramme de phase de l’eau présenté à la figure 2.
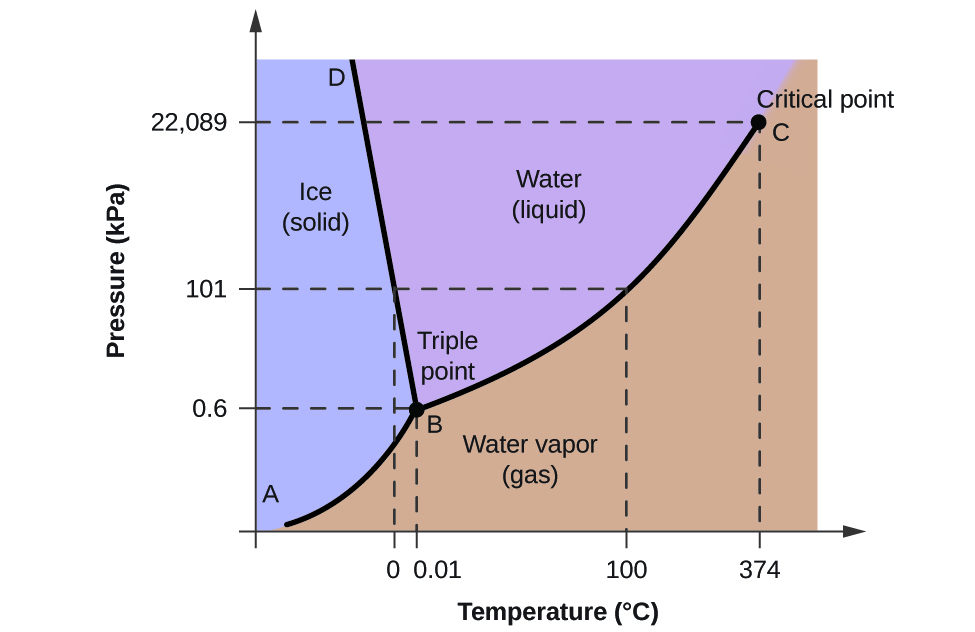
Nous pouvons utiliser le diagramme de phase pour identifier l’état physique d’un échantillon d’eau dans des conditions de pression et de température spécifiées. Par exemple, une pression de 50 kPa et une température de -10 °C correspondent à la région du diagramme étiquetée « glace ». Dans ces conditions, l’eau n’existe que sous forme solide (glace). Une pression de 50 kPa et une température de 50 °C correspondent à la région « eau », où l’eau n’existe qu’à l’état liquide. À 25 kPa et 200 °C, l’eau existe uniquement à l’état gazeux. Notez que sur le diagramme de phase H2O, les axes de pression et de température ne sont pas tracés à une échelle constante afin de permettre l’illustration de plusieurs caractéristiques importantes décrites ici.
La courbe BC de la figure 2 est le tracé de la pression de vapeur en fonction de la température, comme décrit dans le module précédent de ce chapitre. Cette courbe « liquide-vapeur » sépare les régions liquide et gazeuse du diagramme de phase et fournit le point d’ébullition de l’eau à n’importe quelle pression. Par exemple, à 1 atm, le point d’ébullition est de 100 °C. Remarquez que la courbe liquide-vapeur se termine à une température de 374 °C et à une pression de 218 atm, ce qui indique que l’eau ne peut exister sous forme liquide au-dessus de cette température, quelle que soit la pression. Dans ces conditions, les propriétés physiques de l’eau sont intermédiaires entre celles de sa phase liquide et celles de sa phase gazeuse. Cet état unique de la matière est appelé fluide supercritique, un sujet qui sera décrit dans la prochaine section de ce module.
La courbe solide-vapeur, étiquetée AB dans la figure 2, indique les températures et les pressions auxquelles la glace et la vapeur d’eau sont en équilibre. Ces paires de données température-pression correspondent aux points de sublimation, ou de dépôt, de l’eau. Si nous pouvions zoomer sur la ligne solide-gaz de la figure 2, nous verrions que la glace a une pression de vapeur d’environ 0,20 kPa à -10 °C. Ainsi, si nous plaçons un échantillon congelé dans un vide dont la pression est inférieure à 0,20 kPa, la glace se sublime. C’est la base du processus de « lyophilisation » souvent utilisé pour conserver les aliments, comme la crème glacée illustrée à la figure 3.

La courbe solide-liquide étiquetée BD montre les températures et les pressions auxquelles la glace et l’eau liquide sont en équilibre, représentant les points de fusion/congélation de l’eau. Notez que cette courbe présente une légère pente négative (fortement exagérée pour plus de clarté), ce qui indique que le point de fusion de l’eau diminue légèrement lorsque la pression augmente. L’eau est une substance inhabituelle à cet égard, car la plupart des substances présentent une augmentation du point de fusion lorsque la pression augmente. Ce comportement est en partie responsable du mouvement des glaciers, comme celui illustré à la figure 4. Le fond d’un glacier subit une immense pression due à son poids qui peut faire fondre une partie de la glace, formant une couche d’eau liquide sur laquelle le glacier peut plus facilement glisser.

Le point d’intersection des trois courbes est marqué B sur la figure 2. À la pression et à la température représentées par ce point, les trois phases de l’eau coexistent en équilibre. Cette paire de données température-pression est appelée le point triple. À des pressions inférieures au point triple, l’eau ne peut exister sous forme liquide, quelle que soit la température.
Exemple 1
Déterminer l’état de l’eau
En utilisant le diagramme de phase de l’eau donné à la figure 2, déterminez l’état de l’eau aux températures et pressions suivantes :
(a) -10 °C et 50 kPa
(b) 25 °C et 90 kPa
(c) 50 °C et 40 kPa
(d) 80 °C et 5 kPa
(e) -10 °C et 0.3 kPa
(f) 50 °C et 0,3 kPa
Solution
En utilisant le diagramme de phase de l’eau, nous pouvons déterminer que l’état de l’eau à chaque température et pression données sont les suivants : (a) solide ; (b) liquide ; (c) liquide ; (d) gaz ; (e) solide ; (f) gaz.
Vérifiez votre apprentissage
Quels changements de phase l’eau peut-elle subir lorsque la température change si la pression est maintenue à 0,3 kPa ? Si la pression est maintenue à 50 kPa ?
Réponse:
À 0,3 kPa : \N{s};{\long>flèche droite};\N{g} à -58 °C. A 50 kPa : \text{s}\;{\longrightarrow}\;\text{l} à 0 °C, \text{l}\;{\longrightarrow}\;\text{g} à 78 °C
Prenons comme autre exemple le diagramme de phase du dioxyde de carbone présenté à la figure 5. La courbe solide-liquide présente une pente positive, ce qui indique que le point de fusion du CO2 augmente avec la pression, comme c’est le cas pour la plupart des substances (l’eau étant une exception notable, comme décrit précédemment). Remarquez que le point triple est bien supérieur à 1 atm, ce qui indique que le dioxyde de carbone ne peut exister sous forme liquide dans des conditions de pression ambiante. Au contraire, le refroidissement du dioxyde de carbone gazeux à 1 atm entraîne son dépôt à l’état solide. De même, le dioxyde de carbone solide ne fond pas à une pression de 1 atm mais se sublime pour donner du CO2 gazeux. Enfin, remarquez que le point critique du dioxyde de carbone est observé à une température et une pression relativement modestes par rapport à l’eau.
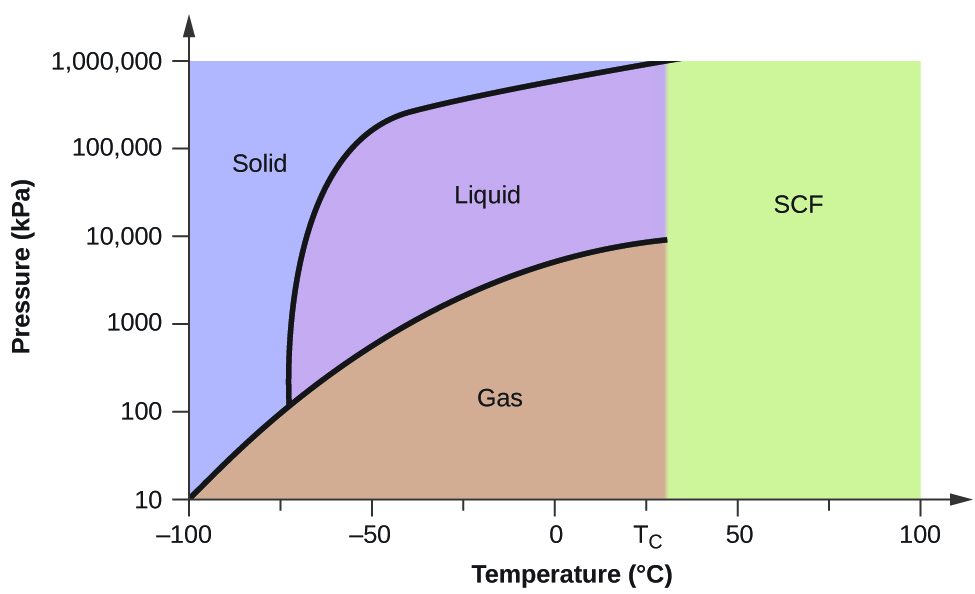
Exemple 2
Détermination de l’état du dioxyde de carbone
À l’aide du diagramme de phase du dioxyde de carbone présenté à la figure 5, déterminez l’état du CO2 aux températures et pressions suivantes :
(a) -30 °C et 2000 kPa
(b) -60 °C et 1000 kPa
(c) -60 °C et 100 kPa
(d) 20 °C et 1500 kPa
(e) 0 °C et 100 kPa
(f) 20 °C et 100 kPa
Solution
En utilisant le diagramme de phase du dioxyde de carbone fourni, nous pouvons déterminer que l’état du CO2 à chaque température et pression données sont les suivants : (a) liquide ; (b) solide ; (c) gaz ; (d) liquide ; (e) gaz ; (f) gaz.
Vérifiez vos acquis
Déterminez les changements de phase que subit le dioxyde de carbone lorsqu’on fait varier sa température, en maintenant ainsi sa pression constante à 1500 kPa ? A 500 kPa ? A quelles températures approximatives ces changements de phase se produisent-ils ?
Réponse:
à 1500 kPa : \text{s}\;{\longrightarrow};\text{l} à -45 °C, \text{l}\;{\longrightarrow}\;\text{g} à -10 °C;
à 500 kPa : \text{s}\;{\longrightarrow}\;\text{g} à -58 °C
Si on place un échantillon d’eau dans un récipient hermétique à 25 °C, qu’on enlève l’air et qu’on laisse l’équilibre de vaporisation-condensation s’établir, on se retrouve avec un mélange d’eau liquide et de vapeur d’eau à une pression de 0,03 atm. On observe clairement une frontière distincte entre le liquide plus dense et le gaz moins dense. Lorsque nous augmentons la température, la pression de la vapeur d’eau augmente, comme le décrit la courbe liquide-gaz dans le diagramme de phase de l’eau (figure 2), et un équilibre biphasé des phases liquide et gazeuse subsiste. À une température de 374 °C, la pression de vapeur est passée à 218 atm, et toute augmentation supplémentaire de la température entraîne la disparition de la frontière entre les phases liquide et gazeuse. Toute l’eau contenue dans le récipient est maintenant présente dans une seule phase dont les propriétés physiques sont intermédiaires entre celles des états gazeux et liquide. Cette phase de la matière est appelée fluide supercritique, et la température et la pression au-dessus desquelles cette phase existe est le point critique (figure 6). Au-dessus de sa température critique, un gaz ne peut pas être liquéfié, quelle que soit la pression appliquée. La pression nécessaire pour liquéfier un gaz à sa température critique est appelée pression critique. Les températures et les pressions critiques de quelques substances courantes sont données dans le tableau 6.
| Substance | Température critique (K) | Pression critique (atm) |
|---|---|---|
| hydrogène | 33.2 | 12,8 |
| azote | 126,0 | 33,5 |
| oxygène | 154.3 | 49,7 |
| dioxyde de carbone | 304,2 | 73,0 |
| ammoniac | 405,5 | 111,5 |
| dioxyde de soufre | 430.3 | 77,7 |
| eau | 647,1 | 217,7 |
| Tableau 6. | ||

Observez la transition liquide-fluide supercritique pour le dioxyde de carbone.
Comme un gaz, un fluide supercritique va se dilater et remplir un récipient, mais sa densité est beaucoup plus grande que les densités typiques des gaz, étant généralement proche de celles des liquides. Comme les liquides, ces fluides sont capables de dissoudre des solutés non volatils. Cependant, ils ne présentent pratiquement aucune tension superficielle et leur viscosité est très faible, ce qui leur permet de pénétrer plus efficacement dans les très petites ouvertures d’un mélange solide et d’en éliminer les composants solubles. Ces propriétés font des fluides supercritiques des solvants extrêmement utiles pour un large éventail d’applications. Par exemple, le dioxyde de carbone supercritique est devenu un solvant très populaire dans l’industrie alimentaire, utilisé pour décaféiner le café, éliminer les graisses des chips et extraire les arômes et les parfums des huiles d’agrumes. Il n’est pas toxique, relativement peu coûteux et n’est pas considéré comme un polluant. Après utilisation, le CO2 peut être facilement récupéré en réduisant la pression et en recueillant le gaz résultant.
Exemple 3
La température critique du dioxyde de carbone
Si nous secouons un extincteur au dioxyde de carbone par une journée fraîche (18 °C), nous pouvons entendre le CO2 liquide s’agiter à l’intérieur du cylindre. Cependant, le même cylindre semble ne contenir aucun liquide par une chaude journée d’été (35 °C). Expliquez ces observations.
Solution
Lors de la journée fraîche, la température du CO2 est inférieure à la température critique du CO2, 304 K ou 31 °C (tableau 6), donc le CO2 liquide est présent dans le cylindre. Le jour chaud, la température du CO2 est supérieure à sa température critique de 31 °C. Au-dessus de cette température, aucune pression ne peut liquéfier le CO2, donc il n’y a pas de CO2 liquide dans l’extincteur.
Vérifiez vos acquis
L’ammoniac peut être liquéfié par compression à température ambiante ; l’oxygène ne peut pas être liquéfié dans ces conditions. Pourquoi ces deux gaz présentent-ils un comportement différent ?
Réponse:
La température critique de l’ammoniac est de 405,5 K, ce qui est supérieur à la température ambiante. La température critique de l’oxygène est inférieure à la température ambiante ; l’oxygène ne peut donc pas être liquéfié à température ambiante.
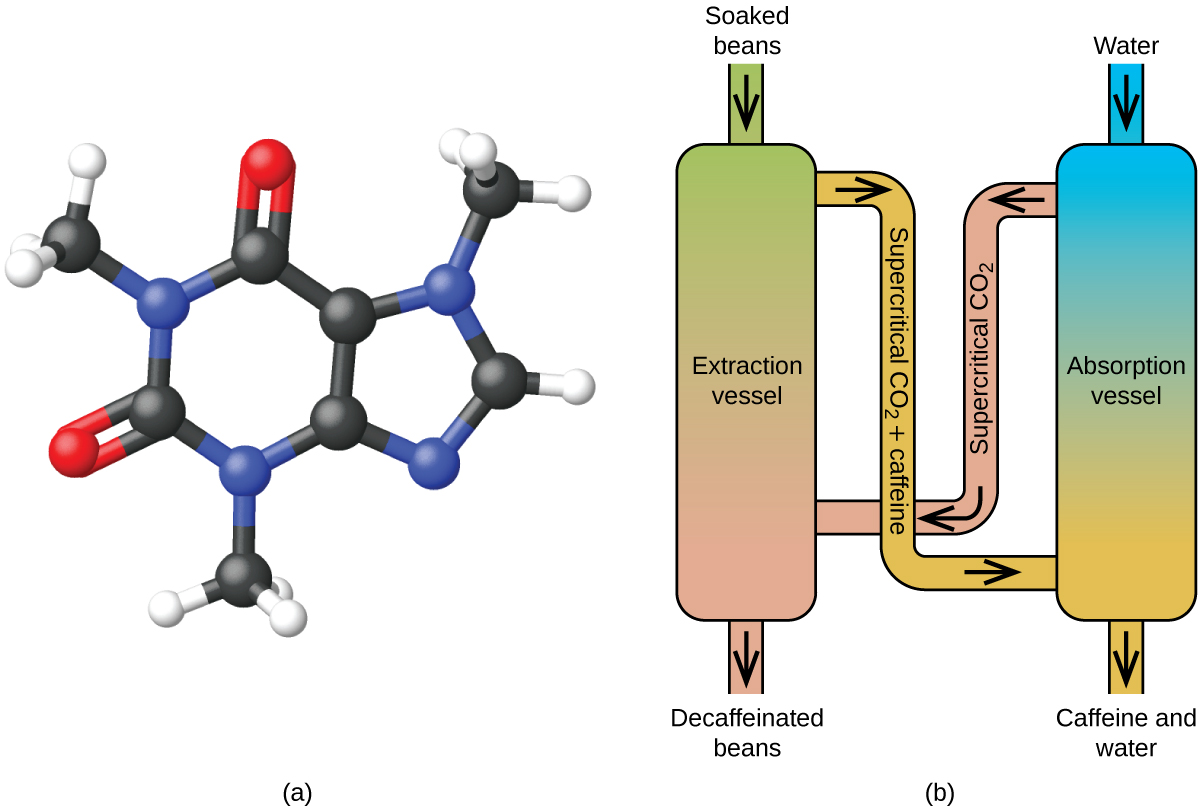
Décaféination du café à l’aide de CO2 supercritique
Le café est la deuxième matière première la plus commercialisée au monde, après le pétrole. Partout dans le monde, les gens aiment l’arôme et le goût du café. Beaucoup d’entre nous dépendent également d’un composant du café – la caféine – pour nous aider à démarrer le matin ou à rester alertes l’après-midi. Mais en fin de journée, l’effet stimulant du café peut vous empêcher de dormir, vous pouvez donc choisir de boire du café décaféiné le soir.
Depuis le début des années 1900, de nombreuses méthodes ont été utilisées pour décaféiner le café. Toutes ont des avantages et des inconvénients, et toutes dépendent des propriétés physiques et chimiques de la caféine. La caféine étant une molécule quelque peu polaire, elle se dissout bien dans l’eau, un liquide polaire. Toutefois, étant donné que bon nombre des plus de 400 autres composés qui contribuent au goût et à l’arôme du café se dissolvent également dans H2O, les procédés de décaféination à l’eau chaude peuvent également éliminer certains de ces composés, ce qui nuit à l’odeur et au goût du café décaféiné. Le dichlorométhane (CH2Cl2) et l’acétate d’éthyle (CH3CO2C2H5) ont une polarité similaire à celle de la caféine, et sont donc des solvants très efficaces pour l’extraction de la caféine, mais tous deux éliminent également certains composants de la saveur et de l’arôme, et leur utilisation nécessite de longs temps d’extraction et de nettoyage. Ces deux solvants étant toxiques, des préoccupations sanitaires ont été soulevées quant à l’effet du solvant résiduel restant dans le café décaféiné.
L’extraction par fluide supercritique à l’aide de dioxyde de carbone est désormais largement utilisée comme méthode de décaféination plus efficace et plus respectueuse de l’environnement (figure 7). À des températures supérieures à 304,2 K et à des pressions supérieures à 7376 kPa, le CO2 est un fluide supercritique, dont les propriétés sont à la fois gazeuses et liquides. Comme un gaz, il pénètre profondément dans les grains de café ; comme un liquide, il dissout efficacement certaines substances. L’extraction au dioxyde de carbone supercritique de grains de café cuits à la vapeur élimine 97 à 99 % de la caféine, laissant intacts la saveur et les composés aromatiques du café. Le CO2 étant un gaz dans des conditions normales, son élimination des grains de café extraits est facile à réaliser, tout comme la récupération de la caféine de l’extrait. La caféine récupérée des grains de café par ce procédé est un produit précieux qui peut être utilisé ultérieurement comme additif à d’autres aliments ou médicaments.
Concepts clés et résumé
Les conditions de température et de pression auxquelles une substance existe à l’état solide, liquide et gazeux sont résumées dans un diagramme de phase pour cette substance. Les diagrammes de phase sont des tracés combinés de trois courbes d’équilibre pression-température : solide-liquide, liquide-gaz, et solide-gaz. Ces courbes représentent les relations entre les températures de transition de phase et les pressions. Le point d’intersection de ces trois courbes représente le point triple de la substance, c’est-à-dire la température et la pression auxquelles les trois phases sont en équilibre. À des pressions inférieures au point triple, une substance ne peut exister à l’état liquide, quelle que soit sa température. Le terminus de la courbe liquide-gaz représente le point critique de la substance, la pression et la température au-dessus desquelles une phase liquide ne peut exister.
Exercices de fin de chapitre de chimie
- D’après le diagramme de phase de l’eau (figure 2), déterminez l’état de l’eau à :
(a) 35 °C et 85 kPa
(b) -15 °C et 40 kPa
(c) -15 °C et 0.1 kPa
(d) 75 °C et 3 kPa
(e) 40 °C et 0,1 kPa
(f) 60 °C et 50 kPa
- Quels changements de phase se produisent lorsque l’eau est soumise à une pression variable à une température constante de 0,005 °C ? A 40 °C ? À -40 °C?
- Les autocuiseurs permettent de cuire les aliments plus rapidement car la pression plus élevée à l’intérieur de l’autocuiseur augmente la température d’ébullition de l’eau. Un autocuiseur particulier possède une soupape de sécurité qui est réglée pour évacuer la vapeur si la pression dépasse 3,4 atm. Quelle est la température maximale approximative qui peut être atteinte dans cet autocuiseur ? Expliquez votre raisonnement.
- D’après le diagramme de phase du dioxyde de carbone de la figure 5, déterminez l’état du CO2 à :
(a) 20 °C et 1000 kPa
(b) 10 °C et 2000 kPa
(c) 10 °C et 100 kPa
(d) -40 °C et 500 kPa
(e) -80 °C et 1500 kPa
.
(f) -80 °C et 10 kPa
- Déterminez les changements de phase que subit le dioxyde de carbone lorsque la pression change si la température est maintenue à -50 °C ? Si la température est maintenue à -40 °C ? A 20 °C ? (Voir le diagramme de phase de la figure 5.)
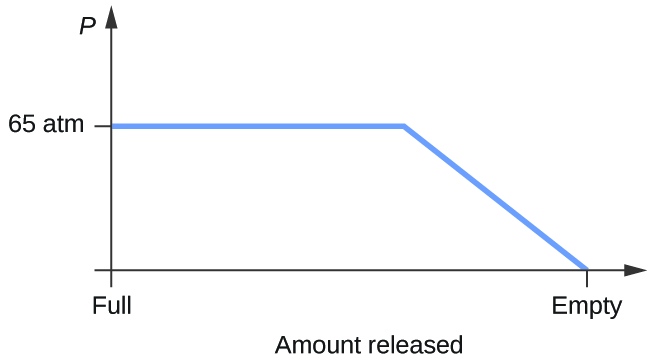
- Considérez un cylindre contenant un mélange de dioxyde de carbone liquide en équilibre avec du dioxyde de carbone gazeux à une pression initiale de 65 atm et à une température de 20 °C. Tracez un graphique représentant la variation de la pression du cylindre en fonction du temps lorsque le dioxyde de carbone gazeux est libéré à température constante.
- La glace sèche, CO2(s), ne fond pas à la pression atmosphérique. Elle se sublime à une température de -78 °C. Quelle est la pression la plus basse à laquelle le CO2(s) fondra pour donner du CO2(l) ? A quelle température approximative cela se produira-t-il ? (Voir la figure 5 pour le diagramme de phase.)
- Si une forte tempête entraîne une perte d’électricité, il peut être nécessaire d’utiliser une corde à linge pour sécher le linge. Dans de nombreuses régions du pays, au cœur de l’hiver, les vêtements vont rapidement geler lorsqu’ils sont suspendus à la corde. S’il ne neige pas, sécheront-ils quand même ? Expliquez votre réponse.
- Est-il possible de liquéfier l’azote à température ambiante (environ 25 °C) ? Est-il possible de liquéfier le dioxyde de soufre à température ambiante ? Expliquez vos réponses.
- Le carbone élémentaire possède une phase gazeuse, une phase liquide et deux phases solides différentes, comme le montre le diagramme de phase :
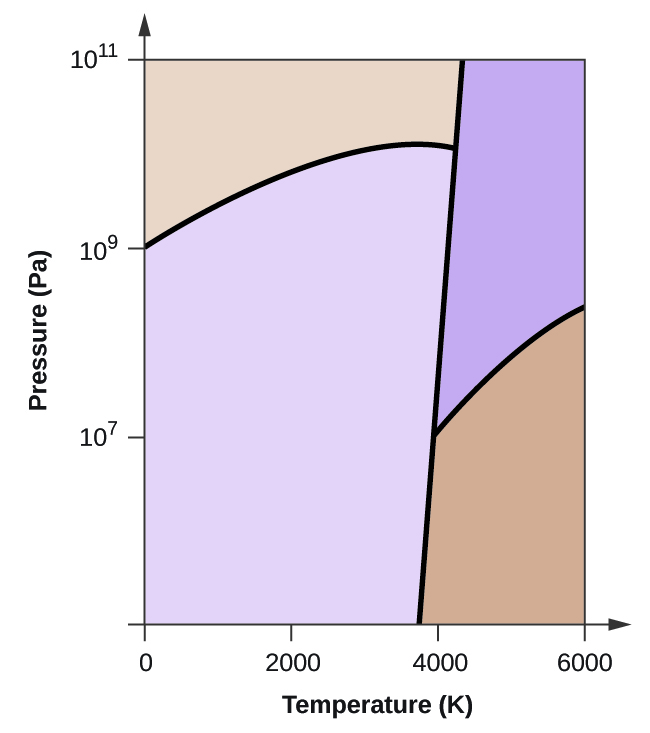
(a) Sur le diagramme de phase, étiquetez les régions gazeuse et liquide.
(b) Le graphite est la phase la plus stable du carbone dans des conditions normales. Sur le diagramme de phase, étiquetez la phase graphite.
(c) Si le graphite aux conditions normales est chauffé à 2500 K alors que la pression est augmentée à 1010 Pa, il se transforme en diamant. Identifiez la phase diamant.
(d) Encerclez chaque point triple sur le diagramme de phase.
(e) Dans quelle phase le carbone existe-t-il à 5000 K et 108 Pa ?
(f) Si la température d’un échantillon de carbone augmente de 3000 K à 5000 K à une pression constante de 106 Pa, quelle transition de phase se produit, le cas échéant ?
Glossaire
point critique température et pression au-dessus desquelles un gaz ne peut être condensé en liquide diagramme de phase graphique pression-température résumant les conditions dans lesquelles les phases d’une substance peuvent exister fluide supercritique substance à une température et une pression supérieures à son point critique ; présente des propriétés intermédiaires entre celles des états gazeux et liquide point triple température et pression auxquelles les phases vapeur, liquide et solide d’une substance sont en équilibre
Solutions
Réponses aux exercices de fin de chapitre de chimie
2. Aux basses pressions et à 0,005 °C, l’eau est un gaz. Lorsque la pression augmente jusqu’à 4,6 torr, l’eau devient un solide ; lorsque la pression augmente encore, elle devient un liquide. À 40 °C, l’eau à basse pression est une vapeur ; à des pressions supérieures à environ 75 torr, elle se transforme en liquide. A -40 °C, l’eau passe de l’état de gaz à l’état solide lorsque la pression augmente au-dessus de valeurs très basses.
4. (a) liquide ; (b) solide ; (c) gaz ; (d) gaz ; (e) gaz ; (f) gaz
8. Oui, la glace se sublime, même si cela peut prendre plusieurs jours. La glace a une faible pression de vapeur, et certaines molécules de glace forment du gaz et s’échappent des cristaux de glace. Au fur et à mesure que le temps passe, de plus en plus de solide se transforme en gaz jusqu’à ce que finalement les vêtements soient secs.
10. (a)
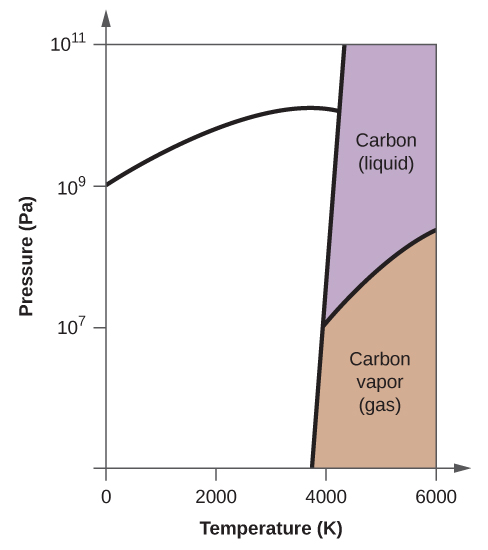
(b)
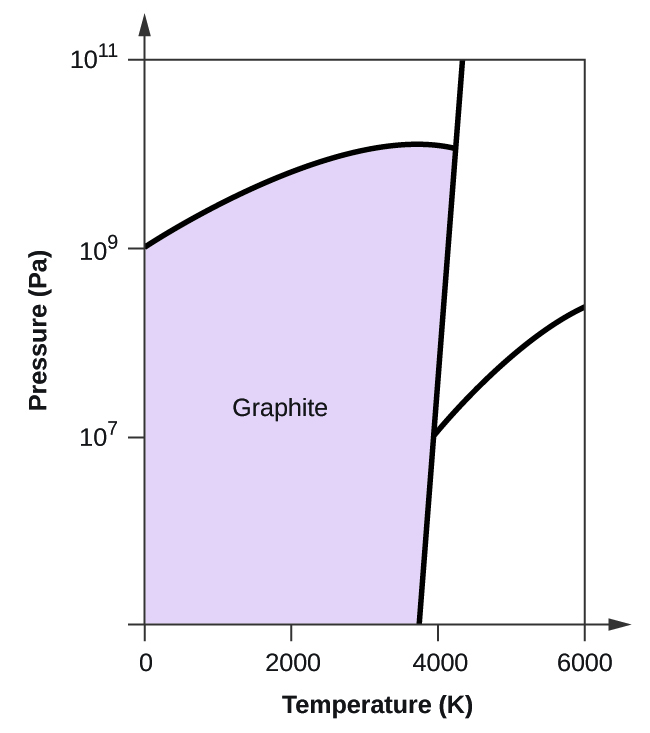
(c)
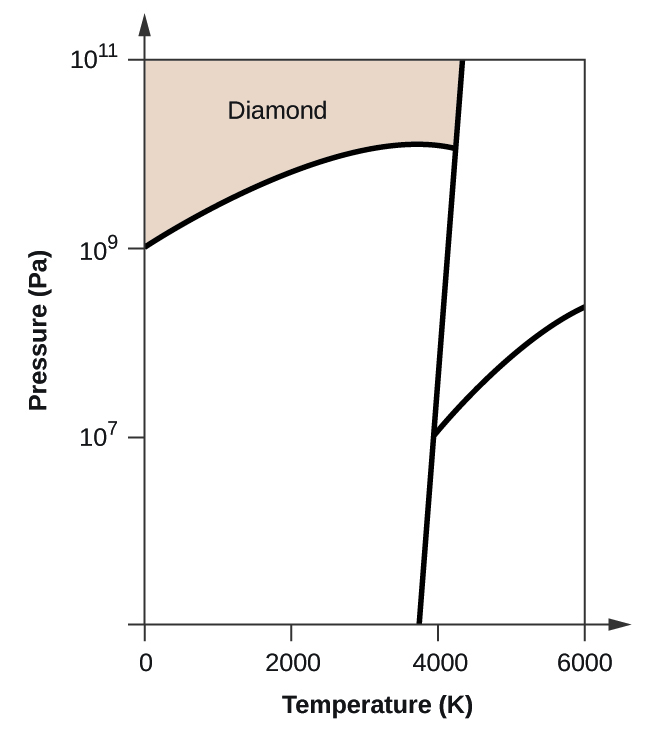
(d)
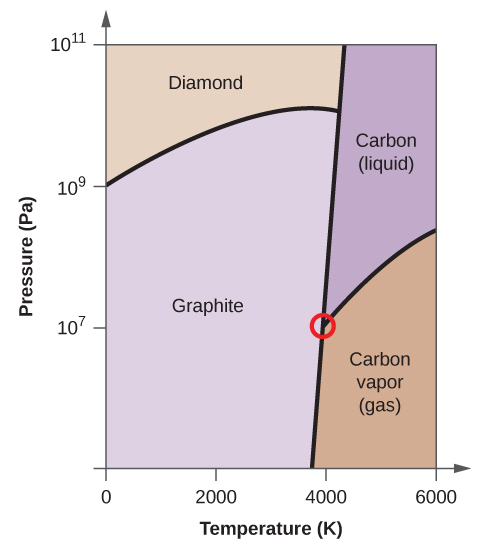
(e) phase liquide (f) sublimation
.
