Tanulmányi célok
- Magyarázza egy tipikus fázisdiagram felépítését és használatát
- Fázisdiagramokat használjon adott hőmérsékleten és nyomáson stabil fázisok azonosítására, és az e tulajdonságok változásából eredő fázisátalakulások leírása
- A szuperkritikus folyadékfázis leírása
Az előző modulban egy folyadék egyensúlyi gőznyomásának a hőmérséklettel való változását ismertettük. A forráspont definícióját figyelembe véve a gőznyomás és a hőmérséklet függvényében készített grafikonok azt mutatják, hogyan változik a folyadék forráspontja a nyomással. Szintén ismertettük a fűtési és hűtési görbék használatát egy anyag olvadási (vagy fagyási) pontjának meghatározásához. Az ilyen mérések elvégzése széles nyomástartományban olyan adatokat eredményez, amelyek fázisdiagram formájában grafikusan ábrázolhatók. A fázisdiagram az anyag folyadék-gáz, szilárd-folyadék és szilárd-gáz fázisátalakulási egyensúlyára vonatkozó nyomás-hőmérséklet ábrákat kombinálja. Ezek a diagramok jelzik az adott nyomás- és hőmérsékleti körülmények között létező fizikai állapotokat, és megadják a fázisátalakulási hőmérsékletek (olvadáspontok, szublimációs pontok, forráspontok) nyomásfüggését is. Egy tiszta anyag tipikus fázisdiagramja az 1. ábrán látható.
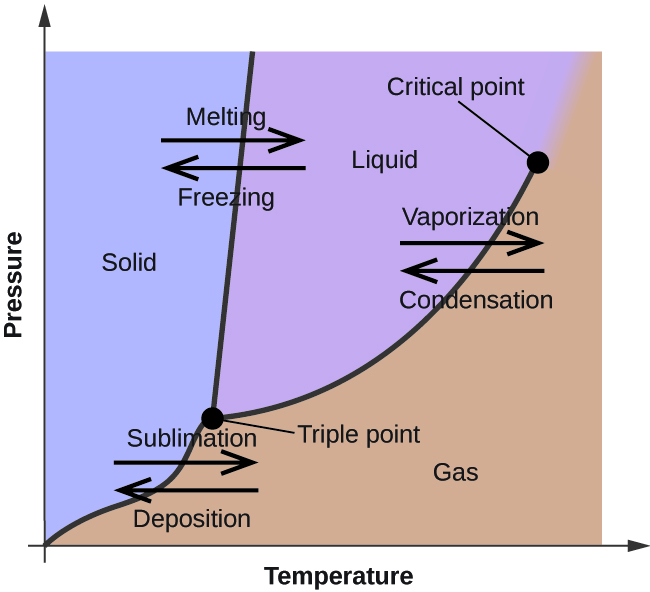
Az ábrák hasznosságának szemléltetésére tekintsük a 2. ábrán látható víz fázisdiagramját.
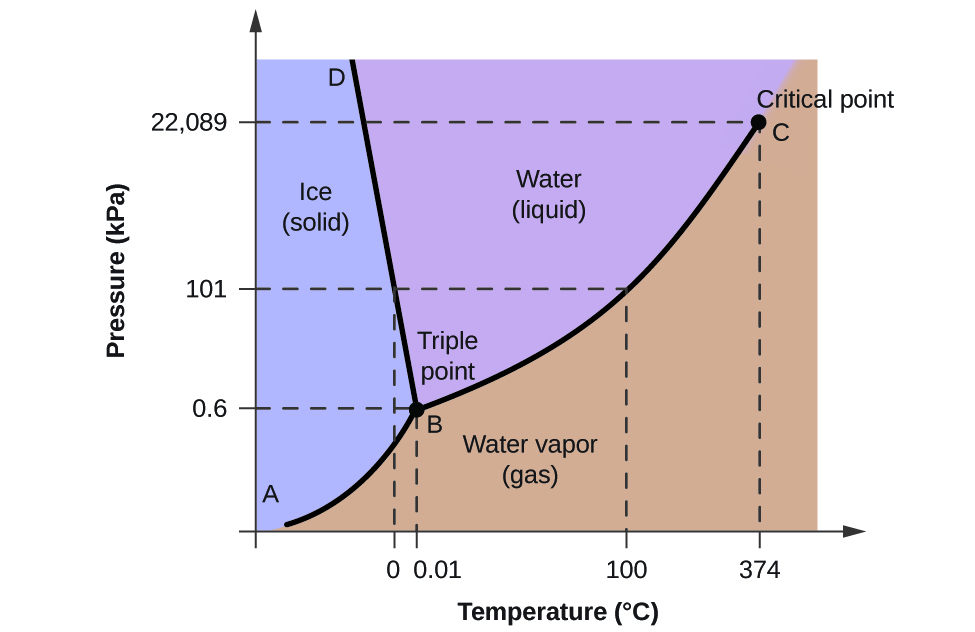
A fázisdiagram segítségével meghatározhatjuk egy vízminta fizikai állapotát meghatározott nyomás- és hőmérsékleti körülmények között. Például 50 kPa nyomás és -10 °C hőmérséklet megfelel a diagram “jég” feliratú tartományának. Ilyen körülmények között a víz csak szilárd anyagként (jégként) létezik. Az 50 kPa nyomás és az 50 °C hőmérséklet a “víz” régiónak felel meg – itt a víz csak folyadékként létezik. 25 kPa nyomáson és 200 °C-on a víz csak gáz halmazállapotban létezik. Vegyük észre, hogy a H2O fázisdiagramon a nyomás és a hőmérséklet tengelyei nem állandó skálán vannak megrajzolva, hogy lehetővé tegyék számos fontos jellemző ábrázolását az itt leírtak szerint.
A 2. ábrán látható BC görbe a gőznyomás és a hőmérséklet diagramja, ahogyan azt e fejezet előző moduljában leírtuk. Ez a “folyadék-gőz” görbe elválasztja a fázisdiagram folyékony és gáznemű tartományait, és megadja a víz forráspontját bármilyen nyomáson. Például 1 atm-nál a forráspont 100 °C. Vegyük észre, hogy a folyadék-gőz görbe 374 °C hőmérsékleten és 218 atm nyomáson végződik, ami azt jelzi, hogy a víz ezen hőmérséklet felett nem létezhet folyadékként, függetlenül a nyomástól. A víz fizikai tulajdonságai ilyen körülmények között a folyékony és a gáz halmazállapotú fázisok között helyezkednek el. Ezt az egyedülálló halmazállapotot nevezzük szuperkritikus folyadéknak, amely témát e modul következő részében ismertetjük.
A 2. ábrán AB-vel jelölt szilárd-gőz görbe jelzi azokat a hőmérsékleteket és nyomásokat, amelyeken a jég és a vízgőz egyensúlyban van. Ezek a hőmérséklet-nyomás adatpárok megfelelnek a víz szublimációs, vagyis lerakódási pontjainak. Ha a 2. ábra szilárd-gáz vonalára ráközelítenénk, láthatnánk, hogy a jég gőznyomása -10 °C-on körülbelül 0,20 kPa. Ha tehát egy fagyasztott mintát 0,20 kPa-nál kisebb nyomású vákuumba helyezünk, a jég szublimálni fog. Ez az alapja az élelmiszerek tartósítására gyakran alkalmazott “fagyasztva szárításnak”, mint például a 3. ábrán látható fagylalt.

A BD-vel jelölt szilárd-folyadék görbe azokat a hőmérsékleteket és nyomásokat mutatja, amelyeken a jég és a folyékony víz egyensúlyban van, és amelyek a víz olvadás/fagyáspontját jelentik. Vegyük észre, hogy ez a görbe enyhe negatív meredekséget mutat (az egyértelműség kedvéért erősen eltúlozva), ami azt jelzi, hogy a víz olvadáspontja a nyomás növekedésével kissé csökken. A víz ebből a szempontból szokatlan anyag, mivel a legtöbb anyag olvadáspontja a nyomás növekedésével nő. Ez a viselkedés részben felelős a gleccserek mozgásáért, mint amilyen a 4. ábrán látható. A gleccser alján a súlya miatt hatalmas nyomás keletkezik, amely megolvaszthatja a jég egy részét, így egy folyékony vízréteg képződik, amelyen a gleccser könnyebben csúszhat.

A 2. ábrán mindhárom görbe metszéspontja B-vel van jelölve. Az e pont által képviselt nyomáson és hőmérsékleten a víz mindhárom fázisa egyensúlyban van. Ezt a hőmérséklet-nyomás adatpárt nevezzük hármaspontnak. A hármaspontnál alacsonyabb nyomáson a víz a hőmérséklettől függetlenül nem tud folyadékként létezni.
1. példa
A víz állapotának meghatározása
A 2. ábrán látható víz fázisdiagramja alapján határozza meg a víz állapotát a következő hőmérsékleteken és nyomásokon:
(a) -10 °C és 50 kPa
(b) 25 °C és 90 kPa
(c) 50 °C és 40 kPa
(d) 80 °C és 5 kPa
(e) -10 °C és 0 kPa.3 kPa
(f) 50 °C és 0,3 kPa
Solution
A víz fázisdiagramját felhasználva meghatározhatjuk, hogy a víz állapota az egyes megadott hőmérsékleten és nyomáson a következő: (a) szilárd; (b) folyékony; (c) folyékony; (d) gáz; (e) szilárd; (f) gáz.
Check Your Learning
Milyen fázisváltozásokon mehet keresztül a víz a hőmérséklet változásával, ha a nyomást 0,3 kPa-on tartjuk? Ha a nyomást 50 kPa értéken tartjuk?
Válasz:
0,3 kPa értéken: \text{s}\;{\longrightarrow}\;\text{g} -58 °C-on. 50 kPa-nál: \text{s}\;{\longrightarrow}\;\text{l} 0 °C-on, \text{l}\;{\longrightarrow}\;\text{g} 78 °C-on
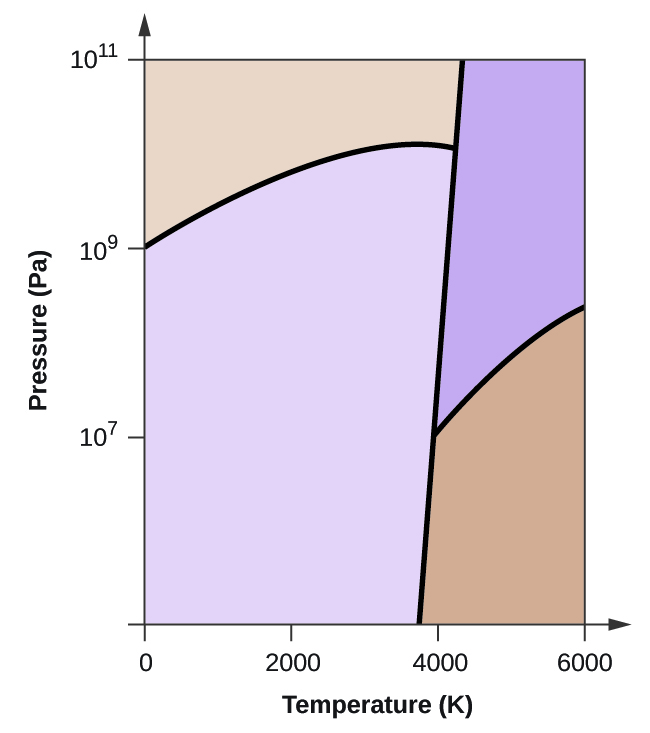
Egy másik példaként tekintsük az 5. ábrán látható szén-dioxid fázisdiagramját. A szilárd-folyadék görbe pozitív meredekséget mutat, ami azt jelzi, hogy a CO2 olvadáspontja a nyomással nő, mint a legtöbb anyag esetében (a víz a korábban ismertetett figyelemre méltó kivétel). Vegyük észre, hogy a hármaspont jóval 1 atm felett van, ami azt jelzi, hogy a szén-dioxid környezeti nyomáson nem létezhet folyadékként. Ehelyett a gáz halmazállapotú szén-dioxid 1 atm hőmérsékleten történő lehűtése a szilárd halmazállapotba kerülését eredményezi. Hasonlóképpen, a szilárd szén-dioxid 1 atm nyomáson nem olvad meg, hanem szublimál, és gáz halmazállapotú CO2-t eredményez. Végül vegyük észre, hogy a szén-dioxid kritikus pontja a vízhez képest viszonylag szerény hőmérsékleten és nyomáson figyelhető meg.
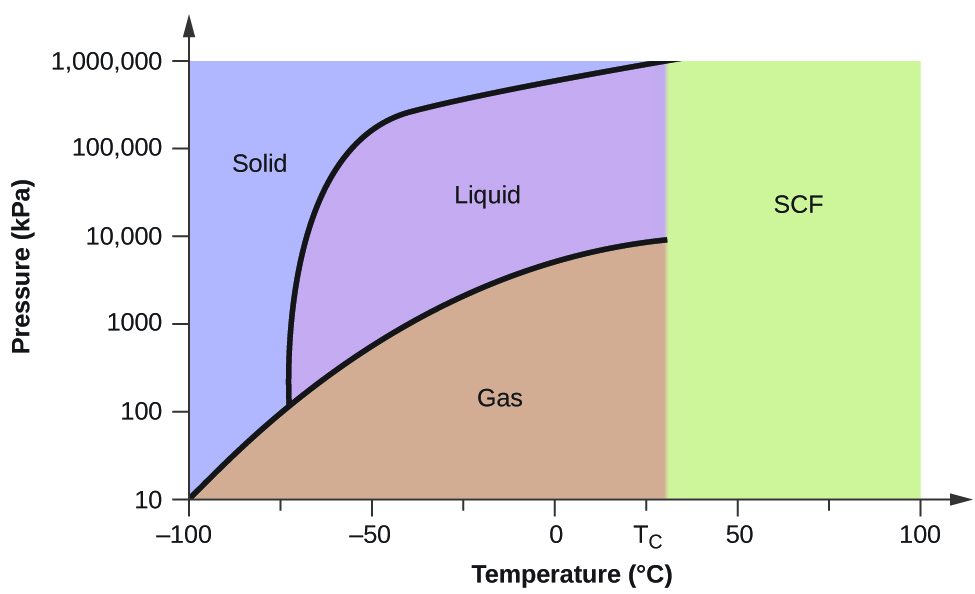
2. példa
A szén-dioxid állapotának meghatározása
A szén-dioxid 5. ábrán látható fázisdiagramja alapján határozza meg a CO2 állapotát a következő hőmérsékleteken és nyomásokon:
(a) -30 °C és 2000 kPa
(b) -60 °C és 1000 kPa
(c) -60 °C és 100 kPa
(d) 20 °C és 1500 kPa. kPa
(e) 0 °C és 100 kPa
(f) 20 °C és 100 kPa
Solution
A megadott szén-dioxid fázisdiagramot használva, meghatározhatjuk, hogy a CO2 állapota minden megadott hőmérsékleten és nyomáson a következő: (a) folyadék; (b) szilárd; (c) gáz; (d) folyadék; (e) gáz; (f) gáz.
Check Your Learning
Meghatározzuk, milyen fázisváltozásokon megy keresztül a szén-dioxid, ha a hőmérsékletét változtatjuk, így a nyomását 1500 kPa értéken tartjuk állandónak? 500 kPa nyomáson? Milyen hozzávetőleges hőmérsékleten következnek be ezek a fázisváltozások?
Válasz:
1500 kPa nyomáson: \text{s}\;{\longrightarrow}\;\text{l} -45 °C-on, \text{l}\;{\longrightarrow}\;\text{g} -10 °C-on;
500 kPa-n: \text{s}\;{\longrightarrow}\;\text{g} -58 °C-on
Ha egy 25 °C-os zárt tartályba vízmintát teszünk, eltávolítjuk a levegőt, és hagyjuk, hogy a párolgás-kondenzációs egyensúly beálljon, akkor 0,03 atm nyomáson folyékony víz és vízgőz keverékét kapjuk. Világosan megfigyelhető a sűrűbb folyadék és a kevésbé sűrű gáz közötti határozott határvonal. Ahogy növeljük a hőmérsékletet, a vízgőz nyomása növekszik, amint azt a víz fázisdiagramjának folyadék-gáz görbéje leírja (2. ábra), és megmarad a folyékony és gázfázisok kétfázisú egyensúlya. 374 °C-os hőmérsékleten a gőznyomás 218 atm-ra emelkedett, és minden további hőmérséklet-növekedés a folyékony és a gőzfázis közötti határ eltűnését eredményezi. A tartályban lévő összes víz egyetlen fázisban van jelen, amelynek fizikai tulajdonságai a gáz- és a folyadékállapotok között helyezkednek el. Ezt az anyagfázist szuperkritikus folyadéknak nevezzük, és az a hőmérséklet és nyomás, amely felett ez a fázis létezik, a kritikus pont (6. ábra). A kritikus hőmérséklet felett a gáz nem cseppfolyósítható, függetlenül attól, hogy mekkora nyomást alkalmazunk. A gáz kritikus hőmérsékleten történő cseppfolyósításához szükséges nyomást kritikus nyomásnak nevezzük. Néhány gyakori anyag kritikus hőmérsékletét és kritikus nyomását a 6. táblázat tartalmazza.
| Állag | Kritikus hőmérséklet (K) | Kritikus nyomás (atm) |
|---|---|---|
| hidrogén | 33. táblázat.2 | 12.8 |
| nitrogén | 126.0 | 33.5 |
| oxigén | 154.3 | 49.7 |
| szén-dioxid | 304.2 | 73.0 |
| ammónia | 405.5 | 111.5 |
| kén-dioxid | 430.3 | 77.7 |
| víz | 647.1 | 217.7 |
| 6. táblázat. | ||

Nézzük meg a szén-dioxid folyékonyból szuperkritikus folyadékká történő átmenetét.
A szuperkritikus folyadék a gázokhoz hasonlóan tágul és kitölti a tartályt, de sűrűsége sokkal nagyobb, mint a tipikus gázoké, jellemzően közel van a folyadékokéhoz. A folyadékokhoz hasonlóan ezek a folyadékok is képesek nem illékony oldott anyagokat oldani. Lényegében azonban nem rendelkeznek felületi feszültséggel és nagyon alacsony viszkozitással, így hatékonyabban tudnak behatolni egy szilárd keverék nagyon kis nyílásain és eltávolítani az oldható komponenseket. Ezek a tulajdonságok a szuperkritikus folyadékokat rendkívül hasznos oldószerré teszik az alkalmazások széles körében. A szuperkritikus szén-dioxid például nagyon népszerű oldószerré vált az élelmiszeriparban: használják a kávé koffeinmentesítésére, a zsírok eltávolítására a burgonyachipekből, valamint íz- és illatanyag-vegyületek kivonására a citrusolajokból. Nem mérgező, viszonylag olcsó, és nem tekinthető szennyező anyagnak. Használat után a CO2 könnyen visszanyerhető a nyomás csökkentésével és a keletkező gáz összegyűjtésével.
Példa 3
A szén-dioxid kritikus hőmérséklete
Ha egy hűvös napon (18 °C) megrázunk egy szén-dioxidos tűzoltókészüléket, halljuk, hogy a palackban folyékony CO2 lötyög. Egy forró nyári napon (35 °C) azonban ugyanez a palack látszólag nem tartalmaz folyadékot. Magyarázza meg ezeket a megfigyeléseket.
Megoldás
A hűvös napon a CO2 hőmérséklete a CO2 kritikus hőmérséklete, 304 K vagy 31 °C alatt van (6. táblázat), tehát folyékony CO2 van a palackban. A meleg napon a CO2 hőmérséklete nagyobb, mint a 31 °C-os kritikus hőmérséklete. E hőmérséklet felett semmilyen nyomás nem képes cseppfolyósítani a CO2-t, így a tűzoltó készülékben nincs folyékony CO2.
Check Your Learning
Az ammónia szobahőmérsékleten kompresszióval cseppfolyósítható; az oxigén ilyen körülmények között nem cseppfolyósítható. Miért viselkedik eltérően a két gáz?
Válasz:
Az ammónia kritikus hőmérséklete 405,5 K, ami magasabb a szobahőmérsékletnél. Az oxigén kritikus hőmérséklete a szobahőmérséklet alatt van, így az oxigén szobahőmérsékleten nem cseppfolyósítható.
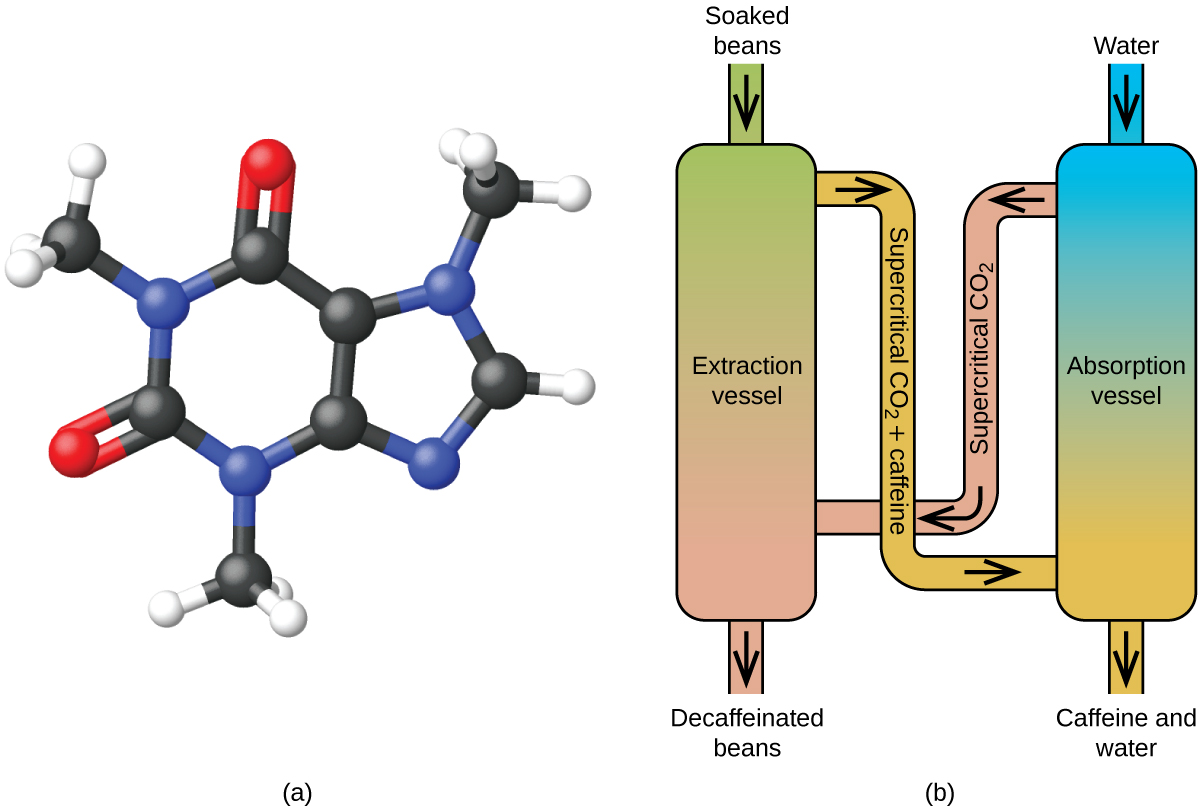
Kávé koffeinmentesítése szuperkritikus CO2 felhasználásával
A kávé a világ második legnagyobb mennyiségben forgalmazott árucikke a kőolaj után. Az emberek szerte a világon szeretik a kávé aromáját és ízét. Sokan közülünk a kávé egyik összetevőjétől, a kávétól is függnek, hogy reggel beinduljunk, vagy délután éberek maradjunk. Késő este azonban a kávé élénkítő hatása miatt nem tudunk elaludni, ezért este inkább koffeinmentes kávét iszunk.
Az 1900-as évek eleje óta számos módszert alkalmaznak a kávé koffeinmentesítésére. Mindegyiknek vannak előnyei és hátrányai, és mindegyik a koffein fizikai és kémiai tulajdonságaitól függ. Mivel a koffein egy kissé poláris molekula, jól oldódik vízben, egy poláris folyadékban. Mivel azonban a kávé ízéhez és aromájához hozzájáruló több mint 400 egyéb vegyület közül sok szintén oldódik H2O-ban, a forró vizes koffeinmentesítési eljárások e vegyületek egy részét is eltávolíthatják, ami kedvezőtlenül befolyásolja a koffeinmentesített kávé illatát és ízét. A diklórmetán (CH2Cl2) és az etil-acetát (CH3CO2C2H5) a koffeinhez hasonló polaritású, ezért nagyon hatékony oldószerek a koffein kivonására, de mindkettő eltávolít néhány íz- és aromakomponenst is, és használatuk hosszú kivonási és tisztítási időt igényel. Mivel mindkét oldószer mérgező, egészségügyi aggályok merültek fel a koffeinmentesített kávéban visszamaradó oldószer hatása miatt.
A szén-dioxiddal történő szuperkritikus fluid extrakciót ma már széles körben alkalmazzák, mint hatékonyabb és környezetbarátabb koffeinmentesítési módszert (7. ábra). 304,2 K feletti hőmérsékleten és 7376 kPa feletti nyomáson a CO2 szuperkritikus folyadék, amely egyszerre rendelkezik gáz és folyadék tulajdonságokkal. Mint gáz, mélyen behatol a kávébabokba; mint folyadék, hatékonyan old fel bizonyos anyagokat. A gőzölt kávébabok szuperkritikus szén-dioxidos extrakciója a koffein 97-99%-át távolítja el, érintetlenül hagyva a kávé íz- és aromakomponenseit. Mivel a CO2 szabványos körülmények között gáz, eltávolítása a kivont kávébabból könnyen megoldható, csakúgy, mint a koffein visszanyerése a kivonatból. A kávébabból ezzel az eljárással kinyert koffein értékes termék, amely később más élelmiszerek vagy gyógyszerek adalékanyagaként használható fel.
Főbb fogalmak és összefoglaló
Azokat a hőmérsékleti és nyomásviszonyokat, amelyek mellett egy anyag szilárd, folyékony és gáz halmazállapotban létezik, az adott anyag fázisdiagramja foglalja össze. A fázisdiagramok három nyomás-hőmérséklet egyensúlyi görbe kombinált ábrái: szilárd-folyadék, folyadék-gáz és szilárd-gáz. Ezek a görbék a fázisátalakulási hőmérsékletek és a nyomások közötti összefüggéseket mutatják. Mindhárom görbe metszéspontja az anyag hármaspontját jelenti – azt a hőmérsékletet és nyomást, ahol mindhárom fázis egyensúlyban van. A hármaspont alatti nyomáson az anyag nem tud folyékony halmazállapotban létezni, függetlenül a hőmérsékletétől. A folyadék-gáz görbe végpontja az anyag kritikus pontját jelöli, azt a nyomást és hőmérsékletet, amely felett a folyékony fázis nem létezhet.
Kémia fejezet végi feladatok
- A víz fázisdiagramjából (2. ábra) határozza meg a víz állapotát:
(a) 35 °C és 85 kPa
(b) -15 °C és 40 kPa
(c) -15 °C és 0.1 kPa
(d) 75 °C és 3 kPa
(e) 40 °C és 0,1 kPa
(f) 60 °C és 50 kPa
- Milyen fázisátalakulás megy végbe, ha 0,005 °C állandó hőmérsékleten változó nyomásnak tesszük ki a vizet? 40 °C-on? -40 °C-on?
- A nyomástűzhelyekben gyorsabban főnek az ételek, mert a nyomástűzhelyben lévő nagyobb nyomás megnöveli a víz forráspontját. Egy adott nyomástűzhelyen van egy biztonsági szelep, amely úgy van beállítva, hogy ha a nyomás meghaladja a 3,4 atm-ot, akkor a gőz távozik. Mennyi a megközelítőleg maximális hőmérséklet, amelyet ebben a gyorsfőzőben el lehet érni? Magyarázza meg az érvelését.
- Az 5. ábrán látható szén-dioxid fázisdiagram alapján határozza meg a CO2 állapotát:
(a) 20 °C és 1000 kPa
(b) 10 °C és 2000 kPa
(c) 10 °C és 100 kPa
(d) -40 °C és 500 kPa
(e) -80 °C és 1500 kPa
.
(f) -80 °C és 10 kPa
- Meghatározzuk, hogy a szén-dioxid milyen fázisváltozásokon megy keresztül a nyomás változásával, ha a hőmérsékletet -50 °C-on tartjuk? Ha a hőmérsékletet -40 °C-on tartjuk? 20 °C-on? (Lásd az 5. ábrán látható fázisdiagramot.)
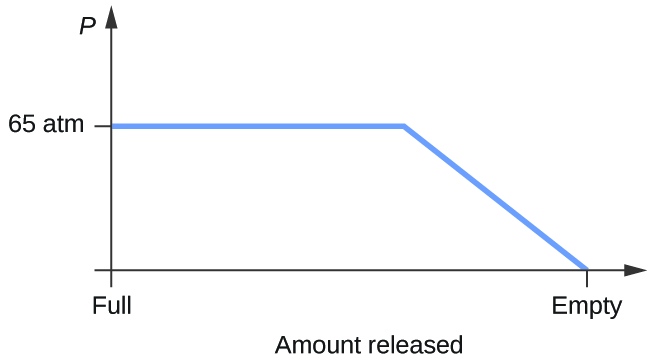
- Feldolgozzunk egy palackot, amely 65 atm kezdeti nyomáson és 20 °C hőmérsékleten egyensúlyban lévő folyékony szén-dioxid és gáz halmazállapotú szén-dioxid keverékét tartalmazza. Vázoljuk fel a palack nyomásának időbeli változását ábrázoló ábrát, ahogy a gáznemű szén-dioxid állandó hőmérsékleten felszabadul.
- A száraz jég, a CO2(s), atmoszférikus nyomáson nem olvad el. A jég -78 °C hőmérsékleten szublimál. Mekkora az a legkisebb nyomás, amelyen a CO2(s) megolvad, és CO2(l) keletkezik? Körülbelül milyen hőmérsékleten következik ez be? (A fázisdiagramot lásd az 5. ábrán.)
- Ha egy heves vihar következtében megszűnik az áramszolgáltatás, a szennyes szárítására ruhaszárítókötélre lehet szükség. Az ország sok részén télvíz idején a ruhák gyorsan megfagynak, ha a kötélre akasztják őket. Ha nem esik a hó, akkor is meg fognak száradni? Magyarázza meg válaszát.
- Szobahőmérsékleten (kb. 25 °C-on) lehet-e nitrogént cseppfolyósítani? Lehetséges-e kén-dioxidot szobahőmérsékleten cseppfolyósítani? Magyarázza meg válaszait.
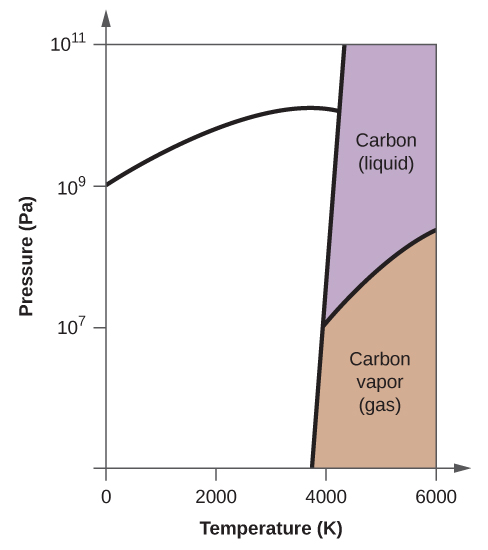
- Az elemi szénnek van egy gázfázisa, egy folyadékfázisa és két különböző szilárd fázisa, amint azt a fázisdiagram mutatja:
(a) Jelölje meg a fázisdiagramon a gáz és folyadék tartományokat.
(b) A grafit a szén legstabilabb fázisa normál körülmények között. Jelölje meg a fázisdiagramon a grafit fázisát.
(c) Ha a grafitot normál körülmények között 2500 K-ra melegítjük, miközben a nyomást 1010 Pa-ra növeljük, gyémánttá alakul. Jelölje meg a gyémánt fázist.
(d) Karikázzon be minden hármaspontot a fázisdiagramon.
(e) Milyen fázisban van a szén 5000 K és 108 Pa nyomáson?
(f) Ha egy szénminta hőmérséklete 3000 K-ról 5000 K-ra nő 106 Pa állandó nyomás mellett, melyik fázisátalakulás következik be, ha van ilyen?
Glosszárium
kritikus pont hőmérséklet és nyomás, amely felett egy gáz nem kondenzálható folyadékká fázisdiagram nyomás-hőmérséklet diagram, amely összefoglalja azokat a feltételeket, amelyek mellett egy anyag fázisai létezhetnek szuperkritikus folyadék anyag a kritikus pontjánál magasabb hőmérsékleten és nyomáson; a gáznemű és a folyékony halmazállapot tulajdonságai között elhelyezkedő tulajdonságokkal rendelkezik Hármaspont hőmérséklet és nyomás, amelynél egy anyag gőz-, folyadék- és szilárd fázisa egyensúlyban van
megoldások
Válaszok a kémia fejezet végi feladatokra
2. Kémia fejezet végi feladatok
. Kis nyomáson és 0,005 °C-on a víz gáz. Ahogy a nyomás 4,6 torrig nő, a víz szilárd anyaggá válik; ahogy a nyomás még tovább nő, folyékony anyaggá válik. 40 °C-on a víz alacsony nyomáson gőz; kb. 75 torrnál nagyobb nyomáson folyadékká alakul. -40 °C-on a víz gázból szilárddá válik, ahogy a nyomás nagyon alacsony értékek fölé emelkedik.
4. (a) folyadék; (b) szilárd; (c) gáz; (d) gáz; (e) gáz; (f) gáz
8. Igen, a jég megdermed, bár ez több napig is eltarthat. A jégnek kicsi a gőznyomása, és néhány jégmolekula gázt képez, és kiszabadul a jégkristályokból. Ahogy telik az idő, egyre több szilárd anyag alakul át gázzá, míg végül a ruhák megszáradnak.
10. (a)
(b)
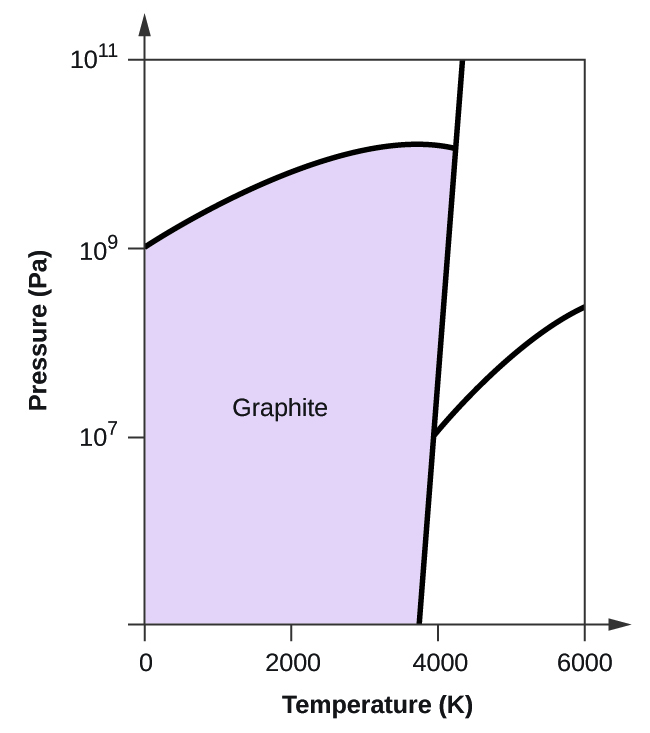
(c)
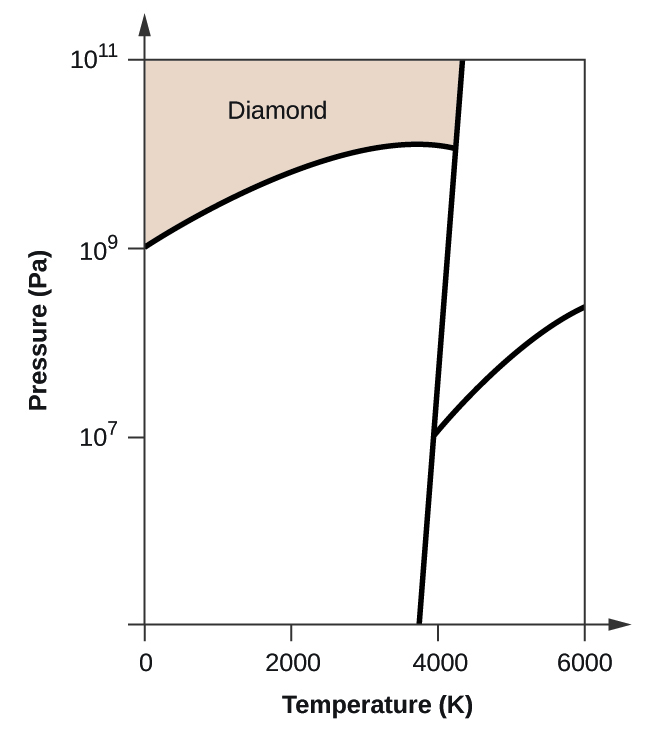
(d)
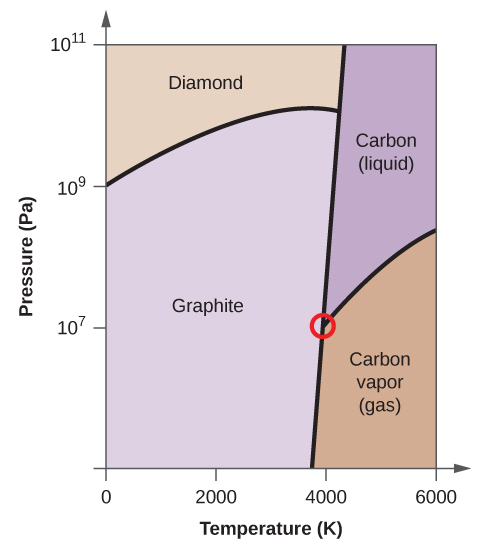
(e) folyékony fázis (f) szublimáció
.
