Cele nauczania
- Wyjaśnić budowę i zastosowanie typowego diagramu fazowego
- Używać diagramów fazowych do identyfikacji faz stabilnych w danych temperaturach i ciśnieniach, oraz opisać przejścia fazowe wynikające ze zmian tych właściwości
- Opisać fazę nadkrytyczną cieczy w materii
W poprzednim module opisano zmianę równowagowej prężności pary cieczy w zależności od temperatury. Biorąc pod uwagę definicję temperatury wrzenia, wykresy ciśnienia pary w zależności od temperatury przedstawiają, jak zmienia się temperatura wrzenia cieczy w zależności od ciśnienia. Opisano również wykorzystanie krzywych grzania i chłodzenia do określenia punktu topnienia (lub zamarzania) substancji. Dokonywanie takich pomiarów w szerokim zakresie ciśnień daje dane, które mogą być przedstawione graficznie jako diagram fazowy. Diagram fazowy łączy wykresy ciśnienia w zależności od temperatury dla równowagi fazowej ciecz-gaz, ciało stałe-ciecz i ciało stałe-gaz danej substancji. Diagramy te wskazują stany fizyczne, które istnieją w określonych warunkach ciśnienia i temperatury, a także przedstawiają zależność temperatur przemian fazowych od ciśnienia (punkty topnienia, sublimacji, wrzenia). Typowy diagram fazowy dla czystej substancji przedstawiono na rysunku 1.
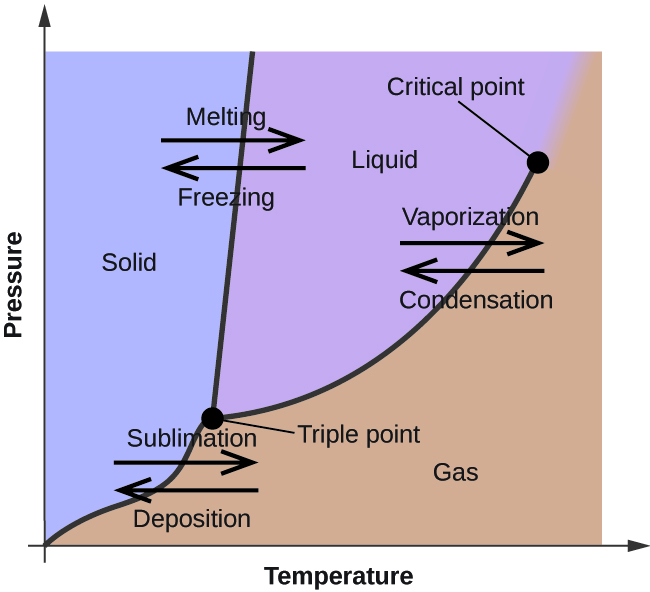
Aby zilustrować użyteczność tych wykresów, rozważmy diagram fazowy dla wody przedstawiony na rysunku 2.
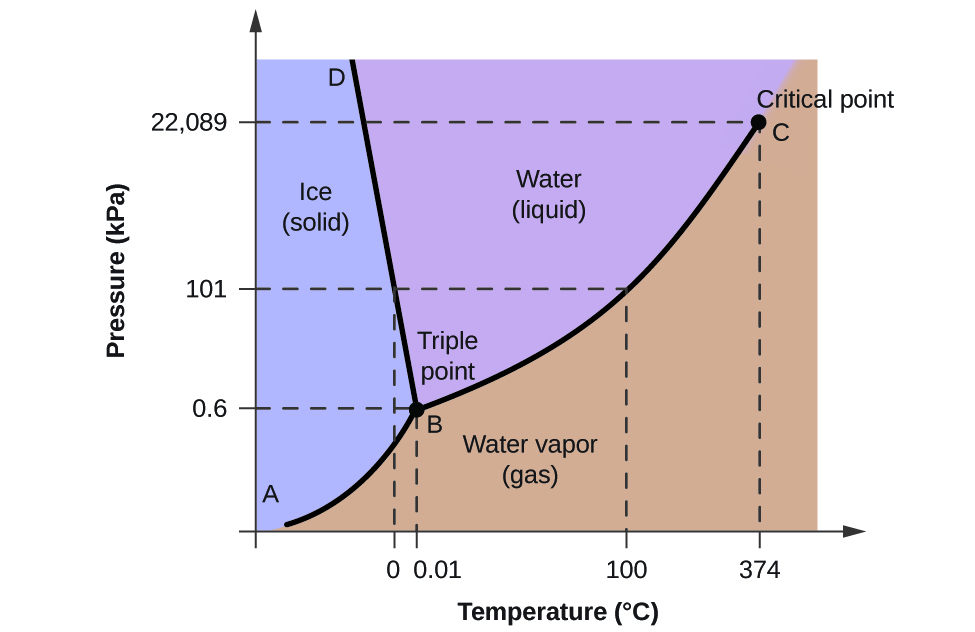
Możemy użyć diagramu fazowego do identyfikacji stanu fizycznego próbki wody w określonych warunkach ciśnienia i temperatury. Na przykład, ciśnienie 50 kPa i temperatura -10 °C odpowiadają obszarowi diagramu oznaczonemu jako „lód”. W tych warunkach woda istnieje tylko jako ciało stałe (lód). Ciśnienie 50 kPa i temperatura 50 °C odpowiadają obszarowi „woda” – w tych warunkach woda występuje tylko jako ciecz. Przy ciśnieniu 25 kPa i temperaturze 200 °C woda występuje tylko w stanie gazowym. Należy zauważyć, że na diagramie fazowym H2O, osie ciśnienia i temperatury nie są narysowane w stałej skali, aby umożliwić ilustrację kilku ważnych cech, jak opisano tutaj.
Krzywa BC na rysunku 2 jest wykresem ciśnienia pary w stosunku do temperatury, jak opisano w poprzednim module tego rozdziału. Ta krzywa „ciecz-para” oddziela ciecz i gazowe regiony diagramu fazowego i zapewnia punkt wrzenia dla wody w dowolnym ciśnieniu. Na przykład, przy ciśnieniu 1 atm, temperatura wrzenia wynosi 100 °C. Zauważmy, że krzywa ciecz-para kończy się w temperaturze 374 °C i pod ciśnieniem 218 atm, co oznacza, że woda nie może istnieć jako ciecz powyżej tej temperatury, niezależnie od ciśnienia. Właściwości fizyczne wody w tych warunkach są pośrednie pomiędzy fazą ciekłą i gazową. Ten unikalny stan materii nazywany jest płynem nadkrytycznym, temat, który zostanie opisany w następnej części tego modułu.
Krzywa ciało stałe-para, oznaczona jako AB na rysunku 2, wskazuje temperatury i ciśnienia, w których lód i para wodna są w równowadze. Te pary danych temperatura-ciśnienie odpowiadają punktom sublimacji lub osadzania się wody. Gdybyśmy mogli powiększyć linię ciało stałe-gaz na rysunku 2, zobaczylibyśmy, że lód ma ciśnienie pary około 0,20 kPa w temperaturze -10°C. Tak więc, jeśli umieścimy zamrożoną próbkę w próżni o ciśnieniu mniejszym niż 0,20 kPa, lód ulegnie sublimacji. Jest to podstawa procesu „liofilizacji” często stosowanego do konserwacji żywności, takiej jak lody pokazane na Rysunku 3.

Krzywa ciało stałe-ciecz oznaczona jako BD pokazuje temperatury i ciśnienia, w których lód i woda w stanie ciekłym są w równowadze, reprezentując punkty topnienia/zamarzania dla wody. Zauważ, że ta krzywa wykazuje lekkie ujemne nachylenie (znacznie przesadzone dla jasności), wskazując, że punkt topnienia dla wody zmniejsza się nieznacznie wraz ze wzrostem ciśnienia. Woda jest pod tym względem niezwykłą substancją, ponieważ większość substancji wykazuje wzrost temperatury topnienia wraz ze wzrostem ciśnienia. To zachowanie jest częściowo odpowiedzialne za ruch lodowców, takich jak ten pokazany na rysunku 4. Dno lodowca doświadcza ogromnego ciśnienia spowodowanego jego ciężarem, który może stopić część lodu, tworząc warstwę ciekłej wody, po której lodowiec może łatwiej się ślizgać.

Punkt przecięcia wszystkich trzech krzywych jest oznaczony jako B na Rysunku 2. Przy ciśnieniu i temperaturze reprezentowanych przez ten punkt, wszystkie trzy fazy wody współistnieją w równowadze. Ta para danych temperatura-ciśnienie nazywana jest punktem potrójnym. Przy ciśnieniu niższym od punktu potrójnego woda nie może istnieć jako ciecz, niezależnie od temperatury.
Przykład 1
Określanie stanu skupienia wody
Korzystając z diagramu fazowego dla wody podanego na rysunku 2, określ stan skupienia wody w następujących temperaturach i ciśnieniach:
(a) -10 °C i 50 kPa
(b) 25 °C i 90 kPa
(c) 50 °C i 40 kPa
(d) 80 °C i 5 kPa
(e) -10 °C i 0.3 kPa
(f) 50 °C i 0,3 kPa
Roztwór
Korzystając z diagramu fazowego dla wody, możemy określić, że stan skupienia wody w każdej podanej temperaturze i ciśnieniu jest następujący: (a) ciało stałe; (b) ciecz; (c) ciecz; (d) gaz; (e) ciało stałe; (f) gaz.
Check Your Learning
Jakim przemianom fazowym może ulegać woda wraz ze zmianą temperatury, jeśli ciśnienie jest utrzymywane na poziomie 0,3 kPa? Jeśli ciśnienie jest utrzymywane na poziomie 50 kPa?
Odpowiedź:
Przy ciśnieniu 0,3 kPa: \^tekst{s}}, ^tekst{g} w temperaturze -58 °C. Przy 50 kPa: \^tekst{s}}, ^tekst{l} w temperaturze 0 °C, ^tekst{l}}, ^tekst{g} w temperaturze 78 °C
Jako kolejny przykład rozważmy diagram fazowy dla dwutlenku węgla przedstawiony na rysunku 5. Krzywa ciało stałe-ciecz wykazuje dodatnie nachylenie, wskazując, że temperatura topnienia dla CO2 wzrasta wraz z ciśnieniem, tak jak dla większości substancji (woda jest godnym uwagi wyjątkiem opisanym wcześniej). Zauważmy, że punkt potrójny jest znacznie powyżej 1 atm, co wskazuje, że dwutlenek węgla nie może istnieć jako ciecz w warunkach ciśnienia otoczenia. Zamiast tego, schłodzenie gazowego dwutlenku węgla pod ciśnieniem 1 atm powoduje jego przejście w stan stały. Podobnie, stały dwutlenek węgla nie topi się pod ciśnieniem 1 atm, lecz sublimuje, dając gazowy CO2. Wreszcie, zauważmy, że punkt krytyczny dla dwutlenku węgla jest obserwowany w stosunkowo niewielkiej temperaturze i ciśnieniu w porównaniu z wodą.
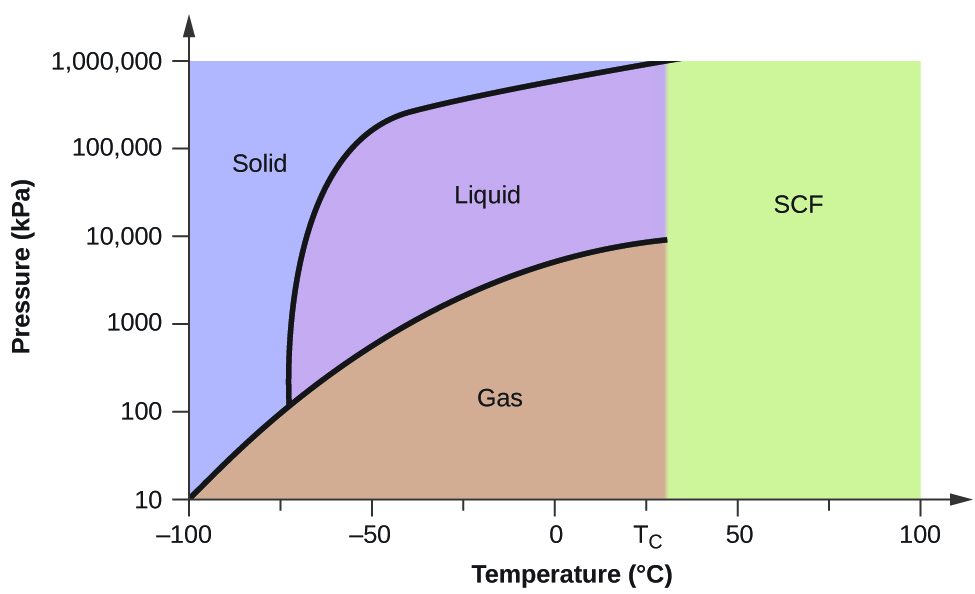
Przykład 2
Określanie stanu skupienia dwutlenku węgla
Korzystając z diagramu fazowego dla dwutlenku węgla przedstawionego na rysunku 5, określ stan skupienia CO2 w następujących temperaturach i ciśnieniach:
(a) -30 °C i 2000 kPa
(b) -60 °C i 1000 kPa
(c) -60 °C i 100 kPa
(d) 20 °C i 1500 kPa
(e) 0 °C i 100 kPa
(f) 20 °C i 100 kPa
Rozwiązanie
Korzystając z podanego diagramu fazowego dla dwutlenku węgla, możemy stwierdzić, że stan skupienia CO2 w każdej z podanych temperatur i ciśnień jest następujący: (a) ciecz; (b) ciało stałe; (c) gaz; (d) ciecz; (e) gaz; (f) gaz.
Check Your Learning
Określ, jakim przemianom fazowym ulega dwutlenek węgla, gdy zmienia się jego temperaturę, utrzymując tym samym jego ciśnienie na stałym poziomie 1500 kPa? Przy 500 kPa? W jakich przybliżonych temperaturach zachodzą te przemiany fazowe?
Odpowiedź:
przy ciśnieniu 1500 kPa: \tekst{s} w temperaturze -45 °C, \tekst{l} w temperaturze -10 °C;
przy 500 kPa: \text{s};\tekst{g} at -58 °C
Jeśli umieścimy próbkę wody w szczelnie zamkniętym pojemniku w temperaturze 25 °C, usuniemy powietrze i pozwolimy, aby równowaga parowanie-kondensacja ustaliła się, pozostaniemy z mieszaniną ciekłej wody i pary wodnej pod ciśnieniem 0,03 atm. Wyraźnie widać granicę pomiędzy bardziej gęstą cieczą a mniej gęstym gazem. Wraz ze wzrostem temperatury ciśnienie pary wodnej wzrasta, co opisuje krzywa ciecz-gaz na diagramie fazowym wody (rys. 2), i pozostaje równowaga dwufazowa fazy ciekłej i gazowej. W temperaturze 374 °C ciśnienie pary wzrosło do 218 atm, a każdy dalszy wzrost temperatury powoduje zanik granicy między fazą ciekłą i parą. Cała woda w zbiorniku znajduje się teraz w jednej fazie, której właściwości fizyczne są pośrednie między stanem gazowym a ciekłym. Ta faza materii nazywana jest płynem nadkrytycznym, a temperatura i ciśnienie, powyżej których ta faza istnieje, to punkt krytyczny (rys. 6). Powyżej temperatury krytycznej gaz nie może zostać skroplony bez względu na to, jak duże ciśnienie zostanie zastosowane. Ciśnienie wymagane do skroplenia gazu w temperaturze krytycznej nazywane jest ciśnieniem krytycznym. Temperatury krytyczne i ciśnienia krytyczne niektórych powszechnie występujących substancji podano w tabeli 6.
| Substancja | Temperatura krytyczna (K) | Ciśnienie krytyczne (atm) |
|---|---|---|
| wodór | 33.2 | 12.8 |
| azot | 126.0 | 33.5 |
| tlen | 154.3 | 49,7 |
| dwutlenek węgla | 304,2 | 73,0 |
| amoniak | 405,5 | 111,5 |
| dwutlenek siarki | 430.3 | 77,7 |
| woda | 647,1 | 217,7 |
| Tabela 6. | ||

Obserwuj przejście ze stanu ciekłego w nadkrytyczny dla dwutlenku węgla.
Podobnie jak gaz, płyn w stanie nadkrytycznym będzie się rozszerzał i wypełniał pojemnik, ale jego gęstość jest znacznie większa niż typowe gęstości gazów, zazwyczaj zbliżona do gęstości cieczy. Podobnie jak ciecze, płyny te są zdolne do rozpuszczania nielotnych rozpuszczalników. Nie wykazują one jednak praktycznie żadnego napięcia powierzchniowego i mają bardzo niską lepkość, dzięki czemu mogą skuteczniej penetrować bardzo małe otwory w mieszaninie stałej i usuwać składniki rozpuszczalne. Te właściwości sprawiają, że ciecze w stanie nadkrytycznym są niezwykle użytecznymi rozpuszczalnikami w szerokim zakresie zastosowań. Na przykład, dwutlenek węgla w stanie nadkrytycznym stał się bardzo popularnym rozpuszczalnikiem w przemyśle spożywczym, stosowanym do dekofeinizacji kawy, usuwania tłuszczów z chipsów ziemniaczanych oraz ekstrakcji związków smakowych i zapachowych z olejków cytrusowych. Jest on nietoksyczny, stosunkowo niedrogi i nie jest uważany za zanieczyszczenie środowiska. Po użyciu, CO2 można łatwo odzyskać poprzez zmniejszenie ciśnienia i zbieranie powstałego gazu.
Przykład 3
Temperatura krytyczna dwutlenku węgla
Jeśli potrząśniemy gaśnicę z dwutlenkiem węgla w chłodny dzień (18 ° C), możemy usłyszeć ciekły CO2 sloshing wokół wewnątrz cylindra. Jednak ta sama butla wydaje się nie zawierać cieczy w gorący letni dzień (35 °C). Wyjaśnij te obserwacje.
Rozwiązanie
W chłodny dzień, temperatura CO2 jest poniżej temperatury krytycznej CO2, 304 K lub 31 °C (Tabela 6), więc ciekły CO2 jest obecny w cylindrze. W gorący dzień temperatura CO2 jest wyższa niż jego temperatura krytyczna wynosząca 31 °C. Powyżej tej temperatury nie można już użyć żadnej siły. Powyżej tej temperatury żadne ciśnienie nie może skroplić CO2, więc w gaśnicy nie ma ciekłego CO2.
Sprawdź swoją wiedzę
Amoniak może być skroplony przez ściskanie w temperaturze pokojowej; tlen nie może być skroplony w tych warunkach. Dlaczego te dwa gazy zachowują się inaczej?
Odpowiedź:
Temperatura krytyczna amoniaku wynosi 405,5 K, czyli jest wyższa od temperatury pokojowej. Temperatura krytyczna tlenu jest niższa od temperatury pokojowej; dlatego tlenu nie można skroplić w temperaturze pokojowej.
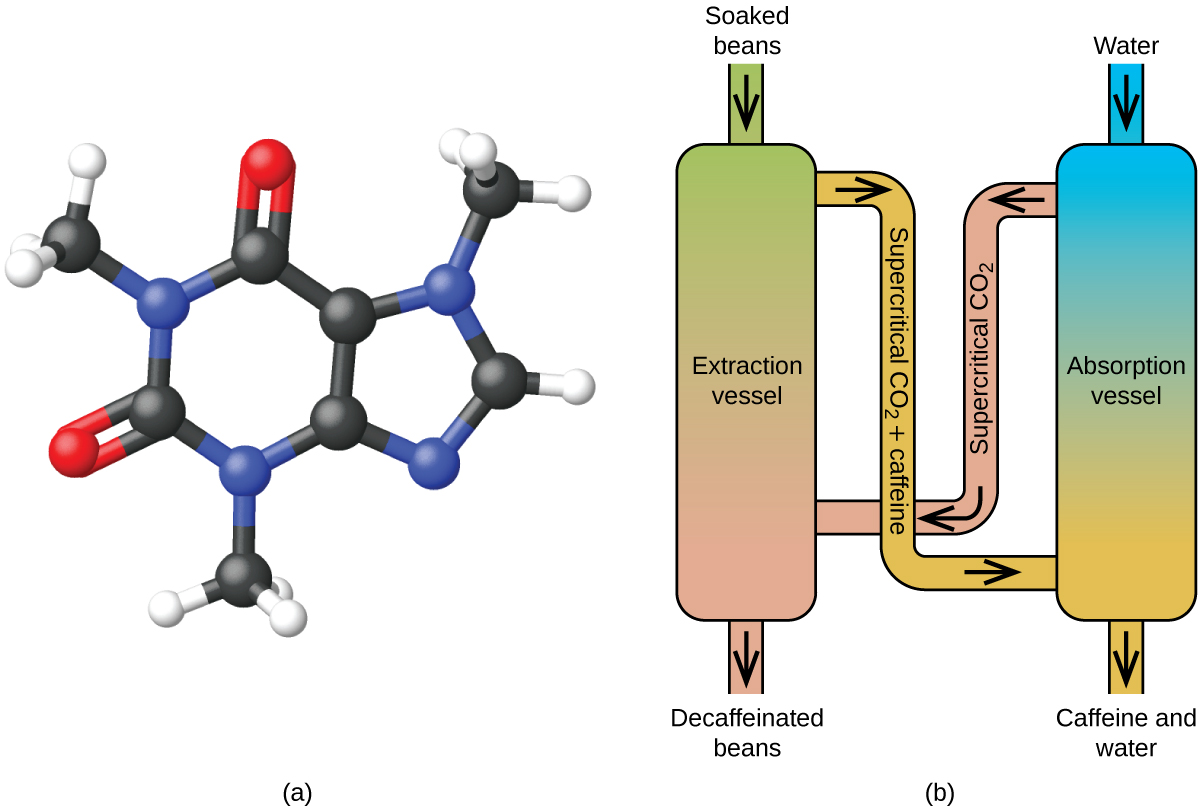
Decaffeinating Coffee Using Supercritical CO2
Kawa jest drugim najczęściej sprzedawanym towarem na świecie, po ropie naftowej. Na całym świecie ludzie kochają aromat i smak kawy. Wielu z nas jest również uzależnionych od jednego składnika kawy – kofeiny, która pomaga nam rano ruszyć z miejsca lub zachować czujność po południu. Ale późno w ciągu dnia, pobudzający efekt kawy może powstrzymać Cię od snu, więc możesz zdecydować się na picie bezkofeinowej kawy wieczorem.
Od wczesnych lat 1900, wiele metod zostało wykorzystanych do dekofeinizacji kawy. Wszystkie mają zalety i wady, a wszystkie zależą od fizycznych i chemicznych właściwości kofeiny. Ponieważ kofeina jest nieco polarną molekułą, dobrze rozpuszcza się w wodzie, polarnej cieczy. Jednakże, ponieważ wiele z ponad 400 innych związków, które wpływają na smak i aromat kawy, również rozpuszcza się w H2O, proces dekofeinizacji w gorącej wodzie może również usunąć niektóre z tych związków, co negatywnie wpływa na zapach i smak kawy bezkofeinowej. Dichlorometan (CH2Cl2) i octan etylu (CH3CO2C2H5) mają podobną polarność do kofeiny i dlatego są bardzo skutecznymi rozpuszczalnikami do ekstrakcji kofeiny, ale oba usuwają również niektóre składniki smakowe i zapachowe, a ich użycie wymaga długiego czasu ekstrakcji i czyszczenia. Ponieważ oba te rozpuszczalniki są toksyczne, pojawiły się obawy dotyczące wpływu pozostałości rozpuszczalnika w kawie bezkofeinowej.
Ekstrakcja w stanie nadkrytycznym przy użyciu dwutlenku węgla jest obecnie szeroko stosowana jako bardziej skuteczna i przyjazna dla środowiska metoda dekofeinizacji (Rysunek 7). W temperaturach powyżej 304,2 K i ciśnieniach powyżej 7376 kPa, CO2 jest płynem nadkrytycznym, o właściwościach zarówno gazu, jak i cieczy. Jako gaz przenika w głąb ziaren kawy, a jako ciecz skutecznie rozpuszcza niektóre substancje. Ekstrakcja nadkrytycznym dwutlenkiem węgla parzonych ziaren kawy usuwa 97-99% kofeiny, pozostawiając nienaruszone składniki smakowe i zapachowe kawy. Ponieważ w standardowych warunkach CO2 jest gazem, jego usunięcie z ekstrahowanych ziaren kawy jest łatwe do przeprowadzenia, podobnie jak odzyskanie kofeiny z ekstraktu. Kofeina odzyskana z ziaren kawy w tym procesie jest cennym produktem, który może być następnie wykorzystany jako dodatek do innych produktów spożywczych lub leków.
Kluczowe pojęcia i podsumowanie
Warunki temperatury i ciśnienia, w których substancja istnieje w stanie stałym, ciekłym i gazowym, są podsumowane w diagramie fazowym dla tej substancji. Diagramy fazowe są połączonymi wykresami trzech krzywych równowagi ciśnienie-temperatura: ciało stałe-ciecz, ciecz-gaz i ciało stałe-gaz. Krzywe te przedstawiają zależności między temperaturami przejścia fazowego a ciśnieniem. Punkt przecięcia wszystkich trzech krzywych reprezentuje punkt potrójny substancji – temperaturę i ciśnienie, w których wszystkie trzy fazy są w równowadze. Przy ciśnieniu poniżej punktu potrójnego, substancja nie może istnieć w stanie ciekłym, niezależnie od jej temperatury. Koniec krzywej ciecz-gaz przedstawia punkt krytyczny substancji, ciśnienie i temperaturę, powyżej których faza ciekła nie może istnieć.
Chemia End of Chapter Exercises
- Na podstawie diagramu fazowego dla wody (rys. 2) określ stan skupienia wody w:
(a) 35 °C i 85 kPa
(b) -15 °C i 40 kPa
(c) -15 °C i 0.1 kPa
(d) 75 °C i 3 kPa
(e) 40 °C i 0,1 kPa
(f) 60 °C i 50 kPa
- Jakie przemiany fazowe zajdą, gdy woda będzie poddawana zmiennemu ciśnieniu w stałej temperaturze 0,005 °C? W temperaturze 40 °C? W temperaturze -40 °C?
- Szybkowary pozwalają na szybsze gotowanie żywności, ponieważ wyższe ciśnienie w szybkowarze zwiększa temperaturę wrzenia wody. Pewien szybkowar posiada zawór bezpieczeństwa, który jest tak ustawiony, że w razie przekroczenia ciśnienia 3,4 atm wypuszcza parę. Jaka jest przybliżona maksymalna temperatura, która może zostać osiągnięta w tym szybkowarze? Wyjaśnij swoje rozumowanie.
- Z diagramu fazowego dla dwutlenku węgla na rysunku 5, określ stan skupienia CO2 przy:
(a) 20 °C i 1000 kPa
(b) 10 °C i 2000 kPa
(c) 10 °C i 100 kPa
(d) -40 °C i 500 kPa
(e) -80 °C i 1500 kPa
.
(f) -80 °C i 10 kPa
- Określ zmiany fazowe, jakim ulega dwutlenek węgla wraz ze zmianą ciśnienia, jeśli temperatura jest utrzymywana na poziomie -50 °C? Jeśli temperatura jest utrzymywana na poziomie -40 °C? W temperaturze 20 °C? (Patrz diagram fazowy na rysunku 5.)
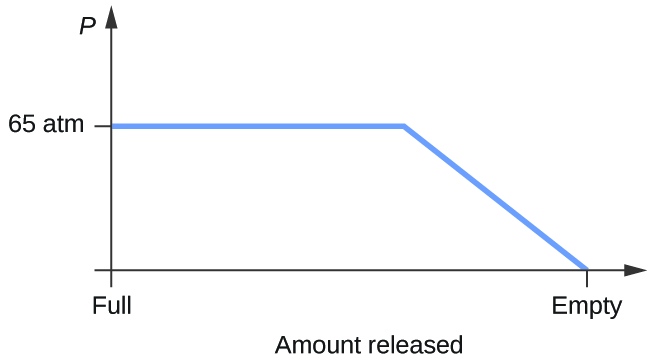
- Rozważmy cylinder zawierający mieszaninę ciekłego dwutlenku węgla w stanie równowagi z gazowym dwutlenkiem węgla przy ciśnieniu początkowym 65 atm i temperaturze 20 °C. Naszkicuj wykres przedstawiający zmianę ciśnienia w cylindrze w czasie w miarę uwalniania się gazowego dwutlenku węgla w stałej temperaturze.
- Suchy lód, CO2(s), nie topi się pod ciśnieniem atmosferycznym. Sublimuje on w temperaturze -78 °C. Jakie jest najniższe ciśnienie, przy którym CO2(s) stopi się dając CO2(l)? W jakiej temperaturze w przybliżeniu to nastąpi? (Diagram fazowy znajduje się na rysunku 5.)
- Jeśli silna burza spowoduje utratę elektryczności, może być konieczne użycie sznura na ubrania do suszenia prania. W wielu częściach kraju w martwym punkcie zimy, ubrania szybko zamarzną, gdy zostaną powieszone na linii. Jeśli nie będzie padał śnieg, to czy i tak wyschną? Wyjaśnij swoją odpowiedź.
- Czy możliwe jest skroplenie azotu w temperaturze pokojowej (około 25 °C)? Czy możliwe jest skroplenie dwutlenku siarki w temperaturze pokojowej? Wyjaśnij swoje odpowiedzi.
- Węgiel pierwiastkowy ma jedną fazę gazową, jedną fazę ciekłą i dwie różne fazy stałe, jak pokazano na diagramie fazowym:
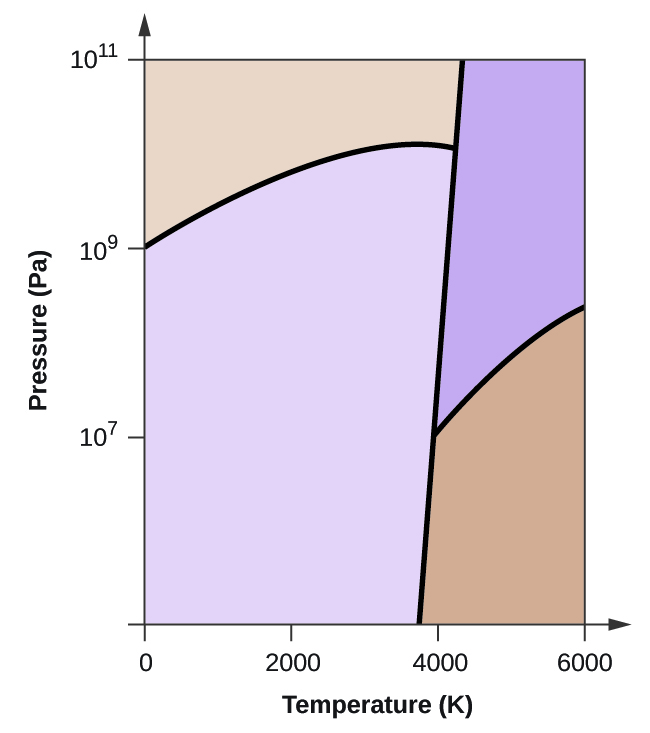
(a) Na diagramie fazowym, oznacz regiony gazu i cieczy.
(b) Grafit jest najbardziej stabilną fazą węgla w normalnych warunkach. Na diagramie fazowym oznacz fazę grafitową.
(c) Jeżeli grafit w warunkach normalnych ogrzeje się do temperatury 2500 K przy jednoczesnym zwiększeniu ciśnienia do 1010 Pa, to przekształci się on w diament. Oznacz fazę diamentu.
(d) Otocz kółkiem każdy punkt potrójny na diagramie fazowym.
(e) W jakiej fazie występuje węgiel w temperaturze 5000 K i ciśnieniu 108 Pa?
(f) Jeżeli temperatura próbki węgla wzrasta z 3000 K do 5000 K przy stałym ciśnieniu 106 Pa, to jakie przejście fazowe zachodzi, jeżeli w ogóle?
Glossary
punkt krytyczny temperatura i ciśnienie, powyżej których gaz nie może zostać skondensowany do postaci cieczy wykres fazowy wykres ciśnienie-temperatura podsumowujący warunki, w których mogą istnieć fazy substancji ciecz w stanie nadkrytycznym substancja w temperaturze i ciśnieniu wyższym niż jej punkt krytyczny; wykazuje właściwości pośrednie między stanami gazowym i ciekłym punkt potrójny temperatura i ciśnienie, w którym fazy pary, cieczy i ciała stałego substancji są w równowadze
Rozwiązania
Answers to Chemistry End of Chapter Exercises
2. Przy niskim ciśnieniu i temperaturze 0,005 °C woda jest gazem. Gdy ciśnienie wzrasta do 4,6 torr, woda staje się ciałem stałym; gdy ciśnienie wzrasta jeszcze bardziej, staje się cieczą. W temperaturze 40 °C woda pod niskim ciśnieniem jest parą; przy ciśnieniu wyższym niż około 75 torr zamienia się w ciecz. W temperaturze -40 °C woda przechodzi z gazu w ciało stałe, gdy ciśnienie wzrasta powyżej bardzo niskich wartości.
4. a) ciecz; b) ciało stałe; c) gaz; d) gaz; e) gaz; f) gaz
8. Tak, lód się wysublimuje, choć może to zająć kilka dni. Lód ma małe ciśnienie pary wodnej, a niektóre cząsteczki lodu tworzą gaz i ulatniają się z kryształów lodu. W miarę upływu czasu, coraz więcej ciała stałego zamienia się w gaz, aż w końcu ubrania są suche.
10. (a)
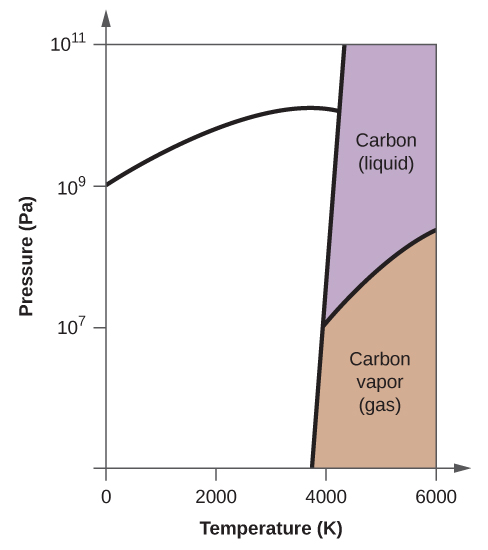
(b)
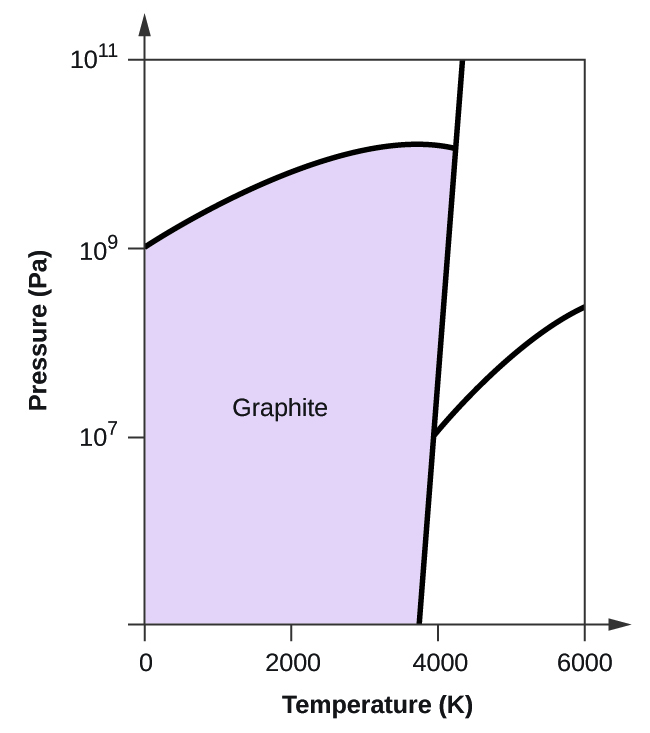
(c)
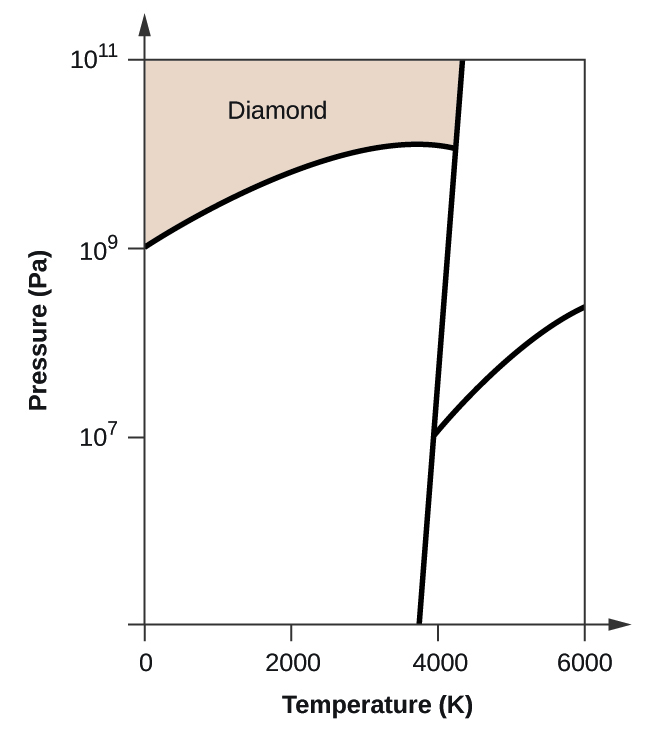
(d)
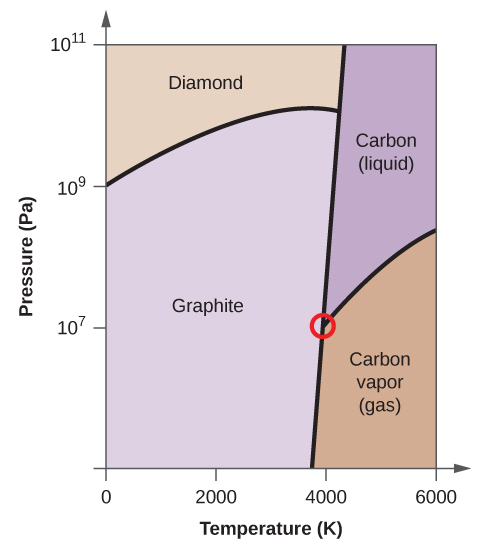
(e) faza ciekła (f) sublimacja
.
