Objectivos de Aprendizagem
- Explicar a construção e uso de um diagrama de fases típico
- Utilizar diagramas de fases para identificar fases estáveis a determinadas temperaturas e pressões, e para descrever as transições de fase resultantes de mudanças nestas propriedades
- Descrever a fase do fluido supercrítico da matéria
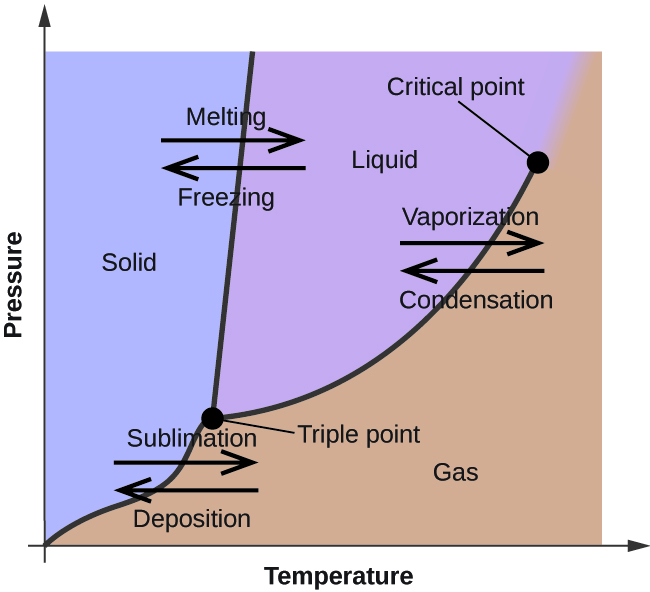
No módulo anterior, foi descrita a variação da pressão do vapor de equilíbrio de um líquido com a temperatura. Considerando a definição de ponto de ebulição, gráficos de pressão de vapor versus temperatura representam como o ponto de ebulição do líquido varia com a pressão. Também foi descrito o uso de curvas de aquecimento e resfriamento para determinar o ponto de fusão (ou congelamento) de uma substância. Fazer tais medições em uma ampla gama de pressões produz dados que podem ser apresentados graficamente como um diagrama de fases. Um diagrama de fases combina gráficos de pressão versus temperatura para os equilíbrios de transição de fase líquido-gás, sólido-líquido e sólido-gás de uma substância. Estes diagramas indicam os estados físicos que existem sob condições específicas de pressão e temperatura, e também fornecem a dependência de pressão das temperaturas de transição de fase (pontos de fusão, pontos de sublimação, pontos de ebulição). Um diagrama de fase típico para uma substância pura é mostrado na Figura 1.
Para ilustrar a utilidade destes gráficos, considere o diagrama de fases para água mostrado na Figura 2.
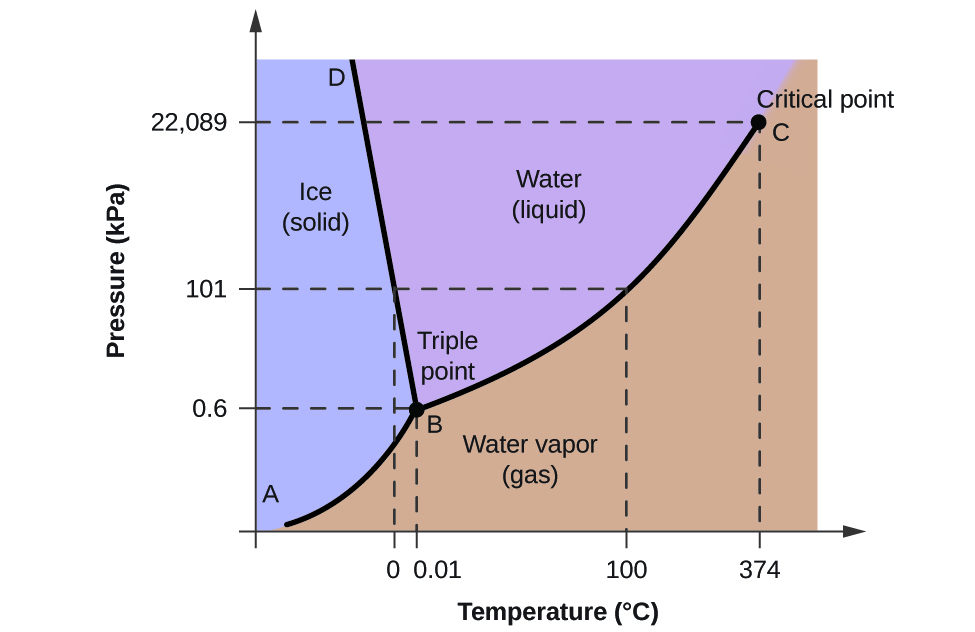
Podemos usar o diagrama de fases para identificar o estado físico de uma amostra de água sob condições especificadas de pressão e temperatura. Por exemplo, uma pressão de 50 kPa e uma temperatura de -10 °C correspondem à região do diagrama rotulada como “gelo”. Nestas condições, a água existe apenas como um sólido (gelo). Uma pressão de 50 kPa e uma temperatura de 50 °C correspondem à região “água” – aqui, a água existe apenas como um líquido. A 25 kPa e 200 °C, a água existe apenas no estado gasoso. Note que no diagrama de fase H2O, os eixos de pressão e temperatura não são atraídos para uma escala constante, a fim de permitir a ilustração de várias características importantes, como descrito aqui.
A curva BC na Figura 2 é o gráfico de pressão de vapor versus temperatura, como descrito no módulo anterior deste capítulo. Esta curva “líquido-vapor” separa as regiões líquida e gasosa do diagrama de fases e fornece o ponto de ebulição da água a qualquer pressão. Por exemplo, a 1 atm, o ponto de ebulição é 100 °C. Observe que a curva líquido-vapor termina a uma temperatura de 374 °C e uma pressão de 218 atm, indicando que a água não pode existir como um líquido acima desta temperatura, independentemente da pressão. As propriedades físicas da água sob estas condições são intermediárias entre as fases líquida e gasosa. Este estado único da matéria é chamado de fluido supercrítico, tópico que será descrito na próxima seção deste módulo.
A curva sólido-vapor, rotulada AB na Figura 2, indica as temperaturas e pressões em que o gelo e o vapor de água estão em equilíbrio. Estes pares de dados de temperatura-pressão correspondem aos pontos de sublimação, ou deposição, da água. Se pudéssemos ampliar a linha de gás sólido na Figura 2, veríamos que o gelo tem uma pressão de vapor de cerca de 0,20 kPa a -10 °C. Assim, se colocarmos uma amostra congelada em vácuo com uma pressão inferior a 0,20 kPa, o gelo sublimará. Esta é a base para o processo de “liofilização” frequentemente usado para preservar alimentos, como o gelado mostrado na Figura 3.

A curva sólido-líquido rotulada BD mostra as temperaturas e pressões em que o gelo e a água líquida estão em equilíbrio, representando os pontos de fusão/congelação para a água. Note que esta curva apresenta uma ligeira inclinação negativa (muito exagerada para maior clareza), indicando que o ponto de fusão para a água diminui ligeiramente à medida que a pressão aumenta. A água é uma substância incomum neste aspecto, já que a maioria das substâncias apresenta um aumento do ponto de fusão com o aumento da pressão. Este comportamento é parcialmente responsável pelo movimento dos glaciares, como o mostrado na Figura 4. O fundo de uma geleira sofre uma pressão imensa devido ao seu peso que pode derreter parte do gelo, formando uma camada de água líquida sobre a qual a geleira pode deslizar mais facilmente.

O ponto de intersecção das três curvas é rotulado como B na Figura 2. Na pressão e temperatura representadas por este ponto, todas as três fases da água coexistem em equilíbrio. Este par de dados de temperatura-pressão é chamado de ponto triplo. Em pressões inferiores ao ponto triplo, a água não pode existir como um líquido, independentemente da temperatura.
Exemplo 1
Determinando o Estado da Água
Utilizando o diagrama de fases para água dado na Figura 2, determinar o estado da água nas seguintes temperaturas e pressões:
(a) -10 °C e 50 kPa
(b) 25 °C e 90 kPa
(c) 50 °C e 40 kPa
(d) 80 °C e 5 kPa
(e) -10 °C e 0.3 kPa
(f) 50 °C e 0,3 kPa
Solução
Utilizando o diagrama de fases da água, podemos determinar que o estado da água a cada temperatura e pressão dadas são as seguintes: (a) sólido; (b) líquido; (c) líquido; (d) gás; (e) sólido; (f) gás.
Cheque seu aprendizado
Que mudanças de fase a água pode sofrer com as mudanças de temperatura se a pressão for mantida a 0,3 kPa? Se a pressão for mantida a 50 kPa?
Resposta:
A 0,3 kPa: \texto:{s;{\i}longrightarrow{\i};texto:{g}a -58 °C. A 50 kPa: \a 0 °C, texto a 0 °C, texto a 0 °C, texto a 0 °C, texto a 78 °C
Considerem o diagrama de fase para dióxido de carbono mostrado na Figura 5 como outro exemplo. A curva sólido-líquido apresenta uma inclinação positiva, indicando que o ponto de fusão para o CO2 aumenta com a pressão como para a maioria das substâncias (sendo a água uma exceção notável, como descrito anteriormente). Observe que o ponto triplo está bem acima de 1 atm, indicando que o dióxido de carbono não pode existir como um líquido sob condições de pressão ambiente. Em vez disso, o arrefecimento do dióxido de carbono gasoso a 1 atm resulta na sua deposição no estado sólido. Da mesma forma, o dióxido de carbono sólido não derrete a 1 atm de pressão, mas, em vez disso, sublima para produzir CO2 gasoso. Finalmente, observe que o ponto crítico para o dióxido de carbono é observado a uma temperatura e pressão relativamente modesta em comparação com a água.
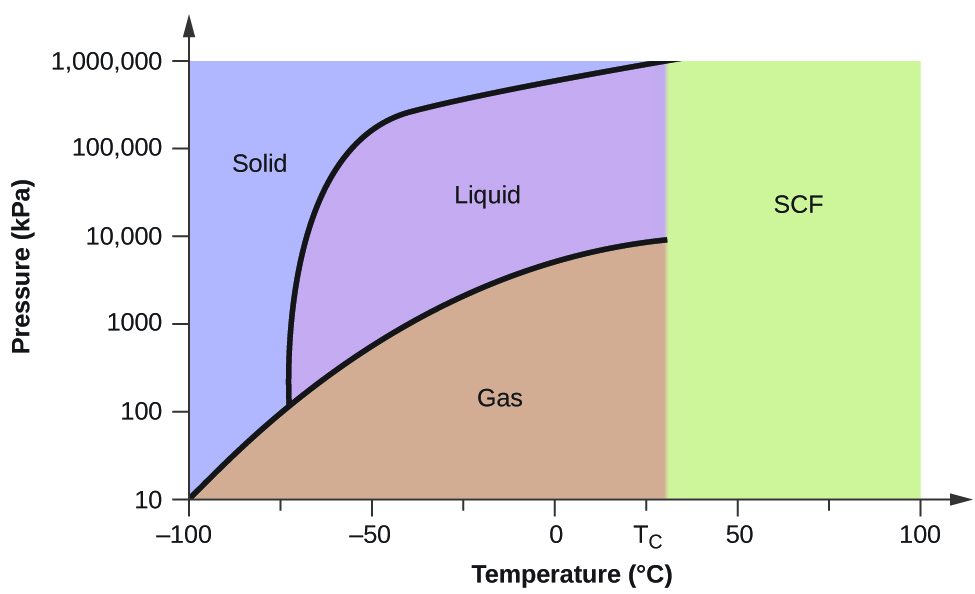
Exemplo 2
Determinar o Estado do Dióxido de Carbono
Usando o diagrama de fases para o dióxido de carbono mostrado na Figura 5, determinar o estado do CO2 nas seguintes temperaturas e pressões:
(a) -30 °C e 2000 kPa
(b) -60 °C e 1000 kPa
(c) -60 °C e 100 kPa
(d) 20 °C e 1500 kPa
(e) 0 °C e 100 kPa
(f) 20 °C e 100 kPa
Solução
Usando o diagrama de fases para o dióxido de carbono fornecido, podemos determinar que o estado do CO2 a cada temperatura e pressão dadas são as seguintes: (a) líquido; (b) sólido; (c) gás; (d) líquido; (e) gás; (f) gás.
Check Your Learning
Determinar as mudanças de fase que o dióxido de carbono sofre quando a sua temperatura é variada, mantendo assim a sua pressão constante a 1500 kPa? A 500 kPa? A que temperaturas aproximadas ocorrem estas mudanças de fase?
Resposta:
a 1500 kPa: \texto:-45 °C, texto:-10 °C;
a 500 kPa: \Se colocarmos uma amostra de água num recipiente selado a 25 °C, removermos o ar e deixarmos o equilíbrio vaporização-condensação estabelecer-se, ficamos com uma mistura de água líquida e vapor de água a uma pressão de 0,03 atm. Uma fronteira distinta entre o líquido mais denso e o gás menos denso é claramente observada. Conforme aumentamos a temperatura, a pressão do vapor de água aumenta, como descrito pela curva líquido-gás no diagrama de fases para água (Figura 2), e um equilíbrio bifásico das fases líquida e gasosa permanece. A uma temperatura de 374 °C, a pressão do vapor subiu para 218 atm, e qualquer aumento adicional na temperatura resulta no desaparecimento da fronteira entre as fases líquida e vapor. Toda a água no recipiente está agora presente numa única fase cujas propriedades físicas são intermediárias entre as dos estados gasoso e líquido. Esta fase da matéria é chamada de fluido supercrítico, e a temperatura e pressão acima da qual esta fase existe é o ponto crítico (Figura 6). Acima de sua temperatura crítica, um gás não pode ser liquefeito, não importa a quantidade de pressão aplicada. A pressão necessária para liquefazer um gás em sua temperatura crítica é chamada de pressão crítica. As temperaturas críticas e pressões críticas de algumas substâncias comuns são dadas na Tabela 6.
| Substância | Temperatura Crítica (K) | Pressão Crítica (atm) |
|---|---|---|
| hidrogênio | 33.2 | 12.8 |
| nitrogênio | 126.0 | 33.5 |
| oxigênio | 154.3 | 49,7 |
| dióxido de carbono | 304,2 | 73,0 |
| amónia | 405,5 | 111,5 |
| dióxido de enxofre | 430.3 | 77.7 |
| água | 647.1 | 217.7 |
| Quadro 6. | ||
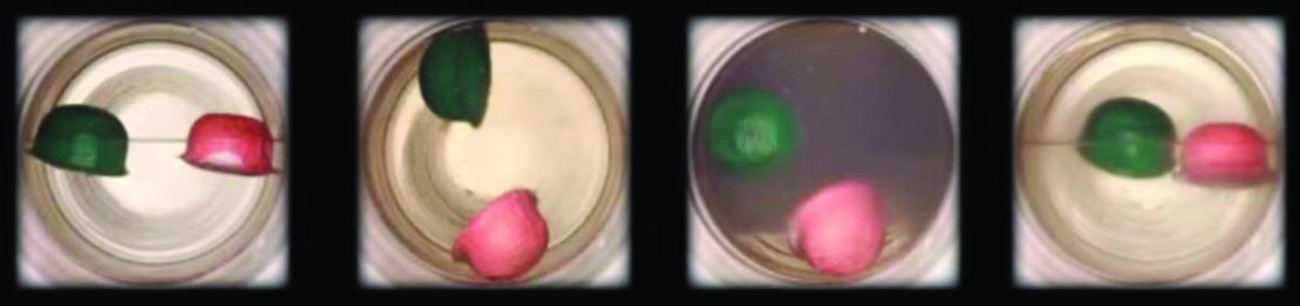

Observa a transição do líquido para o fluido supercrítico para o dióxido de carbono.
Como um gás, um fluido supercrítico se expandirá e encherá um recipiente, mas sua densidade é muito maior do que as densidades típicas dos gases, sendo tipicamente próxima às dos líquidos. Similar aos líquidos, estes fluidos são capazes de dissolver solutos não voláteis. No entanto, não exibem essencialmente tensão superficial e viscosidades muito baixas, pelo que podem penetrar mais eficazmente em aberturas muito pequenas numa mistura sólida e remover componentes solúveis. Estas propriedades tornam os solventes supercríticos extremamente úteis para uma ampla gama de aplicações. Por exemplo, o dióxido de carbono supercrítico tornou-se um solvente muito popular na indústria alimentícia, sendo usado para descafeinar o café, remover gorduras de batatas fritas e extrair compostos de sabor e fragrância de óleos cítricos. É atóxico, relativamente barato e não é considerado um poluente. Após o uso, o CO2 pode ser facilmente recuperado reduzindo a pressão e coletando o gás resultante.
Exemplo 3
A Temperatura Crítica do Dióxido de Carbono
Se agitarmos um extintor de dióxido de carbono em um dia frio (18 °C), podemos ouvir um sloshing de CO2 líquido dentro do cilindro. No entanto, o mesmo cilindro parece não conter líquido num dia quente de verão (35 °C). Explique estas observações.
Solução
No dia frio, a temperatura do CO2 está abaixo da temperatura crítica do CO2, 304 K ou 31 °C (Tabela 6), de modo que o CO2 líquido está presente no cilindro. No dia quente, a temperatura do CO2 é maior do que a sua temperatura crítica de 31 °C. Acima dessa temperatura, nenhuma quantidade de pressão pode liquefazer o CO2, portanto não existe CO2 líquido no extintor.
Check Your Learning
Ammonia can be liquefied by compression at room temperature; oxygen cannot be liquefied under these conditions. Porque é que os dois gases apresentam comportamentos diferentes?
Resposta:
A temperatura crítica do amoníaco é de 405,5 K, que é superior à temperatura ambiente. A temperatura crítica do oxigênio está abaixo da temperatura ambiente; assim, o oxigênio não pode ser liquefeito à temperatura ambiente.
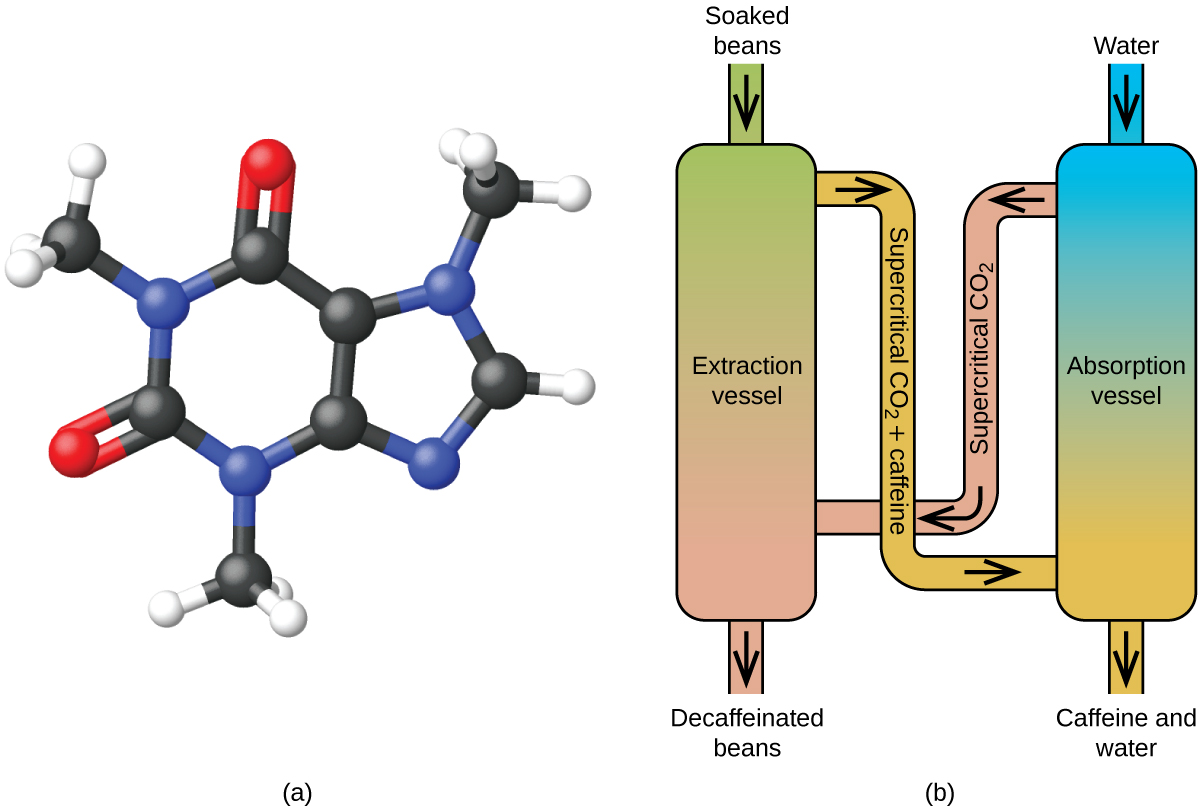
Decafeificando o café usando CO2 supercrítico
O café é o segundo produto mais comercializado no mundo, seguindo apenas o petróleo. Em todo o mundo, as pessoas adoram o aroma e o sabor do café. Muitos de nós também dependem de um componente do café-caféine para nos ajudar a ir de manhã ou ficar alerta à tarde. Mas no final do dia, o efeito estimulante do café pode impedir que você durma, por isso você pode optar por beber café descafeinado à noite.
Desde o início do século XIX, muitos métodos têm sido usados para descafeinar o café. Todos têm vantagens e desvantagens, e todos dependem das propriedades físicas e químicas da cafeína. Como a cafeína é uma molécula algo polar, dissolve-se bem na água, um líquido polar. No entanto, como muitos dos outros mais de 400 compostos que contribuem para o sabor e aroma do café também se dissolvem em H2O, os processos de descafeinação da água quente também podem remover alguns desses compostos, afetando negativamente o cheiro e sabor do café descafeinado. O diclorometano (CH2Cl2) e o acetato de etilo (CH3CO2C2H5) têm polaridade semelhante à cafeína e, portanto, são solventes muito eficazes para a extração da cafeína, mas ambos também removem alguns componentes de sabor e aroma, e seu uso requer longos tempos de extração e limpeza. Como ambos os solventes são tóxicos, foram levantadas preocupações de saúde em relação ao efeito do solvente residual remanescente no café descafeinado.
A extracção de fluidos supercríticos utilizando dióxido de carbono está agora a ser amplamente utilizado como um método de descafeinação mais eficaz e amigo do ambiente (Figura 7). Em temperaturas acima de 304,2 K e pressões acima de 7376 kPa, o CO2 é um fluido supercrítico, com propriedades tanto de gás como de líquido. Como um gás, ele penetra profundamente nos grãos de café; como um líquido, ele dissolve efetivamente certas substâncias. A extração supercrítica de dióxido de carbono dos grãos de café vaporizados remove 97-99% da cafeína, deixando intactos o sabor e os compostos de aroma do café. Como o CO2 é um gás em condições padrão, sua remoção dos grãos de café extraídos é facilmente realizada, assim como a recuperação da cafeína do extrato. A cafeína recuperada dos grãos de café através deste processo é um produto valioso que pode ser utilizado posteriormente como aditivo para outros alimentos ou medicamentos.
Conceitos Chave e Resumo
As condições de temperatura e pressão nas quais uma substância existe em estados sólido, líquido e gasoso estão resumidas em um diagrama de fases para essa substância. Os diagramas de fase são gráficos combinados de três curvas de equilíbrio pressão-temperatura: sólido-líquido, sólido-gás líquido, e sólido-gás. Estas curvas representam as relações entre as temperaturas de transição de fase e as pressões. O ponto de intersecção das três curvas representa o ponto triplo da substância – a temperatura e pressão em que as três fases se encontram em equilíbrio. Em pressões abaixo do ponto triplo, uma substância não pode existir no estado líquido, independentemente da sua temperatura. O terminal da curva líquido-gás representa o ponto crítico da substância, a pressão e a temperatura acima da qual uma fase líquida não pode existir.
Chemistry End of Chapter Exercises
- Do diagrama de fases para água (Figura 2), determinar o estado da água a:
(a) 35 °C e 85 kPa
(b) -15 °C e 40 kPa
(c) -15 °C e 0.1 kPa
(d) 75 °C e 3 kPa
(e) 40 °C e 0,1 kPa
(f) 60 °C e 50 kPa
- Que mudanças de fase ocorrerão quando a água for sujeita a pressão variável a uma temperatura constante de 0,005 °C? A 40 °C? A -40 °C?
- As panelas de pressão permitem que os alimentos cozinhem mais rapidamente porque a maior pressão dentro da panela de pressão aumenta a temperatura de ebulição da água. Uma panela de pressão em particular tem uma válvula de segurança que é ajustada para ventilar o vapor se a pressão exceder 3,4 atm. Qual é a temperatura máxima aproximada que pode ser atingida dentro desta panela de pressão? Explique o seu raciocínio.
- Do diagrama de fases para o dióxido de carbono na Figura 5, determine o estado do CO2 em:
(a) 20 °C e 1000 kPa
(b) 10 °C e 2000 kPa
(c) 10 °C e 100 kPa
(d) -40 °C e 500 kPa
(e) -80 °C e 1500 kPa
(f) -80 °C e 10 kPa
- Determinar as mudanças de fase que o dióxido de carbono sofre à medida que a pressão muda se a temperatura é mantida a -50 °C? Se a temperatura for mantida a -40 °C? A -20 °C? (Veja o diagrama de fases na Figura 5.)
- Condicione um cilindro contendo uma mistura de dióxido de carbono líquido em equilíbrio com dióxido de carbono gasoso a uma pressão inicial de 65 atm e a uma temperatura de 20 °C. Desenhe um gráfico representando a variação da pressão do cilindro com o tempo, pois o dióxido de carbono gasoso é liberado a uma temperatura constante.
- Gelo seco, CO2(s), não derrete à pressão atmosférica. Ele sublima a uma temperatura de -78 °C. Qual é a pressão mais baixa à qual o(s) CO2(s) derrete(m) para dar CO2(l)? A que temperatura aproximadamente isto irá ocorrer? (Ver Figura 5 para o diagrama de fases.)
- Se uma forte tempestade resultar na perda de electricidade, poderá ser necessário utilizar um estendal para secar a roupa. Em muitas partes do país no fim do Inverno, a roupa congelará rapidamente quando for pendurada no estendal. Se não nevar, elas secarão de qualquer maneira? Explique a sua resposta.
- É possível liquefazer nitrogénio à temperatura ambiente (cerca de 25 °C)? É possível liquefazer o dióxido de enxofre à temperatura ambiente? Explique suas respostas.
- O carbono elementar tem uma fase gasosa, uma fase líquida, e duas fases sólidas diferentes, como mostrado no diagrama de fases:
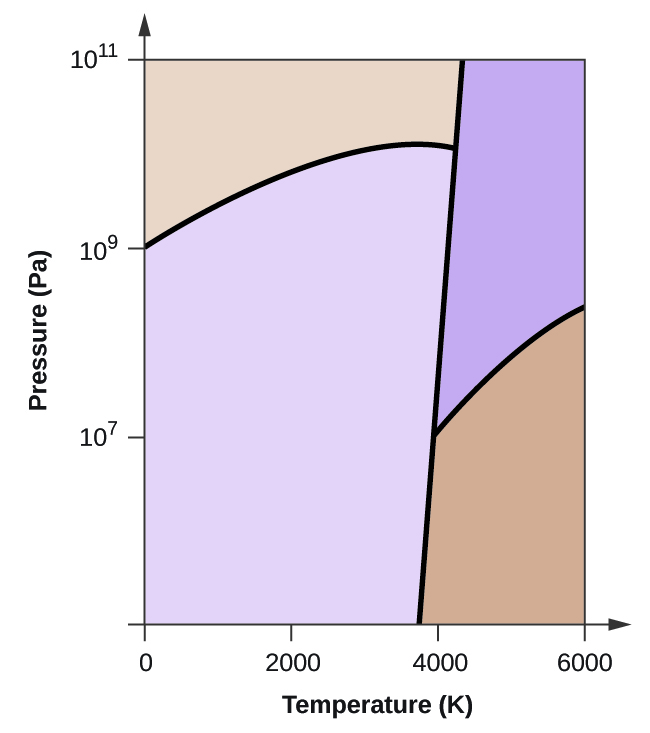
(a) No diagrama de fases, rotular as regiões gasosa e líquida.
(b) A grafite é a fase mais estável do carbono em condições normais. No diagrama de fases, etiquetar a fase de grafite.
(c) Se a grafite em condições normais for aquecida a 2500 K enquanto a pressão é aumentada para 1010 Pa, ela é convertida em diamante. Etiquete a fase diamantada.
(d) Faça um círculo em torno de cada ponto triplo no diagrama de fases.
(e) Em que fase existe carbono a 5000 K e 108 Pa?
(f) Se a temperatura de uma amostra de carbono aumenta de 3000 K para 5000 K a uma pressão constante de 106 Pa, qual transição de fase ocorre, se houver?
Glossary
ponto crítico temperatura e pressão acima do qual um gás não pode ser condensado em um diagrama de pressão-temperatura de fase líquida, resumindo as condições sob as quais as fases de uma substância podem existir fluido supercrítico substância a uma temperatura e pressão superiores ao seu ponto crítico; apresenta propriedades intermediárias entre as dos estados gasoso e líquido temperatura e pressão de ponto triplo em que o vapor, líquido e fases sólidas de uma substância estão em equilíbrio
Soluções
Respostas aos Exercícios de Fim de Capítulo de Química
2. A baixas pressões e 0,005 °C, a água é um gás. À medida que a pressão aumenta para 4,6 torr, a água torna-se um sólido; à medida que a pressão aumenta ainda mais, torna-se um líquido. A 40 °C, a água a baixa pressão é um vapor; a pressões superiores a cerca de 75 torr, ela se converte em um líquido. A -40 °C, a água passa de um gás para um sólido à medida que a pressão aumenta acima de valores muito baixos.
4. (a) líquido; (b) sólido; (c) gás; (d) gás; (e) gás; (f) gás
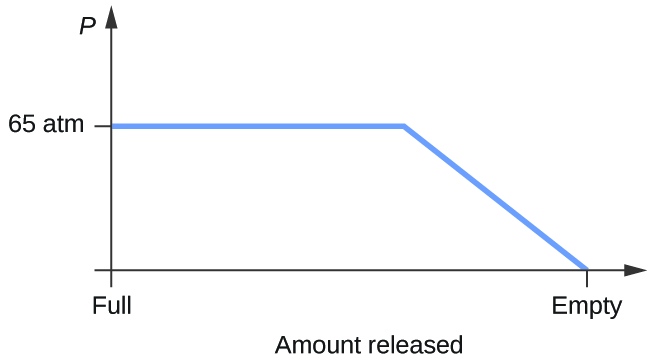
8. Sim, o gelo irá sublime, embora possa demorar vários dias. O gelo tem uma pequena pressão de vapor, e algumas moléculas de gelo formam gás e escapam dos cristais de gelo. Com o passar do tempo, mais e mais sólidos se convertem em gás até que eventualmente a roupa fique seca.
10. (a)
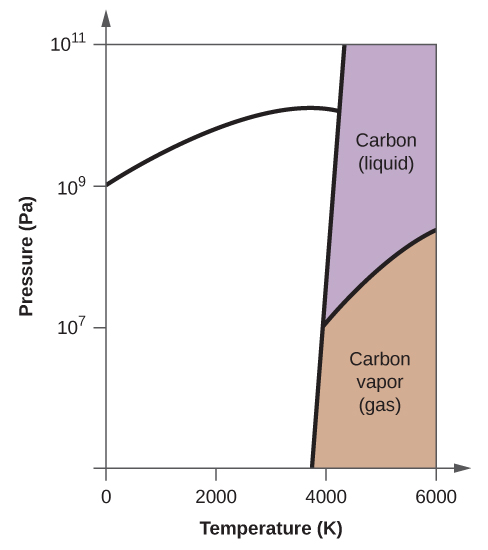
(b)
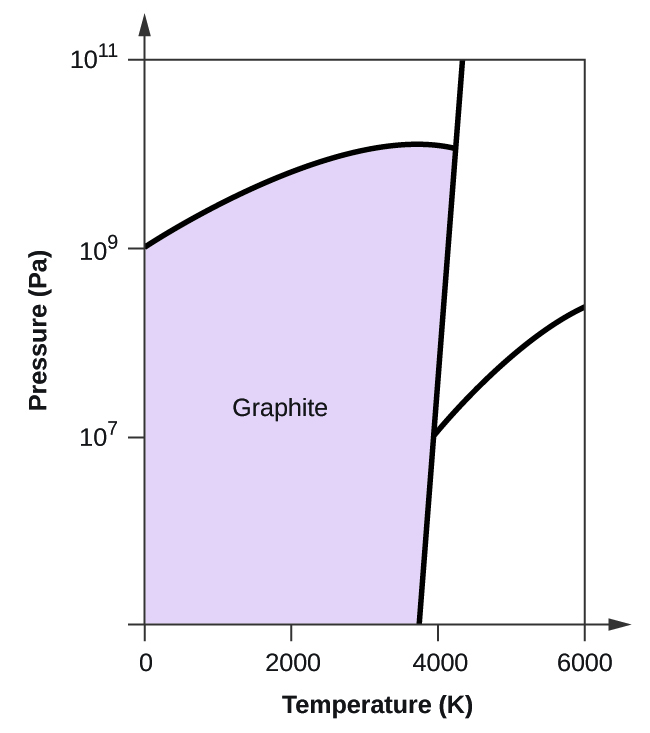
(c)
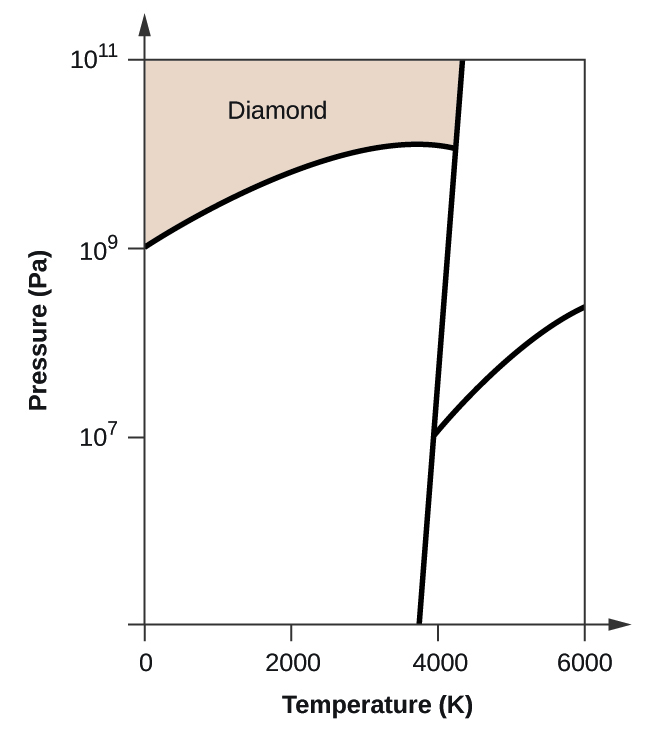
(d)
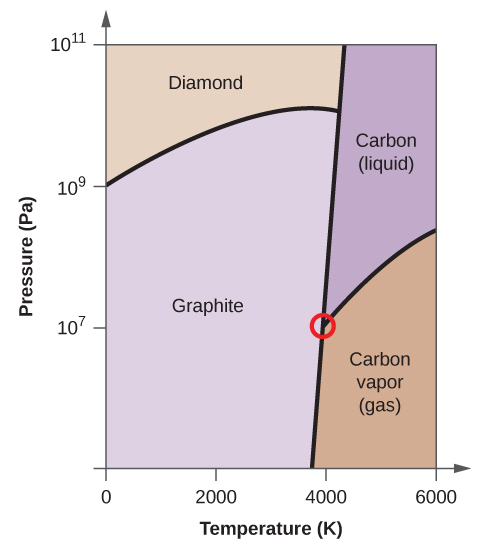
(e) fase líquida (f) sublimação
