Cíle učení
- Vysvětlit konstrukci a použití typického fázového diagramu
- Použít fázové diagramy k určení stabilních fází při daných teplotách a tlacích, a popsat fázové přechody vyplývající ze změn těchto vlastností
- Popsat superkritickou fázi látky
V předchozím modulu byla popsána změna rovnovážného tlaku par kapaliny s teplotou. S ohledem na definici bodu varu znázorňují grafy závislosti tlaku par na teplotě, jak se mění bod varu kapaliny s tlakem. Bylo také popsáno použití křivek ohřevu a ochlazování k určení bodu tání (nebo tuhnutí) látky. Prováděním takových měření v širokém rozsahu tlaků se získávají údaje, které lze graficky znázornit jako fázový diagram. Fázový diagram kombinuje grafy závislosti tlaku na teplotě pro fázové rovnováhy kapalina-plyn, pevná látka-kapalina a pevná látka-plyn. Tyto diagramy ukazují fyzikální stavy, které existují za určitých podmínek tlaku a teploty, a také poskytují závislost teplot fázového přechodu na tlaku (body tání, sublimace, varu). Typický fázový diagram pro čistou látku je znázorněn na obrázku 1.
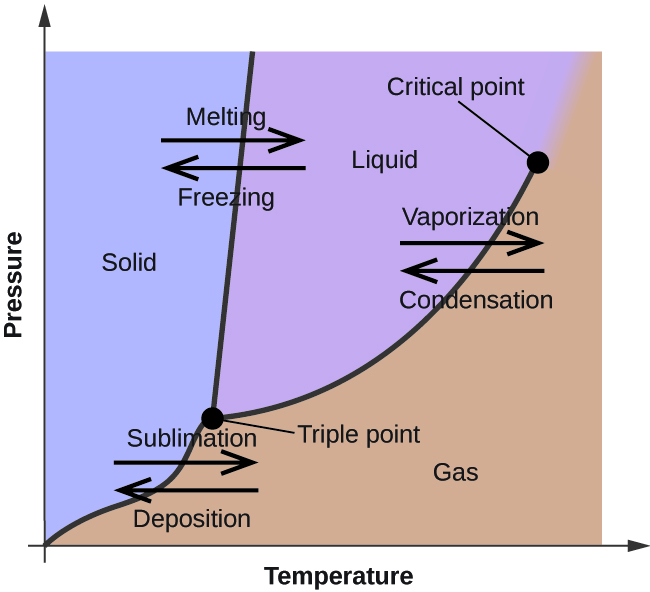
Pro ilustraci užitečnosti těchto grafů uvažujme fázový diagram pro vodu znázorněný na obrázku 2.
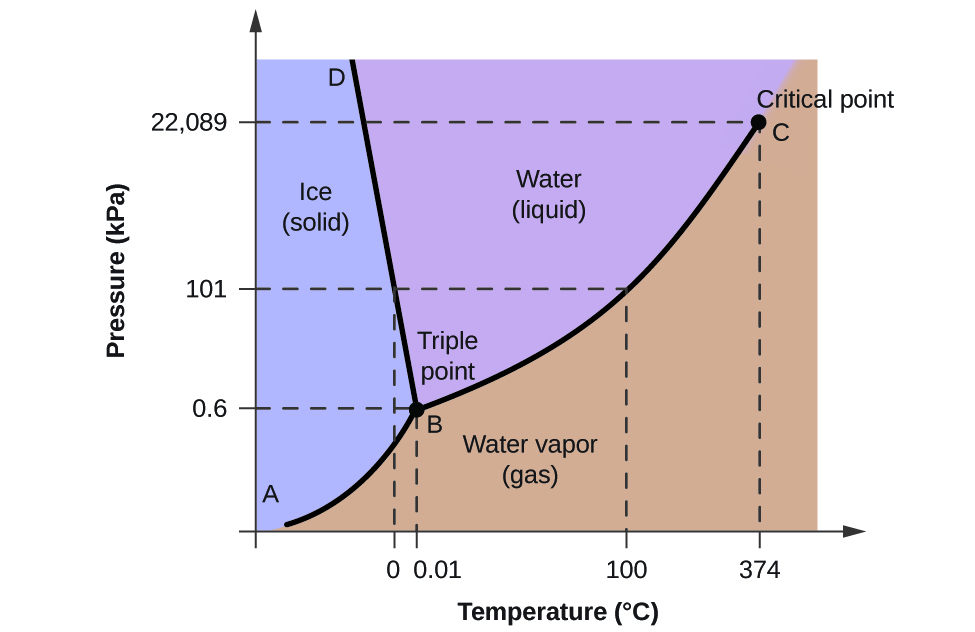
Fázový diagram můžeme použít k určení fyzikálního stavu vzorku vody za stanovených podmínek tlaku a teploty. Například tlak 50 kPa a teplota -10 °C odpovídají oblasti diagramu označené „led“. Za těchto podmínek existuje voda pouze v pevném skupenství (led). Tlak 50 kPa a teplota 50 °C odpovídají oblasti „voda“ – zde voda existuje pouze jako kapalina. Při tlaku 25 kPa a teplotě 200 °C existuje voda pouze v plynném skupenství. Všimněte si, že na fázovém diagramu H2O nejsou osy tlaku a teploty zakresleny v konstantním měřítku, aby bylo možné znázornit několik důležitých vlastností, jak je zde popsáno.
Křivka BC na obrázku 2 je grafem závislosti tlaku par na teplotě, jak je popsáno v předchozím modulu této kapitoly. Tato křivka „kapalina-pára“ odděluje kapalnou a plynnou oblast fázového diagramu a udává bod varu vody při libovolném tlaku. Například při tlaku 1 atm je bod varu 100 °C. Všimněte si, že křivka kapalina-pára končí při teplotě 374 °C a tlaku 218 atm, což znamená, že voda nemůže existovat jako kapalina nad touto teplotou bez ohledu na tlak. Fyzikální vlastnosti vody za těchto podmínek jsou na pomezí mezi její kapalnou a plynnou fází. Tento jedinečný stav hmoty se nazývá superkritická kapalina, což je téma, které bude popsáno v další části tohoto modulu.
Křivka pevné fáze a vodní páry, označená na obrázku 2 jako AB, označuje teploty a tlaky, při kterých jsou led a vodní pára v rovnováze. Tyto dvojice teplot a tlaků odpovídají bodům sublimace nebo usazování vody. Kdybychom mohli přiblížit přímku pevná látka-plyn na obrázku 2, viděli bychom, že led má při teplotě -10 °C tlak vodní páry přibližně 0,20 kPa. Pokud tedy umístíme zmrzlý vzorek do vakua s tlakem nižším než 0,20 kPa, led sublimuje. To je základem procesu „sušení mrazem“, který se často používá ke konzervaci potravin, například zmrzliny zobrazené na obrázku 3.

Křivka pevná látka-kapalina označená BD ukazuje teploty a tlaky, při nichž jsou led a kapalná voda v rovnováze, což představuje body tání/mrznutí pro vodu. Všimněte si, že tato křivka vykazuje mírný záporný sklon (pro názornost značně přehnaný), což znamená, že s rostoucím tlakem teplota tání vody mírně klesá. Voda je v tomto ohledu neobvyklá látka, protože u většiny látek se teplota tání s rostoucím tlakem zvyšuje. Toto chování je částečně zodpovědné za pohyb ledovců, jako je ten na obrázku 4. Na dno ledovce působí v důsledku jeho hmotnosti obrovský tlak, který může rozpustit část ledu a vytvořit vrstvu kapalné vody, po které může ledovec snadněji klouzat.

Příčný bod všech tří křivek je na obrázku 2 označen jako B. Při tlaku a teplotě, které tento bod představuje, koexistují všechny tři fáze vody v rovnováze. Tato dvojice údajů o teplotě a tlaku se nazývá trojný bod. Při tlaku nižším než trojný bod nemůže voda existovat jako kapalina bez ohledu na teplotu.
Příklad 1
Určení stavu vody
Pomocí fázového diagramu pro vodu uvedeného na obrázku 2 určete stav vody při následujících teplotách a tlacích:
(a) -10 °C a 50 kPa
(b) 25 °C a 90 kPa
(c) 50 °C a 40 kPa
(d) 80 °C a 5 kPa
(e) -10 °C a 0.3 kPa
(f) 50 °C a 0,3 kPa
Roztok
Pomocí fázového diagramu pro vodu můžeme určit, že stav vody při každé uvedené teplotě a tlaku je následující: (a) pevná látka; (b) kapalina; (c) kapalina; (d) plyn; (e) pevná látka; (f) plyn.
Prověřte si své znalosti
Které fázové změny může voda prodělávat při změně teploty, pokud je tlak udržován na hodnotě 0,3 kPa? Pokud je tlak udržován na hodnotě 50 kPa?
Odpověď:
Při tlaku 0,3 kPa: \text{s}\;{\longrightarrow}\;\text{g} při -58 °C. Při tlaku 50 kPa: \text{s}\;{\longrightarrow}\;\text{l} při 0 °C, \text{l}\;{\longrightarrow}\;\text{g} při 78 °C
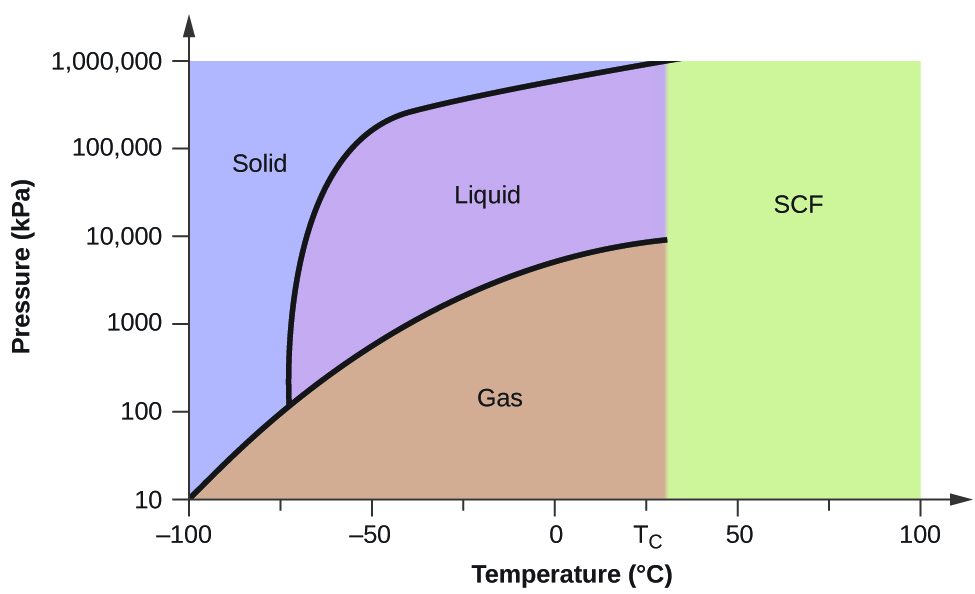
Podívejme se na fázový diagram pro oxid uhličitý uvedený na obrázku 5 jako další příklad. Křivka mezi pevnou a kapalnou fází vykazuje kladný sklon, což naznačuje, že teplota tání CO2 roste s tlakem stejně jako u většiny látek (voda je významnou výjimkou, jak bylo popsáno výše). Všimněte si, že trojný bod je vysoko nad 1 atm, což naznačuje, že oxid uhličitý nemůže existovat jako kapalina za podmínek okolního tlaku. Místo toho dochází při ochlazování plynného oxidu uhličitého při tlaku 1 atm k jeho přechodu do pevného skupenství. Stejně tak se pevný oxid uhličitý při tlaku 1 atm neroztaví, ale sublimuje za vzniku plynného CO2. Nakonec si všimněte, že kritický bod oxidu uhličitého je pozorován při relativně skromné teplotě a tlaku ve srovnání s vodou.
Příklad 2
Určení stavu oxidu uhličitého
Pomocí fázového diagramu oxidu uhličitého uvedeného na obrázku 5 určete stav CO2 při následujících teplotách a tlacích:
(a) -30 °C a 2000 kPa
(b) -60 °C a 1000 kPa
(c) -60 °C a 100 kPa
(d) 20 °C a 1500 kPa
(e) 0 °C a 100 kPa
(f) 20 °C a 100 kPa
Roztok
Podle předloženého fázového diagramu pro oxid uhličitý, můžeme určit, že stav CO2 při každé z uvedených teplot a tlaků je následující: (a) kapalný; (b) pevný; (c) plynný; (d) kapalný; (e) plynný; (f) plynný.
Ověřte si své znalosti
Určete, jakými fázovými změnami prochází oxid uhličitý, když se mění jeho teplota, přičemž jeho tlak zůstává konstantní na hodnotě 1500 kPa? Při tlaku 500 kPa? Při jakých přibližných teplotách k těmto fázovým změnám dochází?
Odpověď:
při tlaku 1500 kPa: \text{s}\;{\longrightarrow}\;\text{l} při -45 °C, \text{l}\;{\longrightarrow}\;\text{g} při -10 °C;
při 500 kPa: \text{s}\;{\longrightarrow}\;\text{g} při -58 °C
Vložíme-li vzorek vody do uzavřené nádoby o teplotě 25 °C, odstraníme vzduch a necháme nastolit rovnováhu mezi vypařováním a kondenzací, zůstane nám směs kapalné vody a vodní páry o tlaku 0,03 atm. Je zřetelně vidět zřetelná hranice mezi hustší kapalinou a méně hustým plynem. Se zvyšující se teplotou se zvyšuje tlak vodní páry, jak popisuje křivka kapalina-plyn ve fázovém diagramu pro vodu (obrázek 2), a zůstává dvoufázová rovnováha kapalné a plynné fáze. Při teplotě 374 °C vzrostl tlak vodní páry na 218 atm a další zvyšování teploty vede k zániku hranice mezi kapalnou a plynnou fází. Veškerá voda v nádobě je nyní přítomna v jediné fázi, jejíž fyzikální vlastnosti jsou na pomezí plynného a kapalného stavu. Tato fáze hmoty se nazývá nadkritická kapalina a teplota a tlak, nad nimiž tato fáze existuje, jsou kritickým bodem (obrázek 6). Nad kritickou teplotou nelze plyn zkapalnit bez ohledu na velikost tlaku. Tlak potřebný ke zkapalnění plynu při jeho kritické teplotě se nazývá kritický tlak. Kritické teploty a kritické tlaky některých běžných látek jsou uvedeny v tabulce 6.
| Látka | Kritická teplota (K) | Kritický tlak (atm) |
|---|---|---|
| vodík | 33. V tabulce 6 jsou uvedeny kritické teploty a kritické tlaky některých běžných látek.2 | 12,8 |
| dusík | 126,0 | 33,5 |
| kyslík | 154.3 | 49,7 |
| oxid uhličitý | 304,2 | 73,0 |
| amoniak | 405,5 | 111,5 |
| oxid siřičitý | 430.3 | 77,7 |
| voda | 647,1 | 217,7 |
| Tabulka 6. | ||

Podívejte se na přechod kapaliny do nadkritické kapaliny pro oxid uhličitý.
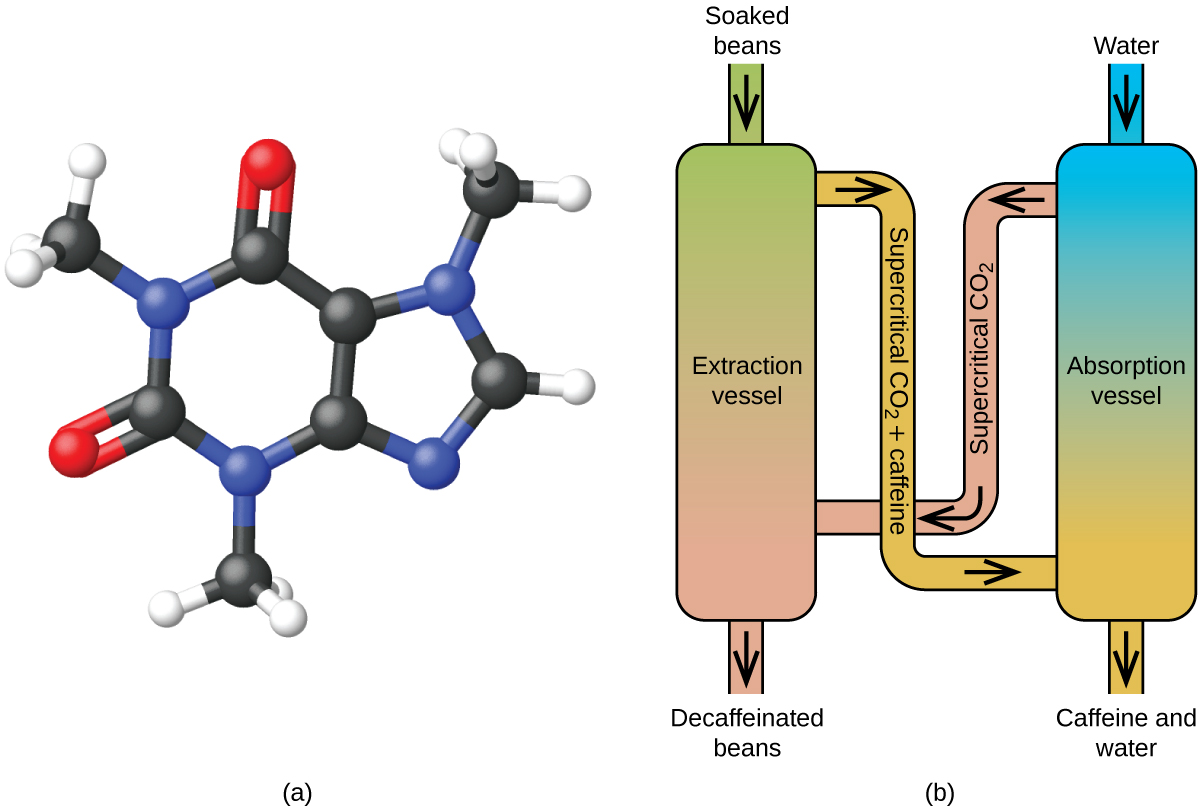
Stejně jako plyn se i nadkritická kapalina rozpíná a zaplňuje nádobu, ale její hustota je mnohem větší než hustota typických plynů a obvykle se blíží hustotě kapalin. Podobně jako kapaliny jsou tyto kapaliny schopny rozpouštět netěkavé rozpuštěné látky. Nevykazují však v podstatě žádné povrchové napětí a mají velmi nízkou viskozitu, takže mohou účinněji pronikat velmi malými otvory v pevné směsi a odstraňovat rozpustné složky. Díky těmto vlastnostem jsou superkritické kapaliny mimořádně užitečnými rozpouštědly pro širokou škálu aplikací. Například superkritický oxid uhličitý se stal velmi oblíbeným rozpouštědlem v potravinářském průmyslu, kde se používá k dekofeinizaci kávy, odstraňování tuků z bramborových lupínků a extrakci chuťových a vonných látek z citrusových olejů. Je netoxický, relativně levný a není považován za znečišťující látku. Po použití lze CO2 snadno získat zpět snížením tlaku a zachycením vzniklého plynu.
Příklad 3
Kritická teplota oxidu uhličitého
Pokud za chladného dne (18 °C) zatřeseme hasicím přístrojem s oxidem uhličitým, můžeme slyšet, jak uvnitř lahve šumí kapalný CO2. V horkém letním dni (35 °C) se však zdá, že stejná láhev neobsahuje žádnou kapalinu. Vysvětlete tato pozorování.
Řešení
V chladný den je teplota CO2 nižší než kritická teplota CO2, 304 K neboli 31 °C (tabulka 6), takže ve válci je přítomen kapalný CO2. V horkém dni je teplota CO2 vyšší než jeho kritická teplota 31 °C. Nad touto teplotou nemůže žádné množství tlaku zkapalnit CO2, takže v hasicím přístroji není žádný kapalný CO2.
Prověřte si své znalosti
Amoniak lze zkapalnit stlačením při pokojové teplotě; kyslík za těchto podmínek zkapalnit nelze. Proč se oba plyny chovají odlišně?
Odpověď:
Kritická teplota amoniaku je 405,5 K, což je vyšší než pokojová teplota. Kritická teplota kyslíku je nižší než pokojová teplota; kyslík tedy nelze zkapalnit při pokojové teplotě.
Dekofeinizace kávy pomocí nadkritického CO2
Káva je po ropě druhou nejobchodovanější komoditou na světě. Po celém světě lidé milují vůni a chuť kávy. Mnozí z nás jsou také závislí na jedné složce kávy – na kofeinu, který nám pomáhá ráno vstát nebo odpoledne zůstat bdělí. Později během dne vám však povzbuzující účinek kávy může bránit ve spánku, a proto se můžete rozhodnout pít večer kávu bez kofeinu.
Od počátku 20. století se k odkofeinování kávy používá mnoho metod. Všechny mají své výhody i nevýhody a všechny závisí na fyzikálních a chemických vlastnostech kofeinu. Protože kofein je do jisté míry polární molekula, dobře se rozpouští ve vodě, polární kapalině. Protože se však mnoho z více než 400 dalších sloučenin, které se podílejí na chuti a vůni kávy, také rozpouští v H2O, mohou procesy dekofeinizace horkou vodou odstranit i některé z těchto sloučenin, což nepříznivě ovlivňuje vůni a chuť dekofeinizované kávy. Dichlormethan (CH2Cl2) a ethylacetát (CH3CO2C2H5) mají podobnou polaritu jako kofein, a jsou proto velmi účinnými rozpouštědly pro extrakci kofeinu, ale obě také odstraňují některé složky chuti a vůně a jejich použití vyžaduje dlouhou dobu extrakce a čištění. Vzhledem k tomu, že obě tato rozpouštědla jsou toxická, objevily se obavy o zdraví v souvislosti s účinkem zbytkového rozpouštědla, které zůstává v dekofeinované kávě.
Superkritická fluidní extrakce pomocí oxidu uhličitého se nyní široce používá jako účinnější a ekologičtější metoda dekofeinace (obrázek 7). Při teplotách nad 304,2 K a tlacích nad 7376 kPa je CO2 superkritická kapalina, která má vlastnosti plynu i kapaliny. Jako plyn proniká hluboko do kávových zrn; jako kapalina účinně rozpouští některé látky. Nadkritickou extrakcí oxidem uhličitým se z napařených kávových zrn odstraní 97-99 % kofeinu, přičemž chuťové a aromatické složky kávy zůstanou nedotčeny. Protože CO2 je za standardních podmínek plyn, je jeho odstranění z extrahovaných kávových zrn snadné, stejně jako získání kofeinu z extraktu. Kofein získaný z kávových zrn tímto postupem je cenným produktem, který lze následně použít jako přísadu do jiných potravin nebo léků.
Klíčové pojmy a shrnutí
Teplotní a tlakové podmínky, při kterých látka existuje v pevném, kapalném a plynném stavu, jsou shrnuty ve fázovém diagramu dané látky. Fázové diagramy jsou kombinované grafy tří křivek rovnováhy tlaku a teploty: pevná látka-kapalina, kapalina-plyn a pevná látka-plyn. Tyto křivky představují vztahy mezi teplotami fázového přechodu a tlaky. Průsečík všech tří křivek představuje trojný bod látky – teplotu a tlak, při nichž jsou všechny tři fáze v rovnováze. Při tlaku pod trojným bodem nemůže látka existovat v kapalném stavu bez ohledu na její teplotu. Konec křivky kapalina-plyn představuje kritický bod látky, tedy tlak a teplotu, nad kterými nemůže existovat kapalná fáze.
Chemie Cvičení ke konci kapitoly
- Z fázového diagramu pro vodu (obrázek 2) určete stav vody při:
(a) 35 °C a 85 kPa
(b) -15 °C a 40 kPa
(c) -15 °C a 0.1 kPa
(d) 75 °C a 3 kPa
(e) 40 °C a 0,1 kPa
(f) 60 °C a 50 kPa
- Které fázové změny nastanou, je-li voda vystavena měnícímu se tlaku při konstantní teplotě 0,005 °C? Při teplotě 40 °C? Při -40 °C?
- Tlakové hrnce umožňují rychlejší vaření potravin, protože vyšší tlak uvnitř tlakového hrnce zvyšuje teplotu varu vody. Konkrétní tlakový hrnec má bezpečnostní ventil, který je nastaven tak, aby vypouštěl páru, pokud tlak překročí 3,4 atm. Jaká je přibližná maximální teplota, které lze v tomto tlakovém hrnci dosáhnout? Vysvětlete své zdůvodnění.
- Z fázového diagramu oxidu uhličitého na obrázku 5 určete stav CO2 při:
(a) 20 °C a 1000 kPa
(b) 10 °C a 2000 kPa
(c) 10 °C a 100 kPa
(d) -40 °C a 500 kPa
(e) -80 °C a 1500 kPa
.
(f) -80 °C a 10 kPa
- Určete, jakým fázovým změnám podléhá oxid uhličitý při změně tlaku, je-li teplota udržována na -50 °C? Pokud je teplota udržována při -40 °C? Při 20 °C? (Viz fázový diagram na obrázku 5.)
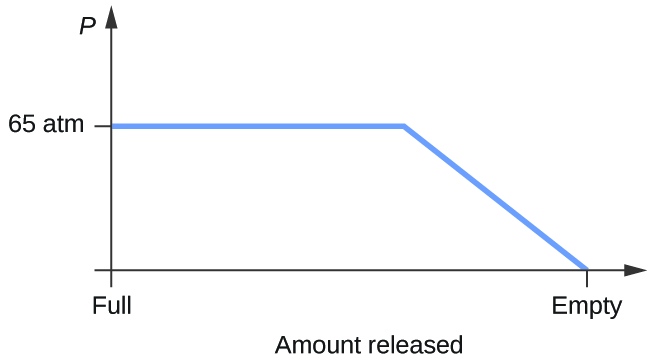
- Považujte válec obsahující směs kapalného oxidu uhličitého v rovnováze s plynným oxidem uhličitým při počátečním tlaku 65 atm a teplotě 20 °C. Načrtněte graf znázorňující změnu tlaku ve válci s časem při uvolňování plynného oxidu uhličitého při konstantní teplotě.
- Suchý led, CO2(s), při atmosférickém tlaku neroztává. Při teplotě -78 °C sublimuje. Při jakém nejnižším tlaku se CO2(s) rozpustí a vznikne CO2(l)? Při jaké teplotě k tomu přibližně dojde? (Fázový diagram naleznete na obrázku 5.)
- Pokud dojde při silné bouřce ke ztrátě elektrické energie, může být nutné použít k sušení prádla šňůru na prádlo. V mnoha částech země uprostřed zimy prádlo zavěšené na šňůře rychle zmrzne. Pokud nebude sněžit, uschnou i tak? Vysvětlete svou odpověď.
- Je možné zkapalnit dusík při pokojové teplotě (asi 25 °C)? Je možné zkapalnit oxid siřičitý při pokojové teplotě? Vysvětlete své odpovědi.
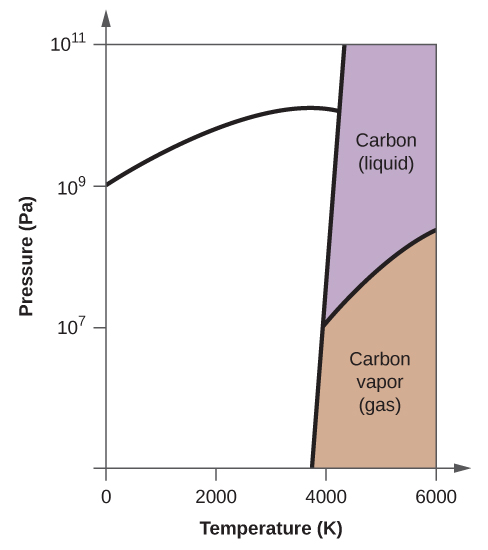
- Elementární uhlík má jednu plynnou fázi, jednu kapalnou fázi a dvě různé pevné fáze, jak je znázorněno na fázovém diagramu:
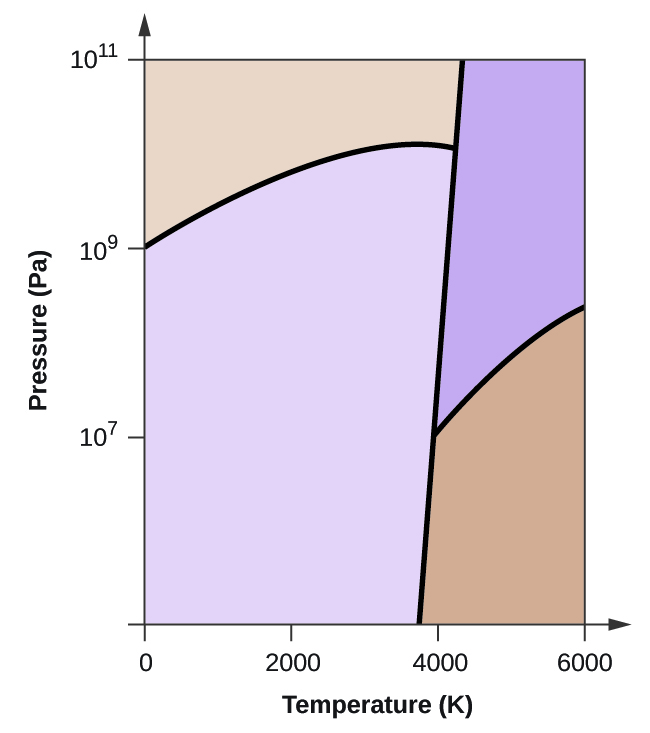
(a) Na fázovém diagramu označte plynnou a kapalnou oblast.
(b) Grafit je nejstabilnější fází uhlíku za normálních podmínek. Na fázovém diagramu označte fázi grafitu.
(c) Jestliže se grafit za normálních podmínek zahřeje na teplotu 2500 K a zároveň se zvýší tlak na 1010 Pa, přemění se na diamant. Označte fázi diamantu.
(d) Zakroužkujte každý trojný bod na fázovém diagramu.
(e) V jaké fázi existuje uhlík při teplotě 5000 K a tlaku 108 Pa.
(f) Jestliže se teplota vzorku uhlíku zvýší z 3000 K na 5000 K při konstantním tlaku 106 Pa, ke kterému fázovému přechodu dochází, pokud vůbec k nějakému?
Glosář
kritický bod teplota a tlak, nad kterými nemůže plyn kondenzovat do kapalné fáze graf tlaku a teploty shrnující podmínky, za kterých mohou existovat fáze látky nadkritická kapalná látka při teplotě a tlaku vyšším než je její kritický bod; vykazuje vlastnosti na pomezí plynného a kapalného skupenství trojný bod teplota a tlak, při nichž jsou plynná, kapalná a pevná fáze látky v rovnováze
Řešení
Odpovědi na cvičení z chemie ke konci kapitoly
2. Při nízkých tlacích a teplotě 0,005 °C je voda plyn. Při zvýšení tlaku na 4,6 torru se voda stává pevnou látkou; při dalším zvýšení tlaku se stává kapalinou. Při teplotě 40 °C je voda za nízkého tlaku pára; při tlaku vyšším než přibližně 75 torrů se mění na kapalinu. Při teplotě -40 °C přechází voda při zvýšení tlaku nad velmi nízké hodnoty z plynu v pevnou látku.
4. a) kapalina; b) pevná látka; c) plyn; d) plyn; e) plyn; f) plyn
8. Ano, led vysublimuje, i když to může trvat několik dní. Led má malý tlak par a některé molekuly ledu tvoří plyn a unikají z ledových krystalů. Postupem času se stále více pevného skupenství mění na plyn, až je nakonec oblečení suché.
10. Jakmile se oblečení vysuší, může se stát, že se v něm objeví led. (a)
(b)
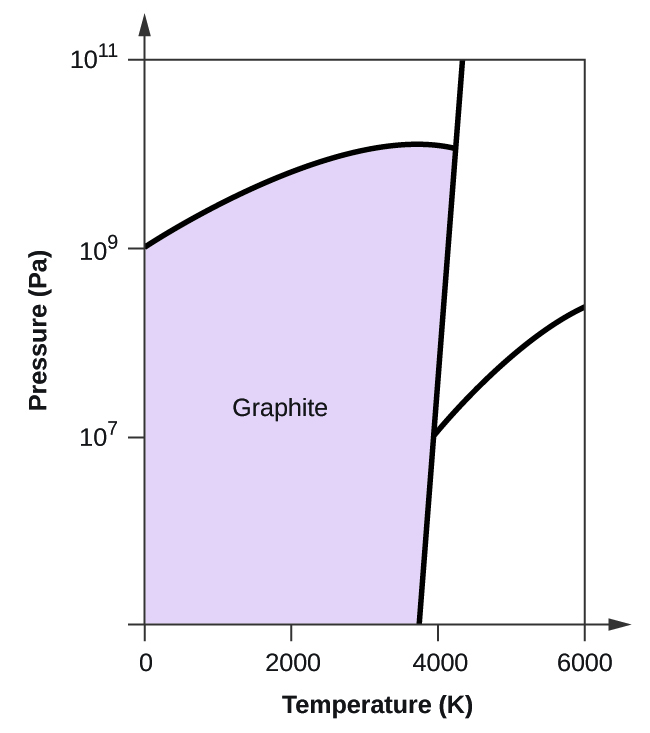
(c)
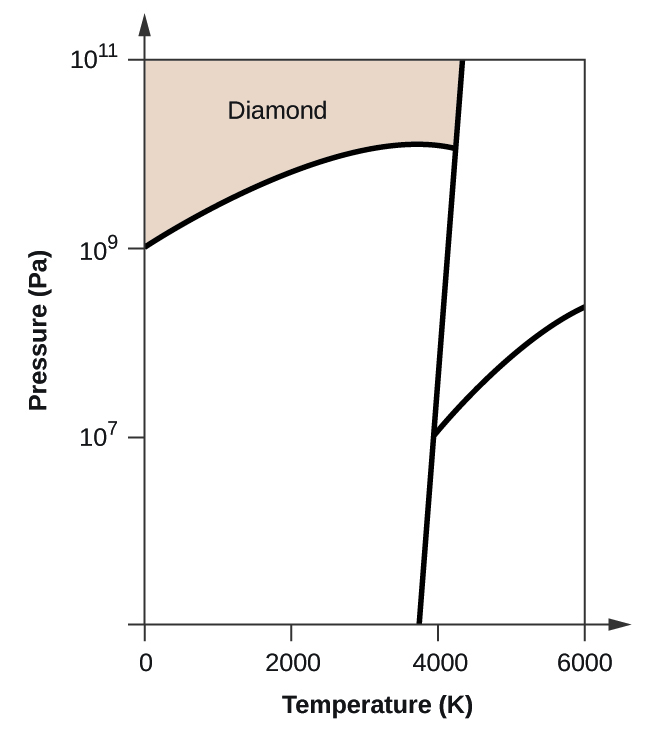
(d)
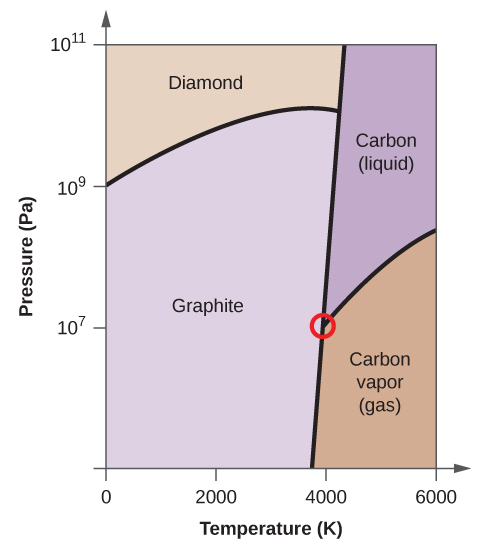
(e) kapalná fáze (f) sublimace
.
