Obiective de învățare
- Explicați construcția și utilizarea unei diagrame de fază tipice
- Utilizați diagramele de fază pentru a identifica fazele stabile la anumite temperaturi și presiuni, și pentru a descrie tranzițiile de fază care rezultă din modificări ale acestor proprietăți
- Descrieți faza fluidă supercritică a materiei
În modulul anterior, a fost descrisă variația presiunii de echilibru a vaporilor unui lichid în funcție de temperatură. Având în vedere definiția punctului de fierbere, graficele presiunii de vapori în funcție de temperatură reprezintă modul în care variază punctul de fierbere al lichidului cu presiunea. De asemenea, a fost descrisă utilizarea curbelor de încălzire și răcire pentru a determina punctul de topire (sau de îngheț) al unei substanțe. Efectuând astfel de măsurători pe o gamă largă de presiuni, se obțin date care pot fi prezentate grafic sub forma unei diagrame de fază. O diagramă de fază combină diagramele de presiune în funcție de temperatură pentru echilibrele de tranziție de fază lichid-gaz, solid-lichid și solid-gaz ale unei substanțe. Aceste diagrame indică stările fizice care există în condiții specifice de presiune și temperatură și furnizează, de asemenea, dependența de presiune a temperaturilor de tranziție de fază (puncte de topire, puncte de sublimare, puncte de fierbere). O diagramă de fază tipică pentru o substanță pură este prezentată în figura 1.
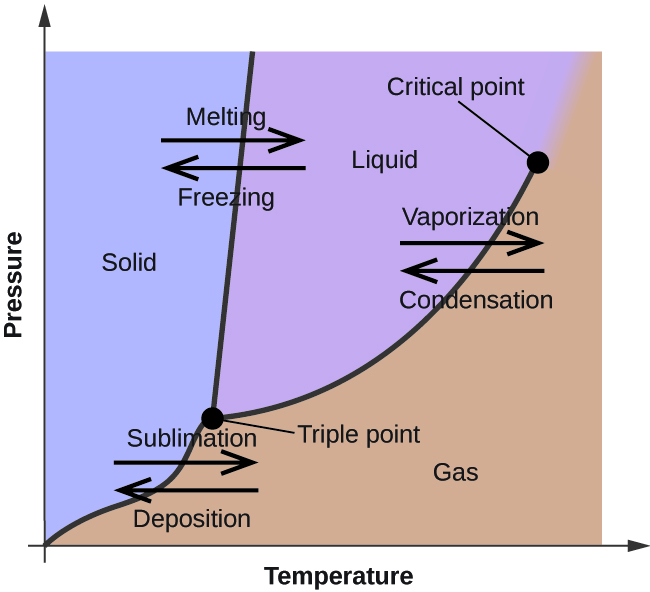
Pentru a ilustra utilitatea acestor diagrame, luați în considerare diagrama de fază pentru apă prezentată în figura 2.
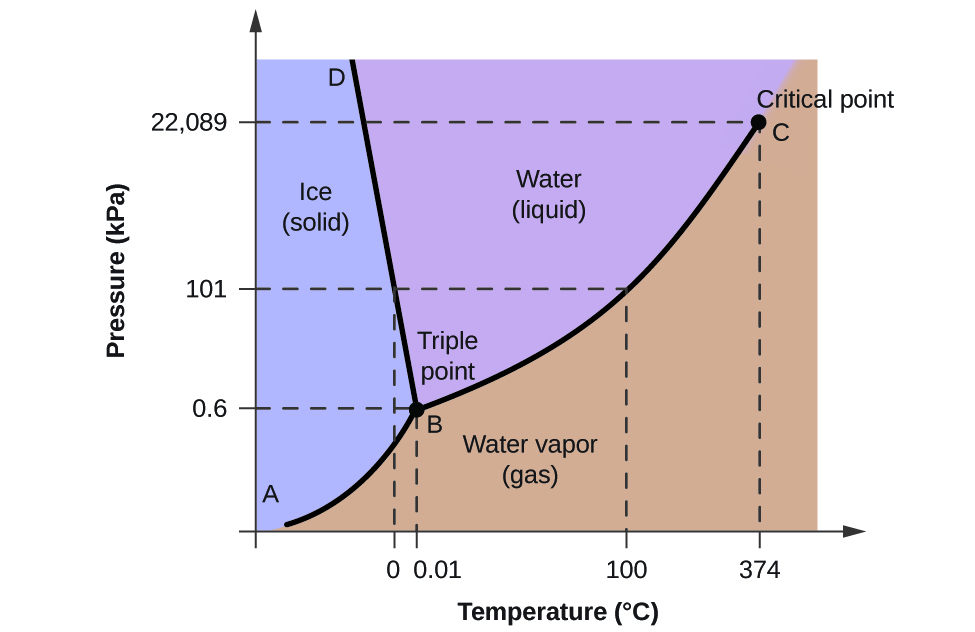
Potem folosi diagrama de fază pentru a identifica starea fizică a unei probe de apă în condiții specificate de presiune și temperatură. De exemplu, o presiune de 50 kPa și o temperatură de -10 °C corespund regiunii din diagramă etichetate „gheață”. În aceste condiții, apa există doar sub formă solidă (gheață). O presiune de 50 kPa și o temperatură de 50 °C corespund regiunii „apă” – aici, apa există doar sub formă de lichid. La 25 kPa și 200 °C, apa există doar în stare gazoasă. Rețineți că pe diagrama de fază H2O, axele presiunii și temperaturii nu sunt trasate la o scară constantă pentru a permite ilustrarea mai multor caracteristici importante, așa cum sunt descrise aici.
Curba BC din figura 2 este reprezentarea grafică a presiunii vaporilor în funcție de temperatură, așa cum este descrisă în modulul anterior al acestui capitol. Această curbă „lichid-vapori” separă regiunile lichidă și gazoasă ale diagramei de fază și furnizează punctul de fierbere pentru apă la orice presiune. De exemplu, la 1 atm, punctul de fierbere este de 100 °C. Observați că curba lichid-vapori se termină la o temperatură de 374 °C și la o presiune de 218 atm, ceea ce indică faptul că apa nu poate exista ca lichid peste această temperatură, indiferent de presiune. Proprietățile fizice ale apei în aceste condiții sunt intermediare între cele ale fazei lichide și cele ale fazei gazoase. Această stare unică a materiei se numește fluid supercritic, un subiect care va fi descris în următoarea secțiune a acestui modul.
Curba solid-vapori, etichetată AB în figura 2, indică temperaturile și presiunile la care gheața și vaporii de apă sunt în echilibru. Aceste perechi de date temperatură-presiune corespund punctelor de sublimare, sau de depunere, pentru apă. Dacă am putea mări linia solid-gaz din figura 2, am vedea că gheața are o presiune de vapori de aproximativ 0,20 kPa la -10 °C. Astfel, dacă plasăm o probă înghețată într-un vid cu o presiune mai mică de 0,20 kPa, gheața se va sublima. Aceasta este baza procesului de „liofilizare” folosit adesea pentru conservarea alimentelor, cum ar fi înghețata prezentată în figura 3.

Curba solid-lichid etichetată BD arată temperaturile și presiunile la care gheața și apa lichidă sunt în echilibru, reprezentând punctele de topire/congelare pentru apă. Observați că această curbă prezintă o ușoară pantă negativă (mult exagerată pentru claritate), ceea ce indică faptul că punctul de topire pentru apă scade ușor pe măsură ce crește presiunea. Apa este o substanță neobișnuită în această privință, deoarece majoritatea substanțelor prezintă o creștere a punctului de topire odată cu creșterea presiunii. Acest comportament este parțial responsabil pentru mișcarea ghețarilor, precum cel prezentat în figura 4. Fundul unui ghețar este supus unei presiuni imense datorate greutății sale, care poate topi o parte din gheață, formând un strat de apă lichidă pe care ghețarul poate aluneca mai ușor.

Punctul de intersecție al celor trei curbe este etichetat B în figura 2. La presiunea și temperatura reprezentate de acest punct, toate cele trei faze ale apei coexistă în echilibru. Această pereche de date temperatură-presiune se numește punct triplu. La presiuni mai mici decât punctul triplu, apa nu poate exista ca lichid, indiferent de temperatură.
Exemplu 1
Determinarea stării apei
Utilizând diagrama de faze pentru apă dată în figura 2, determinați starea apei la următoarele temperaturi și presiuni:
(a) -10 °C și 50 kPa
(b) 25 °C și 90 kPa
(c) 50 °C și 40 kPa
(d) 80 °C și 5 kPa
(e) -10 °C și 0.3 kPa
(f) 50 °C și 0,3 kPa
Soluție
Utilizând diagrama de fază pentru apă, putem determina că starea apei la fiecare temperatură și presiune dată sunt următoarele: (a) solidă; (b) lichidă; (c) lichidă; (d) gazoasă; (e) solidă; (f) gazoasă.
Verifică-ți cunoștințele
Ce schimbări de fază poate suferi apa pe măsură ce se schimbă temperatura, dacă presiunea este menținută la 0,3 kPa? Dacă presiunea este menținută la 50 kPa?
Răspuns:
La 0,3 kPa: \text{s}\;{\longrightarrow}\;\text{g} la -58 °C. La 50 kPa: \text{s}\;{\longrightarrow}\;\text{l} la 0 °C, \text{l}\;{\longrightarrow}\;\text{g} la 78 °C
Considerăm diagrama de fază pentru dioxidul de carbon prezentată în figura 5 ca un alt exemplu. Curba solid-lichid prezintă o pantă pozitivă, ceea ce indică faptul că punctul de topire pentru CO2 crește odată cu presiunea, așa cum se întâmplă în cazul majorității substanțelor (apa fiind o excepție notabilă, așa cum a fost descrisă anterior). Observați că punctul triplu este cu mult peste 1 atm, ceea ce indică faptul că dioxidul de carbon nu poate exista ca lichid în condiții de presiune ambiantă. În schimb, răcirea dioxidului de carbon gazos la 1 atm duce la depunerea acestuia în stare solidă. De asemenea, dioxidul de carbon solid nu se topește la o presiune de 1 atm, ci se sublimează pentru a produce CO2 gazos. În cele din urmă, observați că punctul critic pentru dioxidul de carbon este observat la o temperatură și o presiune relativ modeste în comparație cu apa.
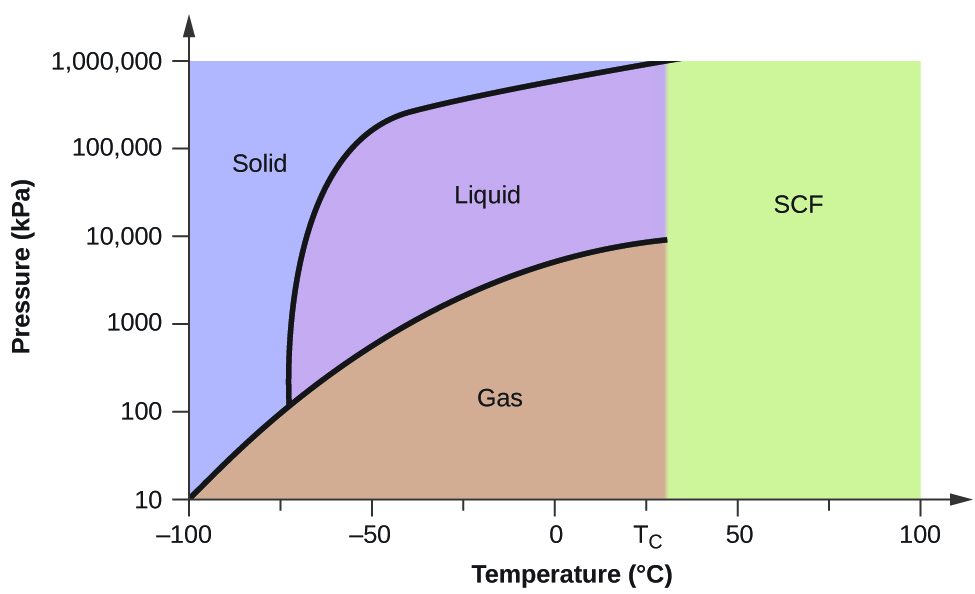
Exemplul 2
Determinarea stării dioxidului de carbon
Utilizând diagrama de fază pentru dioxidul de carbon prezentată în figura 5, determinați starea CO2 la următoarele temperaturi și presiuni:
(a) -30 °C și 2000 kPa
(b) -60 °C și 1000 kPa
(c) -60 °C și 100 kPa
(d) 20 °C și 1500 kPa
(e) 0 °C și 100 kPa
(f) 20 °C și 100 kPa
Soluție
Utilizând diagrama de faze pentru dioxidul de carbon furnizată, putem determina că starea CO2 la fiecare temperatură și presiune date sunt următoarele: (a) lichid; (b) solid; (c) gaz; (d) lichid; (e) gaz; (f) gaz.
Verifică-ți cunoștințele
Determinați care sunt modificările de fază pe care le suferă dioxidul de carbon atunci când temperatura sa variază, menținând astfel presiunea sa constantă la 1500 kPa? La 500 kPa? La ce temperaturi aproximative au loc aceste schimbări de fază?
Răspuns:
la 1500 kPa: \text{s}\;{\longrightarrow}\;\text{l} la -45 °C, \text{l}\;{\longrightarrow}\;\text{g} la -10 °C;
la 500 kPa: \text{s}\;{\longrightarrow}\;\text{g} la -58 °C
Dacă plasăm o mostră de apă într-un recipient sigilat la 25 °C, eliminăm aerul și lăsăm să se stabilească echilibrul de vaporizare-condensare, rămânem cu un amestec de apă lichidă și vapori de apă la o presiune de 0,03 atm. Se observă clar o graniță distinctă între lichidul mai dens și gazul mai puțin dens. Pe măsură ce creștem temperatura, presiunea vaporilor de apă crește, așa cum este descrisă de curba lichid-gaz din diagrama de fază pentru apă (figura 2), și rămâne un echilibru bifazic între faza lichidă și cea gazoasă. La o temperatură de 374 °C, presiunea vaporilor a crescut până la 218 atm, iar orice creștere suplimentară a temperaturii duce la dispariția limitei dintre fazele lichidă și de vapori. Toată apa din recipient este acum prezentă într-o singură fază ale cărei proprietăți fizice sunt intermediare între cele ale stării gazoase și cele ale stării lichide. Această fază a materiei se numește fluid supercritic, iar temperatura și presiunea peste care există această fază reprezintă punctul critic (figura 6). Peste temperatura critică, un gaz nu poate fi lichefiat, indiferent de presiunea aplicată. Presiunea necesară pentru a lichefia un gaz la temperatura sa critică se numește presiune critică. Temperaturile critice și presiunile critice ale unor substanțe comune sunt prezentate în tabelul 6.
| Substanța | Temperatura critică (K) | Presiunea critică (atm) |
|---|---|---|
| hidrogenul | 33.2 | 12,8 |
| azot | 126,0 | 33,5 |
| oxigen | 154.3 | 49,7 |
| dioxid de carbon | 304,2 | 73,0 |
| amoniac | 405,5 | 111,5 |
| dioxid de sulf | 430.3 | 77,7 |
| apă | 647,1 | 217,7 |
| Tabelul 6. | ||
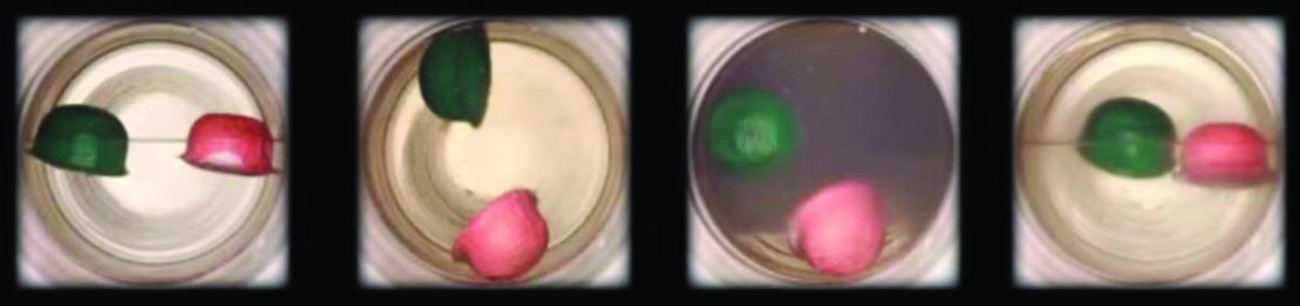

Observați tranziția de la lichid la fluid supercritic pentru dioxidul de carbon.
Ca un gaz, un fluid supercritic se va extinde și va umple un recipient, dar densitatea sa este mult mai mare decât densitățile tipice ale gazelor, fiind de obicei aproape de cele ale lichidelor. La fel ca lichidele, aceste fluide sunt capabile să dizolve soluturi nevolatili. Cu toate acestea, ei nu prezintă practic nicio tensiune superficială și au o vâscozitate foarte scăzută, astfel încât pot pătrunde mai eficient prin deschideri foarte mici într-un amestec solid și pot elimina componentele solubile. Aceste proprietăți fac din fluidele supercritice niște solvenți extrem de utili pentru o gamă largă de aplicații. De exemplu, dioxidul de carbon supercritic a devenit un solvent foarte popular în industria alimentară, fiind utilizat pentru a decafeiniza cafeaua, a îndepărta grăsimile din chipsurile de cartofi și a extrage compușii de aromă și parfum din uleiurile de citrice. Nu este toxic, este relativ ieftin și nu este considerat un poluant. După utilizare, CO2 poate fi recuperat cu ușurință prin reducerea presiunii și colectarea gazului rezultat.
Exemplu 3
Temperatura critică a dioxidului de carbon
Dacă agităm un stingător de incendiu cu dioxid de carbon într-o zi răcoroasă (18 °C), putem auzi CO2 lichid zvâcnind în interiorul cilindrului. Cu toate acestea, același cilindru pare să nu conțină lichid într-o zi călduroasă de vară (35 °C). Explicați aceste observații.
Soluție
În ziua răcoroasă, temperatura CO2 este sub temperatura critică a CO2, 304 K sau 31 °C (tabelul 6), deci CO2 lichid este prezent în cilindru. În ziua caldă, temperatura CO2 este mai mare decât temperatura critică a acestuia, de 31 °C. Peste această temperatură, nicio cantitate de presiune nu poate lichefia CO2, astfel încât în stingătorul de incendiu nu există CO2 lichid.
Verifică-ți cunoștințele
Amoniacul poate fi lichefiat prin comprimare la temperatura camerei; oxigenul nu poate fi lichefiat în aceste condiții. De ce au cele două gaze un comportament diferit?
Răspuns:
Temperatura critică a amoniacului este de 405,5 K, care este mai mare decât temperatura camerei. Temperatura critică a oxigenului este mai mică decât temperatura camerei; astfel, oxigenul nu poate fi lichefiat la temperatura camerei.
Decafeinizarea cafelei folosind CO2 supercritic
Cafeaua este a doua cea mai comercializată marfă din lume, după petrol. Pe tot globul, oamenii iubesc aroma și gustul cafelei. Mulți dintre noi depind, de asemenea, de o componentă a cafelei – cafeina – pentru a ne ajuta să ne punem în mișcare dimineața sau să rămânem alerți după-amiaza. Dar la sfârșitul zilei, efectul stimulant al cafelei vă poate împiedica să dormiți, așa că puteți alege să beți cafea decofeinizată seara.
De la începutul anilor 1900, au fost folosite multe metode pentru a decafeiniza cafeaua. Toate au avantaje și dezavantaje și toate depind de proprietățile fizice și chimice ale cofeinei. Deoarece cafeina este o moleculă oarecum polară, se dizolvă bine în apă, un lichid polar. Cu toate acestea, deoarece mulți dintre ceilalți peste 400 de compuși care contribuie la gustul și aroma cafelei se dizolvă, de asemenea, în H2O, procesele de decafeinizare în apă caldă pot elimina și unii dintre acești compuși, afectând negativ mirosul și gustul cafelei decafeinizate. Diclorometanul (CH2Cl2) și acetatul de etil (CH3CO2C2H5) au o polaritate similară cu cea a cafeinei și, prin urmare, sunt solvenți foarte eficienți pentru extragerea cafeinei, dar ambele elimină și unele componente ale gustului și ale aromei, iar utilizarea lor necesită timpi lungi de extracție și curățare. Deoarece ambii solvenți sunt toxici, au fost ridicate probleme de sănătate cu privire la efectul solventului rezidual care rămâne în cafeaua decafeinizată.
Extragerea cu fluid supercritic folosind dioxid de carbon este acum folosită pe scară largă ca o metodă de decafeinizare mai eficientă și mai ecologică (figura 7). La temperaturi de peste 304,2 K și presiuni de peste 7376 kPa, CO2 este un fluid supercritic, cu proprietăți atât de gaz cât și de lichid. Ca un gaz, acesta pătrunde adânc în boabele de cafea; ca un lichid, dizolvă eficient anumite substanțe. Extracția cu dioxid de carbon supercritică a boabelor de cafea aburite elimină 97-99% din cofeină, lăsând intactă aroma și compușii aromatici ai cafelei. Deoarece CO2 este un gaz în condiții standard, îndepărtarea sa din boabele de cafea extrase este ușor de realizat, la fel ca și recuperarea cafeinei din extract. Cofeina recuperată din boabele de cafea prin acest procedeu este un produs valoros care poate fi utilizat ulterior ca aditiv la alte alimente sau medicamente.
Concepte cheie și rezumat
Condițiile de temperatură și presiune la care o substanță există în stare solidă, lichidă și gazoasă sunt rezumate într-o diagramă de fază pentru acea substanță. Diagramele de fază sunt reprezentări combinate a trei curbe de echilibru presiune-temperatură: solid-lichid, lichid-gaz și solid-gaz. Aceste curbe reprezintă relațiile dintre temperaturile și presiunile de tranziție de fază. Punctul de intersecție al tuturor celor trei curbe reprezintă punctul triplu al substanței – temperatura și presiunea la care toate cele trei faze se află în echilibru. La presiuni sub punctul triplu, o substanță nu poate exista în stare lichidă, indiferent de temperatura sa. Punctul terminus al curbei lichid-gaz reprezintă punctul critic al substanței, presiunea și temperatura peste care nu poate exista o fază lichidă.
Chemistry End of Chapter Exercises
- Din diagrama de fază pentru apă (figura 2), determinați starea apei la:
(a) 35 °C și 85 kPa
(b) -15 °C și 40 kPa
(c) -15 °C și 0,5 kPa.1 kPa
(d) 75 °C și 3 kPa
(e) 40 °C și 0,1 kPa
(f) 60 °C și 50 kPa
- Ce schimbări de fază vor avea loc atunci când apa este supusă la o presiune variabilă la o temperatură constantă de 0,005 °C? La 40 °C? La -40 °C?
- Cafetele sub presiune permit gătirea mai rapidă a alimentelor deoarece presiunea mai mare din interiorul oalei sub presiune crește temperatura de fierbere a apei. O anumită oală sub presiune are o supapă de siguranță care este setată să evacueze aburul în cazul în care presiunea depășește 3,4 atm. Care este temperatura maximă aproximativă care poate fi atinsă în interiorul acestei oale sub presiune? Explicați-vă raționamentul.
- Din diagrama de fază pentru dioxidul de carbon din figura 5, determinați starea CO2 la:
(a) 20 °C și 1000 kPa
(b) 10 °C și 2000 kPa
(c) 10 °C și 100 kPa
(d) -40 °C și 500 kPa
(e) -80 °C și 1500 kPa
(e) -80 °C și 1500 kPa
.
(f) -80 °C și 10 kPa
- Determinați modificările de fază pe care le suferă dioxidul de carbon pe măsură ce presiunea se modifică dacă temperatura este menținută la -50 °C? Dacă temperatura este menținută la -40 °C? La 20 °C? (A se vedea diagrama de fază din figura 5.)
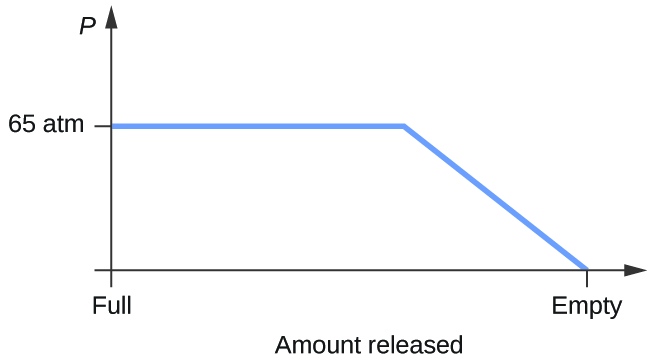
- Considerați un cilindru care conține un amestec de dioxid de carbon lichid în echilibru cu dioxid de carbon gazos la o presiune inițială de 65 atm și o temperatură de 20 °C. Schițați un grafic care să descrie modificarea presiunii din cilindru în timp, pe măsură ce dioxidul de carbon gazos este eliberat la temperatură constantă.
- Gheața uscată, CO2(s), nu se topește la presiunea atmosferică. Ea se sublimează la o temperatură de -78 °C. Care este cea mai mică presiune la care CO2(s) se va topi pentru a da CO2(l)? La aproximativ ce temperatură se va produce acest lucru? (A se vedea figura 5 pentru diagrama de fază.)
- Dacă o furtună puternică duce la pierderea energiei electrice, poate fi necesar să se folosească o frânghie de rufe pentru a usca rufele. În multe părți ale țării, în toiul iernii, hainele vor îngheța rapid atunci când sunt atârnate pe frânghie. Dacă nu ninge, se vor usca oricum? Explicați-vă răspunsul.
- Este posibil să se lichefieze azotul la temperatura camerei (aproximativ 25 °C)? Este posibil să se lichefieze dioxidul de sulf la temperatura camerei? Explicați-vă răspunsurile.
- Carbonatul elementar are o fază gazoasă, o fază lichidă și două faze solide diferite, așa cum se arată în diagrama de fază:
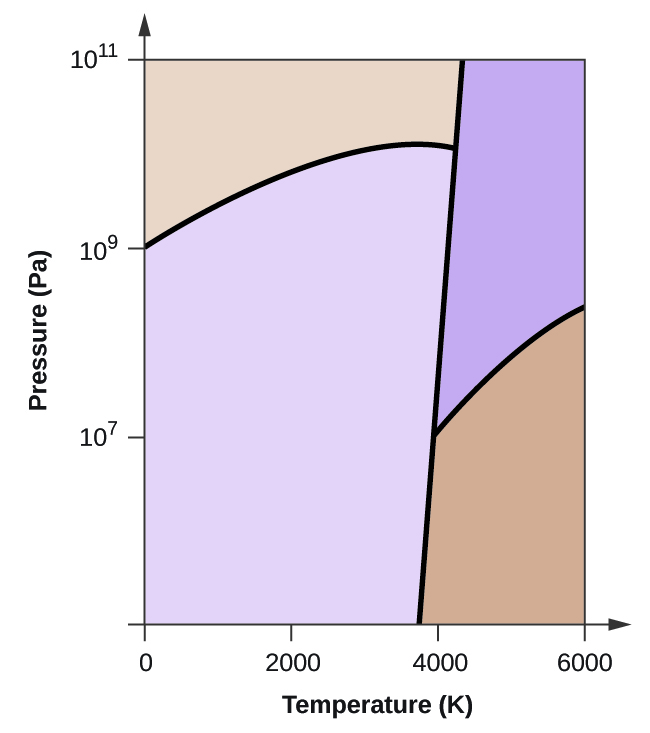
(a) Pe diagrama de fază, etichetați regiunile gazoase și lichide.
(b) Grafitul este cea mai stabilă fază a carbonului în condiții normale. Pe diagrama de fază, etichetați faza grafitului.
(c) Dacă grafitul în condiții normale este încălzit la 2500 K în timp ce presiunea este mărită la 1010 Pa, acesta se transformă în diamant. Etichetați faza diamant.
(d) Încercuiți fiecare punct triplu pe diagrama de fază.
(e) În ce fază există carbonul la 5000 K și 108 Pa?
(f) Dacă temperatura unei probe de carbon crește de la 3000 K la 5000 K la o presiune constantă de 106 Pa, ce tranziție de fază are loc, dacă există?
Glosar
punct critic temperatura și presiunea peste care un gaz nu se poate condensa în lichid diagrama de fază graficul presiune-temperatură care rezumă condițiile în care pot exista fazele unei substanțe fluid supercritic substanță la o temperatură și o presiune mai mari decât punctul său critic; prezintă proprietăți intermediare între cele ale stării gazoase și cele ale stării lichide punctul triplu temperatura și presiunea la care fazele de vapori, lichid și solid ale unei substanțe se află în echilibru
Soluții
Răspunsuri la exerciții de chimie de sfârșit de capitol
2. La presiuni scăzute și la 0,005 °C, apa este un gaz. Pe măsură ce presiunea crește până la 4,6 torr, apa devine un solid; pe măsură ce presiunea crește și mai mult, ea devine un lichid. La 40 °C, apa la presiune scăzută este un vapor; la presiuni mai mari de aproximativ 75 torr, se transformă în lichid. La -40 °C, apa se transformă din gaz în solid pe măsură ce presiunea crește peste valori foarte mici.
4. (a) lichid; (b) solid; (c) gaz; (d) gaz; (e) gaz; (f) gaz
8. Da, gheața se va sublima, deși poate dura câteva zile. Gheața are o presiune de vapori mică, iar unele molecule de gheață formează gaz și scapă din cristalele de gheață. Pe măsură ce trece timpul, din ce în ce mai mult solid se transformă în gaz până când, în cele din urmă, hainele sunt uscate.
10. (a)
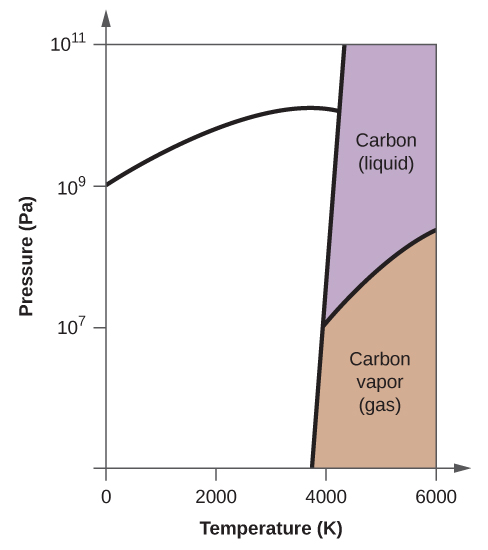
(b)
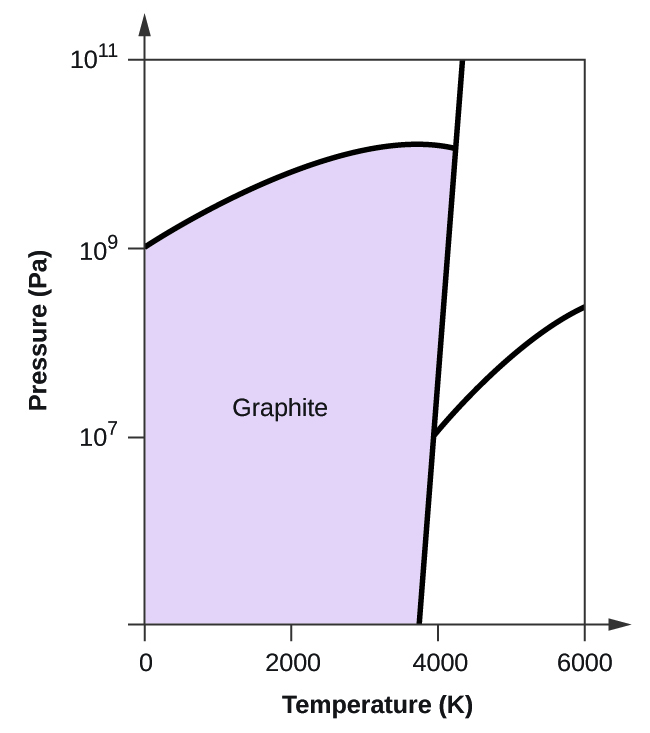
(c)
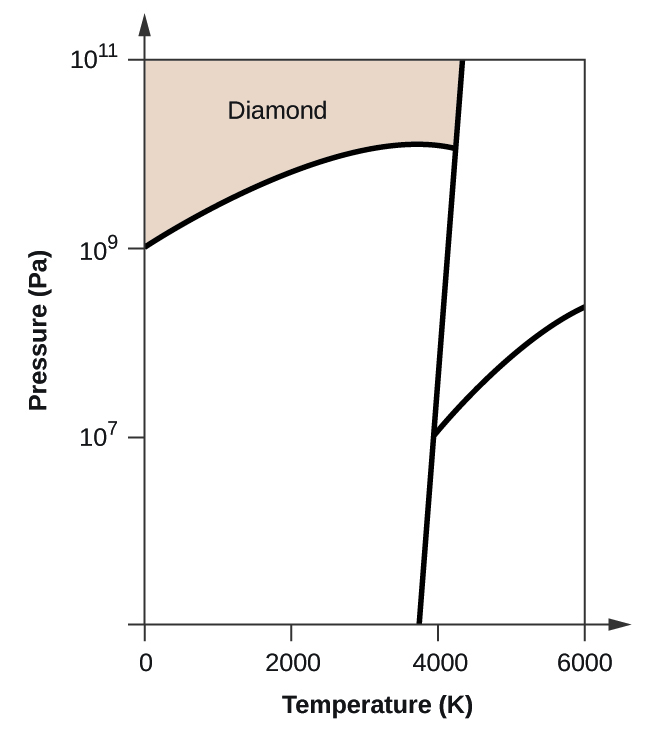
(d)
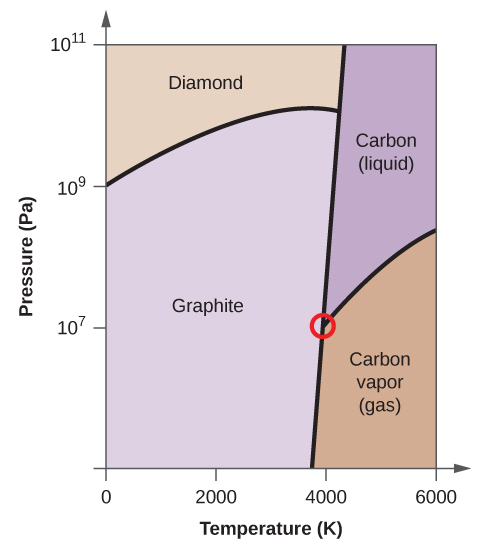
(e) faza lichidă (f) sublimare
.
