Læringsmål
- forklare opbygningen og brugen af et typisk fasediagram
- bruge fasediagrammer til at identificere stabile faser ved givne temperaturer og tryk, og til at beskrive faseovergange som følge af ændringer i disse egenskaber
- Beskriv stoffets superkritiske væskefase
I det foregående modul blev variationen i en væskes ligevægtsdamptryk med temperaturen beskrevet. I betragtning af definitionen af kogepunktet viser plottet af damptrykket over for temperaturen, hvordan væskens kogepunkt varierer med trykket. Der blev også beskrevet brugen af opvarmnings- og afkølingskurver til at bestemme et stofs smelte- (eller frysepunkt). Ved at foretage sådanne målinger over et bredt spektrum af tryk fås data, der kan præsenteres grafisk som et fasediagram. Et fasediagram er en kombination af tryk- og temperaturdiagrammer for et stofs væske-gas-, fast-væske- og fast-gas-faseovergangsligevægtforhold. Disse diagrammer viser de fysiske tilstande, der eksisterer under bestemte tryk- og temperaturforhold, og viser også trykafhængigheden af faseovergangstemperaturerne (smeltepunkter, sublimeringspunkter og kogepunkter). Et typisk fasediagram for et rent stof er vist i figur 1.
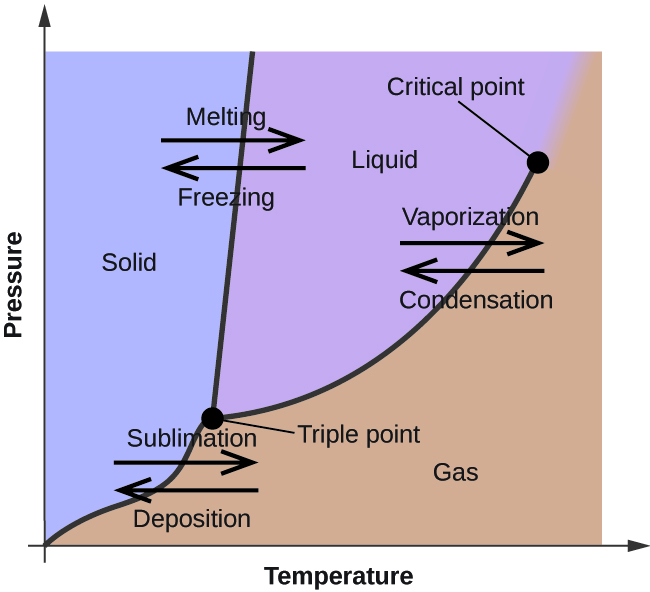
For at illustrere nytten af disse diagrammer kan man se på fasediagrammet for vand, der er vist i figur 2.
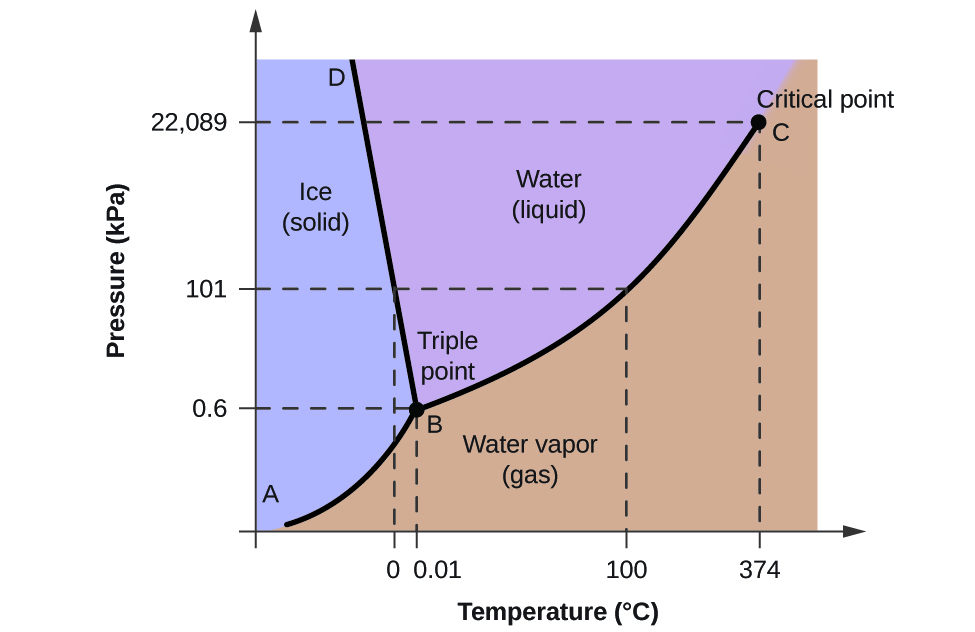
Vi kan bruge fasediagrammet til at identificere den fysiske tilstand af en prøve af vand under bestemte tryk- og temperaturforhold. For eksempel svarer et tryk på 50 kPa og en temperatur på -10 °C til det område i diagrammet, der er mærket “is”. Under disse forhold eksisterer vand kun som et fast stof (is). Et tryk på 50 kPa og en temperatur på 50 °C svarer til området “vand” – her eksisterer vand kun som væske. Ved 25 kPa og 200 °C eksisterer vand kun i gasformig tilstand. Bemærk, at på H2O-fasediagrammet er tryk- og temperaturakserne ikke tegnet i en konstant skala for at muliggøre illustrationen af flere vigtige træk som beskrevet her.
Kurven BC i figur 2 er plottet af damptrykket over for temperaturen som beskrevet i det foregående modul i dette kapitel. Denne “væske-damp”-kurve adskiller de flydende og gasformige områder i fasediagrammet og angiver kogepunktet for vand ved ethvert tryk. Ved 1 atm er kogepunktet f.eks. 100 °C. Bemærk, at væske-damp-kurven slutter ved en temperatur på 374 °C og et tryk på 218 atm, hvilket indikerer, at vand ikke kan eksistere som væske over denne temperatur, uanset trykket. Vandets fysiske egenskaber under disse forhold ligger mellem de flydende og gasformige egenskaber. Denne unikke stoftilstand kaldes en superkritisk væske, et emne, der vil blive beskrevet i næste afsnit af dette modul.
Feststof-damp-kurven, der er mærket AB i figur 2, angiver de temperaturer og tryk, hvor is og vanddamp er i ligevægt. Disse temperatur- og trykpar svarer til sublimerings- eller aflejringspunkterne for vand. Hvis vi kunne zoome ind på faststof-gas-linjen i figur 2, ville vi se, at is har et damptryk på ca. 0,20 kPa ved -10 °C. Hvis vi placerer en frossen prøve i et vakuum med et tryk på under 0,20 kPa, vil isen således sublimeres. Dette er grundlaget for den “frysetørringsproces”, der ofte anvendes til konservering af fødevarer, som f.eks. den is, der er vist i figur 3.

Den fast-væske kurve mærket BD viser de temperaturer og tryk, ved hvilke is og flydende vand er i ligevægt, hvilket repræsenterer smelte- og frysepunkterne for vand. Bemærk, at denne kurve har en let negativ hældning (stærkt overdrevet for klarhedens skyld), hvilket indikerer, at smeltepunktet for vand falder en smule, når trykket stiger. Vand er et usædvanligt stof i denne henseende, da de fleste stoffer udviser en stigning i smeltepunktet med stigende tryk. Denne adfærd er delvis ansvarlig for gletsjernes bevægelse, som den, der er vist i figur 4. Bunden af en gletsjer oplever et enormt tryk som følge af dens vægt, der kan smelte noget af isen og danne et lag flydende vand, som gletsjeren lettere kan glide på.

Skæringspunktet mellem alle tre kurver er markeret med B i figur 2. Ved det tryk og den temperatur, som dette punkt repræsenterer, eksisterer alle tre faser af vand i ligevægt. Dette temperatur- og trykdatapar kaldes tripelpunktet. Ved tryk lavere end tripelpunktet kan vand ikke eksistere som væske, uanset temperaturen.
Eksempel 1
Bestemmelse af vandets tilstand
Bestem vandets tilstand ved følgende temperaturer og tryk ved hjælp af fasediagrammet for vand i figur 2:
(a) -10 °C og 50 kPa
(b) 25 °C og 90 kPa
(c) 50 °C og 40 kPa
(d) 80 °C og 5 kPa
(e) -10 °C og 0.3 kPa
(f) 50 °C og 0,3 kPa
Løsning
Ved hjælp af fasediagrammet for vand kan vi bestemme, at vandets tilstand ved hver given temperatur og tryk er som følger: (a) fast stof; (b) flydende; (c) flydende; (d) gas; (e) fast stof; (f) gas.
Tjek din læring
Hvilke faseændringer kan vand undergå som følge af temperaturændringer, hvis trykket holdes på 0,3 kPa? Hvis trykket holdes på 50 kPa?
Svar:
Ved 0,3 kPa: \text{s}\;{\longrightarrow}\;\text{g} ved -58 °C. Ved 50 kPa: \text{s}\\;{\longrightarrow}\;\text{l} ved 0 °C, \text{l}\;{\longrightarrow}\;\text{g} ved 78 °C
Skønn fasediagrammet for kuldioxid, som er vist i figur 5, som et andet eksempel. Fast-væske-kurven viser en positiv hældning, hvilket indikerer, at smeltepunktet for CO2 stiger med trykket, som det er tilfældet for de fleste stoffer (vand er en bemærkelsesværdig undtagelse, som tidligere beskrevet). Bemærk, at tripelpunktet ligger et godt stykke over 1 atm, hvilket indikerer, at kuldioxid ikke kan eksistere som væske under omgivende trykforhold. I stedet resulterer afkøling af gasformig kuldioxid ved 1 atm i, at den aflejres i fast tilstand. På samme måde smelter fast kuldioxid ikke ved et tryk på 1 atm, men sublimerer i stedet og giver gasformigt CO2. Endelig skal det bemærkes, at det kritiske punkt for kuldioxid observeres ved en relativt beskeden temperatur og et relativt beskedent tryk sammenlignet med vand.
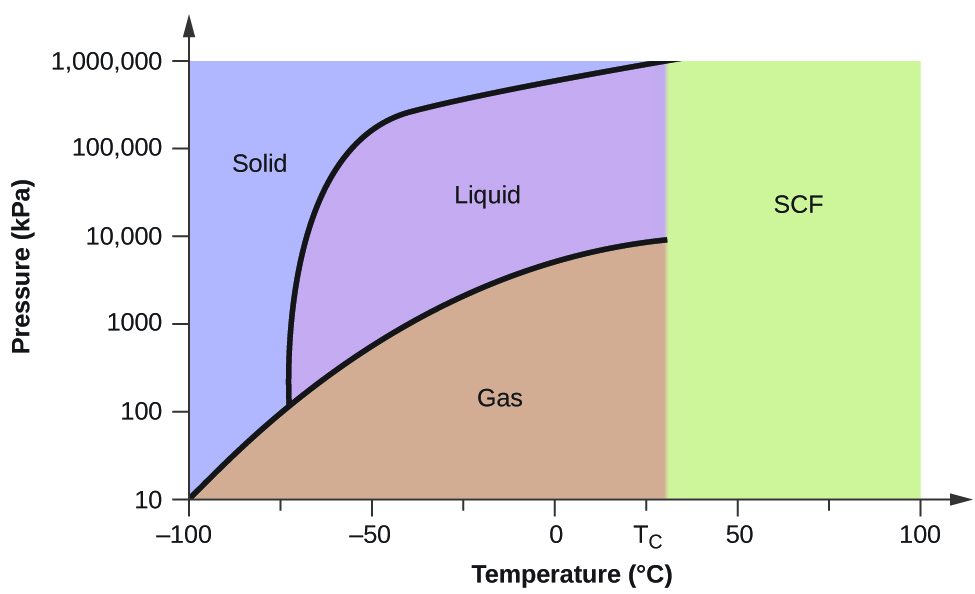
Eksempel 2
Bestemmelse af kuldioxidens tilstand
Bestemm CO2’s tilstand ved følgende temperaturer og tryk ved hjælp af fasediagrammet for kuldioxid, som er vist i figur 5:
(a) -30 °C og 2000 kPa
(b) -60 °C og 1000 kPa
(c) -60 °C og 100 kPa
(d) 20 °C og 1500 kPa
(e) 0 °C og 100 kPa
(f) 20 °C og 100 kPa
Løsning
Med anvendelse af det medfølgende fasediagram for kuldioxid, kan vi bestemme, at tilstanden af CO2 ved hver temperatur og tryk er som følger: (a) flydende; (b) fast stof; (c) gas; (d) flydende; (e) gas; (f) gas.
Check Your Learning
Bestem de faseændringer, som kuldioxid undergår, når dets temperatur varieres, hvorved dets tryk holdes konstant på 1500 kPa? Ved 500 kPa? Ved hvilke omtrentlige temperaturer sker disse faseændringer?
Svar:
ved 1500 kPa: \text{s}\\;{\longrightarrow}\;\text{l} ved -45 °C, \text{l}\;{\longrightarrow}\;\text{g} ved -10 °C;
ved 500 kPa: \text{s}\;{\longrightarrow}\;\text{g} ved -58 °C
Hvis vi placerer en vandprøve i en forseglet beholder ved 25 °C, fjerner luften og lader fordampnings- og kondensationsligevægten etablere sig, står vi tilbage med en blanding af flydende vand og vanddamp ved et tryk på 0,03 atm. Der kan tydeligt ses en tydelig grænse mellem den mere tætte væske og den mindre tætte gas. Når temperaturen øges, stiger vanddampens tryk, som beskrevet af væske-gas-kurven i fasediagrammet for vand (figur 2), og der er fortsat en tofaset ligevægt mellem flydende og gasformig fase. Ved en temperatur på 374 °C er damptrykket steget til 218 atm, og enhver yderligere temperaturstigning resulterer i, at grænsen mellem væske- og dampfasen forsvinder. Alt vandet i beholderen er nu til stede i en enkelt fase, hvis fysiske egenskaber ligger mellem den gasformige og den flydende tilstand. Denne stoffase kaldes en superkritisk væske, og den temperatur og det tryk, over hvilke denne fase eksisterer, er det kritiske punkt (figur 6). Over den kritiske temperatur kan en gas ikke gøres flydende, uanset hvor stort et tryk der påføres den. Det tryk, der kræves for at gøre en gas flydende ved dens kritiske temperatur, kaldes det kritiske tryk. De kritiske temperaturer og kritiske tryk for nogle almindelige stoffer er angivet i tabel 6.
| Stof | Kritisk temperatur (K) | Kritisk tryk (atm) | |
|---|---|---|---|
| Vandstof | 33.2 | 12,8 | |
| kvælstof | 126,0 | 33,5 | |
| syresyre | 154.3 | 49,7 | |
| carbondioxid | 304,2 | 73,0 | |
| ammoniak | 405,5 | 111,5 | |
| svovldioxid | 430.3 | 77,7 | |
| vand | 647,1 | 217,7 | |
| Tabel 6. | |||

Oplev overgangen fra flydende til superkritisk væske for kuldioxid.
Som en gas vil en superkritisk væske udvide sig og fylde en beholder, men dens massefylde er meget større end typiske gasdensiteter og ligger typisk tæt på massefylden for væsker. I lighed med væsker er disse væsker i stand til at opløse ikke-flygtige opløsningsstoffer. De udviser imidlertid stort set ingen overfladespænding og meget lave viskositeter, så de kan mere effektivt trænge ind i meget små åbninger i en fast blanding og fjerne opløselige komponenter. Disse egenskaber gør superkritiske væsker til yderst nyttige opløsningsmidler til en lang række anvendelsesformål. F.eks. er superkritisk kuldioxid blevet et meget populært opløsningsmiddel i fødevareindustrien, hvor det bruges til at fjerne koffein fra kaffe, fjerne fedt fra kartoffelchips og ekstrahere smags- og duftstoffer fra citrusolier. Det er ugiftigt, relativt billigt og anses ikke for at være et forurenende stof. Efter brug kan CO2 let genvindes ved at reducere trykket og opsamle den resulterende gas.
Eksempel 3
Koldioxidens kritiske temperatur
Hvis vi ryster en kuldioxidbrandslukker på en kølig dag (18 °C), kan vi høre flydende CO2 skvulpe rundt inde i flasken. Den samme flaske synes imidlertid ikke at indeholde nogen væske på en varm sommerdag (35 °C). Forklar disse observationer.
Løsning
På den kølige dag er CO2’s temperatur under CO2’s kritiske temperatur, 304 K eller 31 °C (tabel 6), så der er flydende CO2 i cylinderen. På den varme dag er CO2’s temperatur højere end dens kritiske temperatur på 31 °C. Over denne temperatur kan ingen mængde tryk gøre CO2 flydende, så der findes ikke flydende CO2 i brandslukkeren.
Kontroller din læring
Ammoniak kan gøres flydende ved kompression ved stuetemperatur; ilt kan ikke gøres flydende under disse betingelser. Hvorfor opfører de to gasser sig forskelligt?
Svar:
Den kritiske temperatur for ammoniak er 405,5 K, hvilket er højere end stuetemperaturen. Den kritiske temperatur for ilt er under stuetemperatur; ilt kan derfor ikke gøres flydende ved stuetemperatur.
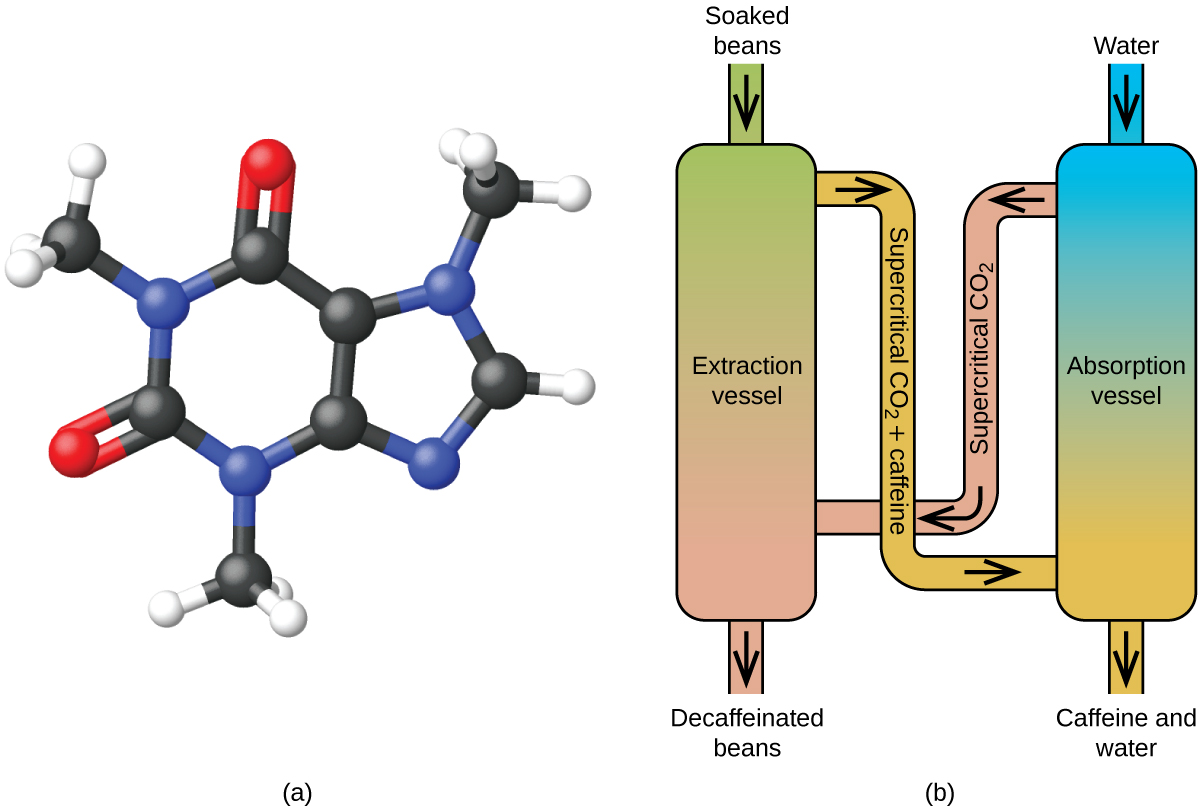
Dekoffeinering af kaffe ved hjælp af superkritisk CO2
Koffe er verdens næstmest handlede råvare, kun overgået af olie. Over hele verden elsker folk kaffens aroma og smag. Mange af os er også afhængige af en af kaffens bestanddele, nemlig koffein, for at komme i gang om morgenen eller holde os vågne om eftermiddagen. Men sidst på dagen kan kaffens stimulerende virkning forhindre dig i at sove, så du kan vælge at drikke koffeinfri kaffe om aftenen.
Siden begyndelsen af 1900-tallet er der blevet brugt mange metoder til at koffeinfri kaffe. Alle har fordele og ulemper, og alle er afhængige af koffeinets fysiske og kemiske egenskaber. Da koffein er et noget polært molekyle, opløses det godt i vand, som er en polær væske. Men da mange af de mere end 400 andre forbindelser, der bidrager til kaffens smag og aroma, også opløses i H2O, kan afkoffeineringsprocesser med varmt vand også fjerne nogle af disse forbindelser og dermed påvirke lugten og smagen af den koffeinfri kaffe negativt. Dichlormethan (CH2Cl2) og ethylacetat (CH3CO2C2H5) har samme polaritet som koffein og er derfor meget effektive opløsningsmidler til ekstraktion af koffein, men begge fjerner også nogle smags- og aromakomponenter, og deres anvendelse kræver lang ekstraktions- og rengøringstid. Da begge disse opløsningsmidler er giftige, er der blevet rejst sundhedsmæssige betænkeligheder med hensyn til virkningen af de resterende opløsningsmidler i den koffeinfri kaffe.
Superkritisk væskeekstraktion med kuldioxid anvendes nu i vid udstrækning som en mere effektiv og miljøvenlig metode til dekoffeinering (figur 7). Ved temperaturer over 304,2 K og tryk over 7376 kPa er CO2 en superkritisk væske, der har egenskaber som både gas og væske. Som en gas trænger det dybt ind i kaffebønnerne, og som en væske opløser det effektivt visse stoffer. Ved superkritisk kuldioxidekstraktion af dampede kaffebønner fjernes 97-99 % af koffeinen, mens kaffens smag og aromaforbindelser forbliver intakte. Da CO2 er en gas under standardbetingelser, er det let at fjerne den fra de ekstraherede kaffebønner, og det samme gælder for genvinding af koffeinen fra ekstraktet. Koffein, der genvindes fra kaffebønner ved hjælp af denne proces, er et værdifuldt produkt, som efterfølgende kan anvendes som tilsætningsstof til andre fødevarer eller lægemidler.
Nøglebegreber og resumé
De temperatur- og trykforhold, ved hvilke et stof eksisterer i fast, flydende og gasformig tilstand, er sammenfattet i et fasediagram for det pågældende stof. Fasediagrammer er kombinerede plotter af tre tryk-temperatur-ligevægtskurver: fast-væske, flydende-gas og fast-gas. Disse kurver viser forholdet mellem faseovergangstemperaturer og tryk. Skæringspunktet mellem alle tre kurver repræsenterer stoffets tripelpunkt – den temperatur og det tryk, hvor alle tre faser er i ligevægt. Ved tryk under tripelpunktet kan et stof ikke eksistere i flydende tilstand, uanset dets temperatur. Slutpunktet af væske-gas-kurven repræsenterer stoffets kritiske punkt, dvs. det tryk og den temperatur, over hvilke der ikke kan eksistere en flydende fase.
Kemi Opgaver til slutningen af kapitlet
- Bestem ud fra fasediagrammet for vand (figur 2) vandets tilstand ved:
(a) 35 °C og 85 kPa
(b) -15 °C og 40 kPa
(c) -15 °C og 0.1 kPa
(d) 75 °C og 3 kPa
(e) 40 °C og 0,1 kPa
(f) 60 °C og 50 kPa
- Hvilke faseændringer vil der finde sted, når vand udsættes for varierende tryk ved en konstant temperatur på 0,005 °C? Ved 40 °C? Ved -40 °C?
- Med trykkogere kan maden tilberedes hurtigere, fordi det højere tryk i trykkogeren øger vandets kogepunktstemperatur. En bestemt trykkoger har en sikkerhedsventil, der er indstillet til at lufte damp ud, hvis trykket overstiger 3,4 atm. Hvad er den omtrentlige maksimale temperatur, der kan opnås i denne trykkoger? Gør rede for din begrundelse.
- Bestem ud fra fasediagrammet for kuldioxid i figur 5, hvilken tilstand CO2 har ved:
(a) 20 °C og 1000 kPa
(b) 10 °C og 2000 kPa
(c) 10 °C og 100 kPa
(d) -40 °C og 500 kPa
(e) -80 °C og 1500 kPa
(f) -80 °C og 10 kPa
- Bestem de faseændringer, som kuldioxid gennemgår, når trykket ændres, hvis temperaturen holdes på -50 °C? Hvis temperaturen holdes ved -40 °C? Ved 20 °C? (Se fasediagrammet i figur 5.)
- Opnå en cylinder med en blanding af flydende kuldioxid i ligevægt med gasformig kuldioxid ved et begyndelsestryk på 65 atm og en temperatur på 20 °C. Skitsér et plot, der viser ændringen i cylinderens tryk med tiden, når gasformig kuldioxid frigives ved konstant temperatur.
- Tøris, CO2(s), smelter ikke ved atmosfærisk tryk. Den sublimerer ved en temperatur på -78 °C. Hvad er det laveste tryk, ved hvilket CO2(s) vil smelte til CO2(l)? Ved hvilken temperatur vil dette omtrent ske? (Se figur 5 for fasediagrammet.)
- Hvis en voldsom storm resulterer i tab af elektricitet, kan det være nødvendigt at bruge en tørresnor til at tørre vasketøj. I mange dele af landet midt om vinteren vil tøjet hurtigt fryse, når det hænges på snoren. Hvis det ikke sner, vil det så alligevel tørre? Gør rede for dit svar.
- Er det muligt at gøre nitrogen flydende ved stuetemperatur (ca. 25 °C)? Er det muligt at gøre svovldioxid flydende ved stuetemperatur? Forklar dine svar.
- Elementært kulstof har en gasfase, en flydende fase og to forskellige faste faser, som vist i fasediagrammet:
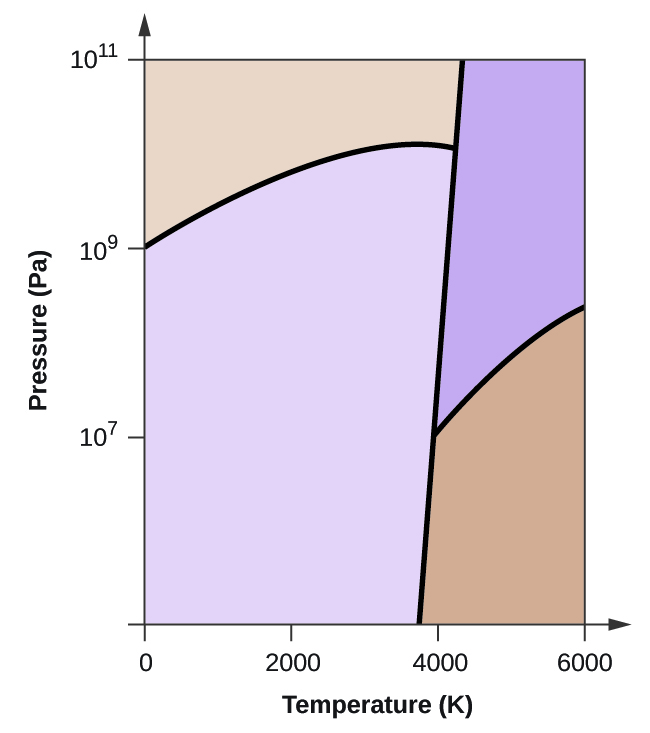
(a) Mærk gas- og væskeområderne på fasediagrammet.
(b) Grafit er den mest stabile fase af kulstof under normale forhold. På fasediagrammet mærkes grafitfasen.
(c) Hvis grafit under normale forhold opvarmes til 2500 K, mens trykket øges til 1010 Pa, omdannes det til diamant. Mærk diamantfasen.
(d) Indkreds hvert tripelpunkt på fasediagrammet.
(e) I hvilken fase findes kulstof ved 5000 K og 108 Pa?
(f) Hvis temperaturen i en prøve af kulstof stiger fra 3000 K til 5000 K ved et konstant tryk på 106 Pa, hvilken faseovergang sker der så i givet fald?
Glossar
kritisk punkt temperatur og tryk, over hvilket en gas ikke kan kondenseres til en væske fasediagram tryk-temperatur graf, der opsummerer de betingelser, under hvilke faserne i et stof kan eksistere superkritisk flydende stof ved en temperatur og et tryk, der er højere end dets kritiske punkt; har egenskaber, der ligger mellem egenskaberne for gasformig og flydende tilstand tripelpunkt temperatur og tryk, hvor et stofs damp-, væske- og fastfase er i ligevægt
Løsninger
Svar på kemiøvelser i slutningen af kapitlet
2. Ved lavt tryk og 0,005 °C er vandet en gas. Når trykket stiger til 4,6 torr, bliver vandet til et fast stof; når trykket stiger endnu mere, bliver det til en væske. Ved 40 °C er vand ved lavt tryk en damp; ved tryk højere end ca. 75 torr bliver det til en væske. Ved -40 °C går vand fra en gas til et fast stof, når trykket stiger over meget lave værdier.
4. (a) væske; (b) fast stof; (c) gas; (d) gas; (e) gas; (f) gas
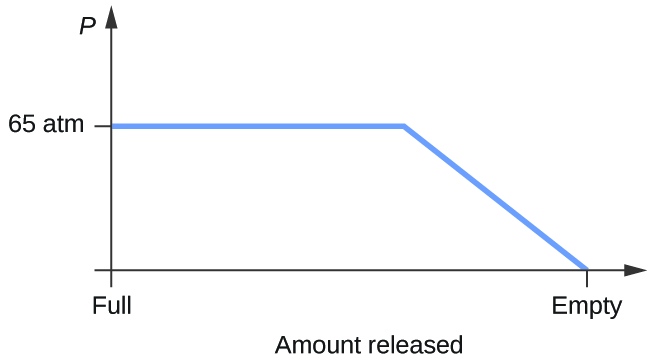
8. Ja, is vil sublimeres, selv om det kan tage flere dage. Is har et lille damptryk, og nogle ismolekyler danner gas og undslipper fra iskrystallerne. Efterhånden som tiden går, bliver mere og mere fast stof omdannet til gas, indtil tøjet til sidst er tørt.
10. (a)
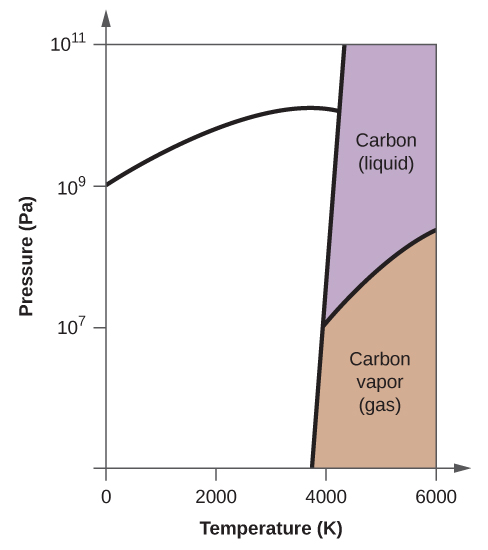
(b)
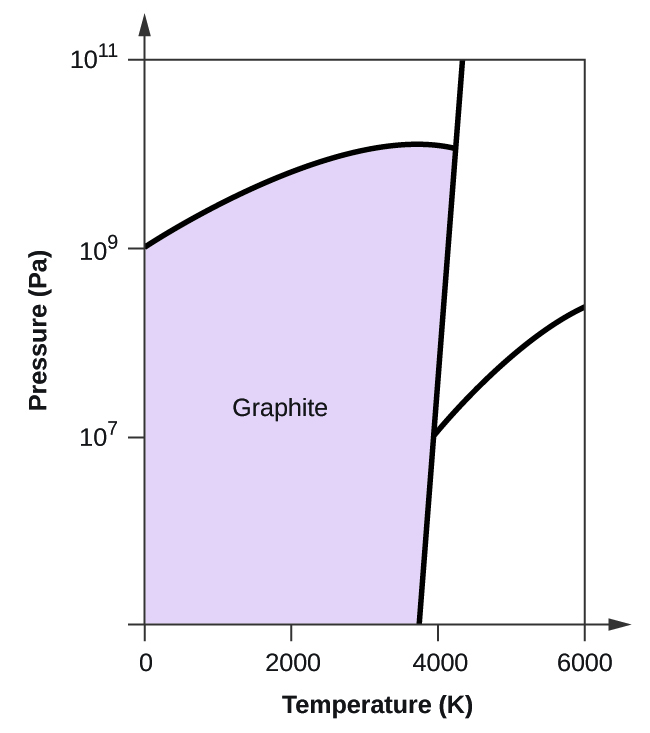
(c)
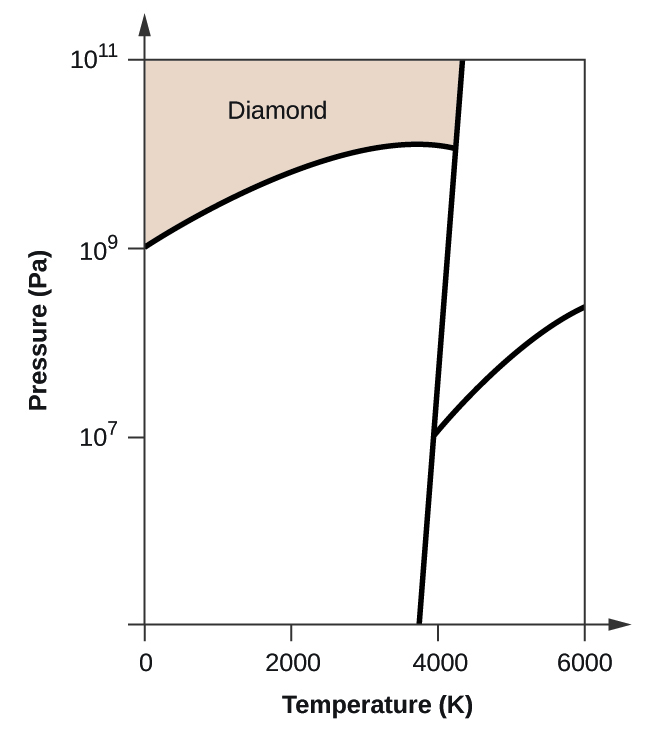
(d)
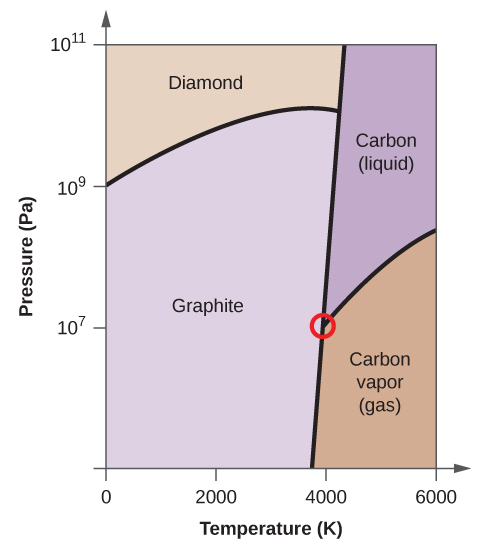
(e) flydende fase (f) sublimering
