En betydande andel nyfödda utvecklar hyperbilirubinemi som kräver behandling (”signifikant” hyperbilirubinemi, SHB) under den första levnadsveckan. En minskning av längden på sjukhusvistelsen vid födseln har tidsmässigt förknippats med en ökad förekomst av bilirubininducerade neurologiska skador . Hälsovårdspersonalens hembesök efter utskrivningen eller familjens sjukhusbesök kan upptäcka SHB, men är inte allmänt genomförbara eller kostnadseffektiva. Innan nyfödda barn skrivs ut från förlossningssjukhuset måste därför de som löper risk att utveckla höga bilirubinnivåer identifieras
En objektiv bedömning före utskrivningen av risken för att utveckla SHB är också viktig eftersom den visuella bedömningen av gulsotens omfattning har begränsad noggrannhet . Riskstratifiering för SHB har gjorts genom att mäta bilirubinbelastning (absoluta nivåer eller ökningstakt av serumbilirubin eller transkutant bilirubin), bilirubinproduktion (utandad kolmonoxid) och identifiering av underliggande kliniska riskfaktorer .
Koncentrationen av bilirubin i perifert blod är en funktion av åldersspecifika hastigheter för bilirubinproduktion, metabolism, utsöndring och reabsorption. Därför baseras tolkningen av bilirubinnivån hos ett nyfött barn på postnatal ålder. Ett timmespecifikt bilirubin-nomogram som utvecklats av Bhutani m.fl. har visat att mätning av serumbilirubin (STB) före utskrivning från förlossningssjukhuset kan hjälpa till att identifiera nyfödda barn som löper risk att få högre percentilvärden av STB under uppföljningen. Bland olika metoder för riskprognostisering har mätning av STB före utskrivningen visat sig ha den bästa diskriminerande förmågan hos nordamerikanska nyfödda barn. På grund av genetiskt betingade skillnader i bilirubinmetabolismen och olikheter i utfodringspraxis kan det kliniska förloppet av hyperbilirubinemi dock variera hos nyfödda som tillhör olika etniciteter eller geografiska platser. Dessutom utvecklades det tidigare nomogrammet från en retrospektiv kohort där informationen om utfallet av betydande hyperbilirubinemi endast var känd för en femtedel av studiepopulationen . Därför är det nödvändigt att konstruera ett timspecifikt bilirubin-nomogram i olika neonatala populationer för att kunna använda bilirubinmätning före utskrivning som en riskbedömningsstrategi.
Vi planerade denna prospektiva kohortstudie för att konstruera timmespecifikt serum totalbilirubin-nomogram hos indiska nyfödda och för att utvärdera effektiviteten av bilirubinmätning före utskrivningen för att förutsäga hyperbilirubinemi som kräver behandling bland termins- och sent prematurfödda nyfödda.
Metoder
Denna prospektiva kohortstudie med utvärdering av diagnostisk testprestanda genomfördes från februari till juni 2010 vid ett undervisningssjukhus i norra Indien. Studieprotokollet godkändes av sjukhusets etiska kommitté och skriftligt informerat samtycke inhämtades från föräldrarna. Friska nyfödda med graviditet ≥35 veckor eller födelsevikt ≥2000 g var berättigade att delta i studien. Av logistiska skäl var nyfödda som fullbordade 24 timmars liv på söndag inte berättigade att delta i studien. Neonatala barn med större medfödda missbildningar, intagning på neonatal intensivvårdsavdelning, positivt direkt Coombs-test (gjordes om moderns blodgrupp var Rhesus-negativ), fototerapi före den första bilirubinmätningen eller oförmåga att komma för uppföljning uteslöts.
Studiemätningar och uppföljning: Blodprov för den första mätningen av serumtotalbilirubin togs vid tidpunkten för metabolisk screening vid 18-30 timmars postnatal ålder. Kapillärt eller perifert venöst blod samlades in i förhepariniserade mikrokapillärer. Blodet centrifugerades omedelbart vid 12 000 rpm i 5 minuter och totalbilirubin mättes med en spektrofotometer (NEO-BIL plus, das srl, Italien).
Neonaten följdes upp under sjukhusvistelsen och efter utskrivningen till slutet av den sjunde postnatala dagen. Tidpunkten för uppföljningsbesöket bestämdes utifrån åldern vid utskrivningen. Spädbarn som skrevs ut före 48 timmars ålder kallades tillbaka mellan 72 och 96 timmars ålder och spädbarn som skrevs ut efter 48 timmars ålder vid 96 till 120 timmars ålder. Utöver den första mätningen av STB vid tidpunkten för metabolisk screening utfördes ytterligare två STB-mätningar på varje nyfött barn. Efter den första mätningen baserades beslutet att utföra den andra och tredje STB-mätningen på en klinisk bedömning. Den kliniska bedömningen av graden av gulsot åtföljdes av transkutan bilirubinmätning (TcB) med en transkutan bilimeter med flera våglängder (BiliChek, variationskoefficient <5 %). STB-skattning gjordes om handflator/sulor var färgade av ikterus eller TcB var >12 mg/dL eller inom 80 % av den åldersspecifika fototerapitröskeln. Om det inte var kliniskt indikerat gjordes en andra och tredje STB-mätning vid 72-96 timmar respektive 96-144 timmars postnatal ålder. STB-värden efter påbörjad fototerapi ingick inte i konstruktionen av nomogrammet.
Kliniska och epidemiologiska riskfaktorer som kan påverka risken för att utveckla SHB registrerades. Följande uppgifter registrerades: födelsevikt, graviditet, kön, moderns utbildning och religion, paritet, antenatala komplikationer, moderns ABO- och Rh-blodgrupp, förlossningssätt, typ av anestesi som användes under förlossningen och användning av oxytocininfusion under förlossningen. Dessutom noterades ålder vid början av utfodring, kompletterande utfodring (annan än amning eller bröstmjölk) under och efter de första 24 timmarna efter födseln och ålder vid första avföring.
Resultat: Huvudresultatet var signifikant hyperbilirubinemi (SHB) som definierades som behov av fototerapi eller utbytestransfusion för behandling av hyperbilirubinemi. Beslutet att starta fototerapi fattades på grundval av barnets ålder i timmar och STB-nivåer, enligt lokal anpassning av American Academy of Pediatrics (AAP) riktlinjer . För nyfödda som föddes vid 38 eller fler graviditetsveckor användes tröskelvärdet för medelrisk och för nyfödda som föddes vid 37 eller färre avslutade graviditetsveckor användes tröskelvärdet för högre risk för att påbörja fototerapi. Tröskelvärdena för medelrisk i AAP:s riktlinjer är nästan identiska med 95
:e percentilvärdet i Bhutani-nomogrammet .
Statistisk analys: I en prospektiv studie observerades signifikant hyperbilirubinemi hos 10 % av de nyfödda som föddes vid ≥35 veckors graviditet . För att undersöka ett diagnostiskt test med en känslighet på minst 95 % (konfidensintervall 5 %) och ett alfavärde på 0,05 behövde vi registrera cirka 1 000 personer .
Data analyserades med hjälp av Stata 9 (StataCorp, College Station, TX, USA). För konstruktion av nomogrammet klubbades STB-värden i sextimmarsepoker (ålder ± 3 timmar) för postnatal ålder upp till 48 timmar och tolvtimmarsepoker (ålder ± 6 timmar) för ålder efter 48 timmar. Data för varje epok undersöktes för symmetri. De 5
:e, 10:e, 25:e, 40:e, 75:e, 90:e och 95:e percentilvärdena beräknades för varje epok. Microsoft Excel (Microsoft Corporation, Richmond, USA) användes för att plotta det timspecifika bilirubin-nomogrammet. Det utjämnade nomogrammet med 40:e, 75:e och 95:e percentilen ritades upp med hjälp av cubic spine-modellering med GAMLSS-paketet för den statistiska programvaran R. Efter utjämning låg 36,5 % av fallen under den 40:e percentillinjen, 77,8 % under den 75:e percentillinjen och 95,1 % under den 95:e percentillinjen. Nomogrammets prediktiva förmåga bedömdes genom att beräkna sensitivitet, specificitet, positivt prediktivt värde, negativt prediktivt värde och sannolikhetskvot, genom att plotta ROC-kurvan (receiver-operating characteristics) och beräkna c-statistik.
Resultat
Under studieperioden föddes totalt 1255 nyfödda barn varav 1090 var berättigade till registrering. Av dessa uteslöts 93 av olika skäl (fig. 1). Totalt 997 nyfödda barn skrevs in i studien. Medelvärdet ± SD-värdet för födelsevikten var 2627±536 g och för dräktighetsåldern 37,8±1,5 veckor (median och IQR: 38 och 37-39) (webbtabell I). De flesta av studiens barn föddes efter ett okomplicerat antenatalt förlopp och hade en händelselös övergång till livet utanför livmodern. Mer än 80 % av nyfödda barn ammades uteslutande under sjukhusvistelsen.
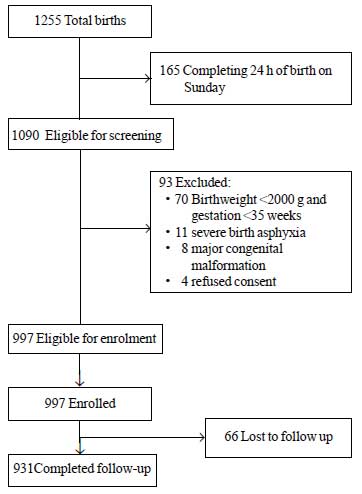
Fig.1 Studieflöde.
Konstruktion av bilirubin-nomogram: Första mätningen av bilirubin utfördes vid 23,3±6,3 timmars ålder och genomsnittlig STB var 7,0±2,0 mg/dL. Tjugonio (2,9 %) nyfödda behövde fototerapi baserat på den första mätningen av bilirubin. Hos dessa nyfödda påbörjades fototerapi vid 27±5,6 timmars ålder med STB-nivåer på 12,3±2,0 mg/dl. Sextiosex (6,6 %) nyfödda förlorade sin uppföljning efter utskrivning från studiens sjukhus. Första bilirubinvärdet hos dessa nyfödda var jämförbart med nyfödda som aldrig utvecklade SHB (6,5±1,9 vs 6,7±1,7 mg/dL, P=0,54) och var signifikant lägre än de som utvecklade SHB (6,5±1,9 vs 8,5±2,2 mg/dL, P< 0,001).
För att konstruera nomogrammet och bedöma fördelningen av STB-värdena delades den postnatala åldern in i sextimmarsepoker för postnatal ålder upp till 48 timmar och tolvtimmarsepoker för ålder bortom 48 timmar. STB vid var och en av epokerna utom vid 42 timmar observerades vara symmetriskt fördelad (fig. 2). Fördelningen av STB-värdena vid 42 timmar observerades vara positivt skev och dessa värden användes inte för att konstruera nomogrammet.
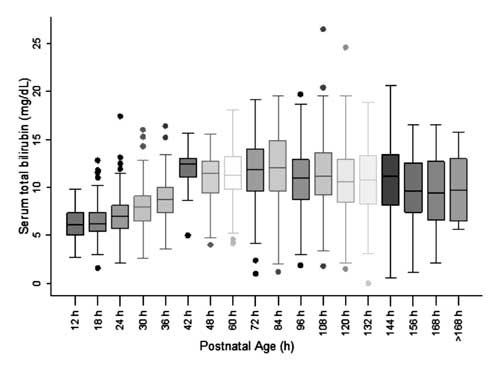
Fig. 2 Box-whisker-plot som visar fördelningen av serumbilirubin totalt.
Den 5
:e, 10:e, 25:e, 40:e, 75:e, 90:e och 95:e percentilen för varje epok beräknades. Ett åldersspecifikt nomogram för serumbilirubin ritades med 40:e, 75:e och 95:e percentilvärden vid stigande postnatal ålder (fig. 3)
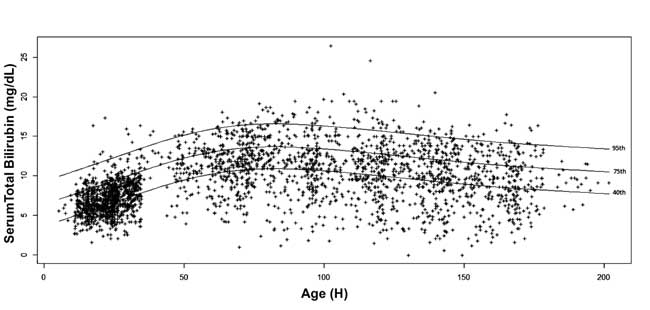
Fig. 3 Bilirubin nomogram – timspecifikt serum totalbilirubin avbildat som 40:e, 75:e och 95:e percentiler.
Prediktiv förmåga av STB före utskrivning: Totalt utvecklade 199 (20 %) nyfödda barn SHB (fick fototerapi). Första bilirubinvärdet användes för att förutsäga senare behov av behandling för hyperbilirubinemi. Om mer än två värden erhölls under de första 48 timmarna efter födseln användes det högre percentilvärdet för förutsägelse.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Totalbilirubin i serum före utskrivning | Resultat | Testprestanda | ||||||
| Percentil | Antal(n=928) | SHB+ | SHB- | PPV | NPV | Känslighet | Specificitet | |
| Över 95:e percentilen | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 | |
| Under 95:e percentilen | 879 | 165 | 714 | |||||
| Över 75:e percentilen | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 | |
| Under 75:e percentilen | 689 | 92 | 597 | |||||
| Över 40:e percentilen | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 | |
| Under 40:e percentilen | 342 | 32 | 310 | |||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
||||||||
Av nyfödda som hade pre-STB-mätning före utskrivning och avslutad uppföljning (n=928), i 49 (5.3 %) neonater före utskrivning var STB mer än 95:e percentilen i den åldersspecifika fördelningen (tabell I). Av dessa 34 nyfödda behövde senare fototerapi (positivt prediktivt värde: 69,4 %, känslighet: 17,1 %). Hos 342 (36,8 %) nyfödda var STB före utskrivningen lägre än 40:e percentilen i den åldersspecifika fördelningen. Av dessa behövde 310 neonater inte efterföljande behandling för hyperbilirubinemi (negativt prediktivt värde: 90,6 % och specificitet: 42,5 %). Positivt prediktivt värde för 75:e percentilgränsen var 44,8 % och negativt prediktivt värde var 86,2 %. ROC-kurvan som visas i figur 4 illustrerar den diagnostiska prestandan för varje percentilavgränsning med en yta under kurvan (c-statistik) på 0,73.
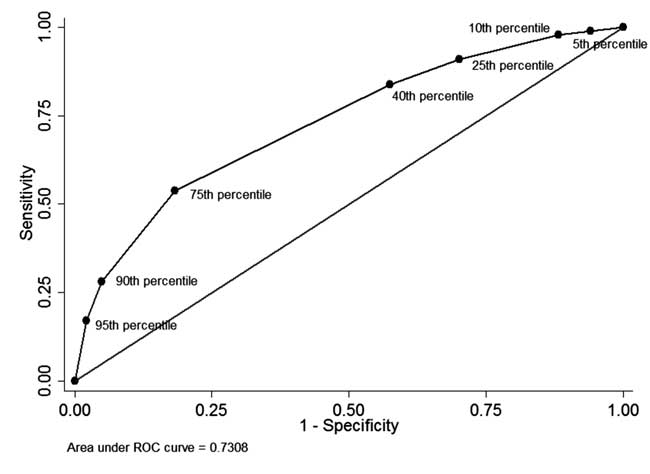
Fig. 4 ROC-kurvan för den diagnostiska förmågan hos olika percentilgränser för serum totalbilirubin före utskrivning.
Sannolikhetskvoten (LR) är ett bättre verktyg för att mäta diagnostisk testprestanda, eftersom kvoten inte påverkas av förändringar i bakgrundsprevalensen av resultatet. LR för positivt test (LR+, sannolikhet för positivt test hos sjuka/ sannolikhet för positivt test hos icke-sjuka) beräknades för varje riskavgränsningszon. STB före utskrivning på ≥95:e percentilen tilldelades högriskzonen, mellan 75:e och 94:e percentilen i övre-intermediär riskzon, mellan 40:e och 74:e percentilen i lägre-intermediär riskzon och under 40:e percentilen i lågriskzonen. Av 49 nyfödda barn i högriskzonen utvecklade 34 SHB; därför var positiv LR för STB i högriskzonen 8,26 (tabell II). Bland 190 nyfödda barn i övre-intermediär riskzon utvecklade 73 barn SHB, varför den positiva LR för STB i denna riskzon var 2,30. På samma sätt var den positiva LR för STB i den lägre-intermediära riskzonen 0,76 och för lågriskzonen 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Totalbilirubin i serum före utskrivning | Testprestanda | ||||||||
| Pre-utskrivning kumulativ riskzon | Percentil | Total | SHB+ | SHB- | P:A ratio | Sannolikhet för sjukdom | LR+ | ||
| Hög risk | ≥95th | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 | ||
| Övre medelnivå | 75 till 94 | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 | ||
| Mindre medelnivå | 40:e till 74:e | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 | ||
| Låg risk | <40th | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 | ||
| 928 | 199 | 729 | 1:4 | 1/5 | |||||
| SHB: signifikant hyperbilirubinemi; P:A-kvot: Presence of outcome : Absence of outcome. | |||||||||
Diskussion
Riskbedömning före utskrivning för senare utveckling av SHB rekommenderas som en potentiell strategi för att minska förekomsten av bilirubininducerad neurologisk skada eller kernicterus. I denna prospektiva kohortstudie har vi konstruerat ett timmespecifikt nomogram för serumbilirubin hos en delmängd nordindiska nyfödda barn och utvärderat effektiviteten av riskavgränsning genom mätning av serumbilirubin före utskrivningen för att förutsäga det efterföljande behovet av fototerapi (SHB). Baslinjeincidensen av SHB var hög i vår studiekohort med 2 av 10 nyfödda som utvecklade SHB. Placering av STB före utskrivning i två högre riskzoner ökade signifikant risken för efterföljande SHB med 7 av 10 nyfödda i högriskzonen som utvecklade SHB (positiv LR=8,26) och 4 av 10 nyfödda i högre-intermediär riskzon som utvecklade SHB (positiv LR=2,3). Placering av STB före utskrivningen i lågriskzonen minskade signifikant risken för efterföljande SHB med 1 av 10 nyfödda som utvecklade SHB (positiv LR = 0,37). Eftersom det negativa prediktiva värdet för gränsvärdet för låg risk endast var 90 %, kunde placering i lågriskzonen dock inte utesluta risken för efterföljande SHB.
Bhutani, et al. visade i en stor kohort att nyfödda med STB före utskrivning i hög- och högintermediära riskzoner har större sannolikhet att få SHB under uppföljningen. Författarna konstruerade percentildiagram för serumbilirubinnivån vid olika postnatala åldrar hos nära och terminerade nyfödda. De fann att 6,1 % av de nyfödda hade serumbilirubin före utskrivningen >95:e percentilen. 32,1 % av dessa spädbarn uppvisade senare hyperbilirubinemi. I jämförelse med Bhutani et al:s timmespecifika nomogram är percentilvärdena för STB i den här studien högre med upp till 2 mg/dl fram till 84-108 timmars postnatal ålder. Neonatala barn av nordindiskt ursprung har observerats uppnå högre bilirubinvärden och ha högre incidens av hyperbilirubinemi . Det genomsnittliga STB-värdet på 7,0±2,0 mg/dl som observerades i denna studie ligger mellan 75:e och 95:e percentilen i Bhutani-nomogrammet. På samma sätt rapporterade Agarwal, et al. en genomsnittlig STB på 5,9±1,8 mg/dl vid 24 timmars postnatal ålder, vilket ligger nära det 75:e percentilvärdet i Bhutani-nomogrammet. En högre andel för tidigt födda barn eller barn med låg födelsevikt och högre andel exklusiv amning i vår studie kan vara faktorer som bidrar till ökade STB-värden och ökad förekomst av SHB. Dessutom ökade vårt beslut att använda den mellersta i stället för den övre linjen i AAP:s tröskelvärden för fototerapi även hos neonatala lågriskbarn också förekomsten av SHB. Efter 108 timmars postnatal ålder är percentilvärdena för STB i denna studie lägre än motsvarande värden i Bhutani-nomogrammet. Inkludering av STB-värden från nyfödda som följdes upp selektivt enligt klinikerns bedömning för att konstruera nomogrammet kan ha resulterat i användning av högre STB-nivåer för att plotta Bhutani-nomogrammet, vilket minskar dess generaliserbarhet. I den aktuella studien, där uppföljningen avslutades oavsett svårighetsgrad av hyperbilirubinemi, når nomogrammet sin topp på fjärde och femte dagen efter födseln med en naturlig nedgång i slutet av den första veckan.
I en prospektiv kohortstudie mätte Agarwal, et al. STB vid 24±6 timmars ålder hos 220 nyfödda födda vid ≥35 veckors graviditet för att förutsäga hyperbilirubinemi . Avsaknad av STB >6 mg/dL vid 24±6 timmars ålder uteslöt praktiskt taget möjligheten av efterföljande SHB (sannolikhetskvot för negativt test 0,07) inom 5 dagar efter födseln. Selektiv mätning av utfallet hos endast de nyfödda som under uppföljningen hade en ”klinisk” bilirubinnivå på >10 mg/dL införde dock en verifieringsbias i studien. I en annan indisk studie visade sig ett gränsvärde på 3,99 mg/dl vid 18-24 timmar ha en sensitivitet och specificitet på 67 % vardera för att förutsäga en efterföljande bilirubinnivå >15 mg/dl . Fullständig uppföljning fanns dock endast hos de spädbarn som stannade kvar på sjukhuset antingen på grund av neonatal sjukdom eller av någon moderlig orsak, t.ex. kejsarsnitt. Mer än 50 % av de spädbarn som var friska och därför skrevs ut tidigt följdes inte upp. I en studie från Turkiet presenterades ett timspecifikt bilirubin-nomogram för nyfödda med en gestationsålder mellan 35 och 37 veckor. STB-värde mer än 95
th percentil hade ett högt positivt prediktivt värde för senare utveckling av SHB . STB-värde lägre än 30:e percentilen hade dock ett negativt prediktivt värde på cirka 90 %. Två stora retrospektiva studier har rapporterat en utmärkt prediktiv förmåga för tidig mätning av STB före utskrivningen med en area under kurvan (AUC) på 0,83 . I vår studie var den diskriminerande förmågan för 40:e och 75:e percentilvärdena lägre än de som tidigare rapporterats . Detta försköt ROC-kurvan i vår studie mot den diagonala linjen vilket resulterade i minskad diskrimineringsförmåga (AUC= 0,73). Den höga grundincidensen av SHB i Turkiet (25,3 %) och i vår studie (20 %) kan förklara oförmågan hos låga percentilvärden att utesluta utvecklingen av senare SHB, vilket begränsar nyttan av STB-mätning före utskrivningen.
En alternativ riskbedömningsstrategi för att förutsäga senare SHB är utvärdering av kliniska riskfaktorer. Graviditet vid födseln, historia av gulsot som behövde behandlas hos tidigare syskon, oxytocininfusion, instrumentell förlossning, förlossningstrauma och otillräcklig utfodring har angetts som riskfaktorer för SHB.
Diskrimineringsförmågan hos kliniska riskmodeller har dock rapporterats vara lägre än den hos tidig STB-mätning. Newman, et al. rapporterade att diskrimineringsförmågan förbättrades när ett kliniskt riskinstrument kombinerades med tidig STB-mätning . På grund av den betydande andelen nyfödda med låg födelsevikt och för tidigt födda barn i vår kohort spekulerar vi i att en kombination av dessa objektivt mätbara kliniska riskfaktorer med tidig STB-mätning skulle generera en riskmodell med förbättrad diskrimineringsförmåga.
Extern tillämplighet av de observationer som gjorts i studien kan påverkas av den relativt höga förekomsten av hyperbilirubinemi i studiekohorten på grund av användningen av lägre bilirubintrösklar för att påbörja fototerapi. I motsats till utvecklade länder har kernicterus rapporterats vid lägre nivåer av toppbilirubin i Indien, vilket tyder på att indiska nyfödda kan utveckla bilirubininducerad neurologisk skada vid lägre toppbilirubinnivåer i serum . Dessutom har ungefär en tredjedel av de nyfödda som föds i Indien låg födelsevikt. Av dessa skäl föreslår Indiens nationella neonatologiska forum i sina riktlinjer att man använder lägre tröskelvärden för att påbörja fototerapi, särskilt i områden med högre förekomst av glukos-6-fosfatdehydrogenasbrist .
Styrkorna i vår studie är bl.a. prospektiv studiedesign, stor urvalsstorlek, uppföljningsfrekvens på mer än 90 % och avsaknad av verifieringsbias. Vi kunde inte fastställa förekomsten av utfallet hos cirka 7 % av de inskrivna nyfödda barnen. Eftersom tidig STB och demografiska egenskaper hos dessa förlorade neonater liknade dem som aldrig utvecklade SHB, är det dock osannolikt att timspecifikt nomogram och riskbedömningsinstrument påverkas. Vi använde inte högpresterande vätskekromatografi (HPLC) som är den ”gyllene standarden” för mätning av bilirubin. Vi mätte bilirubin med en mer vanligt förekommande metod vid sängkanten, nämligen spektrofotometri. Den bilimeter som användes i vår studie hade låg variationskoefficient och den kalibrerades före varje användning.
Vi rekommenderar att som nyfödda med STB före utskrivning i hög eller högintermediär riskzon har hög sannolikhet att utveckla SHB tidigt och frekvent uppföljning bör säkerställas. I miljöer där nära uppföljning inte är möjlig kan man överväga att skjuta upp utskrivningen från sjukhuset tills bilirubinet sjunker till lägre riskzoner. Nyfödda barn med STB i lägre-intermediära eller låga riskområden före utskrivningen kan skrivas ut i enlighet med lokala riktlinjer. En adekvat uppföljning bör dock säkerställas eftersom senare utveckling av SHB inte kan uteslutas.
Till slut kan man konstatera att den högre uppföljningsnivån i vår studie, trots en rätt god särskiljningsförmåga, ökar förtroendet för förmågan att förutsäga SHB hos indiska spädbarn med hjälp av STB före utskrivningen. Ytterligare studier behövs för att validera prestandan hos de riskavgränsningszoner som definieras i detta timspecifika bilirubin-nomogram.
Medarbetare: DC: konceptualiserade och utformade studien; UP och SK: samlade in data; DC: analyserade data; UP: utarbetade artikeln med kritiska bidrag från DC, SK och SJ. Alla författare godkänner den slutliga versionen av manuskriptet för inlämning.
Finansiering: Inga; konkurrerande intressen: Inga angivna.
1. Rapport 2002-2003: National Neonatal Perinatal Database Network. New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. Identifiering av nyfödda med risk för farlig hyperbilirubinemi: nya kliniska insikter. Pediatr Clin North Am. 2009;56:671-87.
3. Hantering av hyperbilirubinemi hos det nyfödda spädbarnet 35 eller fler graviditetsveckor. Pediatrics. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Icke-invasiv uppskattning av totalt serumbilirubin genom spektralreflektion med flera våglängder hos nyfödda. Indian Pediatr. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Tidig neonatal hyperbilirubinemi med hjälp av första dagens serumbilirubinnivå. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Prediction of hyperbilirubinemia in near-term and term infants. Pediatrics 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Icke-invasiv mätning av totalt serumbilirubin i en multiracial nyfödd population före utskrivningen för att bedöma risken för allvarlig hyperbilirubinemi. Pediatrics. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Prediktiv förmåga hos ett timspecifikt serumbilirubin före utskrivningen för efterföljande betydande hyperbilirubinemi hos friska nyfödda som är födda efter terminen och nära födda. Pediatrics. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia. Pediatrics. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Systematisk genomgång av screening för bilirubinencefalopati hos nyfödda. Pediatrics. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Simple nomograms to calculate sample size in diagnostic studies. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Bilirubinscreening för normala nyfödda: en kritik av det timspecifika bilirubin-nomogrammet. Pediatrics. 2009;124:1203-5.
13. Awasthi S, Rehman H. Early prediction of neonatal hyperbilirubinemia. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidence, course, and prediction of hyperbilirubinemia in near-term and term newborns. Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identifiering av nyfödda barn med risk för betydande hyperbilirubinemi: en jämförelse av två rekommenderade metoder. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Kombination av kliniska riskfaktorer med serumbilirubinnivåer för att förutsäga hyperbilirubinemi hos nyfödda barn. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Förutsägelse och förebyggande av extrem neonatal hyperbilirubinemi i en mogen hälsovårdsorganisation. Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. En jämförelse av alternativa riskbedömningsstrategier för att förutsäga betydande neonatal hyperbilirubinemi hos spädbarn som fötts till terminen och spädbarn som fötts nära terminen. Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Riskfaktorer för kernicterus hos spädbarn med icke hemolytisk gulsot. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Brainstem auditory evoked response hos nyfödda barn med hyperbilirubinemi. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidensbaserade riktlinjer för klinisk praxis. National Neonatology Forum of India, New Delhi, Indien, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Preliminär rapport om neonatal screening för medfödd hypotyreos, medfödd binjurehyperplasi och glukos-6-fosfatdehydrogenasbrist: en erfarenhet från Chandigarh. Indian J Pediatr. 2010;77:969-73.
