Een significant deel van de neonaten ontwikkelt tijdens de eerste levensweek hyperbilirubinemie die behandeld moet worden (‘significante’ hyperbilirubinemie, SHB). Afname van de duur van de ziekenhuisopname bij de geboorte is tijdelijk geassocieerd met een verhoogde incidentie van door bilirubine veroorzaakte neurologische schade. Huisbezoeken door gezondheidswerkers na ontslag of ziekenhuisbezoeken door familie kunnen SHB opsporen, maar zijn niet universeel haalbaar of kosteneffectief. Daarom moeten, voordat pasgeborenen uit het geboorteziekenhuis worden ontslagen, de risicogroepen voor het ontwikkelen van hoge bilirubinespiegels worden geïdentificeerd
Objectieve beoordeling van het risico op het ontwikkelen van SHB vóór ontslag is ook belangrijk vanwege de beperkte nauwkeurigheid van visuele beoordeling van de mate van geelzucht. Risicostratificatie voor SHB is gedaan door het meten van bilirubinebelasting (absolute niveaus of stijgingssnelheid van serum totaal bilirubine of transcutane bilirubine), bilirubineproductie (uitgeademde koolmonoxide) en het identificeren van onderliggende klinische risicofactoren .
De bilirubineconcentratie in perifeer bloed is een functie van leeftijdsspecifieke percentages van bilirubineproductie, metabolisme, excretie en reabsorptie. Daarom is de interpretatie van de bilirubinespiegel bij een neonaat gebaseerd op de postnatale leeftijd. Het door Bhutani et al. ontwikkelde uurspecifieke bilirubine-nomogram heeft aangetoond dat meting van de totale serum bilirubine (STB) vóór ontslag uit het geboorteziekenhuis kan helpen bij het identificeren van neonaten bij wie het risico bestaat dat zij tijdens de follow-up hogere percentielwaarden van STB krijgen. Van de verschillende risicovoorspellingsmethoden heeft STB-meting voor ontslag het beste onderscheidend vermogen aangetoond bij Noord-Amerikaanse pasgeborenen. Echter, door genetisch bepaalde verschillen in het bilirubinemetabolisme en verschillen in voedingsgewoonten kan het klinisch beloop van hyperbilirubinemie verschillen bij pasgeborenen van verschillende etniciteiten of geografische locaties. Bovendien werd het vorige nomogram ontwikkeld op basis van een retrospectief cohort waarin de informatie over de uitkomst van significante hyperbilirubinemie slechts voor een vijfde van de studiepopulatie bekend was. Daarom is de constructie van uur-specifieke bilirubine nomogram in verschillende neonatale populaties een eerste vereiste voor het gebruik van pre-discharge bilirubine meting als een risico-inschatting strategie.
Wij planden deze prospectieve cohortstudie om uurspecifiek serum totaal bilirubine nomogram te construeren bij Indiase neonaten en om de doeltreffendheid te evalueren van bilirubinemeting vóór ontslag bij het voorspellen van hyperbilirubinemie die behandeling behoeft bij termijn- en laatprematuren.
Methodes
Deze prospectieve cohortstudie met evaluatie van diagnostische testprestaties werd uitgevoerd van februari tot juni 2010 in een academisch ziekenhuis in het noorden van India. Het studieprotocol werd goedgekeurd door de ethische commissie van het ziekenhuis en er werd schriftelijke toestemming verkregen van de ouders. Gezonde pasgeborenen met een zwangerschapsduur ≥35 weken of een geboortegewicht ≥2000 g kwamen in aanmerking voor inschrijving in de studie. Om logistieke redenen kwamen pasgeborenen die op zondag 24 uur leefden niet in aanmerking voor deelname aan de studie. Neonaten met belangrijke aangeboren misvorming, opname in de neonatale intensive care, positieve directe Coombs-test (werd gedaan indien de bloedgroep van de moeder Rhesus-negatief was), fototherapie vóór de eerste bilirubinemeting of onvermogen om voor follow-up te komen, werden uitgesloten.
Studie metingen en follow-up: Bloedmonster voor de eerste meting van serum totaal bilirubine werd afgenomen op het moment van metabole screening op 18-30 uur postnatale leeftijd. Capillair of perifeer veneus bloed werd verzameld in vooraf gehepariniseerde micro-capillairen. Het bloed werd onmiddellijk gecentrifugeerd bij 12000 rpm gedurende 5 minuten en de totale bilirubine werd gemeten met een spectrofotometer (NEO-BIL plus, das srl, Italië).
Neonaten werden opgevolgd tijdens het ziekenhuisverblijf en na ontslag tot de 7e postnatale dag. Het tijdstip van follow-up bezoek werd bepaald op basis van de leeftijd bij ontslag. Baby’s die voor de leeftijd van 48 uur werden ontslagen, werden teruggeroepen tussen 72 en 96 uur en baby’s die na 48 uur werden ontslagen tussen 96 en 120 uur. Naast de eerste meting van het STB bij de metabole screening werden bij elke pasgeborene nog twee STB-metingen verricht. Na de eerste meting werd de beslissing om de tweede en derde STB-metingen uit te voeren gebaseerd op klinische beoordeling. Klinische beoordeling van de mate van geelzucht ging gepaard met transcutane bilirubinemeting (TcB) met een multi-golflengte transcutane bilimeter (BiliChek, variatiecoëfficiënt <5%). STB-schatting werd gedaan als palmen/zolen gekleurd waren met icterus of TcB >12 mg/dL was of binnen 80% van de leeftijdsspecifieke fototherapiedrempel. Indien klinisch niet geïndiceerd, werden een tweede en derde STB meting gedaan op respectievelijk 72-96 uur en 96-144 uur postnatale leeftijd. STB-waarden na het begin van de fototherapie werden niet opgenomen voor de constructie van het nomogram.
Klinische en epidemiologische risicofactoren die het risico op het ontwikkelen van SHB kunnen beïnvloeden, werden geregistreerd. De volgende gegevens werden geregistreerd: geboortegewicht, zwangerschapsduur, geslacht, opleiding en religie van de moeder, pariteit, prenatale complicaties, ABO- en Rh-bloedgroep van de moeder, wijze van bevalling, type anesthesie tijdens de bevalling en gebruik van oxytocine-infuus tijdens de bevalling. Bovendien werden de leeftijd bij het begin van de voeding, aanvullende voeding (anders dan borstvoeding of afgekolfde moedermelk) tijdens en na de eerste 24 uur na de geboorte en de leeftijd bij het passeren van de eerste ontlasting ook genoteerd.
Uitkomst: Het belangrijkste resultaat was significante hyperbilirubinemie (SHB), die werd gedefinieerd als de noodzaak van fototherapie of wisseltransfusie voor de behandeling van hyperbilirubinemie. De beslissing om met fototherapie te beginnen werd genomen op basis van de leeftijd van de baby in uren en de STB-niveaus, volgens de lokale aanpassing van de richtlijnen van de American Academy of Pediatrics (AAP). Bij neonaten die met 38 of meer weken zwangerschap werden geboren, werd de drempelwaarde voor het gemiddelde risico gebruikt, en bij neonaten die met 37 of minder voltooide weken zwangerschap werden geboren, de drempelwaarde voor het hogere risico, om met fototherapie te beginnen. De drempelwaarden voor gemiddeld risico in de AAP-richtlijnen zijn bijna identiek aan de 95
e percentielwaarden van het Bhutani-nomogram.
Statistische analyse: In een prospectieve studie werd significante hyperbilirubinemie waargenomen bij 10% van de neonaten geboren bij ≥35 weken zwangerschap . Voor het onderzoeken van een diagnostische test met een gevoeligheid van ten minste 95% (betrouwbaarheidsinterval 5%) en alpha-waarde van 0,05, moesten we ongeveer 1000 proefpersonen te registreren .
De gegevens werden geanalyseerd met Stata 9 (StataCorp, College Station, TX, USA). Voor de constructie van het nomogram werden de STB-waarden samengevoegd in tijdperken van zes uur (leeftijd±3 uur) voor de postnatale leeftijd tot 48 uur en tijdperken van twaalf uur (leeftijd±6 uur) voor de leeftijd na 48 uur. De 5
e, 10e, 25e, 40e, 75e, 90e en 95e percentielwaarden werden voor elk tijdvak berekend. Microsoft Excel (Microsoft Corporation, Richmond, VS) werd gebruikt om het uurspecifieke bilirubine-nomogram uit te zetten. Afgevlakte nomogrammen met 40e, 75e en 95e percentiel werden geplot met behulp van kubische ruggengraat modellering met GAMLSS pakket voor R statistische software. Na afvlakking lag 36,5% van de gevallen onder de 40e percentielijn, 77,8% onder de 75e percentielijn en 95,1% onder de 95e percentielijn. De voorspellende waarde van het nomogram werd beoordeeld door berekening van sensitiviteit, specificiteit, positief voorspellende waarde, negatief voorspellende waarde en likelihood ratio, door het uitzetten van receiver-operating characteristics (ROC) curve en het berekenen van c-statistic.
Resultaten
Tijdens de studieperiode werden in totaal 1255 neonaten geboren, waarvan er 1090 in aanmerking kwamen voor inclusie. Daarvan werden er 93 om verschillende redenen uitgesloten (Fig. 1). In totaal werden 997 pasgeborenen ingeschreven in de studie. De gemiddelde ± SD waarde voor geboortegewicht was 2627±536 g en voor zwangerschapsduur was 37,8±1,5 weken (mediaan en IQR: 38 en 37-39) (Web Tabel I). De meeste studiezonen werden geboren na een ongecompliceerd prenataal verloop en hadden een probleemloze overgang naar het leven buiten de baarmoeder. Meer dan 80% van de pasgeborenen kreeg uitsluitend borstvoeding tijdens het verblijf in het ziekenhuis.
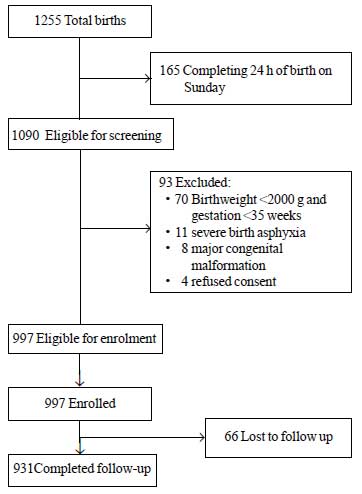
Fig.1 Studieverloop.
Opstellen van bilirubine nomogram: De eerste meting van bilirubine werd uitgevoerd op de leeftijd van 23,3±6,3 uur en de gemiddelde STB was 7,0±2,0 mg/dL. Negenentwintig (2,9%) neonaten hadden fototherapie nodig op basis van de eerste meting van bilirubine. Bij deze neonaten werd fototherapie gestart op 27±5,6 uur leeftijd met STB niveaus van 12,3±2,0 mg/dL. Zesenzestig (6,6%) neonaten werden na ontslag uit het studieziekenhuis niet meer opgevolgd. De eerste bilirubinewaarde bij deze neonaten was vergelijkbaar met neonaten die nooit SHB ontwikkelden (6,5±1,9 vs 6,7±1,7 mg/dL, P=0,54) en was significant lager dan bij degenen die SHB ontwikkelden (6,5±1,9 vs 8,5±2,2 mg/dL, P< 0,001).
Voor de constructie van het nomogram en de beoordeling van de verdeling van de STB-waarden, werd de postnatale leeftijd verdeeld in periodes van zes uur voor de postnatale leeftijd tot 48 uur en periodes van twaalf uur voor de leeftijd na 48 uur. De STB-waarden bij 42 uur bleken positief scheef verdeeld te zijn en deze waarden werden niet gebruikt voor de constructie van het nomogram.
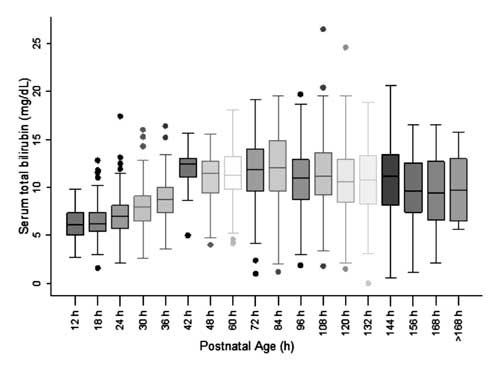
Fig. 2 Box-whisker plot met de verdeling van de totale hoeveelheid serumbilirubine.
De 5-, 10-, 25-, 40-, 75-, 90- en 95-percentielwaarden voor elk tijdvak werden berekend. Er werd een leeftijdsspecifiek serumbilirubine-nomogram getekend met de 40e, 75e en 95e percentielwaarden bij het vorderen van de postnatale leeftijd (Fig. 3).
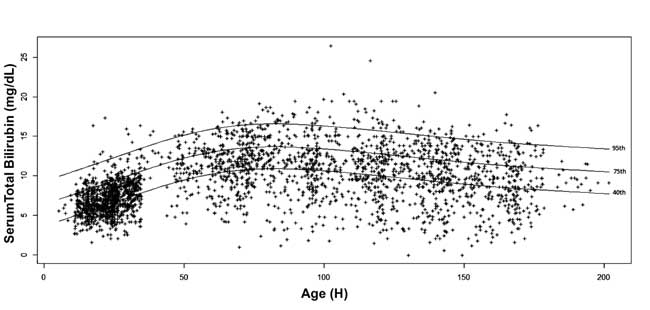
Fig. 3 Bilirubine nomogram – uurspecifiek serum totaal bilirubine afgebeeld als 40e, 75e en 95e percentiel.
Predictief vermogen van STB vóór ontslag: In totaal ontwikkelden 199 (20%) neonaten SHB (kregen fototherapie). De eerste bilirubinewaarde werd gebruikt om de latere noodzaak van behandeling voor hyperbilirubinemie te voorspellen. Indien meer dan twee waarden werden verkregen in de eerste 48 uur na de geboorte, werd de hoogste percentielwaarde gebruikt voor de voorspelling.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Pre-discharge serum total bilirubin | Outcome | Test performance | |||||
| Percentiel | Number(n=928) | SHB+ | SHB- | PPV | NPV | Gevoeligheid | Specificiteit |
| Boven 95e percentiel | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 |
| Lager dan 95e percentiel | 879 | 165 | 714 | ||||
| Boven 75e percentiel | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 |
| Lager dan 75e percentiel | 689 | 92 | 597 | ||||
| Boven 40e percentiel | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 |
| Onder 40e percentiel | 342 | 32 | 310 | ||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
|||||||
Onder de pasgeborenen bij wie vóórontslag STB meting en voltooide follow-up (n=928), bij 49 (5.3%) was de STB voor ontslag hoger dan het 95e percentiel van de leeftijdsspecifieke verdeling (tabel I). Van deze 34 neonaten hadden vervolgens fototherapie nodig (positief voorspellende waarde: 69,4%, sensitiviteit: 17,1%). Bij 342 (36,8%) neonaten was de STB voor ontslag minder dan het 40e percentiel van de leeftijdsspecifieke verdeling. Hiervan hadden 310 neonaten geen verdere behandeling voor hyperbilirubinemie nodig (negatief voorspellende waarde: 90,6% en specificiteit: 42,5%). De positief voorspellende waarde van de afkapwaarde van het 75e percentiel was 44,8% en de negatief voorspellende waarde was 86,2%. De ROC-curve in Fig. 4 illustreert de diagnostische prestaties van elke percentiel-afkapwaarde met een gebied onder de curve (c-statistiek) van 0,73.
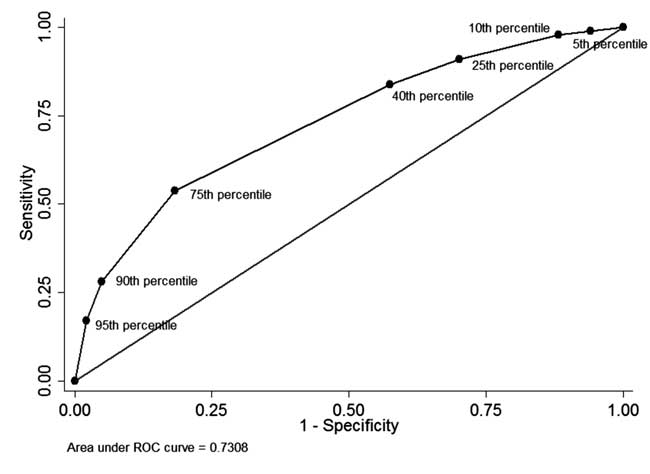
Fig. 4 De ROC-curve voor het diagnostisch vermogen van verschillende percentiel-afkapwaarden van het serum totaal bilirubine vóór ontslag.
Waarschijnlijkheidsverhouding (LR) is een beter instrument om de diagnostische testprestaties te meten, aangezien de verhouding niet wordt beïnvloed door veranderingen in de achtergrondprevalentie van het resultaat. LR van een positieve test (LR+, waarschijnlijkheid van een positieve test bij een ziekte/waarschijnlijkheid van een positieve test bij een niet-ziekte) werd berekend voor elke risicodemarcatiezone. STB van ≥95e percentiel vóór ontslag werd ingedeeld in de hoog-risicozone, tussen 75e en 94e percentiel in de hogere-intermediaire risicozone, tussen 40e en 74e percentiel in de lagere-intermediaire risicozone en onder 40e percentiel in de lage-risicozone. Van de 49 neonaten in de hoog-risico zone ontwikkelden 34 SHB; daarom was de positieve LR voor STB in de hoog-risico zone 8,26 (Tabel II). Van de 190 pasgeborenen in de hogere-intermediaire risicozone ontwikkelden er 73 SHB; daarom was de positieve LR voor STB in deze risicozone 2,30. Evenzo was de positieve LR voor STB in de lage-intermediaire risicozone 0,76 en voor de lage risicozone 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Pre-discharge serum total bilirubin | Outcome | Test performance | ||||||
| Pre-lozing cumulatieve risicozone | Percentiel | Totaal | SHB+ | SHB- | P:A ratio | Kans op ziekte | LR+ | |
| Hoog risico | ≥95ste | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 | |
| Upper-intermediair | 75e t/m 94e | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 | |
| Lager-middelbaar | 40e t/m 74e | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 | |
| Laag-risico | <40e | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 | |
| 928 | 199 | 729 | 1:4 | 1/5 | ||||
| SHB: significante hyperbilirubinemie; P:A-verhouding: Aanwezigheid van uitkomst : Afwezigheid van uitkomst. | ||||||||
Discussie
Risicobeoordeling vóór ontslag met het oog op de latere ontwikkeling van SHB wordt aanbevolen als een potentiële strategie om de incidentie van door bilirubine veroorzaakte neurologische schade of kernicterus te verminderen. In deze prospectieve cohortstudie hebben wij een uurspecifiek serumbilirubine-nomogram opgesteld bij een deelgroep van neonaten uit Noord-India en hebben wij de doeltreffendheid geëvalueerd van risicodemarcering door STB-meting vóór ontslag bij het voorspellen van de latere behoefte aan fototherapie (SHB). De basisincidentie van SHB was hoog in ons studiecohort met 2 van de 10 neonaten die SHB ontwikkelden. De locatie van STB vóór ontslag in twee hogerisicozones verhoogde het risico op latere SHB significant: 7 van de 10 neonaten in de hoogrisicozone ontwikkelden SHB (positieve LR=8,26) en 4 van de 10 neonaten in de hoger-intermediaire risicozone ontwikkelden SHB (positieve LR=2,3). Plaatsing van STB vóór ontslag in de laagrisicozone verlaagde het risico op latere SHB significant met 1 op de 10 neonaten die SHB ontwikkelden (positieve LR=0,37). Aangezien de negatief voorspellende waarde van de laag-risico-afkapwaarde echter slechts 90% bedroeg, kon de ligging in de laag-risico-zone de mogelijkheid van latere SHB niet uitsluiten.
Bhutani, et al. toonden in een groot cohort aan dat neonaten met STB vóór ontslag in de hoge en hoge-intermediaire risicozones meer kans hebben op SHB tijdens de follow-up. De auteurs stelden percentielgrafieken op van de serumbilirubinespiegel op verschillende postnatale leeftijden bij pasgeborenen die kort en laat geboren waren. Zij vonden dat 6,1% van de pasgeborenen voor ontslag serumbilirubine >95ste percentiel hadden; 32,1% van deze zuigelingen vertoonden vervolgens hyperbilirubinemie. In vergelijking met het uurspecifieke nomogram van Bhutani, et al. , zijn de percentielwaarden van STB in deze studie tot 2 mg/dL hoger tot 84-108 uur postnatale leeftijd. Neonaten van Noord-Indiase afkomst hebben hogere waarden van bilirubine bereikt en hebben een hogere incidentie van hyperbilirubinemie. De gemiddelde STB van 7,0±2,0 mg/dL die in deze studie werd waargenomen, ligt tussen het 75e en 95e percentiel van het Bhutani-nomogram. Evenzo rapporteerden Agarwal, et al. een gemiddelde STB van 5,9±1,8 mg/dL op 24 uur postnatale leeftijd, wat dicht bij de 75ste percentielwaarde van het Bhutani nomogram ligt. Het hogere percentage premature of laag geboortegewicht pasgeborenen en het hogere percentage exclusieve borstvoeding in onze studie kunnen de factoren zijn die bijdragen aan de hogere STB-waarden en de hogere incidentie van SHB. Bovendien verhoogde onze beslissing om de middelste in plaats van de bovenste lijn van de AAP-fototherapiedrempels te gebruiken, zelfs bij neonaten met een laag risico, ook de incidentie van SHB. Voorbij 108 uur postnatale leeftijd zijn de percentielwaarden van STB in deze studie lager dan de corresponderende waarden in het Bhutani-nomogram. Het opnemen van STB-waarden van neonaten die selectief werden opgevolgd op oordeel van de clinicus voor het samenstellen van het nomogram kan hebben geleid tot het gebruik van hogere STB-niveaus voor het plotten van het Bhutani-nomogram, waardoor de generaliseerbaarheid van het nomogram afneemt. In de huidige studie, aangezien de follow-up werd voltooid ongeacht de ernst van hyperbilirubinemie, piekt het nomogram op de 4e en 5e dag van de postnatale leeftijd met een natuurlijke daling aan het einde van de eerste week.
In een prospectieve cohortstudie maten Agarwal, et al. STB op 24±6 uur leeftijd bij 220 neonaten geboren bij ≥35 weken zwangerschap voor voorspelling van hyperbilirubinemie . Afwezigheid van STB >6 mg/dL op 24±6 uur leeftijd sloot de mogelijkheid van latere SHB (likelihood ratio van negatieve test 0,07) binnen 5 dagen na de geboorte vrijwel uit. De selectieve meting van het resultaat bij alleen die neonaten die tijdens de follow-up een “klinische” bilirubinespiegel van >10 mg/dL hadden, introduceerde echter een verificatiebias in de studie. In een andere Indiase studie bleek een cut-off van 3,99 mg/dL bij 18-24 uur een sensitiviteit en specificiteit van 67% elk te hebben voor de voorspelling van een latere bilirubinespiegel >15 mg/dL . Volledige follow-up was echter alleen aanwezig bij zuigelingen die in het ziekenhuis verbleven voor neonatale ziekte of een of andere maternale reden, zoals een keizersnede. Meer dan 50% van de zuigelingen, die gezond waren en dus vervroegd werden ontslagen, werden niet opgevolgd. Een studie uit Turkije presenteerde een uurspecifiek bilirubine nomogram bij neonaten met een zwangerschapsduur tussen 35 en 37 weken. STB-waarde meer dan 95
ste percentiel had een hoge positieve voorspellende waarde voor latere ontwikkeling van SHB . Een STB-waarde lager dan het 30e percentiel had echter een negatief voorspellende waarde van ongeveer 90%. Twee grote retrospectieve studies hebben een uitstekende voorspellende waarde van vroege/pre-ontslag meting van STB gerapporteerd met oppervlakte onder curve (AUC) van 0,83 . In onze studie was het onderscheidend vermogen van de 40ste en 75ste percentielwaarden lager dan eerder gerapporteerd. Hierdoor verschoof de ROC-curve in onze studie naar de diagonale lijn, wat resulteerde in een verminderd discriminerend vermogen (AUC= 0,73). De hoge basisincidentie van SHB in de Turkse studie (25,3%) en in onze studie (20%) kan het onvermogen verklaren van lage percentielwaarden om de ontwikkeling van latere SHB uit te sluiten, waardoor het nut van STB-meting vóór het ontslag wordt beperkt.
Een alternatieve risicobeoordelingsstrategie voor de voorspelling van latere SHB is de evaluatie van klinische risicofactoren. Dracht bij de geboorte, geschiedenis van geelzucht die behandeling nodig had bij de vorige broer of zus, oxytocine-infuus, instrumentele bevalling, geboortetrauma en inadequate voeding zijn geïmpliceerd als risicofactoren voor SHB.
Het discriminerend vermogen van klinische risicomodellen is echter lager dan dat van vroege STB-meting. Newman, et al. rapporteerden een verbeterd discriminerend vermogen wanneer een klinisch risico-instrument werd gecombineerd met een vroege STB-meting. Vanwege het significante aandeel van laag geboortegewicht en premature pasgeborenen in ons cohort, speculeren wij dat de combinatie van deze objectief meetbare klinische risicofactoren met vroege STB meting een risicomodel zou genereren met een verbeterd discriminerend vermogen.
De externe toepasbaarheid van de waarnemingen in de studie kan worden beïnvloed door de relatief hoge incidentie van hyperbilirubinemie in het studiecohort als gevolg van het gebruik van lagere bilirubinedrempels voor het starten van fototherapie. In tegenstelling tot de ontwikkelde landen is kernicterus in India bij lagere piekwaarden voor bilirubine gemeld, wat erop wijst dat Indiase pasgeborenen neurologische schade door bilirubine kunnen ontwikkelen bij lagere piekwaarden voor serumbilirubine. Bovendien heeft ongeveer een derde van de in India geboren pasgeborenen een laag geboortegewicht. Om deze redenen suggereert het National Neonatology Forum of India in zijn richtlijnen het gebruik van lagere drempels voor het starten van fototherapie, vooral in gebieden met een hogere incidentie van glucose-6-fosfaat dehydrogenase deficiëntie. Sterke punten van onze studie zijn prospectieve studieopzet, grote steekproefomvang, meer dan 90% follow-up rate en afwezigheid van verificatiebias. Bij ongeveer 7% van de ingeschreven pasgeborenen konden we de uitkomst niet vaststellen. Aangezien echter de vroege STB en demografische karakteristieken bij deze “lost-to-follow-up” neonaten vergelijkbaar waren met die van degenen die nooit SHB ontwikkelden, is het onwaarschijnlijk dat het uur-specifieke nomogram en het risico-inschattingsinstrument beïnvloed zijn. Wij hebben geen gebruik gemaakt van hoge prestatie vloeistofchromatografie (HPLC), de “gouden standaard” methode voor het meten van bilirubine. Wij hebben bilirubine gemeten met een meer algemeen gebruikte bedside-methode van spectrofotometrie. De bilimeter die in onze studie werd gebruikt, had een lage variatiecoëfficiënt en hij werd voor elk gebruik gekalibreerd.
Wij bevelen aan dat als pasgeborenen met STB voor ontslag in hoge of hoge-intermediaire risicozone een hoge waarschijnlijkheid hebben om SHB vroeg te ontwikkelen en frequente follow-up moet worden verzekerd. In settings waar nauwe opvolging niet haalbaar is, kan overwogen worden het ontslag uit het ziekenhuis uit te stellen tot de bilirubine in een lagere risicozone valt. Neonaten met STB vóór ontslag in de lagere-intermediaire of lage risicozones kunnen worden ontslagen volgens het plaatselijke beleid. Er moet echter worden gezorgd voor een adequate follow-up, omdat de latere ontwikkeling van SHB niet kan worden uitgesloten.
Concluderend kan worden gesteld dat, ondanks een redelijk discriminerend vermogen, de hogere mate van follow-up in onze studie het vertrouwen vergroot in het vermogen van STB vóór ontslag om SHB bij Indiase zuigelingen te voorspellen. Verdere studies zijn nodig om de prestaties van de risico-afbakeningszones gedefinieerd in dit uurspecifieke bilirubine nomogram te valideren.
Deelnemers: DC: conceptualiseerde en ontwierp de studie; UP en SK: verzamelde gegevens; DC: analyseerde gegevens; UP: stelde het document op met kritische input van DC, SK en SJ. Alle auteurs keuren de definitieve versie van het manuscript goed voor indiening.
Financiering: Geen; Concurrerende belangen: Geen vermeld.
1. Verslag 2002-2003: National Neonatal Perinatal Database Network. New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. Identification of neonates at risk for hazardous hyperbilirubinemia: emerging clinical insights. Pediatr Clin North Am. 2009;56:671-87.
3. Behandeling van hyperbilirubinemie bij de pasgeborene van 35 of meer weken zwangerschapsduur. Pediatrics. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Non-invasive estimation of total serum bilirubin by multi-wavelength spectral reflectance in neonates. Indian Pediatr. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Early neonatal hyperbilirubinemia using first day serum bilirubin level. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Prediction of hyperbilirubinemia in near-term and term infants. Pediatrics 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Noninvasive measurement of total serum bilirubin in a multiracial predischarge newborn population to assess the risk of severe hyperbilirubinemia. Pediatrics. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Predictive ability of a predischarge hour-specific serum bilirubin for subsequent significant hyperbilirubinemia in healthy term and near-term newborns. Pediatrics. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia. Pediatrics. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Systematic review of screening for bilirubin encephalopathy in neonates. Pediatrics. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Simple nomograms to calculate sample size in diagnostic studies. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Bilirubine screening for normal newborns: a critique of the hour-specific bilirubin nomogram. Pediatrics. 2009;124:1203-5.
13. Awasthi S, Rehman H. Vroege voorspelling van neonatale hyperbilirubinemie. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidentie, beloop en voorspelling van hyperbilirubinemie bij pasgeborenen die bijna zijn geboren en pasgeborenen die zijn geboren. Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identifying newborns at risk of significant hyperbilirubinaemia: a comparison of two recommended approaches. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Combining clinical risk factors with serum bilirubin levels to predict hyperbilirubinemia in newborns. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Prediction and prevention of extreme neonatal hyperbilirubinemia in a mature health maintenance organization. Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. A comparison of alternative risk-assessment strategies for predicting significant neonatal hyperbilirubinemia in term and near-term infants. Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Risicofactoren voor kernicterus bij voldragen baby’s met niet-hemolytische geelzucht. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Brainstem auditory evoked response bij pasgeborenen met hyperbilirubinemie. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidence Based Clinical Practice Guidelines. National Neonatology Forum of India, New Delhi, India, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Preliminary report on neonatal screening for congenital hypothyroidism, congenital adrenal hyperplasia and glucose-6-phosphate dehydrogenase deficiency: a Chandigarh experience. Indian J Pediatr. 2010;77:969-73.
