A significant proportion of neonates develop hyperbilirubinemia needing treatment (’significant’ hyperbilirubinemia, SHB) during first week of life . Zmniejszenie czasu trwania hospitalizacji porodowej było czasowo związane ze zwiększoną częstością występowania uszkodzeń neurologicznych spowodowanych bilirubiną. Wizyty domowe pracownika służby zdrowia po wypisie lub wizyty rodziny w szpitalu mogą wykryć SHB, ale nie są powszechnie wykonalne i opłacalne. Dlatego przed wypisaniem noworodków ze szpitala należy zidentyfikować te, u których istnieje ryzyko rozwoju wysokiego stężenia bilirubiny. Obiektywna ocena ryzyka rozwoju SHB przed wypisem jest również ważna ze względu na ograniczoną dokładność wizualnej oceny stopnia żółtaczki. Stratyfikacja ryzyka dla SHB została przeprowadzona poprzez pomiar obciążenia bilirubiną (bezwzględny poziom lub szybkość wzrostu stężenia bilirubiny całkowitej w surowicy lub bilirubiny przezskórnej), produkcję bilirubiny (wydychany tlenek węgla) oraz identyfikację podstawowych klinicznych czynników ryzyka.
Stężenie bilirubiny we krwi obwodowej jest funkcją zależnego od wieku tempa wytwarzania, metabolizmu, wydalania i reabsorpcji bilirubiny. Dlatego interpretacja poziomu bilirubiny u noworodka opiera się na wieku postnatalnym. Specyficzny dla godziny nomogram bilirubiny opracowany przez Bhutani i wsp. wykazał, że pomiar stężenia bilirubiny całkowitej w surowicy (STB) przed wypisem ze szpitala może pomóc w identyfikacji noworodków, u których istnieje ryzyko wystąpienia wyższych wartości percentyla STB podczas obserwacji. Spośród różnych metod predykcji ryzyka pomiar STB przed wypisem ze szpitala wykazał najlepsze zdolności dyskryminacyjne wśród noworodków z Ameryki Północnej. Jednak ze względu na genetycznie uwarunkowane różnice w metabolizmie bilirubiny oraz odmienność praktyk żywieniowych przebieg kliniczny hiperbilirubinemii może być różny u noworodków należących do różnych grup etnicznych lub o różnym położeniu geograficznym. Ponadto, poprzedni nomogram został opracowany na podstawie retrospektywnej kohorty, w której informacje o wyniku istotnej hiperbilirubinemii były znane tylko dla jednej piątej badanej populacji. W związku z tym skonstruowanie godzinowo specyficznego nomogramu bilirubiny w różnych populacjach noworodków jest warunkiem koniecznym do wykorzystania pomiaru bilirubiny przed wypisem jako strategii oceny ryzyka.
Zaplanowaliśmy to prospektywne badanie kohortowe w celu skonstruowania godzinowo-swoistego nomogramu bilirubiny całkowitej w surowicy u indyjskich noworodków i oceny skuteczności pomiaru bilirubiny przed wypisem w przewidywaniu hiperbilirubinemii wymagającej leczenia u noworodków urodzonych w terminie i późno urodzonych.
Metody
To prospektywne badanie kohortowe z oceną wydajności testów diagnostycznych przeprowadzono od lutego do czerwca 2010 r. w szpitalu edukacyjnym w północnych Indiach. Protokół badania został zatwierdzony przez Komisję Etyczną szpitala, a od rodziców uzyskano pisemną świadomą zgodę. Do badania kwalifikowano zdrowe noworodki z ciążą ≥35 tygodni lub masą urodzeniową ≥2000 g. Ze względów logistycznych nie kwalifikowano do badania noworodków, które ukończyły 24 h życia w niedzielę. Z badania wykluczono noworodki z dużymi wadami wrodzonymi, przebywające na oddziale intensywnej terapii noworodka, z dodatnim bezpośrednim testem Coombsa (wykonywanym w przypadku, gdy grupa krwi matki była ujemna w układzie Rhesus), poddane fototerapii przed pierwszym pomiarem bilirubiny oraz niemożność zgłoszenia się na badanie kontrolne.
Pomiary badawcze i obserwacja: Próbka krwi do pierwszego pomiaru bilirubiny całkowitej w surowicy została pobrana w czasie przesiewowych badań metabolicznych w 18-30 h wieku postnatalnego. Krew kapilarna lub obwodowa krew żylna została pobrana do preheparynizowanych mikrokapilar. Krew natychmiast odwirowywano przy 12000 rpm przez 5 minut i mierzono bilirubinę całkowitą za pomocą spektrofotometru (NEO-BIL plus, das srl, Włochy).
Neonaty były obserwowane podczas pobytu w szpitalu i po wypisie do ukończenia 7. dnia życia płodowego. Termin wizyty kontrolnej ustalano na podstawie wieku przy wypisie. Dzieci wypisane przed 48 godziną życia były wywoływane między 72 a 96 godziną życia, a dzieci wypisane po 48 godzinie życia między 96 a 120 godziną życia. Oprócz pierwszego pomiaru STB w czasie przesiewowego badania metabolicznego, u każdego noworodka wykonywano jeszcze dwa pomiary STB. Po pierwszym pomiarze decyzję o wykonaniu drugiego i trzeciego pomiaru STB podejmowano na podstawie oceny klinicznej. Ocenie klinicznej stopnia żółtaczki towarzyszył pomiar przezskórnej bilirubiny (TcB) za pomocą wielopłaszczyznowego bilimetru przezskórnego (BiliChek, współczynnik zmienności <5%). Ocenę STB wykonywano, jeśli na dłoniach/podeszwach widoczne było zabarwienie żółte lub TcB wynosiła >12 mg/dl lub mieściła się w granicach 80% progu fototerapii właściwego dla danego wieku. Jeśli nie było to wskazane klinicznie, drugi i trzeci pomiar STB wykonywano odpowiednio w 72-96 h i 96-144 h wieku postnatalnego. Wartości STB po rozpoczęciu fototerapii nie były brane pod uwagę przy konstruowaniu nomogramu.
Rejestrowano kliniczne i epidemiologiczne czynniki ryzyka, które mogą wpływać na ryzyko rozwoju SHB. Odnotowano następujące dane: masa urodzeniowa, ciąża, płeć, wykształcenie i wyznanie matki, parytet, powikłania przedporodowe, grupa krwi ABO i Rh u matki, sposób porodu, rodzaj znieczulenia zastosowanego podczas porodu oraz zastosowanie wlewu oksytocyny podczas porodu. Dodatkowo odnotowano również wiek przy rozpoczęciu karmienia, karmienie uzupełniające (inne niż karmienie piersią lub odciągniętym mlekiem matki) podczas i po pierwszych 24 h po porodzie oraz wiek przy oddaniu pierwszego stolca.
Outcome: Kluczowym wynikiem była znacząca hiperbilirubinemia (SHB), która została zdefiniowana jako potrzeba fototerapii lub transfuzji wymiennej w leczeniu hiperbilirubinemii. Decyzja o rozpoczęciu fototerapii była podejmowana na podstawie wieku dziecka w godzinach i poziomu STB, zgodnie z lokalną adaptacją wytycznych Amerykańskiej Akademii Pediatrii (AAP). U noworodków urodzonych w 38 lub więcej tygodniu ciąży do rozpoczęcia fototerapii zastosowano próg średniego ryzyka, a u noworodków urodzonych w 37 lub mniej ukończonych tygodniach ciąży próg wyższego ryzyka. Wartości progu średniego ryzyka w wytycznych AAP są prawie identyczne z wartościami 95
percentyla nomogramu Bhutaniego.
Analiza statystyczna: W badaniu prospektywnym istotną hiperbilirubinemię obserwowano u 10% noworodków urodzonych w ≥35 tygodniu ciąży . Aby opracować test diagnostyczny o czułości co najmniej 95% (przedział ufności 5%) i wartości alfa 0,05, należało objąć badaniem około 1000 osób.
Dane analizowano przy użyciu programu Stata 9 (StataCorp, College Station, TX, USA). W celu skonstruowania nomogramu, wartości STB były łączone w sześciogodzinne epoki (wiek±3 godziny) dla wieku postnatalnego do 48 h i dwunastogodzinne epoki (wiek±6 godzin) dla wieku powyżej 48 h. Dane dla każdej epoki były badane pod kątem symetrii. Dla każdej epoki obliczono wartości 5
tego, 10-tego, 25-tego, 40-tego, 75-tego, 90-tego i 95-tego percentyla. Do wykreślenia nomogramu bilirubiny specyficznego dla danej godziny użyto programu Microsoft Excel (Microsoft Corporation, Richmond, USA). Wygładzony nomogram przedstawiający 40-ty, 75-ty i 95-ty percentyl wykreślono przy użyciu sześciennego modelowania kręgosłupa z pakietem GAMLSS dla oprogramowania statystycznego R. Po wygładzeniu 36,5% przypadków było poniżej linii 40 percentyla, 77,8% przypadków było poniżej linii 75 percentyla, a 95,1% przypadków było poniżej linii 95 percentyla. Zdolność predykcyjną nomogramu oceniano obliczając czułość, swoistość, dodatnią wartość predykcyjną, ujemną wartość predykcyjną i współczynnik prawdopodobieństwa, wykreślając krzywą ROC (receiver-operating characteristics) i obliczając c-statystykę.
Wyniki
W okresie objętym badaniem urodziło się 1255 noworodków, z których 1090 kwalifikowało się do badania. Spośród nich 93 zostało wykluczonych z różnych powodów (ryc. 1). Łącznie do badania włączono 997 noworodków. Średnia ± SD dla masy urodzeniowej wynosiła 2627±536 g, a dla wieku ciążowego 37,8±1,5 tygodnia (mediana i IQR: 38 i 37-39) (tab. I). Większość badanych noworodków urodziła się po niepowikłanym przebiegu porodu, a ich przejście do życia pozamacicznego przebiegało bez komplikacji. Ponad 80% noworodków było karmionych wyłącznie piersią podczas pobytu w szpitalu.
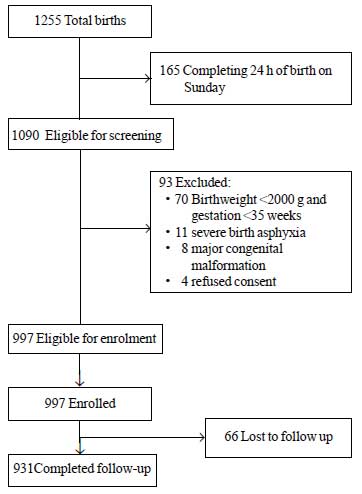
Rys.1 Przebieg badania.
Skonstruowanie nomogramu bilirubiny: Pierwszy pomiar bilirubiny wykonano w 23,3±6,3 h życia, a średnia STB wynosiła 7,0±2,0 mg/dl. Dwadzieścia dziewięć (2,9%) noworodków wymagało fototerapii na podstawie pierwszego pomiaru bilirubiny. U tych noworodków fototerapię rozpoczęto w 27±5,6 h życia, a STB wynosiła 12,3±2,0 mg/dl. Sześćdziesięciu sześciu (6,6%) noworodków utraciło możliwość obserwacji po wypisie ze szpitala. Pierwsza wartość bilirubiny u tych noworodków była porównywalna z noworodkami, u których nigdy nie rozwinęło się SHB (6,5±1,9 vs 6,7±1,7 mg/dl, P=0,54) i była znacząco niższa niż u tych, u których rozwinęło się SHB (6,5±1,9 vs 8,5±2,2 mg/dl, P< 0,001).
W celu skonstruowania nomogramu i oceny rozkładu wartości STB, wiek postnatalny podzielono na sześciogodzinne epoki dla wieku postnatalnego do 48 h i dwunastogodzinne epoki dla wieku powyżej 48 h. Stwierdzono, że STB w każdej z epok, z wyjątkiem 42 h, ma rozkład symetryczny (ryc. 2). Rozkład wartości STB w 42 h zaobserwowano jako dodatnio skośny i wartości tych nie użyto do konstrukcji nomogramu.
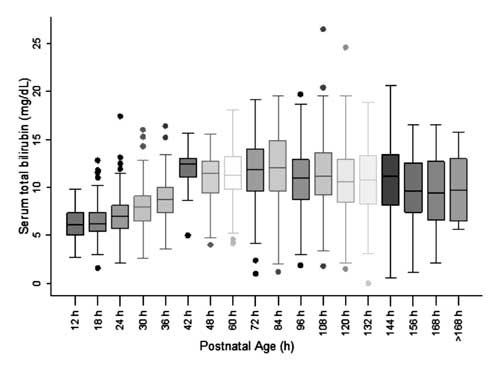
Fig. 2 Wykres Box-whisker przedstawiający rozkład bilirubiny całkowitej w surowicy.
Obliczono wartości 5
tego, 10-tego, 25-tego, 40-tego, 75-tego, 90-tego i 95-tego percentyla dla każdej epoki. Wykreślono nomogram stężenia bilirubiny w surowicy zależny od wieku, z wartościami 40, 75 i 95 percentyla w zaawansowanym wieku postnatalnym (ryc. 3).
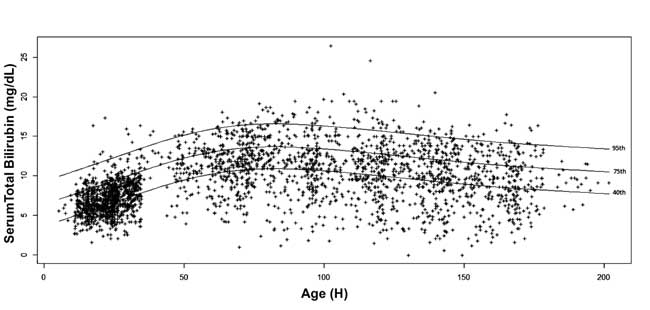
Fig. 3 Nomogram bilirubiny – godzinowe stężenie bilirubiny całkowitej w surowicy przedstawione jako 40, 75 i 95 percentyl.
Zdolność predykcyjna STB przed wypisem: Ogółem u 199 (20%) noworodków rozwinęło się SHB (otrzymały fototerapię). Pierwsza wartość bilirubiny została użyta do przewidywania późniejszej potrzeby leczenia hiperbilirubinemii. Jeśli w ciągu pierwszych 48 h po urodzeniu uzyskano więcej niż dwie wartości, do prognozowania używano wyższej wartości percentyla.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Bilirubina całkowita w surowicy przed wypisem | Wyniki | Wyniki testu | ||||||
| Percentyl | Liczba (n=928) | SHB+ | SHB-. | PPV | NPV | Wrażliwość | Szczególność | |
| Powyżej 95 percentyla | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 | |
| Below 95th percentile | 879 | 165 | 714 | |||||
| Powyżej 75. percentyla | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 | |
| Below 75th percentile | 689 | 92 | 597 | |||||
| Powyżej 40. percentyla | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 | |
| Poniżej 40. percentyla | 342 | 32 | 310 | |||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
||||||||
Wśród noworodków, u których dokonano pomiaru STB przedpomiar STB przed wypisem i zakończoną obserwację (n=928), u 49 (5.U 49 (5. 3%) noworodków STB przed wypisem było większe niż 95. percentyl rozkładu dla danego wieku (tab. I). Spośród nich 34 noworodki wymagały fototerapii (pozytywna wartość predykcyjna: 69,4%, czułość: 17,1%). U 342 (36,8%) noworodków STB przed wypisem było mniejsze niż 40 percentyl rozkładu dla danego wieku. Spośród nich 310 noworodków nie wymagało późniejszego leczenia z powodu hiperbilirubinemii (ujemna wartość predykcyjna: 90,6%, swoistość: 42,5%). Dodatnia wartość predykcyjna dla 75 percentyla odcięcia wynosiła 44,8%, a ujemna wartość predykcyjna 86,2%. Krzywa ROC przedstawiona na rycinie 4 ilustruje skuteczność diagnostyczną każdego percentyla odcięcia z obszarem pod krzywą (c-statystyka) wynoszącym 0,73.
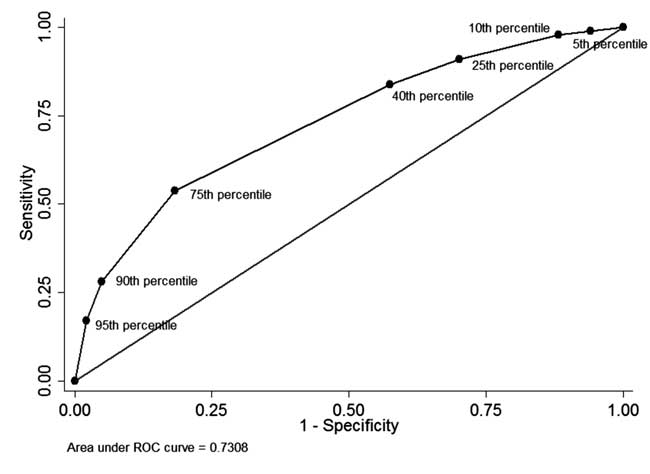
Rys. 4 Krzywa ROC dla zdolności diagnostycznej różnych percentyli odcięcia bilirubiny całkowitej w surowicy przed wypisem.
Stosunek prawdopodobieństwa (LR) jest lepszym narzędziem pomiaru wydajności testu diagnostycznego, ponieważ na stosunek ten nie ma wpływu zmiana w rozpowszechnieniu tła wyniku. LR testu pozytywnego (LR+, prawdopodobieństwo testu pozytywnego u chorych/ prawdopodobieństwo testu pozytywnego u niechorujących) obliczono dla każdej strefy ryzyka. Przedwypisowe STB wynoszące ≥95 centyla przypisywano do strefy wysokiego ryzyka, pomiędzy 75 a 94 centylem do strefy górnego pośredniego ryzyka, pomiędzy 40 a 74 centylem do strefy dolnego pośredniego ryzyka i poniżej 40 centyla do strefy niskiego ryzyka. Wśród 49 noworodków w strefie wysokiego ryzyka u 34 rozwinęło się SHB, dlatego dodatnie LR dla STB w strefie wysokiego ryzyka wynosiło 8,26 (tab. II). Wśród 190 noworodków ze strefy podwyższonego i średniego ryzyka u 73 rozwinęło się SHB, a zatem dodatnie LR dla STB w tej strefie ryzyka wynosiło 2,30. Podobnie, dodatnie LR dla STB w strefie niższego pośredniego ryzyka wynosiło 0,76, a w strefie niskiego ryzyka 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Pre-discharge serum total bilirubin | Outcome | Test performance | |||||
| Pre-strefa skumulowanego ryzyka | Percentyl | Ogółem | SHB+ | SHB- | P:Współczynnik | Prawdopodobieństwo zachorowania | LR+ |
| Wysokie ryzyko | ≥95-te | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 |
| Upper-intermediate | 75th to 94th | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 |
| Lower-intermediate | 40th to 74th | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 |
| Low-risk | <40th | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 |
| 928 | 199 | 729 | 1:4 | 1/5 | |||
| SHB: znaczna hiperbilirubinemia; stosunek P:A: Obecność wyniku : Brak wyniku. | |||||||
Dyskusja
Przedwypisowa ocena ryzyka późniejszego rozwoju SHB jest zalecana jako potencjalna strategia zmniejszająca częstość występowania uszkodzeń neurologicznych wywołanych bilirubiną lub kernicterus. W tym prospektywnym badaniu kohortowym skonstruowaliśmy godzinowo specyficzny nomogram stężenia bilirubiny w surowicy w podgrupie noworodków z północnych Indii i oceniliśmy skuteczność demarkacji ryzyka za pomocą pomiaru STB przed wypisem w przewidywaniu późniejszej potrzeby fototerapii (SHB). Podstawowa częstość występowania SHB była wysoka w naszej kohorcie, u 2 z 10 noworodków wystąpił SHB. Lokalizacja STB przed wypisem w dwóch strefach podwyższonego ryzyka istotnie zwiększała ryzyko wystąpienia SHB u 7 z 10 noworodków w strefie wysokiego ryzyka (dodatnie LR=8,26) oraz u 4 z 10 noworodków w strefie podwyższonego-średniego ryzyka (dodatnie LR=2,3). Umieszczenie przedwypisowego STB w strefie niskiego ryzyka istotnie zmniejszało ryzyko wystąpienia SHB u 1 na 10 noworodków (dodatnie LR=0,37). Jednakże, ponieważ ujemna wartość predykcyjna odcięcia dla niskiego ryzyka wynosiła tylko 90%, lokalizacja w strefie niskiego ryzyka nie była w stanie wykluczyć możliwości późniejszego wystąpienia SHB.
Bhutani i wsp. wykazali w dużej kohorcie, że prawdopodobieństwo wystąpienia SHB u noworodków z STB przed wypisem do domu w strefach wysokiego i średniego ryzyka jest większe w trakcie obserwacji. Autorzy stworzyli wykresy percentylowe stężenia bilirubiny w surowicy w różnym wieku postnatalnym u noworodków urodzonych przed terminem i w terminie. Stwierdzili, że 6,1% noworodków miało przed wypisem stężenie bilirubiny w surowicy >95 percentyla; 32,1% tych noworodków wykazywało następnie hiperbilirubinemię. W porównaniu z godzinowym nomogramem Bhutani i wsp. wartości percentyla STB w tym badaniu są wyższe nawet o 2 mg/dl do 84-108 h wieku postnatalnego. U noworodków pochodzenia północnoindyjskiego obserwuje się wyższe wartości bilirubiny i częstsze występowanie hiperbilirubinemii. Średnia wartość STB wynosząca 7,0±2,0 mg/dl mieści się pomiędzy 75. a 95. percentylem nomogramu Bhutani. Podobnie Agarwal i wsp. odnotowali średnią STB wynoszącą 5,9±1,8 mg/dl w 24 h wieku postnatalnego, która jest zbliżona do 75 percentyla nomogramu Bhutani. Wyższy odsetek wcześniaków lub noworodków z niską masą urodzeniową oraz wyższy wskaźnik wyłącznego karmienia piersią w naszym badaniu mogą być czynnikami przyczyniającymi się do podwyższonych wartości STB i zwiększonej częstości występowania SHB. Dodatkowo, decyzja o zastosowaniu środkowej zamiast górnej linii progów fototerapii AAP nawet u noworodków z niskim ryzykiem również zwiększyła częstość występowania SHB. Po przekroczeniu 108 h wieku postnatalnego wartości percentyla STB w tym badaniu są niższe niż odpowiadające im wartości w nomogramie Bhutaniego. Włączenie do konstrukcji nomogramu wartości STB od noworodków, które były selektywnie obserwowane na podstawie oceny klinicysty, mogło spowodować wykorzystanie wyższych poziomów STB do wykreślenia nomogramu Bhutaniego, zmniejszając tym samym jego zdolność do generalizacji. W obecnym badaniu, ponieważ obserwacja została zakończona niezależnie od ciężkości hiperbilirubinemii, nomogram osiąga szczyt w 4 i 5 dniu wieku postnatalnego z naturalnym spadkiem pod koniec pierwszego tygodnia.
W prospektywnym badaniu kohortowym Agarwal i wsp. dokonali pomiaru STB w 24±6 h życia u 220 noworodków urodzonych w ≥35 tygodniu ciąży w celu przewidywania hiperbilirubinemii. Brak STB >6 mg/dl w 24±6 h życia praktycznie wykluczał możliwość późniejszego wystąpienia SHB (współczynnik prawdopodobieństwa testu ujemnego 0,07) w ciągu 5 dni od urodzenia. Jednak selektywny pomiar wyników tylko u tych noworodków, u których podczas obserwacji stwierdzono „kliniczny” poziom bilirubiny >10 mg/dl, wprowadził błąd weryfikacji w badaniu. W innym badaniu indyjskim stwierdzono, że wartość odcięcia wynosząca 3,99 mg/dl w 18-24 h ma czułość i swoistość wynoszące po 67% dla przewidywania późniejszego poziomu bilirubiny >15 mg/dl. Pełna obserwacja dotyczyła jednak tylko tych niemowląt, które pozostały w szpitalu z powodu choroby noworodka lub z przyczyn matczynych, takich jak cesarskie cięcie. Ponad 50% niemowląt, które były zdrowe i dlatego zostały wcześnie wypisane, nie było poddanych obserwacji. W pracy z Turcji przedstawiono godzinowy nomogram stężenia bilirubiny u noworodków z wiekiem ciążowym pomiędzy 35 a 37 tygodniem. Wartość STB większa niż 95
percentyla miała wysoką pozytywną wartość predykcyjną dla późniejszego rozwoju SHB. Natomiast wartość STB mniejsza niż 30 percentyl miała negatywną wartość predykcyjną wynoszącą około 90%. Dwa duże badania retrospektywne wykazały doskonałą zdolność predykcyjną wczesnego/przedwypisowego pomiaru STB z obszarem pod krzywą (AUC) wynoszącym 0,83 . W naszym badaniu zdolność dyskryminacyjna wartości 40. i 75. percentyla była niższa niż w poprzednio opisywanych badaniach. W naszym badaniu krzywa ROC przesunęła się w kierunku linii ukośnej, co spowodowało zmniejszenie zdolności dyskryminacyjnej (AUC= 0,73). Wysoka wyjściowa częstość występowania SHB w badaniu tureckim (25,3%) i naszym (20%) może wyjaśniać niezdolność niskich wartości percentyla do wykluczenia rozwoju późniejszego SHB, ograniczając w ten sposób użyteczność pomiaru STB przed wypisem.
Alternatywną strategią oceny ryzyka w przewidywaniu kolejnego SHB jest ocena klinicznych czynników ryzyka. Ciąża w chwili urodzenia, żółtaczka w wywiadzie wymagająca leczenia u poprzedniego rodzeństwa, infuzja oksytocyny, poród instrumentalny, uraz porodowy i nieodpowiednie karmienie zostały uznane za czynniki ryzyka SHB.
Jednak zdolność dyskryminacyjna modelu ryzyka klinicznego okazała się niższa niż wczesnego pomiaru STB. Newman i wsp. wykazali poprawę zdolności dyskryminacyjnej, gdy instrument ryzyka klinicznego został połączony z wczesnym pomiarem STB. Ze względu na znaczny odsetek noworodków z niską masą urodzeniową i wcześniaków w naszej kohorcie, spekulujemy, że połączenie tych obiektywnie mierzalnych klinicznych czynników ryzyka z wczesnym pomiarem STB wygenerowałoby model ryzyka o lepszej zdolności dyskryminacyjnej.
Na zewnętrzną przydatność obserwacji poczynionych w badaniu może wpływać stosunkowo duża częstość występowania hiperbilirubinemii w badanej kohorcie z powodu stosowania niższych progów bilirubiny dla rozpoczęcia fototerapii. W przeciwieństwie do krajów rozwiniętych, kernicterus był zgłaszany przy niższych poziomach szczytowej bilirubiny w Indiach, co wskazuje, że indyjskie noworodki mogą rozwijać uszkodzenia neurologiczne wywołane bilirubiną przy niższych szczytowych poziomach bilirubiny w surowicy. Ponadto, około jedna trzecia noworodków urodzonych w Indiach ma niską masę urodzeniową. Z tych powodów National Neonatology Forum of India w swoich wytycznych sugeruje stosowanie niższych progów dla rozpoczęcia fototerapii, szczególnie w obszarach o wyższej częstości występowania niedoboru dehydrogenazy glukozo-6-fosforanowej .
Mocne strony naszego badania obejmują prospektywny projekt badania, dużą wielkość próby, ponad 90% wskaźnik obserwacji i brak stronniczości weryfikacji. Nie udało nam się ustalić występowania wyników u około 7% zapisanych noworodków. Jednakże, ponieważ wczesne STB i charakterystyka demograficzna u tych utraconych w trakcie obserwacji noworodków były podobne do tych, u których nigdy nie rozwinęło się SHB, jest mało prawdopodobne, aby miało to wpływ na specyficzny dla danej godziny nomogram i instrument oceny ryzyka. Nie stosowaliśmy wysokosprawnej chromatografii cieczowej (HPLC), która jest „złotym standardem” metody pomiaru bilirubiny. Bilirubinę mierzyliśmy za pomocą częściej stosowanej przyłóżkowej metody spektrofotometrii. Bilimetr użyty w naszym badaniu miał niski współczynnik zmienności i był kalibrowany przed każdym użyciem.
Zalecamy, aby noworodki z STB przed wypisem ze szpitala, znajdujące się w strefie wysokiego lub pośredniego ryzyka, miały duże prawdopodobieństwo wczesnego rozwoju SHB, dlatego należy zapewnić im częstą obserwację. W warunkach, w których ścisła obserwacja nie jest możliwa, można rozważyć opóźnienie wypisu ze szpitala do czasu obniżenia stężenia bilirubiny do niższego poziomu ryzyka. Noworodki, u których STB przed wypisem ze szpitala znajduje się w strefie niższego pośredniego lub niskiego ryzyka, mogą być wypisane zgodnie z lokalną polityką. Należy jednak zapewnić odpowiednią obserwację, ponieważ nie można wykluczyć późniejszego rozwoju SHB.
Podsumowując, pomimo dobrej zdolności dyskryminacyjnej, wyższy poziom obserwacji w naszym badaniu zwiększa zaufanie do zdolności STB przed wypisem do przewidywania SHB u indyjskich niemowląt. Konieczne są dalsze badania w celu potwierdzenia skuteczności stref demarkacji ryzyka zdefiniowanych w tym godzinowo specyficznym nomogramie bilirubiny.
Współautorzy: DC: stworzył koncepcję i zaprojektował badanie; UP i SK: zebrali dane; DC: przeanalizował dane; UP: sporządził artykuł z krytycznym wkładem DC, SK i SJ. Wszyscy autorzy zatwierdzili ostateczną wersję manuskryptu do przedłożenia.
Funding: Brak; Konkurencyjne interesy: Nie zgłoszono.
1. Raport 2002-2003: National Neonatal Perinatal Database Network. New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. Identification of neonates at risk for hazardous hyperbilirubinemia: emerging clinical insights. Pediatr Clin North Am. 2009;56:671-87.
3. Postępowanie w hiperbilirubinemii u noworodka w 35 lub więcej tygodniu ciąży. Pediatrics. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Nieinwazyjna ocena całkowitej bilirubiny w surowicy przez wielopoziomowy reflektancji spektralnej długości u noworodków. Indian Pediatr. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Early neonatal hyperbilirubinemia using first day serum bilirubin level. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Prediction of hyperbilirubinemia in near-term and term infants. Pediatrics 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Noninvasive measurement of total serum bilirubin in a multiracial predischarge newborn population to assess the risk of severe hyperbilirubinemia. Pediatrics. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Predictive ability of a predischarge hour-specific serum bilirubin for subsequent significant hyperbilirubinemia in healthy term and near-term newborns. Pediatrics. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia. Pediatrics. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Systematic review of screening for bilirubin encephalopathy in neonates. Pediatrics. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Simple nomograms to calculate sample size in diagnostic studies. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Bilirubin screening for normal newborns: a critique of the hour-specific bilirubin nomogram. Pediatrics. 2009;124:1203-5.
13. Awasthi S, Rehman H. Early prediction of neonatal hyperbilirubinemia. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidence, course, and prediction of hyperbilirubinemia in near-term and term newborns. Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identifying newborns at risk of significant hyperbilirubinaemia: a comparison of two recommended approaches. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Combining clinical risk factors with serum bilirubin levels to predict hyperbilirubinemia in newborns. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Prediction and prevention of extreme neonatal hyperbilirubinemia in a mature health maintenance organization. Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. A comparison of alternative risk-assessment strategies for predicting significant neonatal hyperbilirubinemia in term and near-term infants. Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Risk factors for kernicterus in term babies with non-hemolytic jaundice. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Brainstem auditory evoked response in newborns with hyperbilirubinemia. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidence Based Clinical Practice Guidelines. National Neonatology Forum of India, New Delhi, India, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Preliminary report on neonatal screening for congenital hypothyroidism, congenital adrenal hyperplasia and glucose-6-phosphate dehydrogenase deficiency: a Chandigarh experience. Indian J Pediatr. 2010;77:969-73.
.
