Uma proporção significativa de neonatos desenvolve hiperbilirrubinemia que necessita de tratamento (hiperbilirrubinemia ‘significativa’, SHB) durante a primeira semana de vida . A diminuição da duração da hospitalização ao nascimento tem sido temporalmente associada ao aumento da incidência de danos neurológicos induzidos pela bilirrubinemia . Visitas domiciliares pós-descarga do trabalhador de saúde ou visitas hospitalares da família podem detectar a SHB, mas não são universalmente viáveis ou de baixo custo. Portanto, antes da alta hospitalar de recém-nascidos, é necessário identificar aqueles em risco de desenvolver níveis elevados de bilirrubina
Avaliação objetiva antes da alta para o risco de desenvolver SHB também é importante devido à precisão limitada da avaliação visual da extensão da icterícia. A estratificação do risco de SHB tem sido feita medindo a carga de bilirrubina (níveis absolutos ou taxa de aumento da bilirrubina total sérica ou bilirrubina transcutânea), a produção de bilirrubina (monóxido de carbono exalado) e identificando os fatores de risco clínico subjacentes .
A concentração de bilirrubina no sangue periférico é função das taxas específicas de idade de produção, metabolismo, excreção e reabsorção da bilirrubina. Portanto, a interpretação do nível de bilirrubina em um recém-nascido é baseada na idade pós-natal. O nomograma de bilirrubina específico por hora desenvolvido por Bhutani, et al. demonstrou que a medida da bilirrubina total sérica (STB) antes da alta hospitalar pode ajudar na identificação de recém-nascidos que estão em risco de ter valores percentuais mais altos de STB durante o acompanhamento. Entre os vários métodos de previsão de risco, a medição de STB antes da alta hospitalar demonstrou a melhor capacidade de discriminação entre os recém-nascidos norte-americanos. Entretanto, devido às diferenças geneticamente determinadas no metabolismo da bilirrubina e às dissemelhanças nas práticas alimentares, o curso clínico da hiperbilirrubinemia pode variar nos recém-nascidos pertencentes a diferentes etnias ou localizações geográficas. Além disso, o nomograma anterior foi desenvolvido a partir de uma coorte retrospectiva na qual a informação sobre o desfecho da hiperbilirrubinemia significativa era conhecida para apenas um quinto da população estudada. Portanto, a construção de um nomograma de bilirrubina específico para cada hora em diferentes populações neonatais é um pré-requisito para utilizar a medição da bilirrubina pré-descarga como estratégia de avaliação de risco.
Planejamos este estudo de coorte prospectivo para construir um nomograma de bilirrubina total horário específico em neonatos indianos e avaliar a eficácia da mensuração da bilirrubina pré-carga na previsão de hiperbilirrubinemia que necessita de tratamento entre neonatos a termo e a termo.
Métodos
Este estudo de coorte prospectivo com avaliação do desempenho do teste diagnóstico foi realizado de fevereiro a junho de 2010 em um hospital-escola no norte da Índia. O protocolo do estudo foi aprovado pelo Comitê de Ética do hospital e o consentimento livre e esclarecido por escrito foi obtido dos pais. Neonatos saudáveis com gestação ≥35 semanas ou peso ao nascer ≥2000 g foram elegíveis para a inscrição no estudo. Devido a razões logísticas, recém-nascidos que completaram 24 h de vida no domingo não foram elegíveis para a inscrição no estudo. Foram excluídos os neonatos com malformações congênitas graves, admissão em unidade de terapia intensiva neonatal, teste direto positivo de Coombs (foi feito se o grupo sanguíneo materno foi Rhesus negativo), fototerapia antes da primeira medição de bilirrubina ou incapacidade de vir para acompanhamento.
Medições e acompanhamento do estudo: A amostra de sangue para a primeira medição da bilirrubina total sérica foi retirada no momento da triagem metabólica às 18-30 h de idade pós-natal. O sangue capilar ou sangue venoso periférico foi coletado em micro-capilares pré-heparinizados. O sangue foi centrifugado imediatamente a 12000 rpm durante 5 minutos e a bilirrubina total foi medida com um espectrofotômetro (NEO-BIL plus, das srl, Itália).
Neonatos foram acompanhados durante a internação hospitalar e após a alta hospitalar até o 7º dia pós-natal. O momento da visita de acompanhamento foi decidido com base na idade na alta. Os bebês que tiveram alta antes das 48 h de idade foram chamados de volta entre 72 e 96 h de idade e os bebês que tiveram alta após as 48 h de idade entre 96 e 120 h de idade. Além da primeira medição de STB no momento da triagem metabólica, foram realizadas mais duas medições de STB em cada recém-nascido. Após a primeira medição, a decisão de realizar a segunda e terceira medição das STB foi baseada na avaliação clínica. A avaliação clínica do grau de icterícia foi acompanhada pela medição da bilirrubina transcutânea (TcB) com um bilímetro transcutâneo de vários comprimentos de onda (BiliChek, coeficiente de variação <5%). A estimativa de STB foi feita se as palmas das mãos/solos foram coradas com icterícia ou TcB foi >12 mg/dL ou dentro de 80% do limiar de fototerapia específico para a idade. Se não indicado clinicamente, a segunda e terceira medidas de STB foram feitas às 72-96 h e 96-144 h de idade pós-natal, respectivamente. Valores de STB após o início da fototerapia não foram incluídos para a construção do nomograma.
Clinical and epidemiological risk factors which may influence risk of developing SHB were recorded. Foram registrados os seguintes dados: peso ao nascer, gestação, sexo, educação materna e religião, paridade, complicações pré-natais, grupo sanguíneo ABO e Rh materno, modo de parto, tipo de anestesia utilizada durante o parto e uso de infusão de oxitocina durante o trabalho de parto. Além disso, a idade no início da alimentação, alimentação suplementar (além do aleitamento materno ou leite materno expresso) durante e após as primeiras 24 h após o nascimento e a idade na passagem das primeiras fezes também foram observadas.
Outcome: O resultado principal foi a hiperbilirrubinemia (SHB) significativa, que foi definida como a necessidade de fototerapia ou transfusão de troca para o tratamento da hiperbilirrubinemia. A decisão de iniciar a fototerapia foi tomada com base na idade do bebê em horas e nos níveis de STB, conforme adaptação local das diretrizes da American Academy of Pediatrics (AAP) . Em recém-nascidos com 38 ou mais semanas de gestação, o limiar de risco médio, e em recém-nascidos com 37 ou menos semanas de gestação completadas, o limiar de risco superior, foi utilizado para iniciar a fototerapia. Os valores do limiar de risco médio nas diretrizes da AAP são quase idênticos aos 95
valor do percentil 95valor do nomograma de Bhutani .
Análise estatística: Em um estudo prospectivo, foi observada hiperbilirrubinemia significativa em 10% dos neonatos nascidos na ≥35 semanas de gestação . Para a investigação de um teste diagnóstico com sensibilidade de pelo menos 95% (intervalo de confiança de 5%) e valor alfa de 0,05, foi necessário inscrever cerca de 1000 indivíduos .
Os dados foram analisados usando Stata 9 (StataCorp, College Station, TX, EUA). Para a construção do nomograma, os valores de STB foram agrupados em épocas de seis horas (idade±3 horas) para a idade pós-natal até 48 h e de doze horas (idade±6 horas) para a idade acima de 48 h. Os dados para cada época foram examinados para simetria. Os valores dos percentis 5
th, 10th, 25th, 40th, 75th, 90th e 95th foram calculados para cada época. Microsoft Excel (Microsoft Corporation, Richmond, US) foi usado para traçar o nomograma de bilirrubina por hora. O nomograma suavizado representando os percentis 40º, 75º e 95º foi traçado utilizando modelagem de coluna cúbica com o pacote GAMLSS para o software estatístico R. Após suavização, 36,5% dos casos estavam abaixo da linha do percentil 40, 77,8% estavam abaixo da linha do percentil 75 e 95,1% estavam abaixo da linha do percentil 95. A capacidade preditiva do nomograma foi avaliada através do cálculo da sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e razão de verosimilhança, através do traçado da curva de características receiver-operating characteristics (ROC) e do cálculo da estatística c.
Resultados
Durante o período de estudo, um total de 1255 neonatos nasceram, dos quais 1090 foram elegíveis para a inscrição. Entre estes, 93 foram excluídos por diferentes razões (Fig. 1). Um total de 997 recém-nascidos foram inscritos no estudo. O valor médio ± DP para o peso ao nascer foi de 2627±536 g e para a idade gestacional foi de 37,8±1,5 semanas (mediana e IQR: 38 e 37-39) (Tabela Web I). A maioria dos bebês do estudo nasceu após o curso pré-natal sem complicações e teve uma transição sem problemas para a vida extra-uterina. Mais de 80% dos recém-nascidos foram amamentados exclusivamente durante a internação.
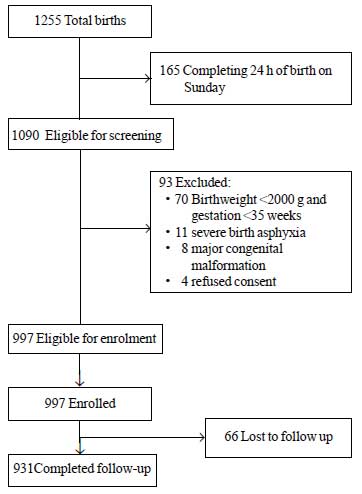
Fig.1 Fluxo do estudo.
Construção do nomograma de bilirrubina: A primeira medição de bilirrubina foi realizada aos 23,3±6,3 h de idade e a média STB foi de 7,0±2,0 mg/dL. Vinte e nove (2,9%) neonatos necessitaram de fototerapia baseada na primeira mensuração da bilirrubina. Nesses neonatos a fototerapia foi iniciada aos 27±5,6 h de idade com níveis de STB de 12,3±2,0 mg/dL. Sessenta e seis (6,6%) recém-nascidos foram perdidos para acompanhamento após a alta hospitalar do estudo. O primeiro valor de bilirrubina nesses neonatos foi comparável aos neonatos que nunca desenvolveram SHB (6,5±1,9 vs 6,7±1,7 mg/dL, P=0,54) e foi significativamente inferior aos que desenvolveram SHB (6,5±1,9 vs 8,5±2,2 mg/dL, P< 0,001).
Para a construção do nomograma e avaliação da distribuição dos valores de BST, a idade pós-natal foi dividida em épocas de seis horas para a idade pós-natal até 48 h e de doze horas para a idade acima de 48 h. A BST em cada uma das épocas, exceto às 42 h, foi observada uma distribuição simétrica (Fig. 2). A distribuição dos valores STB às 42 h foi observada como sendo positivamente enviesada e esses valores não foram utilizados para a construção do nomograma.
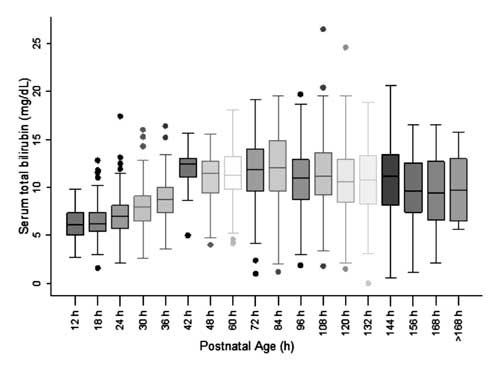
Fig. 2 Box-wisker plot mostrando a distribuição da bilirrubina total sérica.
Os 5
th, 10th, 25th, 40th, 75th, 90th e 95thpercentile values for each epoch were calculated. O nomograma de bilirrubina sérica específica para a idade foi desenhado com os valores dos percentis 40º, 75º e 95º no avanço da idade pós-natal (Fig. 3).
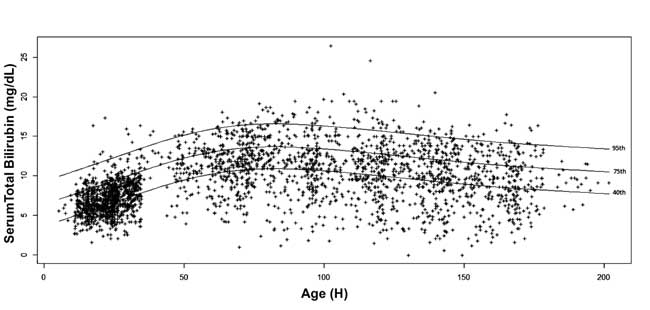
Fig. 3 Bilirrubina nomograma – bilirrubina total sérico específico para a hora, representado como percentis 40º, 75º e 95º.
>
Habilidade preditiva da pré-descarga STB: No total, 199 (20%) neonatos desenvolveram SHB (fototerapia recebida). O primeiro valor de bilirrubina foi usado para prever a necessidade de tratamento posterior para a hiper-bilirrubinemia. Se mais de dois valores foram obtidos nas primeiras 48 h após o nascimento, foi utilizado um valor percentil mais alto para fins de previsão.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Bilirrubina total sérica pré-descarga | SHB+ | Rendimento do teste | ||||||
| Percentil | Número(n=928) | SHB+ | SHB- | PPV | NPV | Sensibilidade | Especificidade | |
| Acima do percentil 95 | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 | |
| Below 95th percentile | 879 | 165 | 714 | |||||
| Acima do percentil 75 | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 | |
| Below percentil 75 | 689 | 92 | 597 | |||||
| Acima do percentil 40 | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 | |
| Below 40th percentile | 342 | 32 | 310 | |||||
>
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. > |
||||||||
Antes de neonatos que tiveram pré-medição STB de descarga e acompanhamento completo (n=928), em 49 (5.3%) neonatos pré-descarga STB foi mais do que o percentil 95 da distribuição por idade (Tabela I). Destes 34 recém-nascidos, 34 necessitaram subseqüentemente de fototerapia (valor preditivo positivo: 69,4%, sensibilidade: 17,1%). Em 342 (36,8%) recém-nascidos com pré-descarga, o STB foi inferior ao percentil 40 da distribuição específica de idade. Destes, 310 recém-nascidos não necessitaram de tratamento subsequente para a hiperbilirrubinemia (valor preditivo negativo: 90,6% e especificidade: 42,5%). O valor preditivo positivo do corte do percentil 75 foi de 44,8% e o valor preditivo negativo foi de 86,2%. A curva ROC como mostrado na Fig. 4 ilustra o desempenho diagnóstico de cada corte do percentil com área sob curva (c-estatística) sendo 0,73.
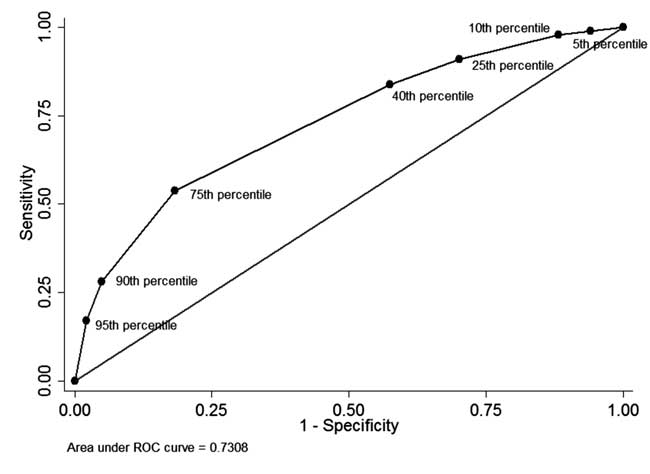
Fig. 4 A curva ROC para a capacidade diagnóstica de diferentes cortes de percentil de bilirrubina total de soro antes da descarga.
Likelihood ratio (LR) é uma melhor ferramenta para medir o desempenho do teste diagnóstico, uma vez que a relação não é afetada pela mudança na prevalência de fundo do resultado. A LR do teste positivo (LR+, probabilidade de teste positivo em doentes/risco positivo em não doentes) foi calculada para cada zona de demarcação de risco. A pré-descarga STB do percentil ≥95th foi atribuída para estar na zona de alto risco, entre 75º e 94º centilo na zona de risco intermédio superior, entre 40º e 74º centilo na zona de risco intermédio inferior e abaixo do percentil 40º na zona de baixo risco. Entre 49 neonatos na zona de alto risco 34 desenvolveram SHB; portanto, o LR positivo para STB na zona de alto risco foi de 8,26 (Tabela II). Entre 190 neonatos na zona de risco intermédio superior, 73 desenvolveram SHB; portanto, a LR positiva para STB nesta zona de risco foi de 2,30. Da mesma forma, a LR positiva para STB na zona de risco intermédio inferior foi de 0,76 e para a zona de baixo risco foi de 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Pré-descarga de bilirrubina total sérica | > | > Desempenho do teste | > | ||||
| Pré-zona de risco cumulativo de descarga | Percentile | Total | SHB+ | SHB- | P:Uma proporção | Probabilidade da doença | LR+ |
| High-risk | ≥95th | 49 | 34 | 15 | 7:3 | 7/10 | >8.26 |
| Intermediário superior | 75° a 94° | 190° | 73° | 117° | 2:3 | 2/5 | 2.30 |
| Primeiro intermediário | 40º a 74º | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 |
| Baixo risco | <40 | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 |
| 928 | 199 | 729 | 1:4 | 1/5 | |||
Discussão
Avaliação do risco de pré-descarga para posterior desenvolvimento de SHB é recomendada como uma estratégia potencial para reduzir a incidência de danos neurológicos induzidos pela bilirrubina ou kernicterus. Neste estudo de coorte prospectivo, construímos um nomograma de bilirrubina sérica específico para uma hora em um subconjunto de neonatos do norte da Índia e avaliamos a eficácia da demarcação de risco por meio da medida STB pré-descarga na previsão da necessidade subseqüente de fototerapia (SHB). A incidência básica de SHB foi alta em nossa coorte de estudo com 2 de cada 10 neonatos desenvolvendo SHB. A localização da STB pré-descarga em duas zonas de maior risco aumentou significativamente o risco de SHB subsequente com 7 em cada 10 neonatos em zona de alto risco desenvolvendo SHB (LR positivo=8,26) e 4 em cada 10 neonatos em zona de risco intermediário superior desenvolvendo SHB (LR positivo=2,3). A localização do STB pré-descarga na zona de baixo risco diminuiu significativamente o risco de SHB subsequente com 1 em cada 10 recém-nascidos a desenvolver SHB (LR positivo = 0,37). No entanto, como o valor preditivo negativo de corte de baixo risco era apenas 90%, a localização na zona de baixo risco não foi capaz de descartar a possibilidade de SHB subseqüente.
Bhutani, et al. mostraram em uma grande coorte que os neonatos com STB pré-descarga em zonas de alto e alto risco intermediário têm maior probabilidade de ter SHB durante o acompanhamento. Os autores construíram gráficos de percentil de bilirrubina sérica em diferentes idades pós-natais em neonatos a curto prazo e a termo. Verificaram que 6,1% dos recém-nascidos tinham bilirrubina sérica pré-descarga >95º percentil; 32,1% desses lactentes apresentaram hiperbilirrubinemia posteriormente. Em comparação ao nomograma específico por hora de Bhutani, et al. , os valores percentuais de STB neste estudo são maiores em até 2 mg/dL até 84-108 h de idade pós-natal. Neonatos de origem norte-indígena têm sido observados para atingir valores mais altos de bilirrubina e têm maior incidência de hiperbilirrubinemia. A média de STB de 7,0±2,0 mg/dL observada neste estudo está entre o 75º e 95º percentil do nomograma de Bhutani. Da mesma forma, Agarwal et al. relataram uma média de STB de 5,9±1,8 mg/dL às 24 h de idade pós-natal, que está próxima do valor do percentil 75 do nomograma de Bhutani. Maior proporção de neonatos pré-termo ou de baixo peso ao nascer e maior taxa de amamentação exclusiva em nosso estudo podem ser os fatores que contribuem para o aumento dos valores de STB e aumento da incidência de SHB. Além disso, nossa decisão de usar limiares de fototerapia AAP médios em vez de superiores, mesmo em recém-nascidos de baixo risco, também aumentou a incidência de SHB. Além das 108 h de idade pós-natal, os valores percentuais de TSB neste estudo são inferiores aos valores correspondentes no nomograma do Bhutani. A inclusão de valores de TSB de neonatos que foram seguidos seletivamente no julgamento clínico para construção do nomograma pode ter resultado no uso de níveis mais altos de STB para traçar o nomograma do Bhutani, diminuindo assim a generalizabilidade deste último. No presente estudo, como o acompanhamento foi concluído independentemente da gravidade da hiperbilirrubinemia, o nomograma atinge o seu pico no 4º e 5º dias de idade pós-natal com declínio natural ao final da primeira semana. o percentil teve um alto valor preditivo positivo para o desenvolvimento subsequente de SHB . Contudo, o valor STB inferior ao percentil 30 tinha um valor preditivo negativo de cerca de 90%. Dois grandes estudos retrospectivos relataram excelente capacidade preditiva de medida precoce/pré-descarga de STB com área sob curva (AUC) de 0,83 . Em nosso estudo, a capacidade de discriminação dos percentis 40° e 75° foi menor do que a relatada anteriormente. Isso deslocou a curva ROC em nosso estudo para a linha diagonal resultando em diminuição da capacidade de discriminação (AUC= 0,73). A alta incidência de base de SHB em turco (25,3%) e nosso estudo (20%) pode explicar a incapacidade de valores baixos de percentil para descartar o desenvolvimento de SHB subseqüente, limitando assim a utilidade da medição de STB pré-descarga.
Uma estratégia alternativa de avaliação de risco para predição de SHB subseqüente é a avaliação dos fatores de risco clínico. Gestação ao nascimento, história de icterícia necessitando de tratamento em irmãos anteriores, infusão de oxitocina, parto instrumental, trauma no nascimento e alimentação inadequada têm sido implicados como fatores de risco de SHB .
No entanto, a capacidade discriminante do modelo de risco clínico tem sido relatada como sendo menor do que a da medição precoce da STB . Newman, et al. relataram melhora na capacidade de discriminação quando um instrumento de risco clínico foi combinado com a medição precoce de STB . Devido à proporção significativa de baixo peso ao nascer e neonatos pré-termo em nossa coorte, especulamos que a combinação desses fatores de risco clínico objetivamente mensuráveis com a medida precoce do STB geraria um modelo de risco com melhor capacidade discriminatória.
Aplicabilidade externa das observações feitas no estudo pode ser influenciada pela incidência relativamente alta de hiperbilirrubinemia na coorte do estudo devido ao uso de limiares mais baixos de bilirrubina para iniciar a fototerapia. Ao contrário dos países desenvolvidos, o kernicterus tem sido relatado em níveis mais baixos de pico de bilirrubina na Índia, o que indica que os neonatos indianos podem desenvolver danos neurológicos induzidos pela bilirrubina em níveis séricos mais baixos de pico de bilirrubina. Além disso, cerca de um terço dos neonatos nascidos na Índia são de baixo peso à nascença. Devido a essas razões, o National Neonatology Forum of India em suas diretrizes sugere o uso de limiares mais baixos para iniciar a fototerapia, especialmente em áreas com maior incidência de deficiência de glicose-6-fosfato desidrogenase .
Força de nosso estudo inclui desenho de estudo prospectivo, tamanho da amostra grande, mais de 90% de taxa de acompanhamento e ausência de viés de verificação. Não pudemos verificar a ocorrência de resultados em cerca de 7% dos neonatos inscritos. Entretanto, como as características demográficas e STB precoces desses recém-nascidos perdidos foram semelhantes às daqueles que nunca desenvolveram SHB, é improvável que o nomograma específico por hora e o instrumento de avaliação de risco sejam afetados. Não utilizamos cromatografia líquida de alta performance (HPLC) que é o método “padrão-ouro” para a medição da bilirrubina. Medimos a bilirrubina por um método de espectrofotometria de beira de leito mais utilizado. O bilimetro usado em nosso estudo tinha baixo coeficiente de variação e foi calibrado antes de cada uso.
Recomendamos que como os neonatos com STB pré-descarga em zona de alto ou alto risco intermediário tenham alta probabilidade de desenvolver SHB precocemente e um acompanhamento frequente deve ser assegurado. Em ambientes onde o acompanhamento próximo não é viável, pode ser considerado adiar a alta do hospital até que a bilirrubina caia para zonas de menor risco. Neonatos com pré-descarga STB em zonas de menor risco intermediário ou de baixo risco podem ter alta de acordo com a política local. No entanto, um acompanhamento adequado deve ser assegurado, pois não se pode descartar o desenvolvimento subseqüente de SHB.
Em conclusão, apesar da justa capacidade discriminatória, o maior nível de acompanhamento em nosso estudo aumenta a confiança na capacidade de STB pré-descarga para prever SHB em bebês indianos. Estudos adicionais são necessários para validar o desempenho das zonas de demarcação de risco definidas neste nomograma de bilirrubina por hora.
Contribuintes: DC: conceitualizou e projetou o estudo; UP e SK: coletou dados; DC: analisou dados; UP: redigiu o trabalho com entradas críticas de DC, SK e SJ. Todos os autores aprovam a versão final do manuscrito para submissão.
Funding: Nenhum; Interesses concorrentes: Nenhum declarado.
1. Relatório 2002-2003: Rede Nacional de Bancos de Dados Perinatais Neonatais. Nova Delhi: Fórum Nacional de Neonatologia da Índia; 2004.
2. Watchko JF. Identification of neonates at risk for hazardous hyperbilirubinemia: emerging clinical insights. Pediatr Clin North Am. 2009;56:671-87.
3. Gestão da hiperbilirrubinemia no recém-nascido com 35 ou mais semanas de gestação. Pediatria. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Estimativa não invasiva da bilirrubina sérica total por reflectância espectral multi-comprimento de onda em neonatos. Pediatra indiano. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Hiperbilirrubinemia neonatal precoce usando o nível sérico de bilirrubina no primeiro dia. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Predição de hiperbilirrubinemia em bebês a curto prazo e a termo. Pediatria 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Medida não-invasiva da bilirrubina sérica total em uma população de recém-nascidos com pré-cimeira multirracial para avaliar o risco de hiperbilirrubinemia grave. Pediatria. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Predictive ability of a predischarge hour-specific serum bilirubinemia for subsequent significant hyperbilirubinemia in healthy term and near-term newborns. Pediatria. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia. Pediatria. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Revisão sistemática do rastreio da encefalopatia por bilirrubina em recém-nascidos. Pediatria. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Nomogramas simples para calcular o tamanho da amostra em estudos diagnósticos. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Triagem bilirrubina para recém-nascidos normais: uma crítica ao nomograma de bilirrubina por hora. Pediatria. 2009;124:1203-5.
13. Awasthi S, Rehman H. Early prediction of neonatal hyperbilirubinemia. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidência, curso e predição de hiperbilirrubinemia em recém-nascidos a curto prazo e a termo. Pediatria. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identificar recém-nascidos em risco de hiperbilirrubinemia significativa: uma comparação de duas abordagens recomendadas. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Combinando fatores de risco clínico com níveis séricos de bilirrubina para prever a hiperbilirrubinemia em recém-nascidos. Arch Pediatr Adolescente Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Previsão e prevenção da hiperbilirrubinemia neonatal extrema em uma organização de manutenção de saúde madura. Arq. Pediatra Adolescente Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. Uma comparação de estratégias alternativas de avaliação de risco para predizer hiperbilirrubinemia neonatal significativa em bebês a termo e a curto prazo. Pediatria. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Fatores de risco para kernicterus em bebês a termo com icterícia não-hemolítica. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Resposta auditiva de tronco encefálico evocada em recém-nascidos com hiperbilirrubinemia. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidence Based Clinical Practice Guidelines. Fórum Nacional de Neonatologia da Índia, Nova Deli, Índia, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Preliminary report on neonatal screening for congenital hypothyroidism, congenital adrenal hyperplasia and glucose-6-phosphate dehydrogenase deficiency: a Chandigarh experience. Pediatra indiano J. 2010;77:969-73.
