Ein erheblicher Anteil der Neugeborenen entwickelt in der ersten Lebenswoche eine behandlungsbedürftige Hyperbilirubinämie („signifikante“ Hyperbilirubinämie, SHB). Eine Verkürzung der Dauer des Krankenhausaufenthalts bei der Geburt wurde zeitlich mit einem erhöhten Auftreten von bilirubinbedingten neurologischen Schäden in Verbindung gebracht. Nach der Entlassung können Hausbesuche durch medizinisches Personal oder Krankenhausbesuche durch die Familie eine SHB aufdecken, sind aber nicht überall durchführbar oder kosteneffektiv. Daher müssen vor der Entlassung von Neugeborenen aus dem Geburtskrankenhaus diejenigen identifiziert werden, bei denen ein Risiko für die Entwicklung hoher Bilirubinwerte besteht
Eine objektive Bewertung des Risikos für die Entwicklung einer SHB vor der Entlassung ist auch deshalb wichtig, weil die visuelle Bewertung des Ausmaßes der Gelbsucht nur begrenzt genau ist. Die Risikostratifizierung für SHB erfolgte durch Messung der Bilirubinbelastung (absolute Werte oder Anstiegsrate des Gesamtbilirubins im Serum oder des transkutanen Bilirubins), der Bilirubinproduktion (ausgeatmetes Kohlenmonoxid) und der Identifizierung der zugrunde liegenden klinischen Risikofaktoren.
Die Bilirubinkonzentration im peripheren Blut ist eine Funktion der altersspezifischen Raten der Bilirubinproduktion, des Metabolismus, der Ausscheidung und der Reabsorption. Die Interpretation des Bilirubinspiegels bei einem Neugeborenen basiert daher auf dem postnatalen Alter. Das von Bhutani et al. entwickelte stundenspezifische Bilirubin-Nomogramm hat gezeigt, dass die Messung des Serum-Gesamtbilirubins (STB) vor der Entlassung aus dem Geburtskrankenhaus dazu beitragen kann, Neugeborene zu identifizieren, bei denen das Risiko besteht, dass sie während der Nachsorge höhere Perzentilwerte des STB aufweisen. Von den verschiedenen Methoden zur Risikovorhersage hat die STB-Messung vor der Entlassung bei nordamerikanischen Neugeborenen die beste Unterscheidungsfähigkeit gezeigt. Aufgrund genetisch bedingter Unterschiede im Bilirubinstoffwechsel und unterschiedlicher Ernährungsgewohnheiten kann der klinische Verlauf der Hyperbilirubinämie bei Neugeborenen verschiedener Ethnien oder geografischer Regionen jedoch variieren. Darüber hinaus wurde das frühere Nomogramm anhand einer retrospektiven Kohorte entwickelt, bei der die Informationen über den Ausgang einer signifikanten Hyperbilirubinämie nur für ein Fünftel der Studienpopulation bekannt waren. Daher ist die Konstruktion eines stundenspezifischen Bilirubin-Nomogramms in verschiedenen neonatalen Populationen eine Voraussetzung für die Verwendung der Bilirubinmessung vor der Entlassung als Strategie zur Risikobewertung.
Wir planten diese prospektive Kohortenstudie, um ein stundenspezifisches Serum-Gesamtbilirubin-Nomogramm bei indischen Neugeborenen zu erstellen und die Wirksamkeit der Bilirubinmessung vor der Entlassung bei der Vorhersage einer behandlungsbedürftigen Hyperbilirubinämie bei Termingeborenen und Spätgeborenen zu bewerten.
Methoden
Diese prospektive Kohortenstudie mit Bewertung der diagnostischen Testleistung wurde von Februar bis Juni 2010 in einem Lehrkrankenhaus in Nordindien durchgeführt. Das Studienprotokoll wurde von der Ethikkommission des Krankenhauses genehmigt und die schriftliche Einwilligung der Eltern wurde eingeholt. Gesunde Neugeborene mit einer Schwangerschaftsdauer von ≥35 Wochen oder einem Geburtsgewicht von ≥2000 g konnten in die Studie aufgenommen werden. Aus logistischen Gründen konnten Neugeborene, die am Sonntag 24 Stunden alt wurden, nicht in die Studie aufgenommen werden. Ausgeschlossen wurden Neugeborene mit schweren angeborenen Fehlbildungen, die auf der Neugeborenen-Intensivstation aufgenommen wurden, ein positiver direkter Coombs-Test (wurde durchgeführt, wenn die Blutgruppe der Mutter Rhesus-negativ war), eine Phototherapie vor der ersten Bilirubinmessung oder die Unfähigkeit, zur Nachuntersuchung zu erscheinen.
Studienmessungen und Follow-up: Die Blutprobe für die erste Messung des Serum-Gesamtbilirubins wurde zum Zeitpunkt des Stoffwechselscreenings im Alter von 18-30 Stunden nach der Geburt entnommen. Kapillar- oder peripheres Venenblut wurde in vorheparinisierten Mikrokapillaren entnommen. Das Blut wurde sofort bei 12000 U/min für 5 Minuten zentrifugiert und das Gesamtbilirubin mit einem Spektralphotometer (NEO-BIL plus, das srl, Italien) gemessen.
Die Neugeborenen wurden während des Krankenhausaufenthalts und nach der Entlassung bis zum Ende des 7. postnatalen Tages nachbeobachtet. Der Zeitpunkt der Nachuntersuchung wurde anhand des Alters bei der Entlassung festgelegt. Säuglinge, die vor dem 48. Lebensmonat entlassen wurden, wurden zwischen 72 und 96 Stunden und Säuglinge, die nach dem 48. Lebensmonat entlassen wurden, zwischen 96 und 120 Stunden nachuntersucht. Zusätzlich zur ersten Messung der STB zum Zeitpunkt des Stoffwechselscreenings wurden bei jedem Neugeborenen zwei weitere STB-Messungen durchgeführt. Nach der ersten Messung wurde die Entscheidung über die Durchführung der zweiten und dritten STB-Messung auf der Grundlage der klinischen Beurteilung getroffen. Die klinische Beurteilung des Grades der Gelbsucht wurde von einer transkutanen Bilirubinmessung (TcB) mit einem transkutanen Bilimeter mit mehreren Wellenlängen (BiliChek, Variationskoeffizient <5%) begleitet. Die STB-Bestimmung wurde durchgeführt, wenn die Handflächen/Sohlen mit Ikterus gefärbt waren oder der TcB-Wert >12 mg/dL oder innerhalb von 80 % des altersspezifischen Schwellenwerts für die Phototherapie lag. Falls klinisch nicht indiziert, wurden eine zweite und dritte STB-Messung im Alter von 72-96 h bzw. 96-144 h nach der Geburt durchgeführt. STB-Werte nach Beginn der Phototherapie wurden bei der Erstellung des Nomogramms nicht berücksichtigt.
Klinische und epidemiologische Risikofaktoren, die das Risiko der Entwicklung einer SHB beeinflussen können, wurden erfasst. Folgende Daten wurden erfasst: Geburtsgewicht, Schwangerschaftsdauer, Geschlecht, Bildung und Religion der Mutter, Parität, vorgeburtliche Komplikationen, mütterliche ABO- und Rhesus-Blutgruppe, Art der Entbindung, Art der Anästhesie während der Entbindung und Verwendung von Oxytocin-Infusion während der Wehen. Darüber hinaus wurden das Alter bei Beginn der Fütterung, die zusätzliche Fütterung (außer Stillen oder abgepumpter Muttermilch) während und nach den ersten 24 Stunden nach der Geburt und das Alter beim ersten Stuhlgang erfasst.
Ergebnis: Hauptergebnis war eine signifikante Hyperbilirubinämie (SHB), die als Notwendigkeit einer Phototherapie oder Austauschtransfusion zur Behandlung der Hyperbilirubinämie definiert wurde. Die Entscheidung, eine Phototherapie zu beginnen, wurde auf der Grundlage des Alters des Babys in Stunden und der STB-Werte getroffen, entsprechend der lokalen Anpassung der Richtlinien der American Academy of Pediatrics (AAP). Bei Neugeborenen, die in der 38. oder mehr Schwangerschaftswochen geboren wurden, wurde ein mittlerer Risikoschwellenwert und bei Neugeborenen, die in der 37. oder weniger abgeschlossenen Schwangerschaftswochen geboren wurden, ein höherer Risikoschwellenwert für die Einleitung der Phototherapie verwendet. Die Schwellenwerte für das mittlere Risiko in den AAP-Leitlinien sind fast identisch mit den 95
Perzentilwerten des Bhutani-Nomogramms.
Statistische Analyse: In einer prospektiven Studie wurde eine signifikante Hyperbilirubinämie bei 10 % der Neugeborenen beobachtet, die in einer Schwangerschaftswoche von ≥35 Wochen geboren wurden. Um einen diagnostischen Test mit einer Sensitivität von mindestens 95 % (Konfidenzintervall 5 %) und einem Alpha-Wert von 0,05 zu ermitteln, mussten etwa 1000 Probanden erfasst werden .
Die Daten wurden mit Stata 9 (StataCorp, College Station, TX, USA) ausgewertet. Für die Erstellung des Nomogramms wurden die STB-Werte in Sechs-Stunden-Epochen (Alter±3 Stunden) für das postnatale Alter bis 48 Stunden und Zwölf-Stunden-Epochen (Alter±6 Stunden) für das Alter nach 48 Stunden zusammengefasst. Für jede Epoche wurden das 5
te, 10te, 25te, 40te, 75te, 90te und 95te Perzentil berechnet. Microsoft Excel (Microsoft Corporation, Richmond, US) wurde verwendet, um das stundengenaue Bilirubin-Nomogramm zu erstellen. Das geglättete Nomogramm, das das 40., 75. und 95. Perzentil darstellt, wurde mithilfe der kubischen Stachelmodellierung mit dem GAMLSS-Paket für die Statistiksoftware R gezeichnet. Nach der Glättung lagen 36,5 % der Fälle unter der 40. Perzentillinie, 77,8 % der Fälle lagen unter der 75. Perzentillinie und 95,1 % der Fälle unter der 95. Die Vorhersagekraft des Nomogramms wurde durch Berechnung von Sensitivität, Spezifität, positivem prädiktivem Wert, negativem prädiktivem Wert und Likelihood Ratio sowie durch Erstellung einer Receiver-Operating-Characteristics (ROC)-Kurve und Berechnung der c-Statistik bewertet.
Ergebnisse
Während des Studienzeitraums wurden insgesamt 1255 Neugeborene geboren, von denen 1090 für die Aufnahme in die Studie in Frage kamen. Von diesen wurden 93 aus verschiedenen Gründen ausgeschlossen (Abb. 1). Insgesamt wurden 997 Neugeborene in die Studie aufgenommen. Der mittlere ± SD-Wert für das Geburtsgewicht lag bei 2627±536 g und für das Gestationsalter bei 37,8±1,5 Wochen (Median und IQR: 38 und 37-39) (Web-Tabelle I). Die meisten Studienkinder wurden nach einem unkomplizierten Schwangerschaftsverlauf geboren und hatten einen problemlosen Übergang ins extrauterine Leben. Mehr als 80 % der Neugeborenen wurden während des Krankenhausaufenthalts ausschließlich gestillt.
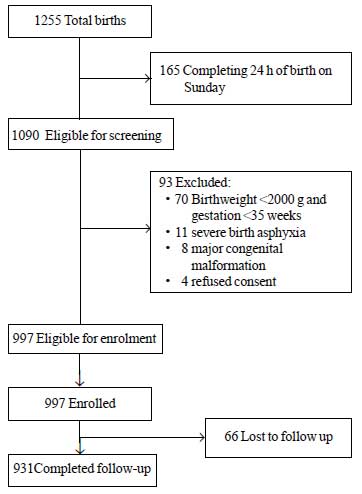
Abb.1 Studienablauf.
Konstruktion des Bilirubin-Nomogramms: Die erste Messung von Bilirubin wurde im Alter von 23,3±6,3 Stunden durchgeführt, und der mittlere STB-Wert betrug 7,0±2,0 mg/dL. Neunundzwanzig (2,9%) Neugeborene benötigten aufgrund der ersten Bilirubinmessung eine Phototherapie. Bei diesen Neugeborenen wurde die Phototherapie im Alter von 27±5,6 Stunden mit einem STB-Wert von 12,3±2,0 mg/dL begonnen. Sechsundsechzig (6,6 %) Neugeborene wurden nach der Entlassung aus dem Studienkrankenhaus nicht weiter beobachtet. Der erste Bilirubinwert bei diesen Neugeborenen war vergleichbar mit Neugeborenen, die nie eine SHB entwickelt hatten (6,5±1,9 vs. 6,7±1,7 mg/dL, P=0,54) und war signifikant niedriger als bei denen, die eine SHB entwickelten (6,5±1,9 vs. 8,5±2,2 mg/dL, P< 0,001).
Für die Erstellung des Nomogramms und die Beurteilung der Verteilung der STB-Werte wurde das postnatale Alter in sechsstündige Epochen für das postnatale Alter bis 48 Stunden und in zwölfstündige Epochen für das Alter nach 48 Stunden unterteilt. Die STB-Werte waren in jeder Epoche mit Ausnahme von 42 Stunden symmetrisch verteilt (Abb. 2). Die Verteilung der STB-Werte nach 42 Stunden erwies sich als positiv schief, und diese Werte wurden nicht für die Erstellung des Nomogramms verwendet.
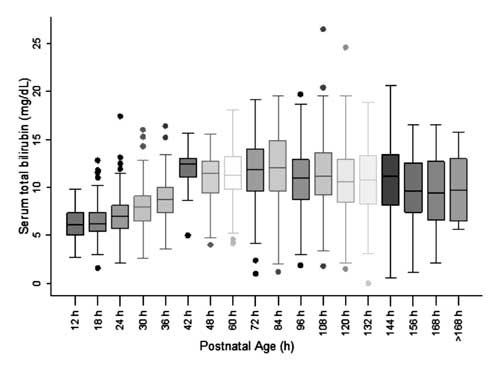
Abb. 2 Box-Whisker-Plot, der die Verteilung des Serum-Gesamtbilirubins zeigt.
Die 5
-, 10-, 25-, 40-, 75-, 90- und 95-Perzentil-Werte für jede Epoche wurden berechnet. Es wurde ein altersspezifisches Serumbilirubin-Nomogramm mit 40-, 75- und 95-Perzentilwerten bei fortschreitendem postnatalem Alter erstellt (Abb. 3).
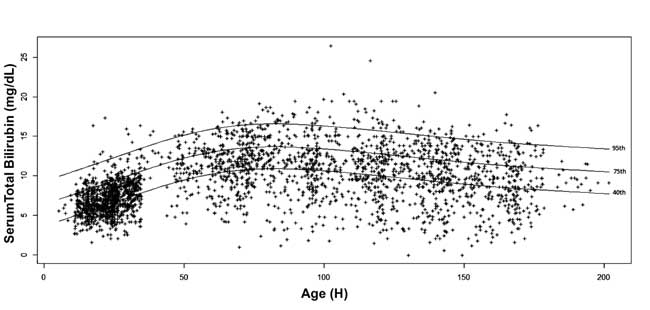
Abb. 3 Bilirubin-Nomogramm – stundengenaues Serum-Gesamtbilirubin dargestellt als 40., 75. und 95. Perzentile.
Vorhersagekraft der STB vor der Entlassung: Insgesamt entwickelten 199 (20 %) Neugeborene eine SHB (erhielten eine Phototherapie). Der erste Bilirubinwert wurde zur Vorhersage des späteren Behandlungsbedarfs bei Hyperbilirubinämie verwendet. Wurden in den ersten 48 Stunden nach der Geburt mehr als zwei Werte ermittelt, wurde der höhere Perzentilwert für die Vorhersage verwendet.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Gesamtbilirubin vor der Entlassung | Ergebnis | Testleistung | |||||
| Perzentil | Anzahl (n=928) | SHB+ | SHB- | PPV | NPV | Empfindlichkeit | Spezifität |
| Über 95. Perzentil | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 |
| unter dem 95. Perzentil | 879 | 165 | 714 | ||||
| Über 75. Perzentil | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 |
| unter dem 75. Perzentil | 689 | 92 | 597 | ||||
| Über 40. Perzentil | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 |
| unter dem 40. Perzentil | 342 | 32 | 310 | ||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
|||||||
Unter den Neugeborenen, bei denen vor derEntlassung eine STB-Messung durchführten und die Nachuntersuchung abschlossen (n=928), in 49 (5.3%) lag die STB vor der Entlassung über dem 95. Perzentil der altersspezifischen Verteilung (Tabelle I). Bei 34 dieser Neugeborenen war anschließend eine Phototherapie erforderlich (positiver prädiktiver Wert: 69,4 %, Sensitivität: 17,1 %). Bei 342 (36,8 %) Neugeborenen lag die STB vor der Entlassung unter dem 40. Perzentil der altersspezifischen Verteilung. Davon benötigten 310 Neugeborene keine weitere Behandlung wegen Hyperbilirubinämie (negativer prädiktiver Wert: 90,6 % und Spezifität: 42,5 %). Der positive prädiktive Wert des 75. Perzentils lag bei 44,8 % und der negative prädiktive Wert bei 86,2 %. Die ROC-Kurve in Abb. 4 veranschaulicht die diagnostische Leistung der einzelnen Perzentil-Cutoffs mit einer Fläche unter der Kurve (c-Statistik) von 0,73.
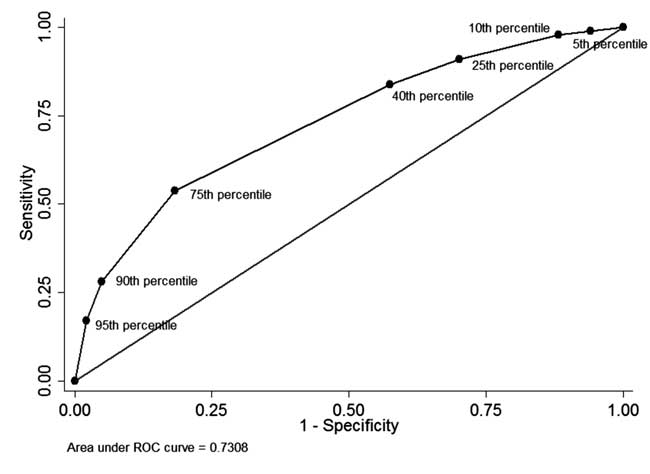
Abb. 4 Die ROC-Kurve für die diagnostische Leistungsfähigkeit verschiedener Perzentil-Cut-offs des Serum-Gesamtbilirubins vor der Entlassung.
Das Wahrscheinlichkeitsverhältnis (LR) ist ein besseres Instrument zur Messung der diagnostischen Testleistung, da das Verhältnis nicht von Änderungen der Hintergrundprävalenz des Ergebnisses beeinflusst wird. Die LR eines positiven Tests (LR+, Wahrscheinlichkeit eines positiven Tests bei Erkrankten/Wahrscheinlichkeit eines positiven Tests bei Nicht-Erkrankten) wurde für jede Risikoabgrenzungszone berechnet. Ein STB-Wert vor der Entlassung von ≥95 Perzentil wurde der Hochrisikozone zugeordnet, ein Wert zwischen dem 75. und 94. Perzentil der oberen und mittleren Risikozone, ein Wert zwischen dem 40. und 74. Von 49 Neugeborenen in der Hochrisikozone entwickelten 34 eine SHB; daher betrug die positive LR für STB in der Hochrisikozone 8,26 (Tabelle II). Von 190 Neugeborenen in der oberen-mittleren Risikozone entwickelten 73 eine SHB; daher betrug die positive LR für STB in dieser Risikozone 2,30. In ähnlicher Weise lag die positive LR für STB in der unteren-mittleren Risikozone bei 0,76 und für die niedrige Risikozone bei 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Gesamtbilirubin im Serum vor der Entlassung | Ergebnis | Testleistung | |||||
| Vor-.Entladung kumulative Risikozone | Perzentil | Gesamt | SHB+ | SHB- | P:A-Quotient | Erkrankungswahrscheinlichkeit | LR+ |
| Hochrisiko | ≥95th | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 |
| Obere Mittelstufe | 75. bis 94. | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 |
| Niedere Mittelstufe | 40. bis 74. | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 |
| Risikoarm | <40. | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 |
| 928 | 199 | 729 | 1:4 | 1/5 | |||
| SHB: signifikante Hyperbilirubinämie; P:A Verhältnis: Vorhandensein eines Ergebnisses : Fehlen eines Ergebnisses. | |||||||
Diskussion
Eine Risikobewertung vor der Entlassung im Hinblick auf die spätere Entwicklung einer SHB wird als mögliche Strategie zur Verringerung der Inzidenz von bilirubininduzierten neurologischen Schäden oder Kernikterus empfohlen. In dieser prospektiven Kohortenstudie haben wir ein stundenspezifisches Serumbilirubin-Nomogramm für eine Untergruppe nordindischer Neugeborener erstellt und die Wirksamkeit der Risikoabgrenzung durch STB-Messung vor der Entlassung bei der Vorhersage der späteren Notwendigkeit einer Phototherapie (SHB) bewertet. Die Ausgangsinzidenz von SHB war in unserer Studienkohorte hoch: 2 von 10 Neugeborenen entwickelten SHB. Die Lage der STB vor der Entlassung in zwei höheren Risikozonen erhöhte das Risiko einer späteren SHB signifikant: 7 von 10 Neugeborenen in der Hochrisikozone entwickelten eine SHB (positive LR=8,26) und 4 von 10 Neugeborenen in der Zone mit höherem bis mittlerem Risiko entwickelten eine SHB (positive LR=2,3). Die Lage der STB vor der Entlassung in der Zone mit niedrigem Risiko verringerte das Risiko einer späteren SHB signifikant: 1 von 10 Neugeborenen entwickelte eine SHB (positive LR=0,37). Da der negative prädiktive Wert des Cut-Offs für niedriges Risiko jedoch nur 90 % betrug, konnte die Lokalisierung in der Niedrigrisikozone die Möglichkeit einer späteren SHB nicht ausschließen.
Bhutani et al. zeigten in einer großen Kohorte, dass bei Neugeborenen mit STB vor der Entlassung in Hoch- und Hochintermediär-Risikozonen die Wahrscheinlichkeit einer SHB während der Nachuntersuchung höher ist. Die Autoren erstellten Perzentilentabellen des Serumbilirubinspiegels in verschiedenen postnatalen Altersstufen bei Kurz- und Termingeborenen. Sie fanden heraus, dass 6,1 % der Neugeborenen vor der Entlassung einen Serumbilirubinwert >95. Perzentil aufwiesen; 32,1 % dieser Säuglinge zeigten später eine Hyperbilirubinämie. Im Vergleich zum stundenspezifischen Nomogramm von Bhutani et al. sind die Perzentilwerte des STB in dieser Studie bis zum postnatalen Alter von 84-108 Stunden um bis zu 2 mg/dL höher. Bei Neugeborenen nordindischer Herkunft wurden höhere Bilirubinwerte und ein häufigeres Auftreten von Hyperbilirubinämie beobachtet. Der in dieser Studie beobachtete mittlere STB-Wert von 7,0±2,0 mg/dL liegt zwischen dem 75. und 95. Perzentil des Bhutani-Nomogramms. In ähnlicher Weise berichteten Agarwal et al. über einen mittleren STB-Wert von 5,9±1,8 mg/dL im Alter von 24 Stunden nach der Geburt, der nahe am 75. Perzentil des Bhutani-Nomogramms liegt. Der höhere Anteil an Frühgeborenen oder Neugeborenen mit niedrigem Geburtsgewicht und die höhere Rate an ausschließlichem Stillen in unserer Studie könnten die Faktoren sein, die zu den erhöhten STB-Werten und der erhöhten Inzidenz von SHB beitragen. Darüber hinaus hat unsere Entscheidung, die mittlere statt der oberen Linie der AAP-Phototherapieschwellenwerte selbst bei Neugeborenen mit niedrigem Risiko zu verwenden, die Inzidenz von SHB erhöht. Jenseits von 108 Stunden postnatalem Alter sind die Perzentilwerte der STB in dieser Studie niedriger als die entsprechenden Werte im Bhutani-Nomogramm. Die Einbeziehung der STB-Werte von Neugeborenen, die auf der Grundlage eines klinischen Urteils selektiv nachbeobachtet wurden, könnte dazu geführt haben, dass bei der Erstellung des Bhutani-Nomogramms höhere STB-Werte verwendet wurden, was die Verallgemeinerbarkeit des Nomogramms beeinträchtigt. In der vorliegenden Studie, in der die Nachbeobachtung unabhängig vom Schweregrad der Hyperbilirubinämie durchgeführt wurde, erreicht das Nomogramm seinen Höhepunkt am 4. und 5.
In einer prospektiven Kohortenstudie maßen Agarwal et al. die STB im Alter von 24±6 Stunden bei 220 Neugeborenen, die im Alter von ≥35 Schwangerschaftswochen geboren wurden, um eine Hyperbilirubinämie vorherzusagen. Das Fehlen von STB >6 mg/dL im Alter von 24±6 Stunden schloss die Möglichkeit einer nachfolgenden SHB innerhalb von 5 Tagen nach der Geburt praktisch aus (Wahrscheinlichkeitsquotient des negativen Tests 0,07). Allerdings führte die selektive Messung des Ergebnisses nur bei den Neugeborenen, die während der Nachbeobachtung einen „klinischen“ Bilirubinwert von >10 mg/dL aufwiesen, zu einer Verzerrung der Studie. In einer anderen indischen Studie wurde festgestellt, dass ein Cut-off-Wert von 3,99 mg/dL bei 18-24 Stunden eine Sensitivität und Spezifität von jeweils 67 % für die Vorhersage eines späteren Bilirubinspiegels >15 mg/dL aufweist. Eine vollständige Nachbeobachtung gab es jedoch nur bei Säuglingen, die entweder wegen einer neonatalen Erkrankung oder aus einem mütterlichen Grund, wie z. B. einem Kaiserschnitt, im Krankenhaus blieben. Mehr als 50 % der Säuglinge, die gesund waren und daher frühzeitig entlassen wurden, wurden nicht weiterverfolgt. In einer Studie aus der Türkei wurde ein stundenspezifisches Bilirubin-Nomogramm bei Neugeborenen mit einem Gestationsalter zwischen 35 und 37 Wochen vorgestellt. Ein STB-Wert über der 95
. Perzentile hatte einen hohen positiven Vorhersagewert für die spätere Entwicklung einer SHB. Ein STB-Wert unter der 30. Perzentile hatte jedoch einen negativen Vorhersagewert von etwa 90 %. Zwei große retrospektive Studien berichteten über eine ausgezeichnete Vorhersagekraft der frühen/vor der Entlassung durchgeführten Messung der STB mit einer Fläche unter der Kurve (AUC) von 0,83. In unserer Studie war die Unterscheidungsfähigkeit der 40- und 75-Perzentil-Werte geringer als in den früheren Berichten. Dadurch verschob sich die ROC-Kurve in unserer Studie in Richtung der diagonalen Linie, was zu einem geringeren Unterscheidungsvermögen führte (AUC= 0,73). Die hohe Ausgangsinzidenz von SHB in der Türkei (25,3 %) und in unserer Studie (20 %) könnte erklären, warum niedrige Perzentilwerte die Entwicklung einer späteren SHB nicht ausschließen können, wodurch der Nutzen der STB-Messung vor der Entlassung eingeschränkt wird.
Eine alternative Strategie zur Risikobewertung für die Vorhersage einer späteren SHB ist die Bewertung klinischer Risikofaktoren. Schwangerschaftsalter bei der Geburt, Gelbsucht in der Vorgeschichte, die bei einem früheren Geschwisterkind behandelt werden musste, Oxytocin-Infusion, instrumentelle Entbindung, Geburtstrauma und unzureichende Ernährung wurden als Risikofaktoren für SHB genannt.
Allerdings wurde berichtet, dass die Unterscheidungsfähigkeit des klinischen Risikomodells geringer ist als die der frühen STB-Messung. Newman et al. berichteten über eine verbesserte Unterscheidungsfähigkeit, wenn ein klinisches Risikoinstrument mit einer frühen STB-Messung kombiniert wurde. Aufgrund des signifikanten Anteils von Neugeborenen mit niedrigem Geburtsgewicht und Frühgeborenen in unserer Kohorte vermuten wir, dass die Kombination dieser objektiv messbaren klinischen Risikofaktoren mit der frühen STB-Messung ein Risikomodell mit verbesserter Unterscheidungsfähigkeit ergeben würde.
Die externe Anwendbarkeit der in der Studie gemachten Beobachtungen könnte durch die relativ hohe Inzidenz von Hyperbilirubinämie in der Studienkohorte beeinflusst werden, da niedrigere Bilirubin-Grenzwerte für den Beginn der Phototherapie verwendet werden. Im Gegensatz zu den Industrieländern wurde in Indien über Kernikterus bei niedrigeren Bilirubinspitzenwerten berichtet, was darauf hindeutet, dass indische Neugeborene bilirubininduzierte neurologische Schäden bei niedrigeren Serumbilirubinspitzenwerten entwickeln können. Darüber hinaus hat etwa ein Drittel der in Indien geborenen Neugeborenen ein niedriges Geburtsgewicht. Aus diesen Gründen empfiehlt das National Neonatology Forum of India in seinen Leitlinien die Verwendung niedrigerer Schwellenwerte für den Beginn der Phototherapie, insbesondere in Gebieten mit einer höheren Inzidenz von Glukose-6-Phosphat-Dehydrogenase-Mangel.
Zu den Vorzügen unserer Studie gehören ein prospektives Studiendesign, ein großer Stichprobenumfang, eine Nachbeobachtungsrate von mehr als 90 % und das Fehlen von Überprüfungsfehlern. Bei etwa 7 % der eingeschlossenen Neugeborenen konnten wir das Auftreten des Ergebnisses nicht feststellen. Da jedoch die frühe STB und die demografischen Merkmale dieser verlorenen Neugeborenen denen derjenigen ähnelten, die nie eine SHB entwickelten, ist es unwahrscheinlich, dass das stundengenaue Nomogramm und das Risikobewertungsinstrument beeinflusst wurden. Wir haben keine Hochleistungsflüssigkeitschromatographie (HPLC) verwendet, die als „Goldstandard“ für die Messung von Bilirubin gilt. Wir haben Bilirubin mit der am Krankenbett üblichen Methode der Spektrophotometrie gemessen. Das in unserer Studie verwendete Bilimeter wies einen niedrigen Variationskoeffizienten auf und wurde vor jedem Gebrauch kalibriert.
Wir empfehlen, dass Neugeborene mit STB vor der Entlassung in der Hoch- oder Hochintermediär-Risiko-Zone mit hoher Wahrscheinlichkeit frühzeitig eine SHB entwickeln und dass eine häufige Nachsorge gewährleistet werden sollte. In Situationen, in denen eine engmaschige Nachsorge nicht möglich ist, kann eine Verzögerung der Entlassung aus dem Krankenhaus in Betracht gezogen werden, bis der Bilirubinwert in einen niedrigeren Risikobereich fällt. Neugeborene mit einem STB-Wert vor der Entlassung, der in den unteren, mittleren oder niedrigen Risikobereichen liegt, können entsprechend den örtlichen Vorschriften entlassen werden. Allerdings sollte eine angemessene Nachbeobachtung sichergestellt werden, da eine spätere Entwicklung von SHB nicht ausgeschlossen werden kann.
Zusammenfassend lässt sich sagen, dass trotz der guten Unterscheidungsfähigkeit die höhere Nachbeobachtungsrate in unserer Studie das Vertrauen in die Fähigkeit von STB vor der Entlassung zur Vorhersage von SHB bei indischen Säuglingen erhöht. Weitere Studien sind erforderlich, um die Leistung der in diesem stundenspezifischen Bilirubin-Nomogramm definierten Risikoabgrenzungszonen zu validieren.
Mitwirkende: DC: Konzeption und Design der Studie; UP und SK: Datenerhebung; DC: Datenanalyse; UP: Abfassung der Arbeit mit kritischen Beiträgen von DC, SK und SJ. Alle Autoren genehmigen die endgültige Fassung des Manuskripts zur Einreichung.
Finanzierung: Keine; Konkurrierende Interessen: Keine angegeben.
1. Bericht 2002-2003: National Neonatal Perinatal Database Network. New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. Identifizierung von Neugeborenen mit Risiko für gefährliche Hyperbilirubinämie: neue klinische Erkenntnisse. Pediatr Clin North Am. 2009;56:671-87.
3. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Nicht-invasive Schätzung des Gesamtserumbilirubins durch spektrale Reflexion mit mehreren Wellenlängen bei Neugeborenen. Indian Pediatr. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Frühe neonatale Hyperbilirubinämie anhand des Serumbilirubinspiegels am ersten Tag. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Prediction of hyperbilirubinemia in near-term and term infants. Pediatrics 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Nichtinvasive Messung des Gesamtserumbilirubins in einer multirassischen Neugeborenenpopulation vor der Entlassung zur Bewertung des Risikos einer schweren Hyperbilirubinämie. Pediatrics. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Prädiktive Fähigkeit eines stundengenauen Serumbilirubins vor der Entlassung für eine spätere signifikante Hyperbilirubinämie bei gesunden Termingeborenen und Kurzzeit-Neugeborenen. Pediatrics. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia. Pediatrics. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Systematic review of screening for bilirubin encephalopathy in neonates. Pediatrics. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Simple nomograms to calculate sample size in diagnostic studies. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Bilirubin-Screening bei normalen Neugeborenen: eine Kritik des stundenbezogenen Bilirubin-Nomogramms. Pediatrics. 2009;124:1203-5.
13. Awasthi S, Rehman H. Early prediction of neonatal hyperbilirubinemia. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidence, course, and prediction of hyperbilirubinemia in near-term and term newborns. Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identifizierung von Neugeborenen mit dem Risiko einer signifikanten Hyperbilirubinämie: ein Vergleich von zwei empfohlenen Ansätzen. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Die Kombination klinischer Risikofaktoren mit Serumbilirubinwerten zur Vorhersage von Hyperbilirubinämie bei Neugeborenen. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Vorhersage und Vorbeugung von extremer neonataler Hyperbilirubinämie in einer reifen Gesundheitsversorgungseinrichtung. Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. Ein Vergleich alternativer Risikobewertungsstrategien zur Vorhersage einer signifikanten neonatalen Hyperbilirubinämie bei Termingeborenen und Frühgeborenen. Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Risk factors for kernicterus in term babies with non-hemolytic jaundice. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Brainstem auditory evoked response in newborns with hyperbilirubinemia. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidence Based Clinical Practice Guidelines. National Neonatology Forum of India, New Delhi, Indien, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Preliminary report on neonatal screening for congenital hypothyroidism, congenital adrenal hyperplasia and glucose-6-phosphate dehydrogenase deficiency: a Chandigarh experience. Indian J Pediatr. 2010;77:969-73.
