Una proporción significativa de neonatos desarrolla hiperbilirrubinemia que necesita tratamiento (hiperbilirrubinemia «significativa», SHB) durante la primera semana de vida . La disminución de la duración de la hospitalización al nacer se ha asociado temporalmente con una mayor incidencia de daños neurológicos inducidos por la bilirrubina . Las visitas domiciliarias posteriores al alta por parte del personal sanitario o las visitas al hospital por parte de la familia pueden detectar la SHB, pero no son factibles ni rentables en todo el mundo. Por lo tanto, antes de que los recién nacidos sean dados de alta del hospital, es necesario identificar a los que corren el riesgo de desarrollar niveles elevados de bilirrubina
La evaluación objetiva previa al alta para detectar el riesgo de desarrollar SHB también es importante debido a la limitada precisión de la evaluación visual de la extensión de la ictericia . La estratificación del riesgo de SHB se ha realizado midiendo la carga de bilirrubina (niveles absolutos o tasa de aumento de la bilirrubina total sérica o de la bilirrubina transcutánea), la producción de bilirrubina (monóxido de carbono exhalado) y la identificación de los factores de riesgo clínicos subyacentes .
La concentración de bilirrubina en sangre periférica es una función de las tasas de producción, metabolismo, excreción y reabsorción de bilirrubina específicas de la edad. Por lo tanto, la interpretación del nivel de bilirrubina en un neonato se basa en la edad postnatal. El nomograma de bilirrubina específico para cada hora desarrollado por Bhutani, et al. ha demostrado que la medición de la bilirrubina total en suero (STB) antes del alta hospitalaria puede ayudar a identificar a los neonatos que corren el riesgo de tener valores percentiles más altos de STB durante el seguimiento. Entre los diversos métodos de predicción del riesgo, la medición de la STB antes del alta ha mostrado la mejor capacidad de discriminación entre los neonatos norteamericanos. Sin embargo, debido a las diferencias genéticas en el metabolismo de la bilirrubina y a las diferencias en las prácticas de alimentación, la evolución clínica de la hiperbilirrubinemia puede variar en neonatos pertenecientes a diferentes etnias o ubicaciones geográficas. Además, el nomograma anterior se desarrolló a partir de una cohorte retrospectiva en la que la información sobre el resultado de la hiperbilirrubinemia significativa se conocía sólo para una quinta parte de la población del estudio. Por lo tanto, la construcción de un nomograma de bilirrubina específico para cada hora en diferentes poblaciones neonatales es un requisito previo para utilizar la medición de la bilirrubina antes del alta como estrategia de evaluación del riesgo.
Planificamos este estudio de cohorte prospectivo para construir un nomograma de bilirrubina total en suero específico para cada hora en neonatos indios y para evaluar la eficacia de la medición de la bilirrubina antes del alta en la predicción de la hiperbilirrubinemia que necesita tratamiento entre los neonatos a término y prematuros.
Métodos
Este estudio de cohorte prospectivo con la evaluación del rendimiento de la prueba de diagnóstico se llevó a cabo de febrero a junio de 2010 en un hospital universitario en el norte de la India. El protocolo del estudio fue aprobado por el Comité de Ética del hospital y se obtuvo el consentimiento informado por escrito de los padres. Los neonatos sanos con una gestación ≥35 semanas o un peso al nacer ≥2000 g fueron elegidos para participar en el estudio. Por razones logísticas, los neonatos que completaron las 24 horas de vida en domingo no pudieron participar en el estudio. Se excluyeron los neonatos con malformaciones congénitas importantes, el ingreso en la unidad de cuidados intensivos neonatales, la prueba de Coombs directa positiva (se realizó si el grupo sanguíneo de la madre era Rhesus negativo), la fototerapia antes de la primera medición de la bilirrubina o la imposibilidad de acudir al seguimiento.
Mediciones del estudio y seguimiento: La muestra de sangre para la primera medición de la bilirrubina total en suero se extrajo en el momento del cribado metabólico a las 18-30 h de edad postnatal. Se recogió sangre capilar o venosa periférica en microcapilares preheparinizados. La sangre se centrifugó inmediatamente a 12000 rpm durante 5 minutos y se midió la bilirrubina total con un espectrofotómetro (NEO-BIL plus, das srl, Italia).
Los neonatos fueron seguidos durante su estancia en el hospital y después del alta hasta completar el 7º día postnatal. El momento de la visita de seguimiento se decidió en función de la edad al alta. Los bebés dados de alta antes de las 48 h de edad fueron citados entre las 72 y las 96 h de edad y los bebés dados de alta después de las 48 h de edad entre las 96 y las 120 h de edad. Además de la primera medición de STB en el momento del cribado metabólico, se realizaron dos mediciones más de STB en cada neonato. Tras la primera medición, la decisión de realizar la segunda y tercera medición de STB se basó en la evaluación clínica. La evaluación clínica del grado de ictericia se acompañó de la medición de la bilirrubina transcutánea (TcB) con un bilímetro transcutáneo de longitud de onda múltiple (BiliChek, coeficiente de variación <5%). La estimación de la STB se realizó si las palmas de las manos/suelas estaban teñidas de ictericia o la TcB era >12 mg/dL o estaba dentro del 80% del umbral de fototerapia específico de la edad. Si no estaba indicado clínicamente, se realizaron una segunda y tercera mediciones de STB a las 72-96 h y 96-144 h de edad postnatal, respectivamente. Los valores de STB después de iniciar la fototerapia no se incluyeron para la construcción del nomograma.
Se registraron los factores de riesgo clínicos y epidemiológicos que pueden influir en el riesgo de desarrollar SHB. Se registraron los siguientes datos: peso al nacer, gestación, sexo, educación y religión de la madre, paridad, complicaciones prenatales, grupo sanguíneo ABO y Rh de la madre, modo de parto, tipo de anestesia utilizada durante el parto y uso de infusión de oxitocina durante el parto. Además, se observó la edad de inicio de la alimentación, la alimentación suplementaria (distinta de la lactancia materna o la leche materna extraída) durante y después de las primeras 24 horas después del nacimiento y la edad de la primera deposición.
Resultado: El resultado clave fue la hiperbilirrubinemia significativa (SHB) que se definió como la necesidad de fototerapia o exanguinotransfusión para el tratamiento de la hiperbilirrubinemia. La decisión de iniciar la fototerapia se tomó en función de la edad del bebé en horas y de los niveles de STB, según la adaptación local de las directrices de la Academia Americana de Pediatría (AAP). En los neonatos nacidos con 38 o más semanas de gestación, se utilizó el umbral de riesgo medio, y en los nacidos con 37 o menos semanas completas de gestación, el umbral de riesgo alto, para iniciar la fototerapia. Los valores del umbral de riesgo medio de las directrices de la AAP son casi idénticos a los valores del percentil 95
del nomograma de Bhutani .
Análisis estadístico: En un estudio prospectivo se observó hiperbilirrubinemia significativa en el 10% de los neonatos nacidos con ≥35 semanas de gestación . Para investigar una prueba diagnóstica con una sensibilidad de al menos el 95% (intervalo de confianza del 5%) y un valor alfa de 0,05, necesitábamos inscribir a unos 1000 sujetos .
Los datos se analizaron utilizando Stata 9 (StataCorp, College Station, TX, USA). Para la construcción del nomograma, los valores de STB se agruparon en épocas de seis horas (edad±3 horas) para la edad postnatal hasta 48 h y en épocas de doce horas (edad±6 horas) para la edad superior a 48 h. Se examinaron los datos de cada época para comprobar su simetría. Se calcularon los valores de los percentiles 5
, 10, 25, 40, 75, 90 y 95 para cada época. Se utilizó Microsoft Excel (Microsoft Corporation, Richmond, EE.UU.) para trazar el nomograma de bilirrubina específico para cada hora. El nomograma suavizado que representaba los percentiles 40, 75 y 95 se trazó utilizando un modelo de columna cúbica con el paquete GAMLSS para el software estadístico R. Tras el suavizado, el 36,5% de los casos estaban por debajo de la línea del percentil 40, el 77,8% de los casos estaban por debajo de la línea del percentil 75 y el 95,1% de los casos estaban por debajo de la línea del percentil 95. La capacidad de predicción del nomograma se evaluó mediante el cálculo de la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la razón de verosimilitud, mediante el trazado de la curva de características operativas del receptor (ROC) y el cálculo del estadístico c.
Resultados
Durante el período de estudio, nacieron un total de 1255 neonatos, de los cuales 1090 fueron elegibles para la inscripción. Entre ellos, 93 fueron excluidos por diferentes motivos (Fig. 1). Se incluyeron en el estudio un total de 997 neonatos. El valor medio ± SD del peso al nacer fue de 2627±536 g y la edad de gestación fue de 37,8±1,5 semanas (mediana y IQR: 38 y 37-39) (Tabla Web I). La mayoría de los neonatos del estudio nacieron después de un curso prenatal sin complicaciones y tuvieron una transición sin problemas a la vida extrauterina. Más del 80% de los neonatos fueron alimentados exclusivamente con leche materna durante su estancia en el hospital.
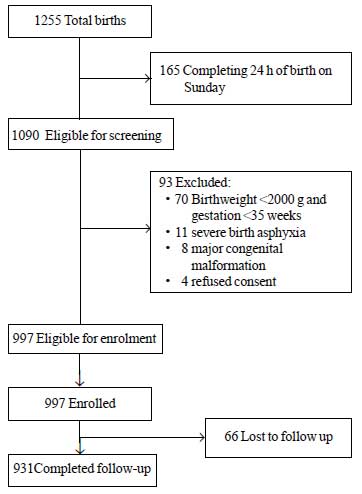
Fig.1 Flujo del estudio.
Construcción del nomograma de bilirrubina: La primera medición de bilirrubina se realizó a las 23,3±6,3 h de edad y la media de STB fue de 7,0±2,0 mg/dL. Veintinueve (2,9%) neonatos necesitaron fototerapia según la primera medición de la bilirrubina. En estos neonatos la fototerapia se inició a las 27±5,6 h de edad con niveles de STB de 12,3±2,0 mg/dL. Sesenta y seis (6,6%) neonatos se perdieron para el seguimiento después del alta del hospital del estudio. El valor de la primera bilirrubina en estos neonatos fue comparable al de los neonatos que nunca desarrollaron SHB (6,5±1,9 frente a 6,7±1,7 mg/dL, P=0,54) y fue significativamente inferior al de los que desarrollaron SHB (6,5±1,9 frente a 8,5±2,2 mg/dL, P< 0,001).
Para la construcción del nomograma y la evaluación de la distribución de los valores de STB, la edad postnatal se dividió en épocas de seis horas para la edad postnatal de hasta 48 h y en épocas de doce horas para la edad de más de 48 h. Se observó que la STB en cada una de las épocas, excepto en la de 42 h, se distribuía simétricamente (Fig. 2). Se observó que la distribución de los valores de STB a las 42 h estaba sesgada positivamente y estos valores no se utilizaron para la construcción del nomograma.
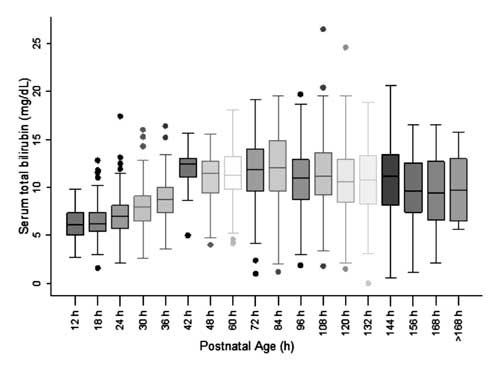
Fig. 2 Diagrama de cajas y bigotes que muestra la distribución de la bilirrubina total en suero.
Se calcularon los valores de los percentiles 5
, 10, 25, 40, 75, 90 y 95 para cada época. Se dibujó el nomograma de bilirrubina sérica específico para cada edad con los valores del percentil 40, 75 y 95 al avanzar la edad postnatal (Fig. 3).
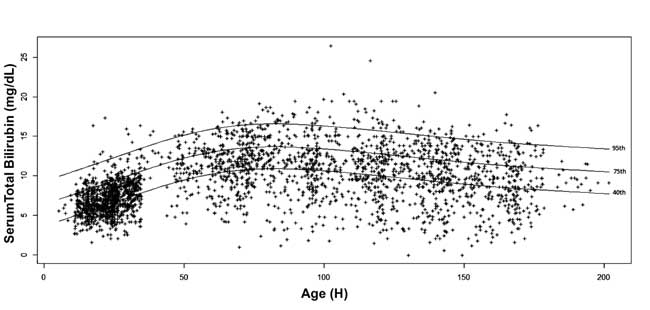
Fig. 3 Nomograma de bilirrubina – bilirrubina total sérica específica de la hora representada en los percentiles 40, 75 y 95.
Capacidad predictiva de la BTS antes del alta: En total, 199 (20%) neonatos desarrollaron BTS (recibieron fototerapia). El primer valor de bilirrubina se utilizó para predecir la necesidad posterior de tratamiento para la hiperbilirrubinemia. Si se obtuvieron más de dos valores en las primeras 48 h después del nacimiento, se utilizó el valor del percentil más alto para la predicción.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Bilirrubina total en suero antes del alta | Resultado | Resultado de la prueba | |||||
| Percentil | Número(n=928) | SHB+ | SHB- | PPV | NPV | Sensibilidad | Especificidad |
| Superior al percentil 95 | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 |
| Bajo el percentil 95 | 879 | 165 | 714 | ||||
| Superior al percentil 75 | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 |
| Bajo el percentil 75 | 689 | 92 | 597 | ||||
| Superior al percentil 40 | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 |
| Bajo el percentil 40 | 342 | 32 | 310 | ||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
|||||||
Entre los neonatos a los que se les realizó la medición del STB antes delmedición de STB antes del alta y completaron el seguimiento (n=928), en 49 (5.El 3% de los neonatos en los que se midió el STB antes del alta fue superior al percentil 95 de la distribución por edades (Tabla I). De estos 34 neonatos necesitaron posteriormente fototerapia (valor predictivo positivo: 69,4%, sensibilidad: 17,1%). En 342 (36,8%) neonatos el STB antes del alta fue inferior al percentil 40 de la distribución específica de la edad. De ellos, 310 neonatos no necesitaron tratamiento posterior para la hiperbilirrubinemia (valor predictivo negativo: 90,6% y especificidad: 42,5%). El valor predictivo positivo del percentil 75 de corte fue del 44,8% y el valor predictivo negativo del 86,2%. La curva ROC que se muestra en la Fig. 4 ilustra el rendimiento diagnóstico de cada percentil de corte con un área bajo la curva (estadístico c) de 0,73.
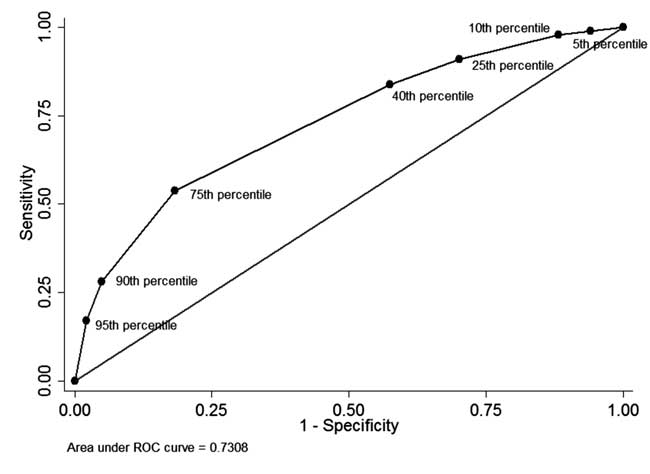
Fig. 4 La curva ROC para la capacidad diagnóstica de diferentes percentiles de corte de la bilirrubina total en suero antes del alta.
La razón de probabilidad (LR) es una mejor herramienta para medir el rendimiento de la prueba diagnóstica ya que la razón no se ve afectada por el cambio en la prevalencia de fondo del resultado. El LR de la prueba positiva (LR+, probabilidad de que la prueba sea positiva en los enfermos/probabilidad de que la prueba sea positiva en los no enfermos) se calculó para cada zona de demarcación de riesgo. Se asignó un STB previo al alta de ≥95º percentil para estar en zona de alto riesgo, entre 75º y 94º percentil en zona de riesgo intermedio-alto, entre 40º y 74º percentil en zona de riesgo intermedio-bajo y por debajo de 40º percentil en zona de bajo riesgo. De los 49 neonatos de la zona de alto riesgo, 34 desarrollaron SHB; por lo tanto, el LR positivo para STB en la zona de alto riesgo fue de 8,26 (Tabla II). Entre los 190 neonatos de la zona de riesgo intermedio-superior, 73 desarrollaron BSA; por lo tanto, el LR positivo para BSA en esta zona de riesgo fue de 2,30. Del mismo modo, el LR positivo para STB en la zona de riesgo inferior-intermedio fue de 0,76 y para la zona de bajo riesgo fue de 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Bilirrubina total en suero antes del alta | Resultado | Resultado de la prueba | |||||
| Pre-zona de riesgo acumulado al alta | Percentil | Total | SHB+ | SHB- | P:A ratio | Probabilidad de enfermedad | LR+ |
| Alto riesgo | ≥95th | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 |
| Intermedio alto | 75 a 94 | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 |
| Intermedio bajo | 40 a 74 | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 |
| Riesgo bajo | <40º | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 |
| 928 | 199 | 729 | 1:4 | 1/5 | |||
| SHB: hiperbilirrubinemia significativa; relación P:A: Presencia de resultado : Ausencia de resultado. | |||||||
Discusión
Se recomienda la evaluación del riesgo antes del alta para el desarrollo posterior de SHB como estrategia potencial para reducir la incidencia de daño neurológico inducido por la bilirrubina o kernicterus. En este estudio de cohorte prospectivo hemos construido un nomograma de bilirrubina sérica específico para cada hora en un subconjunto de neonatos del norte de la India y hemos evaluado la eficacia de la demarcación del riesgo mediante la medición de la bilirrubina sérica antes del alta para predecir la necesidad posterior de fototerapia (SHB). La incidencia inicial de SHB fue alta en nuestra cohorte de estudio, ya que 2 de cada 10 neonatos desarrollaron SHB. La localización del STB antes del alta en dos zonas de alto riesgo aumentó significativamente el riesgo de SHB posterior, ya que 7 de cada 10 neonatos en la zona de alto riesgo desarrollaron SHB (LR positivo=8,26) y 4 de cada 10 neonatos en la zona de riesgo alto-intermedio desarrollaron SHB (LR positivo=2,3). La localización del STB antes del alta en la zona de bajo riesgo disminuyó significativamente el riesgo de SHB posterior con 1 de cada 10 neonatos desarrollando SHB (LR positivo=0,37). Sin embargo, como el valor predictivo negativo del punto de corte de bajo riesgo fue sólo del 90%, la localización en la zona de bajo riesgo no pudo descartar la posibilidad de SHB posterior.
Bhutani, et al. demostraron en una gran cohorte que los neonatos con STB antes del alta en zonas de riesgo alto e intermedio son más propensos a tener SHB durante el seguimiento. Los autores construyeron gráficos de percentiles del nivel de bilirrubina sérica a diferentes edades postnatales en neonatos a corto plazo y a término. Descubrieron que el 6,1% de los neonatos tenían una bilirrubina sérica >95º percentil antes del alta; el 32,1% de estos bebés mostraron hiperbilirrubinemia posteriormente. En comparación con el nomograma específico por horas de Bhutani, et al. , los valores del percentil de STB en este estudio son más altos hasta en 2 mg/dL hasta las 84-108 h de edad postnatal. Se ha observado que los neonatos de origen norindio alcanzan valores más altos de bilirrubina y tienen mayor incidencia de hiperbilirrubinemia . La media de STB de 7,0±2,0 mg/dL observada en este estudio está entre el percentil 75 y 95 del nomograma de Bhutani. Del mismo modo, Agarwal et al. informaron de una media de STB de 5,9±1,8 mg/dL a las 24 horas de la edad postnatal, que está cerca del valor del percentil 75 del nomograma de Bhutani. La mayor proporción de neonatos prematuros o de bajo peso al nacer y la mayor tasa de lactancia materna exclusiva en nuestro estudio pueden ser los factores que contribuyen al aumento de los valores de STB y a la mayor incidencia de SHB. Además, nuestra decisión de utilizar la línea media en lugar de la superior de los umbrales de fototerapia de la AAP, incluso en los neonatos de bajo riesgo, también aumentó la incidencia de SHB. Más allá de las 108 h de edad postnatal, los valores percentiles de STB en este estudio son inferiores a los valores correspondientes del nomograma de Bhutani. La inclusión de los valores de STB de los neonatos a los que se les hizo un seguimiento selectivo a juicio del clínico para la construcción del nomograma puede haber dado lugar a la utilización de niveles de STB más altos para trazar el nomograma de Bhutani, disminuyendo así la capacidad de generalización de este último. En el presente estudio, como el seguimiento se completó con independencia de la gravedad de la hiperbilirrubinemia, el nomograma alcanza su máximo en el 4º y 5º día de edad postnatal con un descenso natural al final de la primera semana.
En un estudio de cohorte prospectivo, Agarwal, et al. midieron la STB a las 24±6 h de edad en 220 neonatos nacidos a las ≥35 semanas de gestación para predecir la hiperbilirrubinemia . La ausencia de STB >6 mg/dL a las 24±6 h de edad prácticamente descartó la posibilidad de SHB posterior (ratio de probabilidad de prueba negativa 0,07) en los 5 días siguientes al nacimiento. Sin embargo, la medición selectiva del resultado sólo en aquellos neonatos que durante el seguimiento tenían un nivel de bilirrubina «clínico» de >10 mg/dL introdujo un sesgo de verificación en el estudio. En otro estudio indio, se encontró que un punto de corte de 3,99 mg/dL a las 18-24 h tenía una sensibilidad y especificidad del 67% cada una para la predicción de un nivel de bilirrubina posterior >15 mg/dL . Sin embargo, el seguimiento completo sólo se dio en los lactantes que permanecieron en el hospital por enfermedad neonatal o por algún motivo materno, como la cesárea. Más del 50% de los lactantes, que estaban sanos y, por tanto, fueron dados de alta antes de tiempo, no fueron objeto de seguimiento. Un estudio de Turquía presentó un nomograma de bilirrubina específico por hora en neonatos con una edad gestacional entre 35 y 37 semanas. El valor de STB superior al percentil 95
tenía un alto valor predictivo positivo para el desarrollo posterior de SHB . Sin embargo, el valor de STB inferior al percentil 30 tenía un valor predictivo negativo de aproximadamente el 90%. Dos grandes estudios retrospectivos han informado de una excelente capacidad predictiva de la medición temprana/previa al alta de la STB con un área bajo la curva (AUC) de 0,83 . En nuestro estudio, la capacidad de discriminación de los valores de los percentiles 40 y 75 fue inferior a la de los estudios anteriores. Esto desplazó la curva ROC en nuestro estudio hacia la línea diagonal, lo que resultó en una menor capacidad de discriminación (AUC= 0,73). La alta incidencia basal de SHB en Turquía (25,3%) y en nuestro estudio (20%) puede explicar la incapacidad de los valores de percentil bajos para descartar el desarrollo de SHB posterior, limitando así la utilidad de la medición de STB antes del alta.
Una estrategia alternativa de evaluación del riesgo para predecir el SHB posterior es la evaluación de los factores de riesgo clínicos. La gestación en el momento del nacimiento, los antecedentes de ictericia que necesitaron tratamiento en el hermano anterior, la infusión de oxitocina, el parto instrumental, el traumatismo en el parto y la alimentación inadecuada se han señalado como factores de riesgo de SHB.
Sin embargo, se ha informado de que la capacidad de discriminación del modelo de riesgo clínico es menor que la de la medición temprana de STB. Newman, et al. informaron de una mejor capacidad de discriminación cuando se combinó un instrumento de riesgo clínico con la medición del STB temprano. Debido a la significativa proporción de neonatos de bajo peso al nacer y prematuros en nuestra cohorte, especulamos que la combinación de estos factores de riesgo clínicos objetivamente medibles con la medición temprana de STB generaría un modelo de riesgo con una mejor capacidad de discriminación.
La aplicabilidad externa de las observaciones realizadas en el estudio puede verse influida por la incidencia relativamente alta de hiperbilirrubinemia en la cohorte del estudio debido al uso de umbrales de bilirrubina más bajos para iniciar la fototerapia. A diferencia de los países desarrollados, en la India se han notificado casos de kernicterus con niveles más bajos de pico de bilirrubina, lo que indica que los neonatos indios pueden desarrollar daños neurológicos inducidos por la bilirrubina con niveles más bajos de pico de bilirrubina sérica. Además, alrededor de un tercio de los neonatos nacidos en la India tienen bajo peso al nacer. Debido a estas razones, el Foro Nacional de Neonatología de la India sugiere en sus directrices el uso de umbrales más bajos para el inicio de la fototerapia, especialmente en las zonas con mayor incidencia de la deficiencia de glucosa-6-fosfato deshidrogenasa.
Los puntos fuertes de nuestro estudio incluyen el diseño prospectivo del estudio, el gran tamaño de la muestra, la tasa de seguimiento de más del 90% y la ausencia de sesgo de verificación. No pudimos determinar la aparición del resultado en aproximadamente el 7% de los neonatos inscritos. Sin embargo, como el STB temprano y las características demográficas en estos neonatos perdidos para el seguimiento fueron similares a los que nunca desarrollaron SHB, es poco probable que el nomograma específico de la hora y el instrumento de evaluación del riesgo se vean afectados. No utilizamos la cromatografía líquida de alta resolución (HPLC), que es el método de referencia para la medición de la bilirrubina. Medimos la bilirrubina mediante un método más común de espectrofotometría a pie de cama. El bilímetro utilizado en nuestro estudio tenía un bajo coeficiente de variación y se calibró antes de cada uso.
Recomendamos que, dado que los neonatos con STB antes del alta en la zona de riesgo alto o intermedio tienen una alta probabilidad de desarrollar SHB de forma precoz, se garantice un seguimiento frecuente. En entornos en los que no es posible un seguimiento estrecho, puede considerarse la posibilidad de retrasar el alta hospitalaria hasta que la bilirrubina descienda a zonas de menor riesgo. Los neonatos con una BSA previa al alta en zonas de riesgo bajo-intermedio o bajo pueden ser dados de alta según la política local. Sin embargo, debe garantizarse un seguimiento adecuado, ya que no puede descartarse el desarrollo posterior de SHB.
En conclusión, a pesar de una capacidad de discriminación justa, el mayor nivel de seguimiento en nuestro estudio aumenta la confianza en la capacidad del STB previo al alta para predecir el SHB en los bebés indios. Se necesitan más estudios para validar el rendimiento de las zonas de demarcación de riesgo definidas en este nomograma de bilirrubina específico para cada hora.
Contribuidores: DC: conceptualizó y diseñó el estudio; UP y SK: recogieron los datos; DC: analizaron los datos; UP: redactaron el artículo con aportaciones críticas de DC, SK y SJ. Todos los autores aprueban la versión final del manuscrito para su presentación.
Financiación: Ninguna; Intereses concurrentes: Ninguno declarado.
1. Informe 2002-2003: Red Nacional de Bases de Datos Neonatales Perinatales. New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. Identificación de neonatos con riesgo de hiperbilirrubinemia peligrosa: conocimientos clínicos emergentes. Pediatr Clin North Am. 2009;56:671-87.
3. Manejo de la hiperbilirrubinemia en el recién nacido de 35 o más semanas de gestación. Pediatrics. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Non-invasive estimation of total serum bilirubin by multi-wavelength spectral reflectance in neonates. Indian Pediatr. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Hiperbilirrubinemia neonatal temprana mediante el nivel de bilirrubina sérica del primer día. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Predicción de la hiperbilirrubinemia en lactantes a corto plazo y a término. Pediatrics 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Medición no invasiva de la bilirrubina sérica total en una población multirracial de recién nacidos antes del alta para evaluar el riesgo de hiperbilirrubinemia grave. Pediatrics. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Predictive ability of a predischarge hour-specific serum bilirubin for subsequent significant hyperbilirubinemia in healthy term and near-term newborns. Pediatrics. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia. Pediatrics. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Systematic review of screening for bilirubin encephalopathy in neonates. Pediatrics. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Simple nomograms to calculate sample size in diagnostic studies. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Cribado de bilirrubina en recién nacidos normales: una crítica del nomograma de bilirrubina específico de la hora. Pediatrics. 2009;124:1203-5.
13. Awasthi S, Rehman H. Early prediction of neonatal hyperbilirubinemia. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidencia, curso y predicción de la hiperbilirrubinemia en recién nacidos a corto plazo y a término. Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identificación de recién nacidos con riesgo de hiperbilirrubinemia significativa: comparación de dos enfoques recomendados. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Combinación de los factores de riesgo clínicos con los niveles de bilirrubina sérica para predecir la hiperbilirrubinemia en los recién nacidos. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Predicción y prevención de la hiperbilirrubinemia neonatal extrema en una organización de mantenimiento de la salud madura. Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. A comparison of alternative risk-assessment strategies for predicting significant neonatal hyperbilirubinemia in term and near-term infants. Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Risk factors for kernicterus in term babies with non-hemolytic jaundice. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Respuesta evocada auditiva del tronco cerebral en recién nacidos con hiperbilirrubinemia. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidence Based Clinical Practice Guidelines. National Neonatology Forum of India, New Delhi, India, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Informe preliminar sobre el cribado neonatal de hipotiroidismo congénito, hiperplasia suprarrenal congénita y deficiencia de glucosa-6-fosfato deshidrogenasa: una experiencia de Chandigarh. Indian J Pediatr. 2010;77:969-73.
