En betydelig andel af nyfødte udvikler hyperbilirubinæmi, der kræver behandling (‘signifikant’ hyperbilirubinæmi, SHB) i løbet af den første leveuge. Afkortning af varigheden af fødselsindlæggelse har været tidsmæssigt forbundet med øget forekomst af bilirubininduceret neurologisk skade . Sundhedspersonalets hjemmebesøg efter udskrivelsen eller familiens hospitalsbesøg kan afsløre SHB, men er ikke universelt gennemførlige eller omkostningseffektive. Derfor skal de nyfødte, der er i risiko for at udvikle høje bilirubinniveauer, identificeres, inden de udskrives fra fødeklinikken
En objektiv vurdering forud for udskrivelsen af risikoen for udvikling af SHB er også vigtig på grund af den begrænsede nøjagtighed af den visuelle vurdering af gulsotens omfang . Risikostratificering for SHB er blevet foretaget ved måling af bilirubinbelastning (absolutte niveauer eller stigningstakt for serumtotalbilirubin eller transkutan bilirubin), bilirubinproduktion (udåndet kulilte) og identifikation af underliggende kliniske risikofaktorer .
Koncentrationen af bilirubin i perifert blod er en funktion af aldersspecifikke hastigheder for bilirubinproduktion, metabolisme, udskillelse og reabsorption. Derfor er fortolkningen af bilirubinniveauet hos et nyfødt barn baseret på postnatal alder. Et timerspecifikt bilirubin-nomogram udviklet af Bhutani, et al. har vist, at måling af serum total bilirubin (STB) før udskrivelse fra fødeklinikken kan hjælpe med at identificere nyfødte, som er i risiko for at få højere percentilværdier af STB under opfølgningen. Blandt forskellige risikoprædiktionsmetoder har måling af STB før udskrivelsen vist sig at have den bedste diskriminerende evne blandt nordamerikanske nyfødte . På grund af genetisk betingede forskelle i bilirubinmetabolismen og forskelle i fodringspraksis kan det kliniske forløb af hyperbilirubinæmi imidlertid variere hos nyfødte, der tilhører forskellige etniciteter eller geografiske områder. Desuden blev det tidligere nomogram udviklet på grundlag af en retrospektiv kohorte, hvor oplysningerne om udfaldet af betydelig hyperbilirubinæmi kun var kendt for en femtedel af undersøgelsespopulationen . Derfor er udarbejdelsen af et timespecifikt bilirubin-nomogram i forskellige neonatale populationer en forudsætning for at kunne anvende bilirubinmåling før udskrivelsen som en risikovurderingsstrategi.
Vi planlagde denne prospektive kohorteundersøgelse for at konstruere timespecifikt serum total bilirubin nomogram hos indiske nyfødte og for at evaluere effektiviteten af måling af bilirubin før udskrivelse til at forudsige hyperbilirubinæmi, der kræver behandling blandt term og sent præmature nyfødte.
Metoder
Denne prospektive kohorteundersøgelse med evaluering af diagnostisk testydelse blev gennemført fra februar til juni 2010 på et universitetshospital i det nordlige Indien. Undersøgelsesprotokollen blev godkendt af hospitalets etiske komité, og der blev indhentet skriftligt informeret samtykke fra forældrene. Sunde nyfødte med en gestation ≥35 uger eller en fødselsvægt ≥2000 g var berettiget til at deltage i undersøgelsen. Af logistiske årsager kunne nyfødte, der fuldførte 24 timer af deres liv om søndagen, ikke deltage i undersøgelsen. Nyfødte med større medfødte misdannelser, indlæggelse på neonatal intensivafdeling, positiv direkte Coombs-test (blev udført, hvis moderens blodgruppe var Rhesus-negativ), fototerapi før den første bilirubinmåling eller manglende evne til at komme til opfølgning blev udelukket.
Studiemålinger og opfølgning: Blodprøve til første måling af serumtotal bilirubin blev udtaget på tidspunktet for metabolisk screening ved 18-30 timer efter fødslen. Kapillær- eller perifert veneblod blev opsamlet i præheparinerede mikrokapillærer. Blodet blev straks centrifugeret ved 12 000 rpm i 5 minutter, og totalbilirubin blev målt med et spektrofotometer (NEO-BIL plus, das srl, Italien).
Neonater blev fulgt op under hospitalsopholdet og efter udskrivelsen indtil afslutningen af 7. postnatale dag. Tidspunktet for opfølgningsbesøget blev besluttet på grundlag af alderen ved udskrivelsen. Spædbørn, der blev udskrevet før 48 timers alderen, blev kaldt tilbage mellem 72 og 96 timers alderen, og spædbørn, der blev udskrevet efter 48 timers alderen, blev kaldt tilbage mellem 96 og 120 timers alderen. Ud over den første måling af STB på tidspunktet for den metaboliske screening blev der foretaget yderligere to STB-målinger hos hvert nyfødt barn. Efter den første måling blev beslutningen om at foretage anden og tredje STB-måling truffet på grundlag af en klinisk vurdering. Den kliniske vurdering af graden af gulsot blev ledsaget af en transkutan bilirubinmåling (TcB) med et transkutant bilimeter med flere bølgelængder (BiliChek, variationskoefficient <5 %). STB-estimering blev foretaget, hvis håndfladerne/sålene var farvede med icterus eller TcB var >12 mg/dL eller inden for 80 % af den aldersspecifikke fototerapitærskel. Hvis det ikke var klinisk indikeret, blev der foretaget anden og tredje STB-måling ved henholdsvis 72-96 timer og 96-144 timer efter fødslen. STB-værdier efter start af fototerapi blev ikke medtaget i opbygningen af nomogrammet.
Kliniske og epidemiologiske risikofaktorer, som kan påvirke risikoen for at udvikle SHB, blev registreret. Følgende data blev registreret: fødselsvægt, gestation, køn, moderens uddannelse og religion, paritet, prænatale komplikationer, moderens ABO- og Rh-blodgruppe, fødselsmåde, anæstesitype anvendt under fødslen og brug af oxytocininfusion under fødslen. Desuden blev der også noteret alder ved påbegyndelse af fodring, supplerende fodring (andet end amning eller udpumpet modermælk) under og efter de første 24 timer efter fødslen og alder ved passage af første afføring.
Resultat: Det vigtigste resultat var signifikant hyperbilirubinæmi (SHB), som blev defineret som behov for fototerapi eller udskiftningstransfusion til behandling af hyperbilirubinæmi. Beslutningen om at starte fototerapi blev truffet på grundlag af barnets alder i timer og STB-niveauer, i henhold til den lokale tilpasning af American Academy of Pediatrics (AAP) retningslinjer . Hos nyfødte, der er født i 38 eller flere svangerskabsuge, blev tærskelværdien for mellemrisiko anvendt til at indlede fototerapi, og hos nyfødte, der er født i 37 eller færre fulde svangerskabsuge, blev tærskelværdien for højere risiko anvendt til at indlede fototerapi. Mellemrisikotærskelværdierne i AAP-retningslinjerne er næsten identiske med 95
-percentileværdierne i Bhutani-nomogrammet .
Statistisk analyse: I en prospektiv undersøgelse blev der observeret signifikant hyperbilirubinæmi hos 10 % af de nyfødte, der blev født i ≥35 svangerskabsuge . For at undersøge en diagnostisk test med en sensitivitet på mindst 95 % (konfidensinterval 5 %) og en alfaværdi på 0,05 var det nødvendigt at registrere ca. 1000 personer .
Data blev analyseret ved hjælp af Stata 9 (StataCorp, College Station, TX, USA). Til opbygning af nomogrammet blev STB-værdierne klynget i seks timers epoker (alder ± 3 timer) for postnatal alder op til 48 h og tolv timers epoker (alder ± 6 timer) for alder ud over 48 h. Data for hver epok blev undersøgt for symmetri. De 5
te, 10., 25., 40., 75., 90. og 95. percentilværdier blev beregnet for hver epok. Microsoft Excel (Microsoft Corporation, Richmond, USA) blev anvendt til at tegne det timespecifikke bilirubin-nomogram. Det udglattede nomogram, der viser 40., 75. og 95. percentil, blev plottet ved hjælp af cubic spine-modellering med GAMLSS-pakken til R-statistiksoftware. Efter udjævning var 36,5 % af tilfældene under 40. percentillinjen, 77,8 % af tilfældene under 75. percentillinjen og 95,1 % af tilfældene under 95. percentillinjen. Nomogrammets prædiktive evne blev vurderet ved at beregne sensitivitet, specificitet, positiv prædiktiv værdi, negativ prædiktiv værdi og sandsynlighedskvotient, ved at tegne ROC-kurven (receiver-operating characteristics) og beregne c-statistikken.
Resultater
I løbet af undersøgelsesperioden blev der født i alt 1255 nyfødte, hvoraf 1090 var berettigede til at blive registreret. Blandt disse blev 93 udelukket af forskellige årsager (fig. 1). I alt 997 nyfødte blev indskrevet i undersøgelsen. Gennemsnitlig ± SD-værdi for fødselsvægt var 2627 ± 536 g og for gestationsalder var 37,8 ± 1,5 uger (median og IQR: 38 og 37-39) (webtabel I). De fleste af undersøgelsens spædbørn blev født efter et ukompliceret fødselsforløb og havde en begivenhedsløs overgang til livet uden for livmoderen. Mere end 80 % af de nyfødte blev udelukkende ammet under hospitalsopholdet.
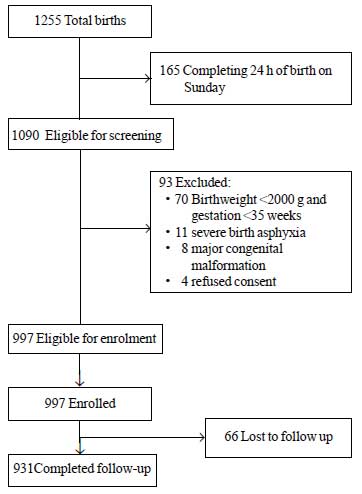
Fig.1 Undersøgelsesflow.
Konstruktion af bilirubin-nomogram: Første måling af bilirubin blev foretaget ved 23,3±6,3 timers alderen, og gennemsnitlig STB var 7,0±2,0 mg/dL. Niogtyve (2,9 %) nyfødte havde behov for fototerapi baseret på første måling af bilirubin. Hos disse nyfødte blev fototerapi påbegyndt ved en alder på 27±5,6 timer med STB-niveauer på 12,3±2,0 mg/dL. Seksogtres (6,6 %) nyfødte blev tabt til opfølgning efter udskrivelse fra undersøgelseshospitalet. Første bilirubinværdi hos disse neonater var sammenlignelig med neonater, der aldrig udviklede SHB (6,5±1,9 vs 6,7±1,7 mg/dL, P=0,54) og var signifikant lavere end de neonater, der udviklede SHB (6,5±1,9 vs 8,5±2,2 mg/dL, P< 0,001).
Til konstruktion af nomogrammet og vurdering af fordelingen af STB-værdierne blev den postnatale alder opdelt i seks-timers epoker for postnatal alder op til 48 h og tolv-timers epoker for alder ud over 48 h. STB ved hver af epokerne undtagen ved 42 h blev observeret at være symmetrisk fordelt (fig. 2). Fordelingen af STB-værdierne ved 42 timer blev observeret som værende positivt skæv, og disse værdier blev ikke anvendt til konstruktion af nomogrammet.
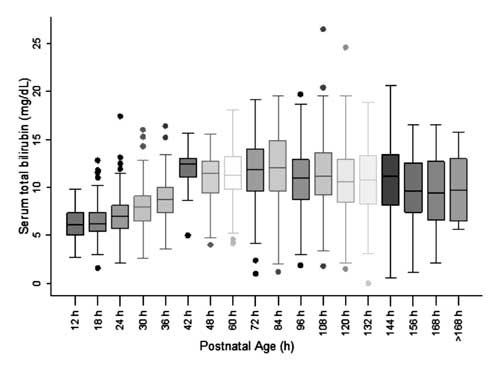
Fig. 2 Box-whisker plot, der viser fordelingen af serum total bilirubin.
Den 5
te, 10., 25., 40., 75., 90. og 95. percentilværdi for hver epok blev beregnet. Aldersspecifikke serumbilirubin-nomogrammer blev tegnet med 40., 75. og 95. percentilværdier ved fremadskridende postnatal alder (fig. 3)
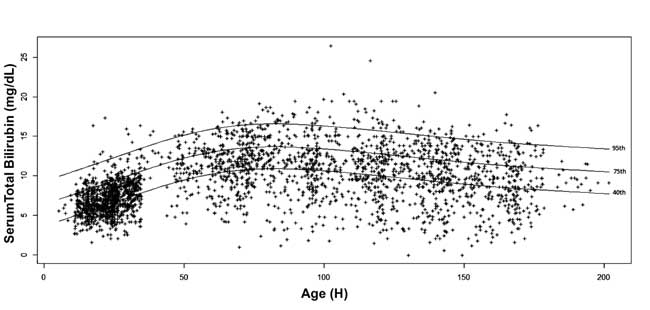
Figur. 3 Bilirubin-nomogram – timerspecifikt serum totalbilirubin afbildet som 40., 75. og 95. percentiler.
Prediktiv evne af STB før udskrivelsen: Samlet set udviklede 199 (20 %) nyfødte børn SHB (modtog fototerapi). Første bilirubinværdi blev brugt til at forudsige det efterfølgende behov for behandling for hyperbilirubinæmi. Hvis der blev opnået mere end to værdier i de første 48 timer efter fødslen, blev den højeste percentilværdi anvendt til forudsigelse.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Totalbilirubin i serum før udskrivelse | Outcome | Testpræstation | |||||||
| Percentil | Antal(n=928) | SHB+ | SHB- | PPV | NPV | Sensitivitet | Specificitet | ||
| Over 95. percentil | 49 | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 | |
| Under 95. percentil | 879 | 165 | 714 | ||||||
| Over 75. percentil | 239 | 107 | 132 | 132 | 44.8 | 86.2 | 53.8 | 81.9 | |
| Under 75. percentil | 689 | 92 | 597 | ||||||
| Over 40. percentil | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 | ||
| Under 40. percentil | 342 | 32 | 32 | 310 | |||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
|||||||||
Am blandt nyfødte, der havde præudskrivelse STB-måling og gennemførte opfølgning (n=928), i 49 (5.3 %) neonater før udskrivelse var STB mere end 95. percentil af den aldersspecifikke fordeling (tabel I). Af disse 34 nyfødte havde efterfølgende behov for fototerapi (positiv prædiktiv værdi: 69,4 %, sensitivitet: 17,1 %). Hos 342 (36,8 %) nyfødte var STB før udskrivelsen mindre end 40. percentil af den aldersspecifikke fordeling. Af disse havde 310 nyfødte ikke behov for efterfølgende behandling for hyperbilirubinæmi (negativ prædiktiv værdi: 90,6 % og specificitet: 42,5 %). Den positive prædiktive værdi af 75. percentil cut-off var 44,8 % og den negative prædiktive værdi var 86,2 %. ROC-kurven, som vist i fig. 4, illustrerer den diagnostiske ydeevne for hver percentil-cutoff med et areal under kurven (c-statistik) på 0,73.
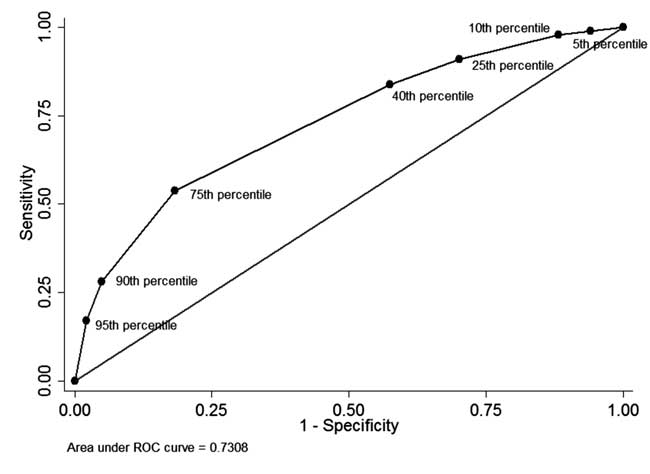
Figur 4 ROC-kurven for diagnostisk evne for forskellige percentil cut-offs af serum total bilirubin før udskrivelse.
Likelihood ratio (LR) er et bedre redskab til måling af diagnostisk testpræstation, da forholdet ikke påvirkes af ændringer i baggrundsprævalensen af resultatet. LR for positiv test (LR+, sandsynlighed for positiv test hos syge/ sandsynlighed for positiv test hos ikke-syge) blev beregnet for hver risikoafgrænsningszone. STB før udskrivelse på ≥95. percentil blev tildelt højrisikozonen, mellem 75. og 94. centile i øvre-intermediær risikozone, mellem 40. og 74. centile i lavere-intermediær risikozone og under 40. percentil i lavrisikozonen. Blandt 49 nyfødte i højrisikozonen udviklede 34 nyfødte SHB; derfor var den positive LR for STB i højrisikozonen 8,26 (tabel II). Blandt 190 nyfødte i den øvre-intermediære risikozone udviklede 73 nyfødte SHB; derfor var den positive LR for STB i denne risikozone 2,30. På samme måde var den positive LR for STB i den lavere-intermediære risikozone 0,76 og for lavrisikozonen 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Pre-de-udskrivelse serum total bilirubin | |||||||||
| Pre-udledning kumulativ risikozone | Percentil | Total | SHB+ | SHB- | P:A ratio | Sandsynlighed for sygdom | LR+ | ||
| Høj risiko | ≥95th | 49 | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 | |
| Overste mellemtrin | 75. til 94. | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 | ||
| Mindre mellemlangt | 40. til 74. | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 | ||
| Lav risiko | <40. | 342 | 32 | 32 | 310 | 1:10 | 1/11 | 0.37 | |
| 928 | 199 | 729 | 1:4 | 1/5 | |||||
| SHB: signifikant hyperbilirubinæmi; P:A-forhold: Tilstedeværelse af resultat : Fravær af resultat. | |||||||||
Diskussion
Risikovurdering før udskrivelse for efterfølgende udvikling af SHB anbefales som en potentiel strategi til at reducere forekomsten af bilirubininduceret neurologisk skade eller kernicterus. I denne prospektive kohorteundersøgelse har vi konstrueret et timespecifikt serumbilirubin-nomogram i en delmængde af nordindiske nyfødte og har evalueret effektiviteten af risikoafgrænsning ved hjælp af STB-måling før udskrivelsen med henblik på at forudsige det efterfølgende behov for lysbehandling (SHB). Baselineforekomsten af SHB var høj i vores undersøgelseskohorte, idet 2 ud af 10 nyfødte udviklede SHB. Placering af STB før udskrivelsen i to højere risikozoner øgede signifikant risikoen for efterfølgende SHB med 7 ud af 10 nyfødte i højrisikozonen, der udviklede SHB (positiv LR=8,26) og 4 ud af 10 nyfødte i højere-intermediær risikozone, der udviklede SHB (positiv LR=2,3). Placering af STB før udskrivelsen i lavrisikozonen mindskede signifikant risikoen for efterfølgende SHB med 1 ud af 10 nyfødte, der udviklede SHB (positiv LR=0,37). Da den negative prædiktive værdi af lavrisiko-afgrænsningen imidlertid kun var 90 %, kunne placering i lavrisikozonen ikke udelukke muligheden for efterfølgende SHB.
Bhutani, et al. viste i en stor kohorte, at nyfødte med STB før udskrivelsen i høj- og højintermediær risikozone er mere tilbøjelige til at få SHB under opfølgningen. Forfatterne konstruerede percentildiagrammer for serumbilirubinniveauet ved forskellige postnatale aldre hos næsten terminale og terminale nyfødte. De fandt, at 6,1 % af de nyfødte havde serumbilirubin >95. percentil før udskrivelsen; 32,1 % af disse spædbørn viste efterfølgende hyperbilirubinæmi. I sammenligning med det timespecifikke nomogram af Bhutani, et al. er percentilværdierne for STB i denne undersøgelse højere med op til 2 mg/dL indtil 84-108 timer efter fødslen. Neonater af nordindisk oprindelse er blevet observeret til at nå højere værdier af bilirubin og har højere forekomst af hyperbilirubinæmi . Den gennemsnitlige STB-værdi på 7,0 ± 2,0 mg/dL, der blev observeret i denne undersøgelse, ligger mellem 75. og 95. percentil i Bhutani-nomogrammet. Agarwal, et al. rapporterede ligeledes en gennemsnitlig STB på 5,9 ± 1,8 mg/dL ved 24 timers postnatal alder, hvilket ligger tæt på 75. percentilværdi i Bhutani-nomogrammet. En højere andel af for tidligt fødte eller nyfødte med lav fødselsvægt og en højere grad af eksklusiv amning i vores undersøgelse kan være de faktorer, der bidrager til øgede STB-værdier og øget forekomst af SHB. Desuden øgede vores beslutning om at anvende den midterste i stedet for den øverste linje af AAP’s fototerapitærskelværdier, selv hos nyfødte med lav risiko, også forekomsten af SHB. Efter 108 timers postnatal alder er percentilværdierne for STB i denne undersøgelse lavere end de tilsvarende værdier i Bhutani-nomogrammet. Inddragelse af STB-værdier fra nyfødte, der selektivt blev fulgt op efter klinikerens vurdering ved udarbejdelsen af nomogrammet, kan have resulteret i anvendelse af højere STB-niveauer ved udarbejdelsen af Bhutani-nomogrammet, hvorved sidstnævntes generaliserbarhed mindskes . I den foreliggende undersøgelse, hvor opfølgningen blev afsluttet uanset sværhedsgraden af hyperbilirubinæmi, toppede nomogrammet på 4. og 5. dag i den postnatale alder med et naturligt fald ved udgangen af den første uge.
I en prospektiv kohortestudie målte Agarwal, et al. STB ved 24±6 timers alder hos 220 nyfødte født ved ≥35 gestationsuger med henblik på forudsigelse af hyperbilirubinæmi . Fravær af STB >6 mg/dL ved 24±6 timers alder udelukkede praktisk talt muligheden for efterfølgende SHB (sandsynlighedsforholdet for negativ test 0,07) inden for 5 dage efter fødslen. Selektiv måling af resultatet hos kun de nyfødte, som under opfølgningen havde et “klinisk” bilirubinniveau på >10 mg/dL, indførte imidlertid en verifikationsbias i undersøgelsen. I en anden indisk undersøgelse blev det konstateret, at en grænseværdi på 3,99 mg/dL ved 18-24 timer havde en sensitivitet og specificitet på 67 % for forudsigelse af et efterfølgende bilirubinniveau >15 mg/dL . Der var dog kun fuldstændig opfølgning hos de spædbørn, der blev på hospitalet enten på grund af neonatal sygdom eller af en eller anden moderlig årsag, f.eks. kejsersnit. Mere end 50 % af de spædbørn, som var raske og derfor blev udskrevet tidligt, blev ikke fulgt op. I en undersøgelse fra Tyrkiet blev der fremlagt et timespecifikt bilirubin-nomogram for nyfødte med en gestationsalder på mellem 35 og 37 uger. STB-værdi mere end 95
-percentilen havde en høj positiv prædiktiv værdi for efterfølgende udvikling af SHB . STB-værdi mindre end 30. percentil havde imidlertid en negativ prædiktiv værdi på ca. 90 %. To store retrospektive undersøgelser har rapporteret om en fremragende prædiktiv evne ved tidlig/før udskrivelse måling af STB med et område under kurven (AUC) på 0,83 . I vores undersøgelse var den diskriminerende evne af 40. og 75. percentilværdierne lavere end de tidligere rapporterede . Dette forskød ROC-kurven i vores undersøgelse i retning af den diagonale linje, hvilket resulterede i en nedsat diskriminationsevne (AUC= 0,73). Den høje baselineforekomst af SHB i tyrkisk (25,3 %) og i vores undersøgelse (20 %) kan forklare, at lave percentilværdier ikke er i stand til at udelukke udvikling af efterfølgende SHB, hvilket begrænser nytten af STB-måling før udskrivelse.
En alternativ risikovurderingsstrategi til forudsigelse af efterfølgende SHB er evaluering af kliniske risikofaktorer. Gestation ved fødslen, anamnese af gulsot, der har krævet behandling hos tidligere søskende, oxytocininfusion, instrumentel fødsel, fødselstraume og utilstrækkelig fodring er blevet nævnt som risikofaktorer for SHB .
Imidlertid er det blevet rapporteret, at den kliniske risikomodels diskriminerende evne er lavere end den, som tidlig STB-måling giver . Newman, et al. rapporterede om forbedret diskriminationsevne, når et klinisk risikoinstrument blev kombineret med tidlig STB-måling . På grund af den betydelige andel af nyfødte med lav fødselsvægt og for tidligt fødte børn i vores kohorte spekulerer vi på, at en kombination af disse objektivt målbare kliniske risikofaktorer med tidlig STB-måling ville generere en risikomodel med forbedret diskriminationsevne.
Ekstern anvendelighed af observationer foretaget i undersøgelsen kan være påvirket af den relativt høje forekomst af hyperbilirubinæmi i undersøgelseskohorten på grund af brugen af lavere bilirubintærskler for start af fototerapi. I modsætning til udviklede lande er kernicterus blevet rapporteret ved lavere niveauer af peak bilirubin i Indien, hvilket indikerer, at indiske nyfødte kan udvikle bilirubininduceret neurologisk skade ved lavere peak serumbilirubinniveauer . Desuden har omkring en tredjedel af de nyfødte, der fødes i Indien, en lav fødselsvægt. Af disse grunde foreslår det nationale neonatologiske forum i Indien i sine retningslinjer, at der anvendes lavere tærskelværdier for start af fototerapi, især i områder med højere forekomst af glukose-6-fosfatdehydrogenasemangel .
Stærke sider ved vores undersøgelse er bl.a. prospektivt undersøgelsesdesign, stor stikprøvestørrelse, mere end 90 % opfølgningsrate og fravær af verifikationsbias. Vi kunne ikke konstatere forekomsten af udfaldet hos ca. 7 % af de indskrevne nyfødte. Da tidlig STB og demografiske karakteristika hos disse neonater, der mistede opfølgningen, imidlertid lignede dem, der aldrig udviklede SHB, er det usandsynligt, at det timerspecifikke nomogram og risikovurderingsinstrumentet påvirkes. Vi anvendte ikke højtydende væskekromatografi (HPLC), som er den “guldstandard” metode til måling af bilirubin. Vi målte bilirubin ved hjælp af en mere almindeligt anvendt bedside-metode, nemlig spektrofotometri. Det bilimeter, der blev anvendt i vores undersøgelse, havde en lav variationskoefficient, og det blev kalibreret før hver brug.
Vi anbefaler, at da nyfødte med STB før udskrivelsen i høj- eller højintermediær risikozone har stor sandsynlighed for at udvikle SHB tidligt, bør der sikres hyppig opfølgning. I situationer, hvor tæt opfølgning ikke er mulig, kan man overveje at udsætte udskrivelsen fra hospitalet, indtil bilirubin falder til lavere risikozoner. Nyfødte med STB inden udskrivelsen i lavere-intermediære eller lave risikozoner kan udskrives i henhold til den lokale politik. Der bør dog sikres en passende opfølgning, da det ikke kan udelukkes, at der senere udvikles SHB.
Sammenfattende kan det konkluderes, at på trods af en rimelig diskriminerende evne øger det højere niveau af opfølgning i vores undersøgelse tilliden til, at STB før udskrivelsen kan forudsige SHB hos indiske spædbørn. Der er behov for yderligere undersøgelser for at validere ydeevnen af de risikoafgrænsningszoner, der er defineret i dette timespecifikke bilirubin-nomogram.
Medvirkende: DC: konceptualiserede og designede undersøgelsen; UP og SK: indsamlede data; DC: analyserede data; UP: udarbejdede artiklen med kritiske input fra DC, SK og SJ. Alle forfattere godkender den endelige version af manuskriptet til indsendelse.
Funding: Ingen; konkurrerende interesser: Ingen angivet.
1. Rapport 2002-2003: National Neonatal Perinatal Database Network. New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. Identifikation af nyfødte i risiko for farlig hyperbilirubinæmi: ny klinisk indsigt. Pediatr Clin North Am. 2009;56:671-87.
3. Håndtering af hyperbilirubinæmi hos det nyfødte spædbarn 35 eller flere uger af gestation. Pediatrics. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Ikke-invasiv estimering af total serumbilirubin ved hjælp af spektralreflektion i flere bølgelængder hos nyfødte. Indian Pediatr. 2000;37;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Tidlig neonatal hyperbilirubinæmi ved hjælp af første dags serumbilirubinniveau. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Prediction of hyperbilirubinemia in near-term and term infants. Pediatrics 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Ikke-invasiv måling af total serumbilirubin i en multiracial population af nyfødte før udskrivelsen med henblik på vurdering af risikoen for alvorlig hyperbilirubinæmi. Pediatrics. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Prædiktiv evne af et timerspecifikt serumbilirubin før udskrivelsen til at forudsige efterfølgende betydelig hyperbilirubinæmi hos raske nyfødte med termin og nær termin. Pediatrics. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. En evidensbaseret gennemgang af vigtige spørgsmål vedrørende neonatal hyperbilirubinæmi. Pediatrics. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Systematisk gennemgang af screening for bilirubin-encephalopati hos nyfødte. Pediatrics. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Simple nomogrammer til beregning af stikprøvestørrelse i diagnostiske undersøgelser. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Bilirubinscreening for normale nyfødte: en kritik af det timespecifikke bilirubin-nomogram. Pediatrics. 2009;124:1203-5.
13. Awasthi S, Rehman H. Tidlig forudsigelse af neonatal hyperbilirubinæmi. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Forekomst, forløb og forudsigelse af hyperbilirubinæmi hos nyfødte med kort og lang levetid. Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identificering af nyfødte med risiko for betydelig hyperbilirubinæmi: en sammenligning af to anbefalede fremgangsmåder. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Kombination af kliniske risikofaktorer med serumbilirubinniveauer med henblik på at forudsige hyperbilirubinæmi hos nyfødte. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Forudsigelse og forebyggelse af ekstrem neonatal hyperbilirubinæmi i en moden sundhedsvæsenorganisation. Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. En sammenligning af alternative risikovurderingsstrategier til forudsigelse af betydelig neonatal hyperbilirubinæmi hos termins- og næsten-terminsbørn. Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Risikofaktorer for kernicterus hos terminsbørn med ikke-hemolytisk gulsot. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Brainstem auditivt fremkaldt respons hos nyfødte med hyperbilirubinæmi. Indian Pediatr. 1998;35;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidensbaserede retningslinjer for klinisk praksis. National Neonatology Forum of India, New Delhi, Indien, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Foreløbig rapport om neonatal screening for medfødt hypothyreose, medfødt binyrebarkhypoplasi og glukose-6-fosfatdehydrogenasemangel: en erfaring fra Chandigarh. Indian J Pediatr. 2010;77:969-73.
