Una percentuale significativa di neonati sviluppa un’iperbilirubinemia che richiede un trattamento (iperbilirubinemia “significativa”, SHB) durante la prima settimana di vita. La diminuzione della durata dell’ospedalizzazione alla nascita è stata associata temporalmente a un’aumentata incidenza di danni neurologici indotti dalla bilirubina. Le visite domiciliari post-dimissione da parte del personale sanitario o le visite in ospedale da parte della famiglia possono rilevare la SHB, ma non sono universalmente fattibili o convenienti. Pertanto, prima che i neonati vengano dimessi dall’ospedale di nascita, quelli a rischio di sviluppare alti livelli di bilirubina devono essere identificati
La valutazione oggettiva prima della dimissione per il rischio di sviluppare SHB è importante anche a causa della limitata accuratezza della valutazione visiva dell’estensione dell’ittero. La stratificazione del rischio per la SHB è stata fatta misurando il carico di bilirubina (livelli assoluti o tasso di aumento della bilirubina totale nel siero o della bilirubina transcutanea), la produzione di bilirubina (monossido di carbonio espirato) e identificando i fattori di rischio clinici sottostanti.
La concentrazione di bilirubina nel sangue periferico è una funzione dei tassi di produzione, metabolismo, escrezione e riassorbimento della bilirubina specifici dell’età. Pertanto, l’interpretazione del livello di bilirubina in un neonato si basa sull’età postnatale. Il nomogramma della bilirubina ora-specifico sviluppato da Bhutani, et al. ha dimostrato che la misurazione della bilirubina totale nel siero (STB) prima della dimissione dall’ospedale di nascita può aiutare a identificare i neonati che sono a rischio di avere valori percentili più alti di STB durante il follow-up. Tra i vari metodi di previsione del rischio, la misurazione della STB prima della dimissione ha mostrato la migliore capacità di discriminazione tra i neonati nordamericani. Tuttavia, a causa delle differenze geneticamente determinate nel metabolismo della bilirubina e delle differenze nelle pratiche di alimentazione, il decorso clinico dell’iperbilirubinemia può variare nei neonati appartenenti a diverse etnie o località geografiche. Inoltre, il nomogramma precedente è stato sviluppato da una coorte retrospettiva in cui le informazioni sull’esito dell’iperbilirubinemia significativa erano note solo per un quinto della popolazione dello studio. Pertanto, la costruzione di un nomogramma della bilirubina ora-specifico in diverse popolazioni neonatali è un prerequisito per utilizzare la misurazione della bilirubina prima della dimissione come strategia di valutazione del rischio.
Abbiamo pianificato questo studio prospettico di coorte per costruire il nomogramma ora-specifico della bilirubina sierica totale nei neonati indiani e per valutare l’efficacia della misurazione della bilirubina prima della dimissione nel predire l’iperbilirubinemia che necessita di trattamento tra i neonati a termine e pretermine.
Metodi
Questo studio prospettico di coorte con valutazione delle prestazioni dei test diagnostici è stato condotto da febbraio a giugno 2010 in un ospedale universitario nel nord dell’India. Il protocollo dello studio è stato approvato dal comitato etico dell’ospedale e il consenso informato scritto è stato ottenuto dai genitori. I neonati sani con gestazione ≥35 settimane o peso alla nascita ≥2000 g erano idonei all’arruolamento nello studio. Per motivi logistici, i neonati che completavano le 24 ore di vita di domenica non sono stati ammessi all’arruolamento nello studio. Sono stati esclusi i neonati con malformazioni congenite importanti, ricovero in unità di terapia intensiva neonatale, test di Coombs diretto positivo (è stato fatto se il gruppo sanguigno della madre era Rhesus negativo), fototerapia prima della prima misurazione della bilirubina o incapacità di venire per il follow-up.
Misurazioni dello studio e follow-up: Il campione di sangue per la prima misurazione della bilirubina totale nel siero è stato prelevato al momento dello screening metabolico a 18-30 h di età postnatale. Il sangue venoso capillare o periferico è stato raccolto in microcapillari pre-heparinizzati. Il sangue è stato centrifugato immediatamente a 12000 rpm per 5 minuti e la bilirubina totale è stata misurata con uno spettrofotometro (NEO-BIL plus, das srl, Italia).
I neonati sono stati seguiti durante la permanenza in ospedale e dopo la dimissione fino al completamento del 7° giorno postnatale. La tempistica della visita di follow-up è stata decisa in base all’età alla dimissione. I bambini dimessi prima delle 48 ore di età sono stati richiamati tra le 72 e le 96 ore di età e i bambini dimessi dopo le 48 ore di età tra le 96 e le 120 ore di età. Oltre alla prima misurazione della STB al momento dello screening metabolico, sono state effettuate altre due misurazioni della STB in ogni neonato. Dopo la prima misurazione, la decisione di eseguire la seconda e la terza misurazione STB era basata sulla valutazione clinica. La valutazione clinica del grado di ittero è stata accompagnata dalla misurazione della bilirubina transcutanea (TcB) con un bilimetro transcutaneo a più lunghezze d’onda (BiliChek, coefficiente di variazione <5%). La stima della STB è stata fatta se i palmi/suole erano macchiati di ittero o se la TcB era >12 mg/dL o entro l’80% della soglia di fototerapia specifica dell’età. Se non indicato clinicamente, la seconda e la terza misurazione STB sono state fatte rispettivamente a 72-96 h e 96-144 h di età postnatale. I valori STB dopo l’inizio della fototerapia non sono stati inclusi per la costruzione del nomogramma.
Sono stati registrati i fattori di rischio clinici ed epidemiologici che possono influenzare il rischio di sviluppare SHB. Sono stati registrati i seguenti dati: peso alla nascita, gestazione, sesso, educazione e religione materna, parità, complicazioni prenatali, gruppo sanguigno ABO e Rh materno, modalità di parto, tipo di anestesia utilizzata durante il parto e uso di infusione di ossitocina durante il travaglio. Inoltre, l’età all’inizio dell’alimentazione, l’alimentazione supplementare (diversa dall’allattamento al seno o dal latte materno espresso) durante e dopo le prime 24 ore dopo la nascita e l’età al passaggio delle prime feci sono stati anche annotati.
Outcome: Il risultato chiave era l’iperbilirubinemia significativa (SHB), definita come necessità di fototerapia o trasfusione di scambio per il trattamento dell’iperbilirubinemia. La decisione di iniziare la fototerapia è stata presa sulla base dell’età del bambino in ore e dei livelli di STB, come da adattamento locale delle linee guida dell’American Academy of Pediatrics (AAP). Nei neonati nati a 38 o più settimane di gestazione, la soglia di rischio medio, e nei neonati nati a 37 o meno settimane complete di gestazione, la soglia di rischio superiore, è stata utilizzata per iniziare la fototerapia. I valori di soglia a medio rischio nelle linee guida AAP sono quasi identici ai valori del 95
esimo percentile del nomogramma di Bhutani.
Analisi statistica: In uno studio prospettico è stata osservata una significativa iperbilirubinemia nel 10% dei neonati nati a ≥35 settimane di gestazione. Per studiare un test diagnostico con sensibilità di almeno il 95% (intervallo di confidenza 5%) e valore alfa di 0,05, avevamo bisogno di arruolare circa 1000 soggetti.
I dati sono stati analizzati utilizzando Stata 9 (StataCorp, College Station, TX, USA). Per la costruzione del nomogramma, i valori STB sono stati raggruppati in epoche di sei ore (età±3 ore) per l’età postnatale fino a 48 h e in epoche di dodici ore (età±6 ore) per l’età oltre le 48 h. I dati per ogni epoca sono stati esaminati per simmetria. I valori del 5°, 10°, 25°, 40°, 75°, 90° e 95° percentile sono stati calcolati per ogni epoca. Microsoft Excel (Microsoft Corporation, Richmond, USA) è stato utilizzato per tracciare il nomogramma della bilirubina specifico dell’ora. Il nomogramma smussato raffigurante il 40°, 75° e 95° percentile è stato tracciato utilizzando la modellazione della spina dorsale cubica con il pacchetto GAMLSS per il software statistico R. Dopo lo smussamento, il 36,5% dei casi era al di sotto della linea del 40° percentile, il 77,8% dei casi era al di sotto della linea del 75° percentile e il 95,1% dei casi era al di sotto della linea del 95° percentile. La capacità predittiva del nomogramma è stata valutata calcolando sensibilità, specificità, valore predittivo positivo, valore predittivo negativo e likelihood ratio, tracciando la curva delle caratteristiche operative del ricevitore (ROC) e calcolando la statistica c.
Risultati
Durante il periodo di studio, sono nati un totale di 1255 neonati di cui 1090 erano idonei all’arruolamento. Tra questi, 93 sono stati esclusi per diversi motivi (Fig. 1). Un totale di 997 neonati sono stati arruolati nello studio. Il valore medio ± SD del peso alla nascita era di 2627±536 g e l’età gestazionale era di 37,8±1,5 settimane (mediana e IQR: 38 e 37-39) (Tabella I). La maggior parte dei neonati dello studio sono nati dopo un decorso prenatale non complicato e hanno avuto una transizione senza problemi alla vita extrauterina. Più dell’80% dei neonati sono stati allattati esclusivamente al seno durante il soggiorno in ospedale.
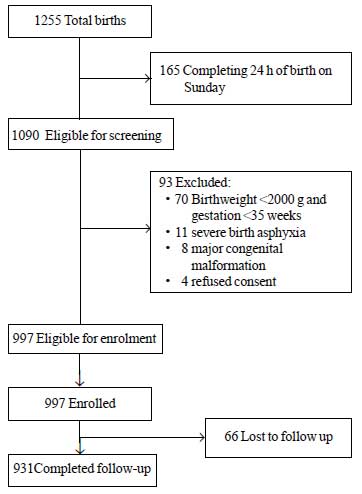
Fig.1 Flusso dello studio.
Costruzione del nomogramma della bilirubina: La prima misurazione della bilirubina è stata eseguita a 23,3±6,3 ore di età e la STB media era di 7,0±2,0 mg/dl. Ventinove (2,9%) neonati avevano bisogno di fototerapia in base alla prima misurazione della bilirubina. In questi neonati la fototerapia è stata iniziata a 27±5,6 ore di età con livelli di STB di 12,3±2,0 mg/dl. Sessantasei (6,6%) neonati hanno perso il follow-up dopo la dimissione dall’ospedale dello studio. Il primo valore di bilirubina in questi neonati era paragonabile ai neonati che non hanno mai sviluppato SHB (6,5±1,9 vs 6,7±1,7 mg/dL, P=0,54) ed era significativamente inferiore a quelli che hanno sviluppato SHB (6,5±1,9 vs 8,5±2,2 mg/dL, P< 0,001).
Per la costruzione del nomogramma e la valutazione della distribuzione dei valori STB, l’età postnatale è stata divisa in epoche di sei ore per l’età postnatale fino a 48 ore e in epoche di dodici ore per l’età oltre le 48 ore. La distribuzione dei valori STB a 42 ore è stata osservata essere positivamente asimmetrica e questi valori non sono stati utilizzati per la costruzione del nomogramma.
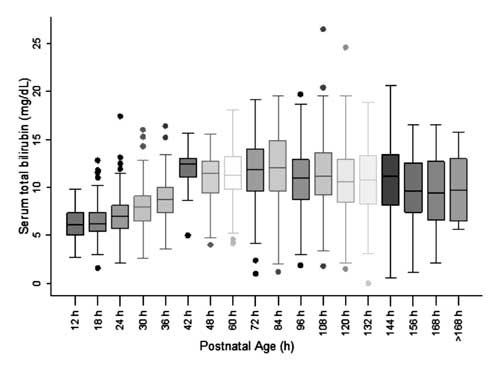
Fig. 2 Box-whisker plot che mostra la distribuzione della bilirubina totale del siero.
Sono stati calcolati i valori del 5
, 10°, 25°, 40°, 75°, 90° e 95°percentile per ogni epoca. Il nomogramma della bilirubina sierica specifico dell’età è stato disegnato con i valori del 40°, 75° e 95° percentile all’avanzare dell’età postnatale (Fig. 3).
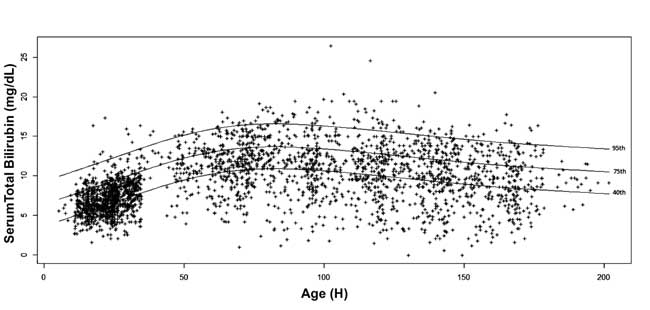
Fig. 3 Nomogramma della bilirubina – bilirubina totale sierica specifica per ora rappresentata come 40°, 75° e 95° percentile.
Capacità predittiva della STB pre-dimissione: Complessivamente, 199 (20%) neonati hanno sviluppato SHB (ricevuto fototerapia). Il primo valore di bilirubina è stato utilizzato per predire la successiva necessità di trattamento per l’iper-bilirubinemia. Se sono stati ottenuti più di due valori nelle prime 48 ore dopo la nascita, il valore percentile più alto è stato utilizzato per la previsione.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Bilirubina totale sierica pre-dimissione | Outcome | Prestazione del test | |||||
| Percentile | Numero (n=928) | SHB+ | SHB- | PPV | NPV | Sensibilità | Specificità |
| Superiore al 95° percentile | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 |
| Sotto il 95° percentile | 879 | 165 | 714 | ||||
| Superiore al 75° percentile | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 |
| Sotto il 75° percentile | 689 | 92 | 597 | ||||
| Superiore al 40° percentile | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 |
| Sotto il 40° percentile | 342 | 32 | 310 | ||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
|||||||
Tra i neonati che avevano una misurazione STB premisurazione STB prima della dimissione e hanno completato il follow-up (n=928), in 49 (5.3%) neonati la STB prima della dimissione era superiore al 95° percentile della distribuzione specifica per età (Tabella I). Di questi 34 neonati hanno successivamente avuto bisogno di fototerapia (valore predittivo positivo: 69.4%, sensibilità: 17.1%). In 342 (36,8%) neonati la STB prima della dimissione era inferiore al 40° percentile della distribuzione specifica per età. Di questi, 310 neonati non hanno avuto bisogno di un trattamento successivo per l’iperbilirubinemia (valore predittivo negativo: 90,6% e specificità: 42,5%). Il valore predittivo positivo del cut-off del 75° percentile era del 44,8% e il valore predittivo negativo era dell’86,2%. La curva ROC come mostrato in Fig. 4 illustra la performance diagnostica di ogni percentile-cutoff con un’area sotto la curva (c-statistica) di 0,73.
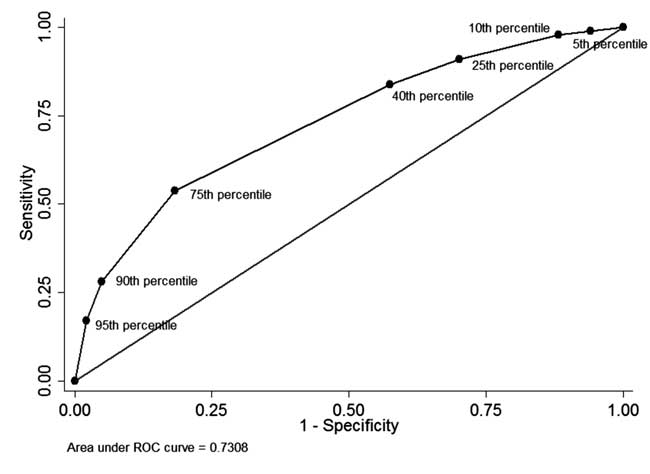
Fig. 4 La curva ROC per la capacità diagnostica di diversi cut-off percentili di bilirubina totale nel siero prima della dimissione.
Il rapporto di probabilità (LR) è uno strumento migliore per misurare le prestazioni del test diagnostico poiché il rapporto non è influenzato dal cambiamento della prevalenza di fondo del risultato. La LR del test positivo (LR+, probabilità di test positivo nei malati/ probabilità di test positivo nei non malati) è stata calcolata per ogni zona di demarcazione del rischio. Un STB pre-dimissione ≥95° percentile è stato assegnato alla zona ad alto rischio, tra il 75° e il 94° centile alla zona a rischio intermedio superiore, tra il 40° e il 74° centile alla zona a rischio intermedio inferiore e sotto il 40° percentile alla zona a basso rischio. Tra 49 neonati nella zona ad alto rischio, 34 hanno sviluppato SHB; quindi, la LR positiva per STB nella zona ad alto rischio era 8,26 (Tabella II). Tra 190 neonati nella zona a rischio medio-alto, 73 hanno sviluppato SHB; quindi, la LR positiva per STB in questa zona a rischio era 2,30. Allo stesso modo, la LR positiva per la STB nella zona a rischio intermedio-basso era 0,76 e per la zona a basso rischio era 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Bilirubina totale nel siero prima della dimissione | Outcome | Prestazione del test | |||||
| Pre-zona di rischio cumulativo di scarico | Percentile | Totale | SHB+ | SHB- | P:Un rapporto | Probabilità di malattia | LR+ |
| Alto rischio | ≥95° | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 |
| Superiore-intermedio | 75° a 94° | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 |
| Basso-intermedio | 40° a 74° | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 |
| Basso rischio | <40° | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 |
| 928 | 199 | 729 | 1:4 | 1/5 | |||
| SHB: iperbilirubinemia significativa; rapporto P:A: Presenza di esito : Assenza di esito. | |||||||
Discussione
La valutazione del rischio prima della dimissione per il successivo sviluppo di SHB è raccomandata come una potenziale strategia per ridurre l’incidenza del danno neurologico indotto dalla bilirubina o del kernicterus. In questo studio di coorte prospettico abbiamo costruito il nomogramma della bilirubina sierica ora-specifica in un sottogruppo di neonati dell’India del nord e abbiamo valutato l’efficacia della demarcazione del rischio tramite la misurazione STB pre-dimissione nel predire la successiva necessità di fototerapia (SHB). L’incidenza di base di SHB era alta nella nostra coorte di studio con 2 neonati su 10 che sviluppavano SHB. La localizzazione del STB pre-dimissione in due zone a rischio più elevato ha aumentato significativamente il rischio di successiva SHB con 7 neonati su 10 nella zona ad alto rischio che sviluppano SHB (LR=8,26 positivo) e 4 neonati su 10 nella zona a rischio medio-alto che sviluppano SHB (LR=2,3 positivo). La localizzazione del STB pre-dimissione nella zona a basso rischio diminuiva significativamente il rischio di successivo SHB con 1 neonato su 10 che sviluppava SHB (LR positivo=0,37). Tuttavia, poiché il valore predittivo negativo del cut-off a basso rischio era solo del 90%, la localizzazione nella zona a basso rischio non era in grado di escludere la possibilità di un successivo SHB.
Bhutani, et al. hanno dimostrato in un’ampia coorte che i neonati con STB pre-dimissione nelle zone ad alto e alto rischio intermedio hanno maggiori probabilità di avere SHB durante il follow-up. Gli autori hanno costruito grafici percentili del livello di bilirubina nel siero a diverse età postnatali in neonati a breve termine e a termine. Hanno scoperto che il 6,1% dei neonati aveva una bilirubina sierica pre-dimissione >95° percentile; il 32,1% di questi neonati ha mostrato successivamente un’iperbilirubinemia. Rispetto al nomogramma ora-specifico di Bhutani, et al. , i valori percentili di STB in questo studio sono più alti fino a 2 mg/dL fino a 84-108 h di età postnatale. I neonati di origine nord indiana sono stati osservati per raggiungere valori più elevati di bilirubina e hanno una maggiore incidenza di iperbilirubinemia. La STB media di 7.0±2.0 mg/dL osservata in questo studio è tra il 75° e il 95° percentile del nomogramma di Bhutani. Allo stesso modo Agarwal, et al. hanno riportato un STB medio di 5.9±1.8 mg/dL a 24 ore di età postnatale che è vicino al valore del 75° percentile del nomogramma di Bhutani. Una proporzione più alta di neonati pretermine o di basso peso alla nascita e un tasso più alto di allattamento al seno esclusivo nel nostro studio possono essere i fattori che contribuiscono ad aumentare i valori STB e l’incidenza di SHB. Inoltre, la nostra decisione di utilizzare la linea media invece di quella superiore delle soglie di fototerapia AAP anche nei neonati a basso rischio ha aumentato l’incidenza di SHB. Oltre 108 h di età postnatale, i valori percentili di STB in questo studio sono inferiori ai valori corrispondenti nel nomogramma di Bhutani. L’inclusione dei valori STB dei neonati che sono stati seguiti selettivamente su giudizio clinico per la costruzione del nomogramma può aver portato all’uso di livelli STB più elevati per tracciare il nomogramma di Bhutani, diminuendo così la generalizzabilità di quest’ultimo. Nel presente studio, poiché il follow-up è stato completato indipendentemente dalla gravità dell’iperbilirubinemia, il nomogramma raggiunge i picchi al 4° e 5° giorno di età postnatale con un declino naturale alla fine della prima settimana.
In uno studio prospettico di coorte, Agarwal, et al. hanno misurato STB a 24±6 h di età in 220 neonati nati a ≥35 settimane di gestazione per la previsione dell’iperbilirubinemia . L’assenza di STB >6 mg/dL a 24±6 h di età escludeva virtualmente la possibilità di una successiva SHB (rapporto di probabilità del test negativo 0,07) entro 5 giorni dalla nascita. Tuttavia, la misurazione selettiva dell’esito solo in quei neonati che durante il follow-up avevano un livello di bilirubina “clinica” di >10 mg/dL ha introdotto un bias di verifica nello studio. In un altro studio indiano, un cut-off di 3,99 mg/dL a 18-24 h è stato trovato per avere sensibilità e specificità del 67% ciascuno per la previsione del successivo livello di bilirubina >15 mg/dL . Tuttavia, il follow-up completo era presente solo nei neonati che sono rimasti in ospedale o per malattia neonatale o per qualche motivo materno, come il taglio cesareo. Più del 50% dei neonati, che erano sani e quindi dimessi presto, non sono stati seguiti. Uno studio dalla Turchia ha presentato il nomogramma della bilirubina ora-specifica nei neonati con un’età gestazionale tra 35 e 37 settimane. Il valore STB superiore al 95
esimo percentile aveva un alto valore predittivo positivo per il successivo sviluppo di SHB. Tuttavia, il valore STB inferiore al 30° percentile aveva un valore predittivo negativo di circa il 90%. Due grandi studi retrospettivi hanno riportato un’eccellente capacità predittiva della misurazione precoce/pre-dimissione di STB con un’area sotto la curva (AUC) di 0,83. Nel nostro studio, la capacità discriminante dei valori del 40° e 75° percentile era inferiore a quelli precedentemente riportati. Questo ha spostato la curva ROC nel nostro studio verso la linea diagonale con conseguente diminuzione della capacità discriminante (AUC= 0,73). L’alta incidenza di base di SHB in turco (25,3%) e nel nostro studio (20%) può spiegare l’incapacità dei valori percentili bassi di escludere lo sviluppo di successivi SHB, limitando così l’utilità della misurazione STB prima della dimissione.
Una strategia alternativa di valutazione del rischio per la previsione di un successivo SHB è la valutazione dei fattori di rischio clinico. La gestazione alla nascita, la storia di ittero che necessita di trattamento nel fratello precedente, l’infusione di ossitocina, il parto strumentale, il trauma della nascita e l’alimentazione inadeguata sono stati implicati come fattori di rischio di SHB.
Tuttavia, la capacità discriminante del modello di rischio clinico è stata riportata come inferiore a quella della misurazione STB precoce. Newman et al. hanno riportato una migliore capacità di discriminazione quando uno strumento di rischio clinico è stato combinato con la misurazione STB precoce. A causa della proporzione significativa di neonati a basso peso alla nascita e pretermine nella nostra coorte, ipotizziamo che la combinazione di questi fattori di rischio clinico oggettivamente misurabili con la misurazione STB precoce genererebbe un modello di rischio con una migliore capacità discriminante.
L’applicabilità esterna delle osservazioni fatte nello studio può essere influenzata dall’incidenza relativamente alta di iperbilirubinemia nella coorte di studio a causa dell’uso di soglie di bilirubina più basse per iniziare la fototerapia. In contrasto con i paesi sviluppati, il kernicterus è stato segnalato a livelli più bassi di bilirubina di picco in India, il che indica che i neonati indiani possono sviluppare danni neurologici indotti dalla bilirubina a livelli inferiori di bilirubina sierica di picco. Inoltre, circa un terzo dei neonati nati in India sono di basso peso alla nascita. A causa di questi motivi, il National Neonatology Forum of India nelle sue linee guida suggerisce l’uso di soglie più basse per iniziare la fototerapia, soprattutto nelle aree con una maggiore incidenza di deficit di glucosio-6-fosfato deidrogenasi.
I punti di forza del nostro studio includono un disegno di studio prospettico, una grande dimensione del campione, più del 90% di follow-up e l’assenza di bias di verifica. Non abbiamo potuto accertare il verificarsi dell’esito in circa il 7% dei neonati arruolati. Tuttavia, poiché la STB precoce e le caratteristiche demografiche in questi neonati lost-to-follow-up erano simili a quelli che non hanno mai sviluppato SHB, è improbabile che il nomogramma ora-specifico e lo strumento di valutazione del rischio siano influenzati. Non abbiamo utilizzato la cromatografia liquida ad alte prestazioni (HPLC) che è il metodo “gold-standard” per la misurazione della bilirubina. Abbiamo misurato la bilirubina con un metodo più comunemente usato al letto del paziente, la spettrofotometria. Il bilimetro utilizzato nel nostro studio aveva un basso coefficiente di variazione e veniva calibrato prima di ogni utilizzo.
Raccomandiamo che, poiché i neonati con STB pre-dimissione nella zona ad alto o alto rischio intermedio hanno un’alta probabilità di sviluppare SHB precocemente e dovrebbe essere garantito un frequente follow-up. Nei contesti in cui un follow-up ravvicinato non è fattibile, si può prendere in considerazione la possibilità di ritardare la dimissione dall’ospedale fino a quando la bilirubina non scende in zone di rischio più basse. I neonati con STB pre-dimissione in zone di rischio medio-basso o basso possono essere dimessi secondo la politica locale. Tuttavia, dovrebbe essere garantito un adeguato follow-up in quanto il successivo sviluppo di SHB non può essere escluso.
In conclusione, nonostante la discreta capacità discriminatoria, il più alto livello di follow-up nel nostro studio aumenta la fiducia nella capacità del STB pre-dimissione di predire SHB nei neonati indiani. Sono necessari ulteriori studi per convalidare le prestazioni delle zone di demarcazione del rischio definite in questo nomogramma della bilirubina ora-specifica.
Contribuenti: DC: ha concettualizzato e progettato lo studio; UP e SK: hanno raccolto i dati; DC: ha analizzato i dati; UP: ha redatto l’articolo con contributi critici di DC, SK e SJ. Tutti gli autori approvano la versione finale del manoscritto per la presentazione.
Finanziamento: Nessuno; Interessi concorrenti: Nessuno dichiarato.
1. Rapporto 2002-2003: National Neonatal Perinatal Database Network. New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. Identificazione dei neonati a rischio di iperbilirubinemia pericolosa: intuizioni cliniche emergenti. Pediatr Clin North Am. 2009;56:671-87.
3. Gestione di iperbilirubinemia nel neonato 35 o più settimane di gestazione. Pediatria. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Stima non invasiva della bilirubina sierica totale mediante riflettanza spettrale a più lunghezze d’onda nei neonati. Indian Pediatr. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Iperbilirubinemia neonatale precoce utilizzando il livello di bilirubina sierica del primo giorno. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Previsione di iperbilirubinemia in neonati a termine e a breve termine. Pediatria 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Misurazione non invasiva della bilirubina sierica totale in una popolazione neonatale multirazziale per valutare il rischio di iperbilirubinemia grave. Pediatria. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Capacità predittiva di una bilirubina sierica ora-specifica per la successiva iperbilirubinemia significativa in neonati sani a termine e quasi a termine. Pediatria. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. Una revisione basata sull’evidenza di questioni importanti riguardanti l’iperbilirubinemia neonatale. Pediatria. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Revisione sistematica dello screening per l’encefalopatia da bilirubina nei neonati. Pediatria. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Nomogrammi semplici per calcolare la dimensione del campione negli studi diagnostici. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Screening della bilirubina per i neonati normali: una critica del nomogramma della bilirubina ora-specifica. Pediatria. 2009;124:1203-5.
13. Awasthi S, Rehman H. Precoce previsione di iperbilirubinemia neonatale. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidenza, corso e previsione dell’iperbilirubinemia nei neonati a breve termine e a termine. Pediatria. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identificazione dei neonati a rischio di iperbilirubinemia significativa: un confronto tra due approcci raccomandati. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Combinando i fattori di rischio clinico con i livelli di bilirubina nel siero per prevedere l’iperbilirubinemia nei neonati. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Previsione e prevenzione dell’iperbilirubinemia neonatale estrema in un’organizzazione di manutenzione sanitaria matura. Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. Un confronto tra strategie alternative di valutazione del rischio per prevedere una significativa iperbilirubinemia neonatale in neonati a termine e a breve termine. Pediatria. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Fattori di rischio per il kernicterus nei bambini a termine con ittero non emolitico. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Risposta uditiva evocata del tronco encefalico nei neonati con iperbilirubinemia. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidence Based Clinical Practice Guidelines. National Neonatology Forum of India, New Delhi, India, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Rapporto preliminare sullo screening neonatale per ipotiroidismo congenito, iperplasia surrenale congenita e deficit di glucosio-6-fosfato deidrogenasi: un’esperienza Chandigarh. Indian J Pediatr. 2010;77:969-73.
