Oppimistavoitteet
- selittää tyypillisen faasidiagrammin rakentamisen ja käytön
- käyttää faasidiagrammeja stabiilien faasien tunnistamiseen tietyissä lämpötiloissa ja paineissa, ja kuvaamaan näiden ominaisuuksien muutoksista johtuvia faasisiirtymiä
- Kuvaamaan aineen ylikriittistä nestefaasia
Edellisessä moduulissa kuvattiin nesteen tasapainohöyrynpaineen vaihtelua lämpötilan mukaan. Kun otetaan huomioon kiehumispisteen määritelmä, höyrynpaineen ja lämpötilan kuvaajat esittävät, miten nesteen kiehumispiste vaihtelee paineen mukaan. Lisäksi kuvattiin lämmitys- ja jäähdytyskäyrien käyttöä aineen sulamis- (tai jäätymispisteen) määrittämiseksi. Tekemällä tällaisia mittauksia laajalla painealueella saadaan tietoja, jotka voidaan esittää graafisesti faasidiagrammina. Faasidiagrammissa yhdistyvät paineen ja lämpötilan kuvaajat aineen neste-kaasu-, kiinteä-neste- ja kiinteä-kaasu-faasimuutostasapainosta. Näistä diagrammeista nähdään fysikaaliset tilat, jotka vallitsevat tietyissä paine- ja lämpötilaolosuhteissa, ja niistä nähdään myös faasien siirtymislämpötilojen (sulamispisteet, sublimoitumispisteet, kiehumispisteet) riippuvuus paineesta. Tyypillinen puhtaan aineen faasidiagrammi on esitetty kuvassa 1.
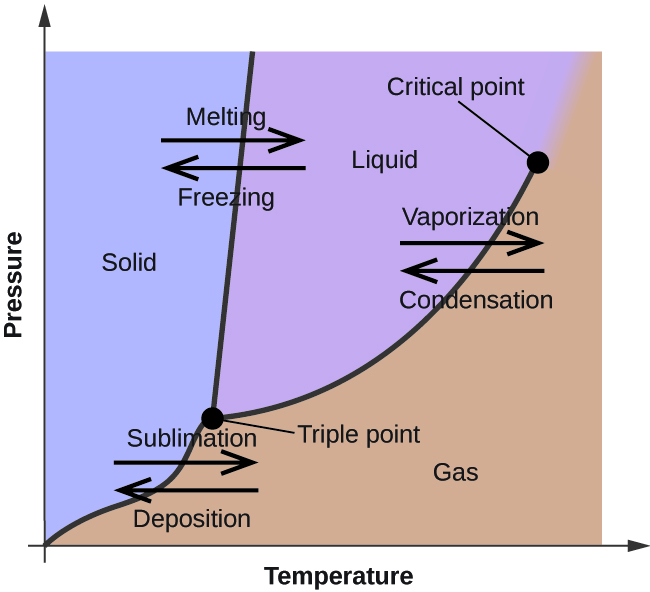
Kuvassa 2 on esitetty veden faasidiagrammi, joka havainnollistaa näiden diagrammien käyttökelpoisuutta.
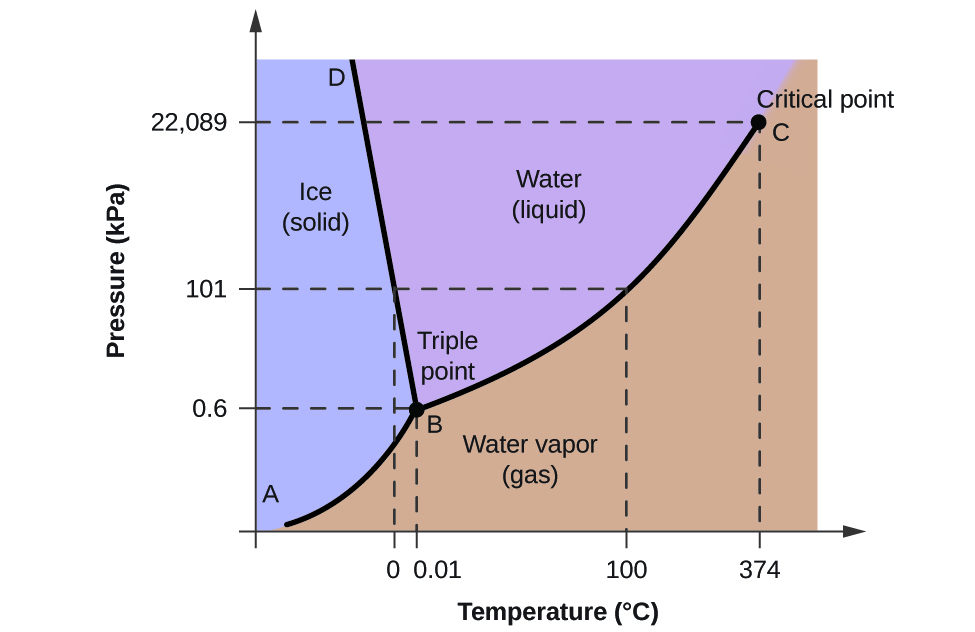
Voidaan käyttää faasidiagrammia veden näytteen fysikaalisen tilan tunnistamiseen tietyissä paine- ja lämpötilaolosuhteissa. Esimerkiksi 50 kPa:n paine ja -10 °C:n lämpötila vastaavat diagrammin aluetta, jossa on merkintä ”jää”. Näissä olosuhteissa vesi on olemassa vain kiinteänä aineena (jää). Paine 50 kPa ja lämpötila 50 °C vastaavat aluetta ”vesi”, jossa vesi on olemassa vain nesteenä. Kun paine on 25 kPa ja lämpötila 200 °C, vesi on olemassa vain kaasumaisessa tilassa. Huomaa, että H2O:n faasidiagrammissa paine- ja lämpötila-akseleita ei ole piirretty vakioasteikolla, jotta voidaan havainnollistaa useita tärkeitä piirteitä tässä kuvatulla tavalla.
Kuvassa 2 oleva käyrä BC on höyrynpaineen ja lämpötilan välinen kuvaaja, joka on kuvattu tämän luvun edellisessä moduulissa. Tämä ”neste-höyry”-käyrä erottaa faasidiagrammin nestemäiset ja kaasumaiset alueet toisistaan ja antaa veden kiehumispisteen missä tahansa paineessa. Esimerkiksi 1 atm:n lämpötilassa kiehumispiste on 100 °C. Huomaa, että neste-höyry-käyrä päättyy 374 °C:n lämpötilassa ja 218 atm:n paineessa, mikä osoittaa, että vesi ei voi olla nestemäisenä tämän lämpötilan yläpuolella paineesta riippumatta. Veden fysikaaliset ominaisuudet ovat näissä olosuhteissa neste- ja kaasufaasin väliltä. Tätä ainutlaatuista olotilaa kutsutaan ylikriittiseksi nesteeksi, jota käsitellään tämän moduulin seuraavassa osassa.
Kuvassa 2 AB:llä merkitty kiinteä-höyry-käyrä osoittaa lämpötilat ja paineet, joissa jää ja vesihöyry ovat tasapainossa. Nämä lämpötila-paine-tietoparit vastaavat veden sublimoitumis- eli laskeutumispisteitä. Jos voisimme zoomata kuvan 2 kiinteä-kaasu -viivaa, näkisimme, että jään höyrynpaine on noin 0,20 kPa -10 °C:ssa. Jos siis asetamme jäädytetyn näytteen tyhjiöön, jonka paine on alle 0,20 kPa, jää sublimoituu. Tähän perustuu ”pakastekuivaus”, jota käytetään usein elintarvikkeiden, kuten kuvassa 3 esitetyn jäätelön, säilömiseen.

BD:llä merkitty kiinteä-neste-käyrä osoittaa lämpötilat ja paineet, joissa jää ja nestemäinen vesi ovat tasapainossa ja jotka edustavat veden sulamis- ja jäätymispisteitä. Huomaa, että tällä käyrällä on lievästi negatiivinen kaltevuus (selvyyden vuoksi liioiteltu), mikä osoittaa, että veden sulamispiste laskee hieman paineen kasvaessa. Vesi on tässä suhteessa epätavallinen aine, sillä useimpien aineiden sulamispiste kasvaa paineen kasvaessa. Tämä käyttäytyminen on osittain vastuussa jäätiköiden, kuten kuvassa 4 esitetyn jäätikön, liikkeistä. Jäätikön pohjaan kohdistuu sen painosta johtuva valtava paine, joka voi sulattaa osan jäästä muodostaen nestemäisen vesikerroksen, jonka päällä jäätikkö voi liukua helpommin.

Kuvan 2 kuvassa kaikkien kolmen käyrän leikkauspiste on merkitty B:llä. Tämän pisteen edustamassa paineessa ja lämpötilassa kaikki kolme veden faasia ovat rinnakkain tasapainossa. Tätä lämpötila-paine-tietoparia kutsutaan kolmoispisteeksi. Kolmiopistettä alhaisemmissa paineissa vesi ei voi olla nesteenä lämpötilasta riippumatta.
Esimerkki 1
Veden olomuodon määrittäminen
Määritä veden olomuoto seuraavissa lämpötiloissa ja paineissa käyttämällä kuvan 2 mukaista veden faasidiagrammia:
(a) -10 °C ja 50 kPa
(b) 25 °C ja 90 kPa
(c) 50 °C ja 40 kPa
(d) 80 °C ja 5 kPa
(e) -10 °C ja 0.3 kPa
(f) 50 °C ja 0,3 kPa
Liuos
Veden faasidiagrammin avulla voimme määrittää, että veden olomuoto kussakin annetussa lämpötilassa ja paineessa on seuraava: (a) kiinteä; (b) neste; (c) neste; (d) kaasu; (e) kiinteä; (f) kaasu.
Tarkista oppimasi
Mitä faasimuutoksia vesi voi kokea lämpötilan muuttuessa, jos paine pidetään 0,3 kPa:ssa? Jos paine pidetään 50 kPa:ssa?
Vastaus:
Jos paine on 0,3 kPa: \text{s}\;\longrightarrow}\;\text{g} -58 °C:ssa. 50 kPa:ssa: Kiinteä-neste-käyrällä on positiivinen kaltevuus, mikä osoittaa, että hiilidioksidin sulamispiste nousee paineen kasvaessa, kuten useimmilla aineilla (vesi on huomattava poikkeus, kuten aiemmin on kuvattu). Huomaa, että kolmoispiste on selvästi yli 1 atm, mikä osoittaa, että hiilidioksidi ei voi olla nestemäistä ympäristön paineessa. Sen sijaan kaasumaisen hiilidioksidin jäähdyttäminen 1 atm:n paineessa johtaa sen siirtymiseen kiinteään tilaan. Samoin kiinteä hiilidioksidi ei sula 1 atm:n paineessa, vaan se sublimoituu kaasumaiseksi hiilidioksidiksi. Huomaa lopuksi, että hiilidioksidin kriittinen piste havaitaan suhteellisen vaatimattomassa lämpötilassa ja paineessa verrattuna veteen.
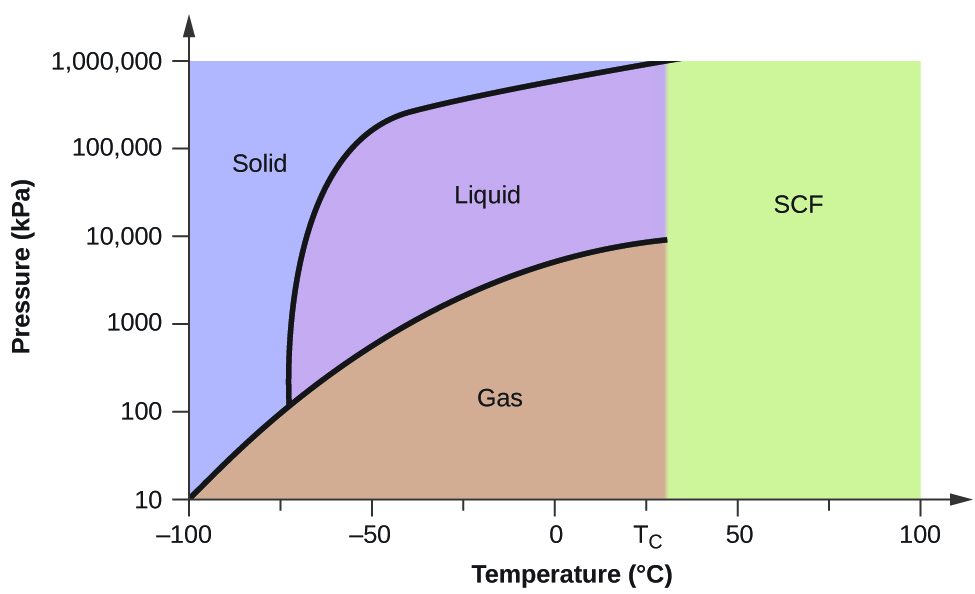
Esimerkki 2
Hiilidioksidin olomuodon määrittäminen
Määritä hiilidioksidin olomuoto seuraavissa lämpötiloissa ja paineissa käyttämällä kuvassa 5 esitettyä hiilidioksidin faasidiagrammia:
(a) -30 °C ja 2000 kPa
(b) -60 °C ja 1000 kPa
(c) -60 °C ja 100 kPa
(d) 20 °C ja 1500 kPa
(e) 0 °C ja 100 kPa
(f) 20 °C ja 100 kPa
Liuos
Käytetään annettua hiilidioksidin faasidiagrammia, voimme määrittää, että CO2:n olomuodot kussakin annetussa lämpötilassa ja paineessa ovat seuraavat: (a) neste; (b) kiinteä; (c) kaasu; (d) neste; (e) kaasu; (f) kaasu.
Tarkista oppimasi
Määritä faasimuutokset, jotka hiilidioksidi käy läpi, kun sen lämpötilaa muutetaan, jolloin sen paine pysyy vakiona 1500 kPa:ssa? 500 kPa:ssa? Missä likimääräisissä lämpötiloissa nämä faasimuutokset tapahtuvat?
Vastaus:
1500 kPa:ssa: \text{s}\;{\longrightarrow}\;\text{l} -45 °C:ssa, \text{l}\;{\longrightarrow}\;\text{g} -10 °C:ssa;
500 kPa:ssa: Tiheämmän nesteen ja vähemmän tiheän kaasun välillä on selvästi havaittavissa selvä raja. Kun lämpötilaa nostetaan, vesihöyryn paine kasvaa, kuten veden faasidiagrammin neste-kaasukäyrä kuvaa (kuva 2), ja jäljelle jää neste- ja kaasufaasien kaksivaiheinen tasapaino. Lämpötilassa 374 °C höyrynpaine on noussut 218 atm:iin, ja lämpötilan nostaminen edelleen johtaa neste- ja höyryfaasien välisen rajan häviämiseen. Kaikki säiliössä oleva vesi on nyt yhdessä faasissa, jonka fysikaaliset ominaisuudet ovat kaasumaisen ja nestemäisen tilan välissä. Tätä ainevaihetta kutsutaan ylikriittiseksi nesteeksi, ja lämpötila ja paine, joiden yläpuolella tämä vaihe esiintyy, on kriittinen piste (kuva 6). Kriittisen lämpötilan yläpuolella kaasua ei voi nesteyttää, vaikka siihen kohdistettaisiin kuinka suuri paine. Painetta, joka tarvitaan kaasun nesteyttämiseen sen kriittisessä lämpötilassa, kutsutaan kriittiseksi paineeksi. Joidenkin yleisten aineiden kriittiset lämpötilat ja kriittiset paineet on esitetty taulukossa 6.
| Aine | Kriittinen lämpötila (K) | Kriittinen paine (atm) |
|---|---|---|
| vety | 33.2 | 12.8 |
| typpi | 126.0 | 33.5 |
| happi | 154.3 | 49.7 |
| hiilidioksidi | 304.2 | 73.0 |
| ammoniakki | 405.5 | 111.5 |
| rikkidioksidi | 430.3 | 77.7 |
| vesi | 647.1 | 217.7 |
| Taulukko 6. | ||


Katsokaa hiilidioksidin siirtymistä nestemäisestä ylikriittiseksi nesteeksi.
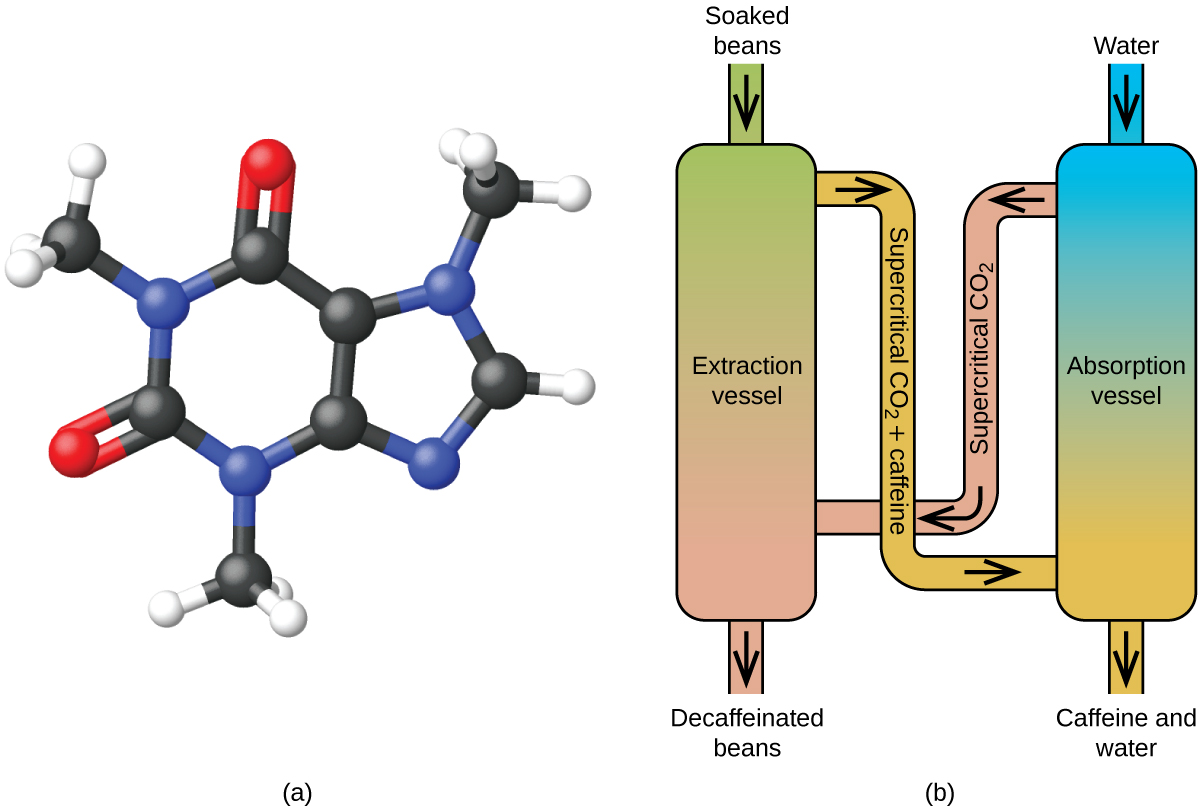
Ylikriittinen neste laajenee kaasun tavoin ja täyttää astian, mutta sen tiheys on paljon tyypillistä kaasun tiheyttä suurempi, tyypillisesti lähellä nesteiden tiheyttä. Nesteiden tavoin nämä nesteet kykenevät liuottamaan haihtumattomia liuottimia. Niillä ei kuitenkaan ole käytännössä lainkaan pintajännitystä ja niiden viskositeetti on hyvin alhainen, joten ne voivat tunkeutua tehokkaammin hyvin pieniin aukkoihin kiinteässä seoksessa ja poistaa liukoisia komponentteja. Nämä ominaisuudet tekevät ylikriittisistä nesteistä erittäin käyttökelpoisia liuottimia monenlaisiin sovelluksiin. Esimerkiksi ylikriittisestä hiilidioksidista on tullut erittäin suosittu liuotin elintarviketeollisuudessa, ja sitä käytetään kahvin kofeiinittomuuteen, rasvojen poistamiseen perunalastuista ja aromi- ja hajusteyhdisteiden uuttamiseen sitrusöljyistä. Se on myrkytön, suhteellisen edullinen, eikä sitä pidetä saastuttavana aineena. Käytön jälkeen hiilidioksidi voidaan helposti ottaa talteen vähentämällä painetta ja keräämällä syntyvä kaasu.
Esimerkki 3
Hiilidioksidin kriittinen lämpötila
Jos ravistelemme hiilidioksidisammutinta viileänä päivänä (18 °C), kuulemme nestemäisen hiilidioksidin liplattavan kaasupullon sisällä. Kuumana kesäpäivänä (35 °C) samassa kaasupullossa ei kuitenkaan näytä olevan nestettä. Selitä nämä havainnot.
Ratkaisu
Viileänä päivänä hiilidioksidin lämpötila on alle hiilidioksidin kriittisen lämpötilan, 304 K eli 31 °C (taulukko 6), joten pullossa on nestemäistä hiilidioksidia. Kuumana päivänä CO2:n lämpötila on suurempi kuin sen kriittinen lämpötila 31 °C. Tämän lämpötilan yläpuolella mikään määrä painetta ei voi nesteyttää CO2:ta, joten sammuttimessa ei ole nestemäistä CO2:ta.
Tarkista oppimasi
Ammonia voidaan nesteyttää puristamalla huoneenlämmössä; happea ei voi nesteyttää näissä olosuhteissa. Miksi nämä kaksi kaasua käyttäytyvät eri tavalla?
Vastaus:
Ammoniakin kriittinen lämpötila on 405,5 K, joka on korkeampi kuin huoneenlämpötila. Hapen kriittinen lämpötila on huoneenlämpötilan alapuolella, joten happea ei voi nesteyttää huoneenlämmössä.
Kahvin kofeiinittomaksi tekeminen ylikriittisen hiilidioksidin avulla
Kahvi on maailman toiseksi eniten vaihdettu hyödyke öljyn jälkeen. Ympäri maailmaa ihmiset rakastavat kahvin aromia ja makua. Monet meistä ovat myös riippuvaisia yhdestä kahvin ainesosasta, kahvista, joka auttaa meitä pääsemään vauhtiin aamulla tai pysymään hereillä iltapäivällä. Myöhään päivällä kahvin piristävä vaikutus voi kuitenkin estää sinua nukkumasta, joten voit halutessasi juoda kofeiinitonta kahvia illalla.
Kahvin kofeiinittomaksi tekemiseen on käytetty monia menetelmiä 1900-luvun alusta lähtien. Kaikilla on etuja ja haittoja, ja kaikki riippuvat kofeiinin fysikaalisista ja kemiallisista ominaisuuksista. Koska kofeiini on jokseenkin poolinen molekyyli, se liukenee hyvin veteen, joka on poolinen neste. Koska monet muista yli 400 yhdisteestä, jotka vaikuttavat kahvin makuun ja aromiin, liukenevat myös H2O:han, kuumassa vedessä tapahtuva kofeiinipoisto voi kuitenkin poistaa joitakin näistä yhdisteistä, mikä vaikuttaa haitallisesti kofeiinittoman kahvin tuoksuun ja makuun. Dikloorimetaanilla (CH2Cl2) ja etyyliasetaatilla (CH3CO2C2H5) on samankaltainen polaarisuus kuin kofeiinilla, joten ne ovat erittäin tehokkaita liuottimia kofeiinin uuttamiseen, mutta molemmat poistavat myös joitakin maku- ja aromikomponentteja, ja niiden käyttö vaatii pitkiä uutto- ja puhdistusaikoja. Koska molemmat liuottimet ovat myrkyllisiä, kofeiinittomaan kahviin jäävien liuotinjäämien terveysvaikutuksista on esitetty huolenaiheita.
Ylikriittinen nesteuutto hiilidioksidia käyttäen on nykyään laajalti käytössä tehokkaampana ja ympäristöystävällisempänä kofeiininpoistomenetelmänä (kuva 7). Yli 304,2 K:n lämpötilassa ja yli 7376 kPa:n paineessa hiilidioksidi on ylikriittinen neste, jolla on sekä kaasun että nesteen ominaisuuksia. Kaasun tavoin se tunkeutuu syvälle kahvipapuihin, ja nesteen tavoin se liuottaa tehokkaasti tiettyjä aineita. Höyrytettyjen kahvipapujen ylikriittinen hiilidioksidiuutto poistaa 97-99 prosenttia kofeiinista ja jättää kahvin maku- ja aromiyhdisteet koskemattomiksi. Koska hiilidioksidi on standardiolosuhteissa kaasu, sen poistaminen uutetuista kahvipavuista on helppoa, samoin kuin kofeiinin talteenotto uutteesta. Tällä prosessilla kahvipavuista talteenotettu kofeiini on arvokas tuote, jota voidaan myöhemmin käyttää muiden elintarvikkeiden tai lääkkeiden lisäaineena.
Keskeiset käsitteet ja yhteenveto
Lämpötila- ja paineolosuhteet, joissa aine esiintyy kiinteässä, nestemäisessä ja kaasumaisessa olomuodossa, esitetään tiivistetysti kyseisen aineen faasidiagrammissa. Faasidiagrammit ovat kolmen paine-lämpötilatasapainokäyrän yhdistettyjä kuvaajia: kiinteä-neste, neste-kaasu ja kiinteä-kaasu. Nämä käyrät kuvaavat faasimuutoslämpötilojen ja paineiden välisiä suhteita. Kaikkien kolmen käyrän leikkauspiste edustaa aineen kolmoispistettä – lämpötilaa ja painetta, jossa kaikki kolme faasia ovat tasapainossa. Kolmiopistettä alhaisemmissa paineissa aine ei voi olla nestemäisessä tilassa lämpötilasta riippumatta. Neste-kaasukäyrän päätepiste edustaa aineen kriittistä pistettä eli painetta ja lämpötilaa, jonka yläpuolella nestefaasia ei voi esiintyä.
Kemia Luvun lopun harjoitukset
- Määritä veden faasidiagrammista (kuva 2) veden olomuoto:
(a) 35 °C:n ja 85 kPa:n lämpötilassa
(b) -15 °C:n ja 40 kPa:n lämpötilassa
(c) -15 °C:n lämpötilassa ja 0.1 kPa
(d) 75 °C ja 3 kPa
(e) 40 °C ja 0,1 kPa
(f) 60 °C ja 50 kPa
- Mitä faasimuutoksia tapahtuu, kun vettä altistetaan vaihtelevalle paineelle vakiolämpötilan ollessa 0,005 °C? 40 °C:ssa? -40 °C:ssa?
- Painekattiloissa ruoka kypsyy nopeammin, koska korkeampi paine painekattilassa nostaa veden kiehumislämpötilaa. Tietyssä painekattilassa on varoventtiili, joka on asetettu poistamaan höyryä, jos paine ylittää 3,4 atm. Mikä on likimääräinen enimmäislämpötila, joka voidaan saavuttaa tässä painekattilassa? Selitä perustelut.
- Kuvassa 5 olevan hiilidioksidin faasidiagrammin perusteella määritä hiilidioksidin olomuoto:
(a) 20 °C ja 1000 kPa
(b) 10 °C ja 2000 kPa
(c) 10 °C ja 100 kPa
(d) -40 °C ja 500 kPa
(e) -80 °C ja 1500 kPa
.
(f) -80 °C ja 10 kPa
- Määritä faasimuutokset, jotka hiilidioksidi käy läpi paineen muuttuessa, jos lämpötila pidetään -50 °C:ssa? Jos lämpötila pidetään -40 °C:ssa? 20 °C:n lämpötilassa? (Katso faasidiagrammi kuvasta 5.)
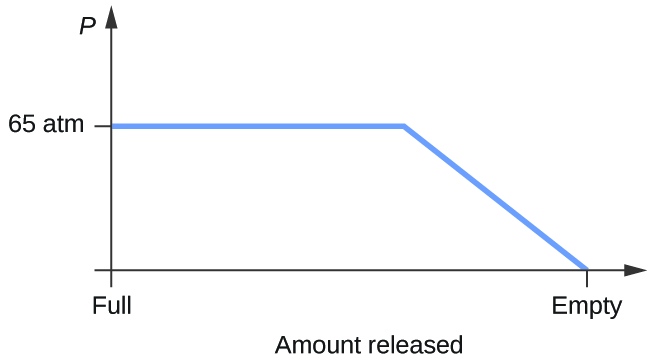
- Harkitse sylinteriä, joka sisältää nestemäisen hiilidioksidin seoksen, joka on tasapainossa kaasumaisen hiilidioksidin kanssa alkupaineessa 65 atm ja lämpötilassa 20 °C. Piirrä kaavio, joka kuvaa sylinterin paineen muutosta ajan funktiona, kun kaasumaista hiilidioksidia vapautuu vakiolämpötilassa.
- Kuiva jää, CO2(s), ei sula ilmakehän paineessa. Se sublimoituu -78 °C:n lämpötilassa. Missä alimmassa paineessa CO2(s) sulaa, jolloin syntyy CO2(l)? Missä lämpötilassa tämä tapahtuu suunnilleen? (Katso faasidiagrammi kuvasta 5.)
- Jos ankaran myrskyn seurauksena sähköt katkeavat, voi olla tarpeen käyttää pyykkinarua pyykin kuivaamiseen. Monissa osissa maata keskellä talvea vaatteet jäätyvät nopeasti, kun ne ripustetaan narulle. Jos lunta ei tule, kuivuvatko ne kuitenkin? Selitä vastauksesi.
- Voidaanko typpeä nesteyttää huoneenlämmössä (noin 25 °C)? Onko mahdollista nesteyttää rikkidioksidia huoneenlämmössä? Selitä vastauksesi.
- Elementtihiilellä on yksi kaasufaasi, yksi nestefaasi ja kaksi erilaista kiinteää faasia, kuten faasidiagrammi osoittaa:
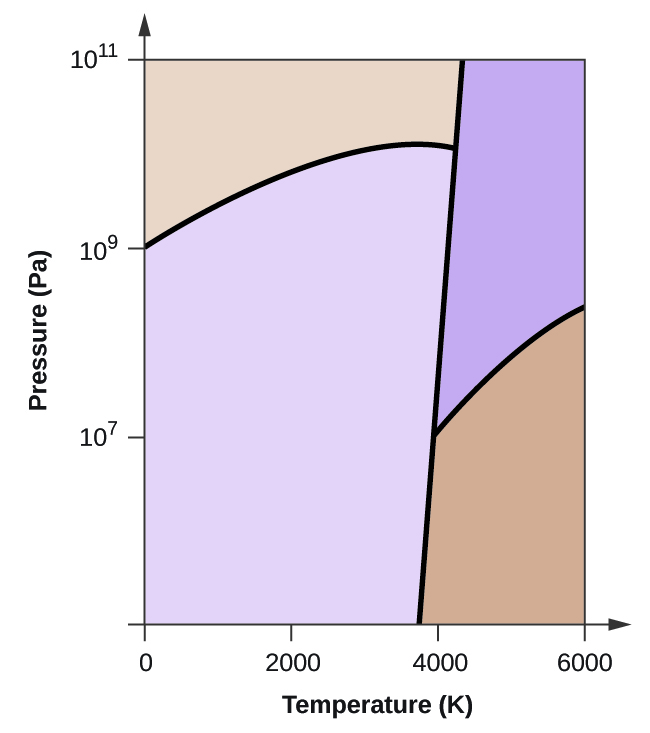
(a) Merkitse faasidiagrammiin kaasu- ja nestealueet.
(b) Grafiitti on hiilen stabiilein faasi normaaliolosuhteissa. Merkitse faasidiagrammiin grafiittivaihe.
(c) Jos grafiitti normaaliolosuhteissa kuumennetaan 2500 K:een samalla kun paine nostetaan 1010 Pa:han, se muuttuu timantiksi. Merkitse timanttivaihe.
(d) Ympyröi jokainen kolmoispiste faasidiagrammissa.
(e) Missä faasissa hiili on 5000 K:n lämpötilassa ja 108 Pa:n paineen ollessa 108 Pa:n paineen alaisena?
(f) Jos hiilinäytteen lämpötila nousee 3000 K:n lämpötilasta 5000 K:n lämpötilaan vakiopaineessa 106 Pa:n paineen pysyvyydellä, mikä faasimuutos tapahtuu, jos sellainen tapahtuu?
Sanasto
kriittinen piste lämpötila ja paine, jonka yläpuolella kaasu ei voi tiivistyä nesteeksi faasidiagrammi paine-lämpötilakuvaaja, jossa esitetään yhteenveto olosuhteista, joissa aineen faasit voivat olla olemassa ylikriittinen neste aine, jonka lämpötila ja paine ovat korkeammat kuin sen kriittinen piste; jolla on kaasumaisen ja nestemäisen tilan ominaisuuksien välimaastossa olevia ominaisuuksia Kolmiopiste lämpötila ja paine, jossa aineen höyry-, neste- ja kiinteäfaasit ovat tasapainossa
Ratkaisut
Answers to Chemistry End of Chapter Exercises
2. Pienessä paineessa ja 0,005 °C:ssa vesi on kaasua. Kun paine nousee 4,6 torr:iin, vedestä tulee kiinteää; kun paine nousee vielä enemmän, siitä tulee nestettä. 40 °C:n lämpötilassa vesi on matalassa paineessa höyryä; yli 75 torrin paineessa se muuttuu nesteeksi. -40 °C:ssa vesi muuttuu kaasusta kiinteäksi, kun paine nousee hyvin alhaisia arvoja suuremmaksi.
4. a) neste; b) kiinteä; c) kaasu; d) kaasu; e) kaasu; f) kaasu
8. Kyllä, jää muuttuu sublimoituvaksi, vaikkakin siihen voi kulua useita päiviä. Jäällä on pieni höyrynpaine, ja osa jäämolekyyleistä muodostaa kaasua ja poistuu jääkiteistä. Ajan kuluessa yhä enemmän kiinteää ainetta muuttuu kaasuksi, kunnes lopulta vaatteet ovat kuivia.
10. (a)
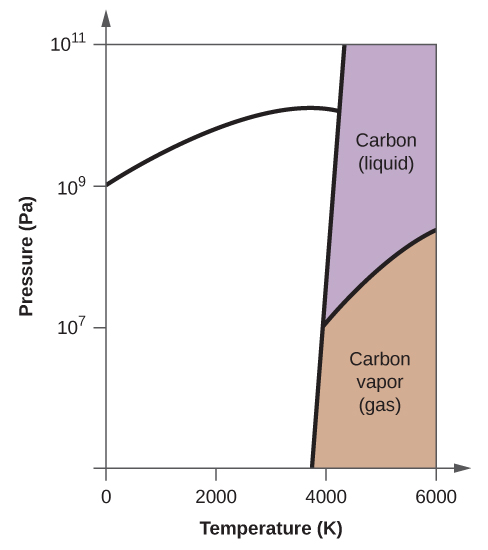
(b)
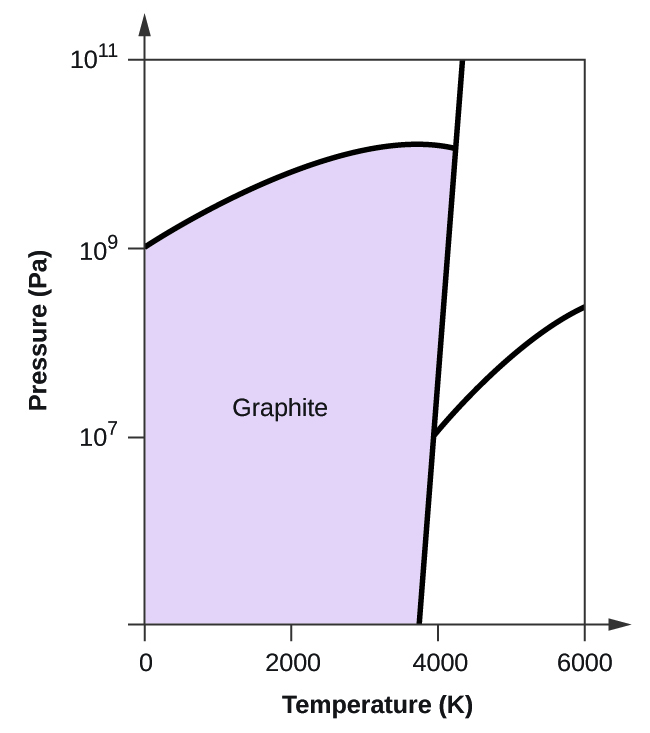
(c)
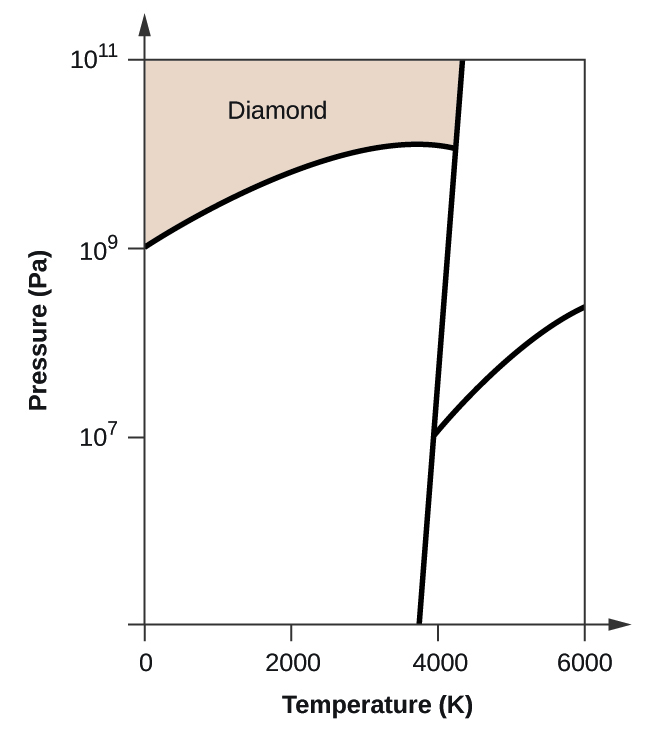
(d)
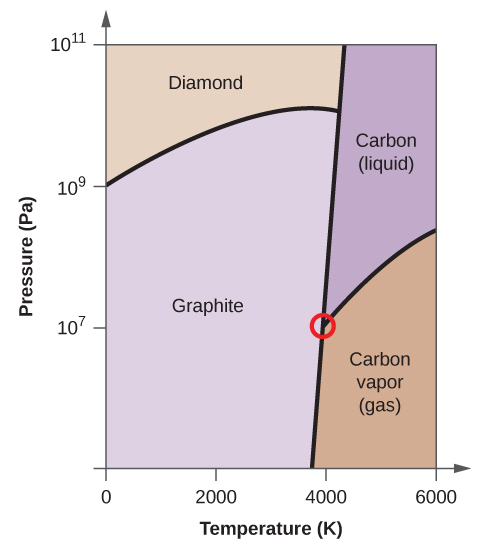
(e) nestemäinen faasi (f) sublimoituminen
