Los hidrocarburos aromáticos se definen por tener estructuras de anillos de 6 miembros con dobles enlaces alternos (Fig 8.2).
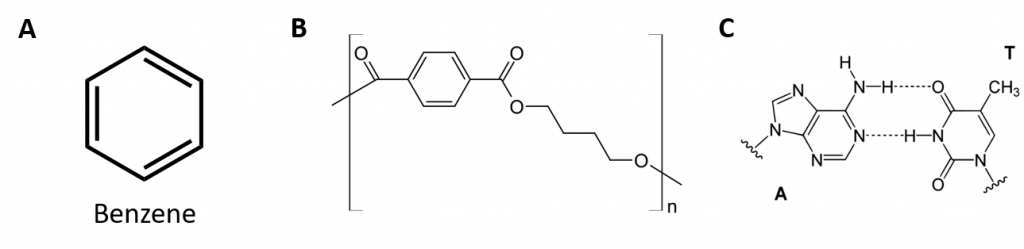
Figura 8.2: Hidrocarburos aromáticos. Los hidrocarburos aromáticos contienen la estructura de anillo de benceno de 6 miembros (A) que se caracteriza por la alternancia de dobles enlaces. Ultradur, PBT es un polímero plástico que contiene un grupo funcional aromático. El monómero repetitivo de Ultradur se muestra en (B). El Ultradur puede encontrarse en cabezales de ducha, cerdas de cepillos de dientes, carcasas de plástico para cables de fibra óptica y en componentes exteriores e interiores de automóviles. Las moléculas biológicamente importantes, como el ácido desoxirribonucleico, ADN (C), también contienen una estructura de anillos aromáticos.
Por lo tanto, tienen fórmulas que pueden dibujarse como alquenos cíclicos, lo que las hace insaturadas. Sin embargo, debido a la estructura cíclica, las propiedades de los anillos aromáticos son generalmente muy diferentes, y no se comportan como los alquenos típicos. Los compuestos aromáticos son la base de muchos fármacos, antisépticos, explosivos, disolventes y plásticos (por ejemplo, poliésteres y poliestireno).
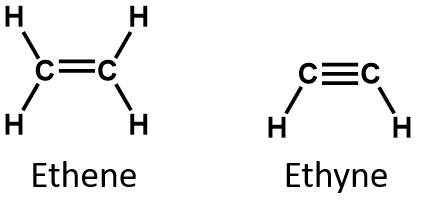
Los dos compuestos insaturados más simples -el etileno (ethene) y el acetileno (ethyne)- se utilizaron en su día como anestésicos y se introdujeron en el campo de la medicina en 1924. Sin embargo, se descubrió que el acetileno forma mezclas explosivas con el aire, por lo que su uso médico se abandonó en 1925. Se pensó que el etileno era más seguro, pero también estuvo implicado en numerosos incendios y explosiones mortales durante la anestesia. Aun así, siguió siendo un anestésico importante hasta la década de 1960, cuando fue sustituido por anestésicos no inflamables como el halotano (CHBrClCF3).
- (Volver al principio)
- 8.1 Visión general de alquenos y alquinos
- (Volver al principio)
- 8.2 Propiedades de los alquenos
- Mirando más de cerca: Nota ambiental
- Ejercicios de repaso de conceptos
- Respuestas
- Las propiedades físicas de los alquenos son muy parecidas a las de los alcanos: sus puntos de ebullición aumentan con el incremento de la masa molar y son insolubles en agua.
- Ejercicios
- Respuesta
- Ejercicios de repaso de conceptos
- Respuestas
- Las claves
- 8.3 Alquinos
- Nota
- Ejercicios de repaso de conceptos
- Las claves
- Ejercicios
- (Volver al principio)
- 8.4 Compuestos aromáticos: Benceno
- Nota
- A su salud: El benceno y nosotros
- Ejercicios de repaso de conceptos
- Reconociendo los compuestos aromáticos
- Ejercicio de habilidad
- Lo más importante
- (Volver al principio)
- Hidrocarburos aromáticos policíclicos
- Para su salud: Hidrocarburos Aromáticos Policíclicos y Cáncer
- Compuestos biológicamente importantes con anillos de benceno
- Nota
- 8.5 Isómeros geométricos
- Haga clic aquí para ver un video tutorial de Kahn Academy sobre la estructura del alqueno.
- Nomenclatura cis-trans
- Haga clic aquí para ver un video tutorial de Kahn Academy sobre la isomerización Cis/Trans
- A su salud
- Haga clic aquí para ver un video tutorial de Kahn Academy sobre las grasas saturadas, insaturadas y trans
- Factores clave para determinar la isomerización Cis/Trans
- Ejemplo trabajado
- Ejercicio de habilidad
- Ejercicios de repaso de conceptos
- Respuestas
- Las claves
- (Volver al principio)
- Nomenclatura E-Z
- Haga clic aquí para ver un video tutorial de Kahn Academy sobre la isomerización E/Z.
- (Volver al principio)
(Volver al principio)
8.1 Visión general de alquenos y alquinos
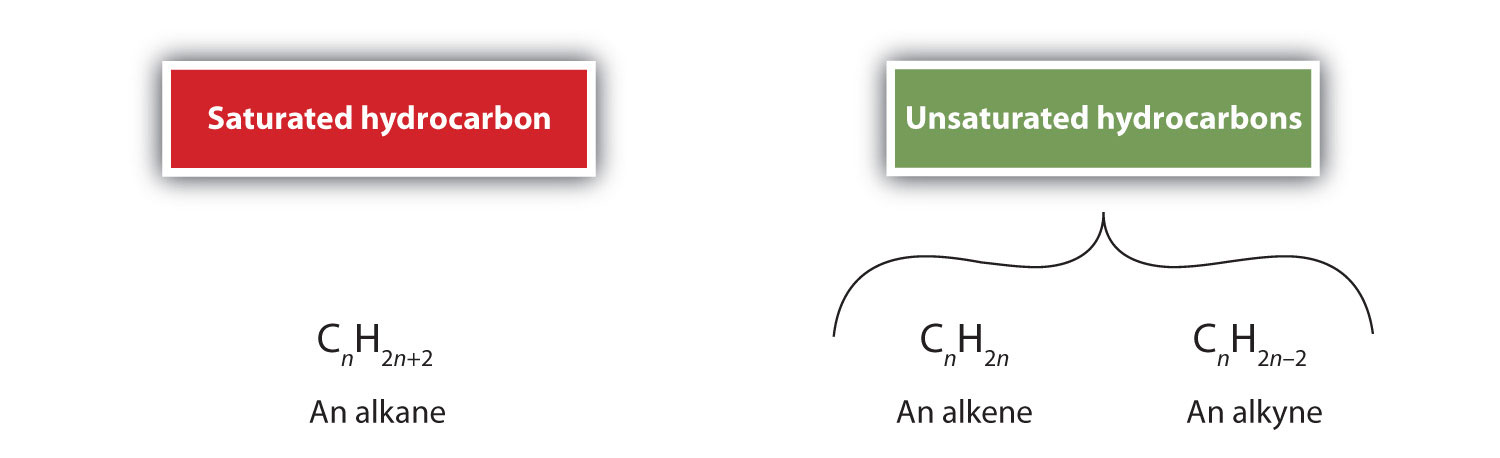
Por definición, los alquenos son hidrocarburos con uno o más dobles enlaces carbono-carbono (R2C=CR2), mientras que los alquinos son hidrocarburos con uno o más triples enlaces carbono-carbono (R-C≡C-R). En conjunto, se denominan hidrocarburos insaturados, que se definen como hidrocarburos que tienen uno o más enlaces múltiples (dobles o triples) entre los átomos de carbono. Como resultado de la naturaleza del doble o triple enlace, los alquenos y alquinos tienen menos átomos de hidrógeno que los alcanos comparables con el mismo número de átomos de carbono. Matemáticamente, esto puede indicarse mediante las siguientes fórmulas generales:
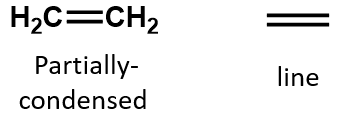
En un alqueno, el doble enlace es compartido por los dos átomos de carbono y no implica a los átomos de hidrógeno, aunque la fórmula condensada no hace evidente este punto, es decir, la fórmula condensada del eteno es CH2CH2. La naturaleza del doble o triple enlace de una molécula es aún más difícil de discernir a partir de las fórmulas moleculares. Tenga en cuenta que la fórmula molecular del eteno es C2H4, mientras que la del eteno es C2H2. Por lo tanto, hasta que se familiarice con el lenguaje de la química orgánica, a menudo es más útil dibujar estructuras lineales o parcialmente condensadas, como se muestra a continuación:
(Volver al principio)
8.2 Propiedades de los alquenos
Las propiedades físicas de los alquenos son similares a las de los alcanos. La tabla 8.1 muestra que los puntos de ebullición de los alquenos de cadena recta aumentan con el incremento de la masa molar, al igual que ocurre con los alcanos. Para moléculas con el mismo número de átomos de carbono y la misma forma general, los puntos de ebullición suelen diferir sólo ligeramente, tal como cabría esperar para sustancias cuya masa molar difiere sólo en 2 u (equivalente a dos átomos de hidrógeno). Al igual que otros hidrocarburos, los alquenos son insolubles en agua pero solubles en disolventes orgánicos.
En la Tabla 8.1 se dan algunos alquenos representativos-sus nombres, estructuras y propiedades físicas.
Tabla 8.1 Propiedades físicas de algunos alquenos seleccionados
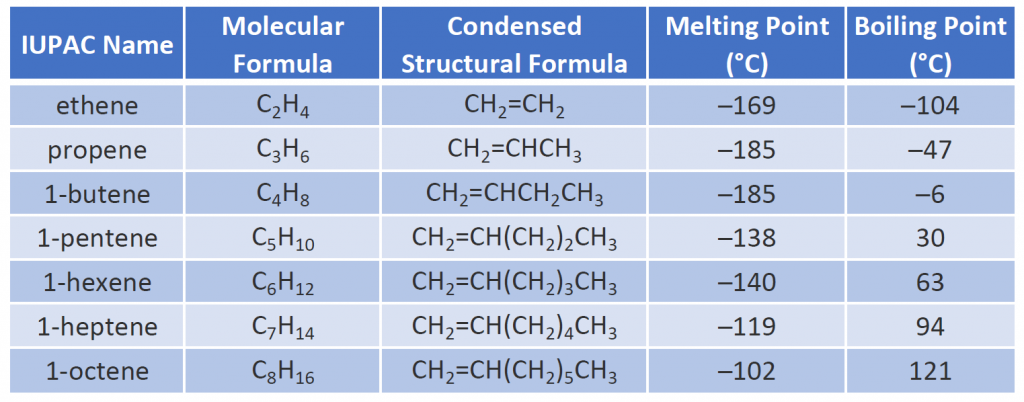
Los dos primeros alquenos de la tabla 8.1, el eteno y el propeno, se denominan con mayor frecuencia por sus nombres comunes: etileno y propileno, respectivamente. El etileno es un producto químico comercial importante. La industria química estadounidense produce unos 25.000 millones de kilogramos de etileno al año, más que cualquier otra sustancia química orgánica sintética. Más de la mitad de este etileno se destina a la fabricación de polietileno, uno de los plásticos más conocidos. El propileno es también un importante producto químico industrial. Se convierte en plásticos, alcohol isopropílico y una variedad de otros productos.
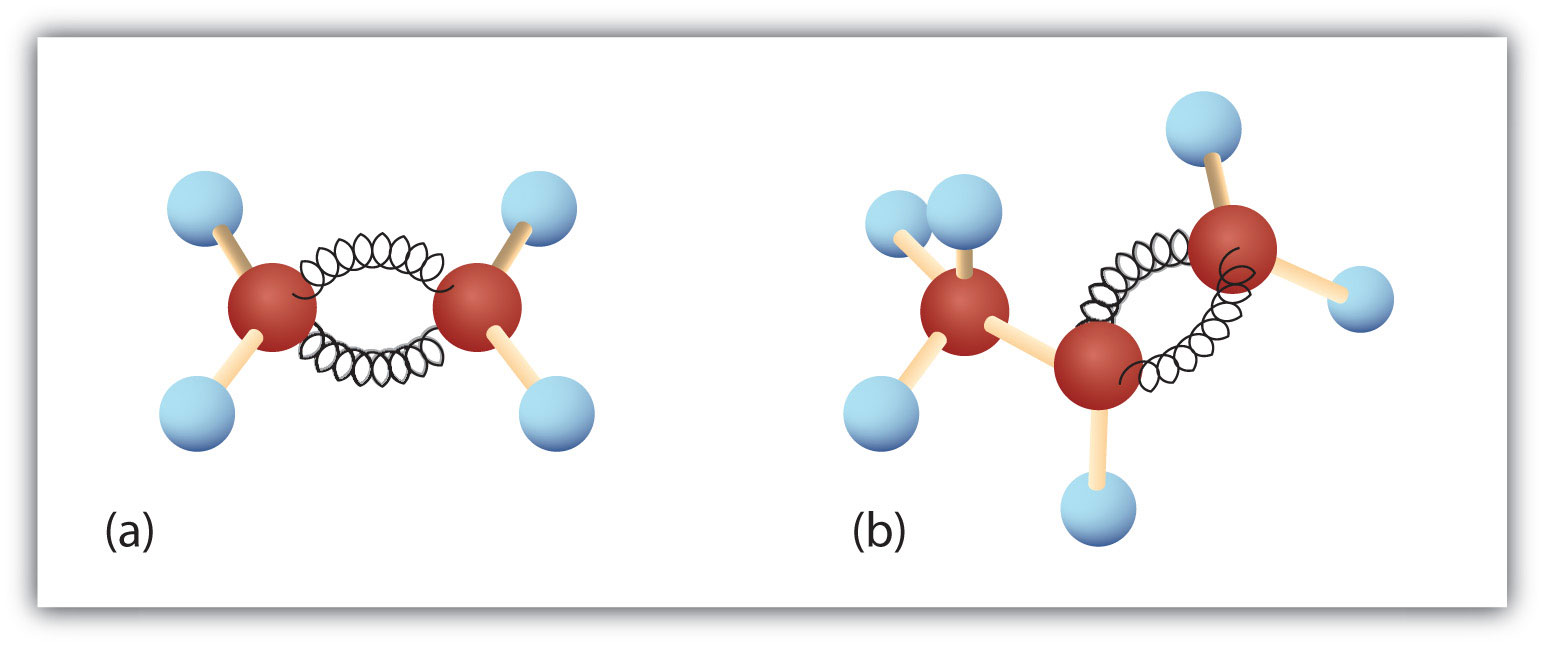
Figura 8.3. Eteno y propeno. Los modelos de bola y resorte de etileno/etileno (a) y propeno/propileno (b) muestran sus respectivas formas, especialmente los ángulos de enlace.
Mirando más de cerca: Nota ambiental
Los alquenos se dan ampliamente en la naturaleza. Las frutas y verduras que maduran desprenden etileno, que desencadena una mayor maduración. Los procesadores de fruta introducen etileno de forma artificial para acelerar el proceso de maduración; la exposición a tan sólo 0,1 mg de etileno durante 24 horas puede madurar 1 kg de tomates. Desgraciadamente, este proceso no duplica exactamente el proceso de maduración, y los tomates recogidos en verde y tratados de esta manera no saben mucho como los tomates madurados en la viña recién sacados del jardín.
Otros alquenos que se encuentran en la naturaleza son el 1-octeno, un componente del aceite de limón, y el octadeceno (C18H36) que se encuentra en el hígado de los peces. También son comunes los dienos (dos dobles enlaces) y los polienos (tres o más dobles enlaces). El butadieno (CH2=CHCH=CH2) se encuentra en el café. El licopeno y los carotenos son polienos isoméricos (C40H56) que dan los atractivos colores rojo, naranja y amarillo a las sandías, tomates, zanahorias y otras frutas y verduras. La vitamina A, esencial para una buena visión, se deriva de un caroteno. El mundo sería un lugar mucho menos colorido sin los alquenos.

Figura 8.4 El color rojo brillante de los tomates se debe al licopeno.
Foto de : © Thinkstock; Estructura del licopeno de: Jeff Dahl
Ejercicios de repaso de conceptos
-
Describa brevemente las propiedades físicas de los alquenos. Cómo se comparan estas propiedades con las de los alcanos?
-
Sin consultar tablas, ordene los siguientes alquenos en orden de aumento del punto de ebullición:

Respuestas
-
Los alquenos tienen propiedades físicas (puntos de ebullición bajos, insolubles en agua) bastante similares a las de sus correspondientes alcanos.
-
Eteno < propeno < 1-buteno < 1-hexeno
Las propiedades físicas de los alquenos son muy parecidas a las de los alcanos: sus puntos de ebullición aumentan con el incremento de la masa molar y son insolubles en agua.
Ejercicios
-
Sin consultar una tabla u otra referencia, prediga qué miembro de cada par tiene el mayor punto de ebullición.
- 1-penteno o 1-buteno
- 3-hepteno o 3-noneno
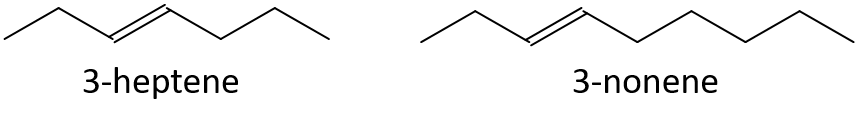
- 1-penteno o 1-buteno
-
¿Cuál es un buen disolvente para el ciclohexeno? pentano o agua?
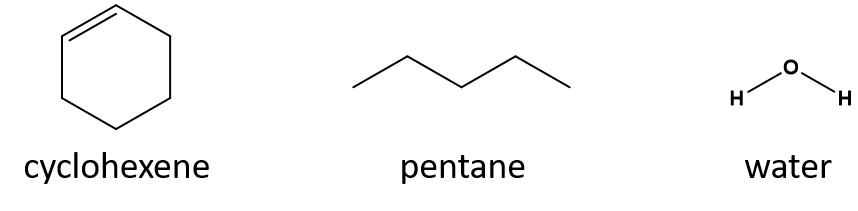
Respuesta
-
- 1-penteno
- 3-noneno
Ejercicios de repaso de conceptos
-
Identificar brevemente las distinciones importantes entre un hidrocarburo saturado y un hidrocarburo insaturado.
-
Identificar brevemente las distinciones importantes entre un alqueno y un alcano.
-
Clasificar cada compuesto como saturado o insaturado. Identifique cada uno como un alcano, un alqueno o un alquino.
-
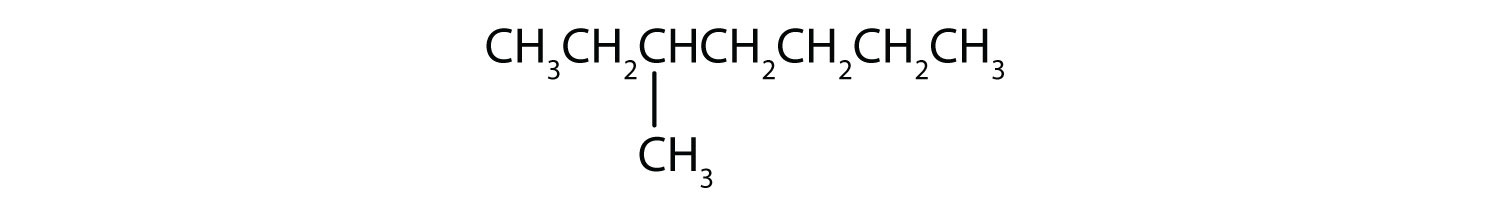
- CH3CH2C≡CCH3
-

-
.
Respuestas
-
Los hidrocarburos no saturados tienen dobles o triples enlaces y son bastante reactivos; los hidrocarburos saturados sólo tienen enlaces simples y son poco reactivos.
-
Un alqueno tiene un doble enlace; un alcano sólo tiene enlaces simples.
-
- Saturado; alcano
- Insaturado; alquino
- Insaturado; alqueno
Las claves
- Los alquenos son hidrocarburos con un doble enlace carbono-carbono.
8.3 Alquinos
El alquino más simple -un hidrocarburo con triple enlace carbono-carbono- tiene la fórmula molecular C2H2 y se conoce por su nombre común: acetileno (Fig 8.5). Su estructura es H-C≡C-H.
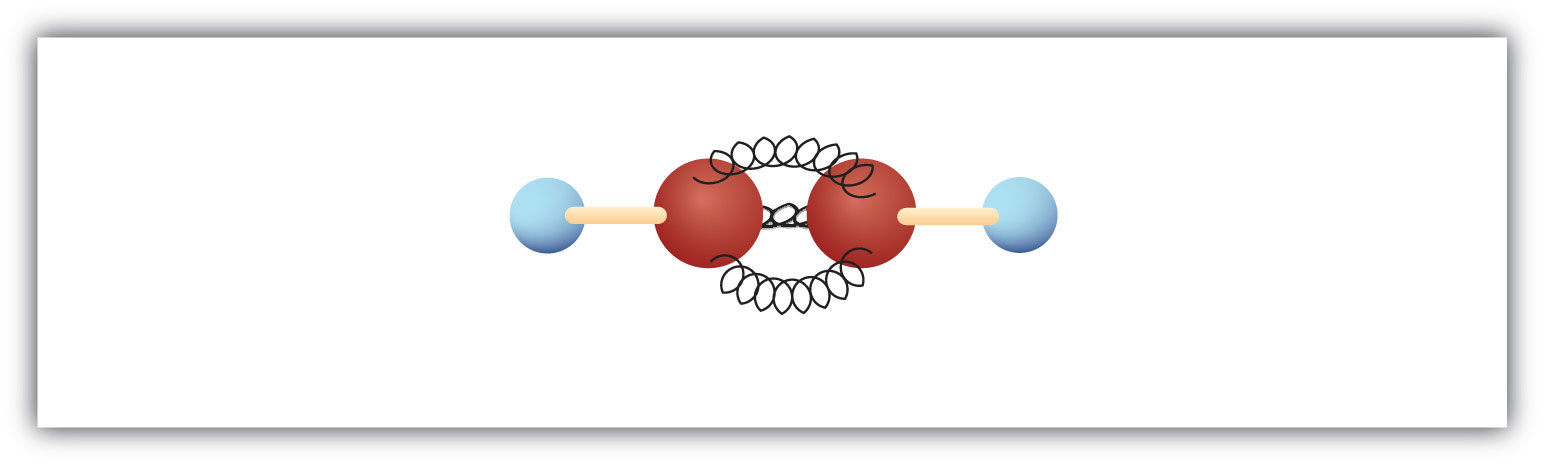
Figura 8.5 Modelo de bola y resorte del acetileno. El acetileno (etileno) es el miembro más simple de la familia de los alquinos.
Nota
El acetileno se utiliza en los sopletes oxiacetilénicos para cortar y soldar metales. La llama de un soplete de este tipo puede ser muy caliente. Sin embargo, la mayor parte del acetileno se convierte en productos químicos intermedios que se utilizan para fabricar plásticos vinílicos y acrílicos, fibras, resinas y una variedad de otros productos.
Los alquinos son similares a los alquenos en cuanto a sus propiedades físicas y químicas. Por ejemplo, los alquinos experimentan muchas de las reacciones de adición típicas de los alquenos. Los nombres de la Unión Internacional de Química Pura y Aplicada (IUPAC) para los alquinos son paralelos a los de los alquenos, salvo que la terminación de la familia es -yne en lugar de -ene. El nombre IUPAC del acetileno es eteno. Los nombres de otros alquinos se ilustran en los siguientes ejercicios.
Ejercicios de repaso de conceptos
-
Identifique brevemente las diferencias importantes entre un alqueno y un alquino. ¿En qué se parecen?
-
El alqueno (CH3)2CHCH2CH=CH2 se llama 4-metil-1-penteno. Cómo se llama el (CH3)2CHCH2C≡CH?
-
¿Los alquinos presentan isomería cis-trans? Explique.
Respuestas
-
Los alquenos tienen dobles enlaces; los alquinos tienen triples enlaces. Ambos sufren reacciones de adición.
-
4-metil-1-pentina
-
No; un átomo de carbono con triple enlace sólo puede formar otro enlace. Tendría que tener dos grupos unidos para mostrar isomerismo cis-trans.
Las claves
- Los alquinos son hidrocarburos con triples enlaces carbono-carbono y propiedades muy parecidas a las de los alquenos.
Ejercicios
-
Dibuja la estructura de cada compuesto.
- acetileno
- 3-metil-1-hexina
-
Dibuja la estructura de cada compuesto.
- 4-metil-2-hexina
- 3-octina
-
Nombre cada alquino.
- CH3CH2CH2C≡CH
- CH3CH2CHC≡CCH3
Respuestas
-
- H-C≡C-H
-
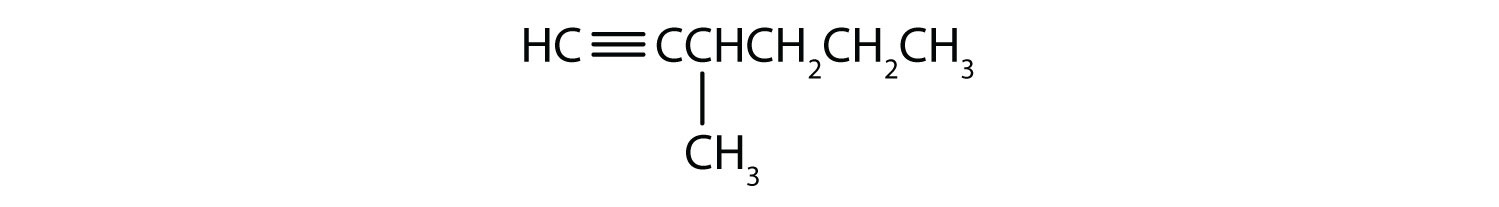
-
- 1-pentina
- 2-hexina
(Volver al principio)
8.4 Compuestos aromáticos: Benceno
A continuación consideramos una clase de hidrocarburos con fórmulas moleculares como las de los hidrocarburos insaturados, pero que, a diferencia de los alquenos, no sufren fácilmente reacciones de adición. Estos compuestos constituyen una clase distinta, denominada hidrocarburos aromáticos. Los hidrocarburos aromáticos son compuestos que contienen una estructura de anillo de benceno. El compuesto aromático más sencillo es el benceno (C6H6) y es de gran importancia comercial, pero también tiene notables efectos nocivos para la salud (véase «Para su salud: el benceno y nosotros»).
La fórmula C6H6 parece indicar que el benceno tiene un alto grado de insaturación. (El hexano, el hidrocarburo saturado con seis átomos de carbono, tiene la fórmula C6H14, ocho átomos de hidrógeno más que el benceno). Sin embargo, a pesar del aparente bajo nivel de saturación, el benceno es bastante poco reactivo. Esto se debe a la estructura de resonancia que se forma a partir de la estructura de doble enlace alternante del anillo aromático.

Nota
El benceno es un líquido que huele a gasolina, hierve a 80°C y se congela a 5,5°C. Es el hidrocarburo aromático que se produce en mayor volumen. Antiguamente se utilizaba para descafeinar el café y era un componente importante de muchos productos de consumo, como los decapantes de pintura, los cementos de caucho y los quitamanchas de limpieza en seco. Se eliminó de las fórmulas de muchos productos en la década de 1950, pero otros siguieron utilizando el benceno en los productos hasta la década de 1970, cuando se asoció con muertes por leucemia. El benceno sigue siendo importante en la industria como precursor en la producción de plásticos (como la espuma de poliestireno y el nylon), medicamentos, detergentes, caucho sintético, pesticidas y tintes. Se utiliza como disolvente para la limpieza y el mantenimiento de equipos de impresión y para adhesivos como los utilizados para fijar las suelas de los zapatos. El benceno es un componente natural de los productos petrolíferos, pero debido a que es un carcinógeno conocido, su uso como aditivo en la gasolina es ahora limitado.
A su salud: El benceno y nosotros
La mayor parte del benceno utilizado comercialmente procede del petróleo. Se emplea como material de partida para la producción de detergentes, medicamentos, tintes, insecticidas y plásticos. El benceno, que en su día se utilizó ampliamente como disolvente orgánico, tiene ahora efectos tóxicos a corto y largo plazo. La inhalación de grandes concentraciones puede provocar náuseas e incluso la muerte por insuficiencia respiratoria o cardíaca, mientras que la exposición repetida provoca una enfermedad progresiva en la que se acaba destruyendo la capacidad de la médula ósea para producir nuevas células sanguíneas. Esto da lugar a una enfermedad denominada anemia aplásica, en la que se produce una disminución del número de glóbulos rojos y blancos.
Ejercicios de repaso de conceptos
-
¿En qué se diferencian las reacciones típicas del benceno de las de los alquenos?
-
Describa brevemente el enlace en el benceno.
-
¿Qué significa el círculo en la representación química del benceno?
Respuestas
-
El benceno es bastante poco reactivo hacia las reacciones de adición en comparación con un alqueno.
-
Los electrones de valencia son compartidos por igual por los seis átomos de carbono (es decir, los electrones están deslocalizados).
-
Los seis electrones son compartidos por igual por los seis átomos de carbono.
Reconociendo los compuestos aromáticos
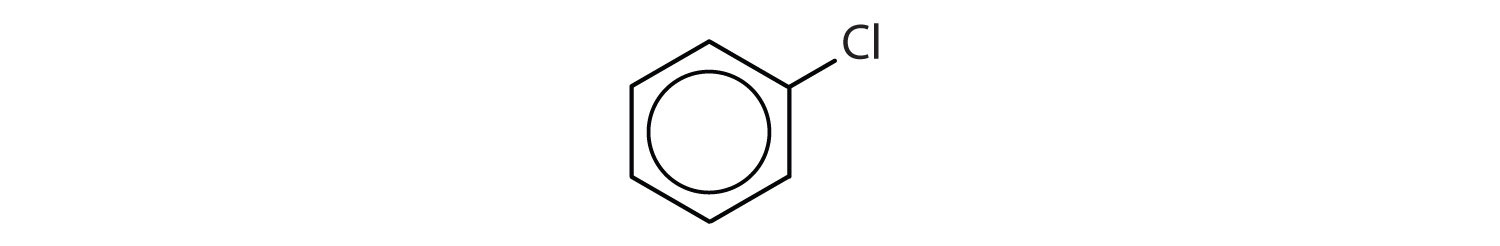
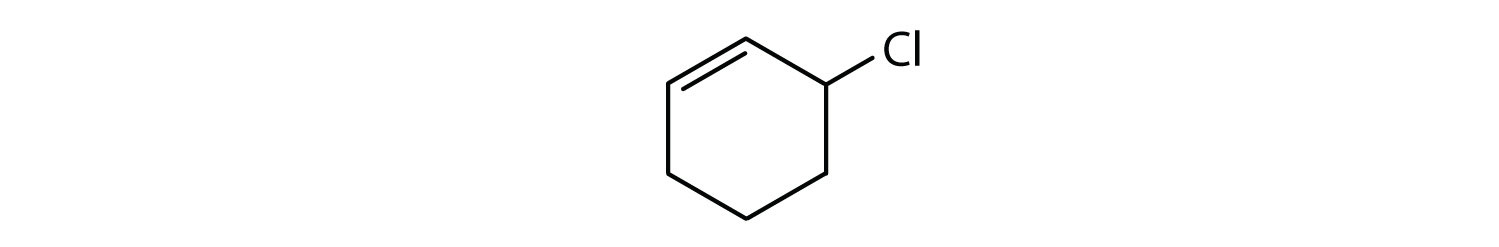
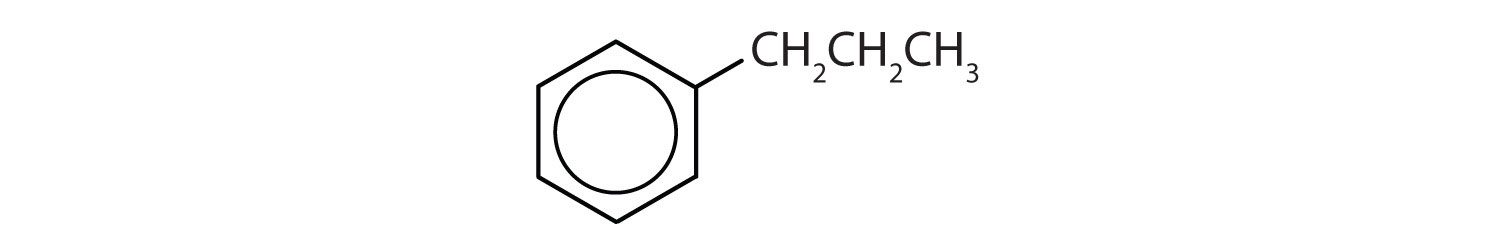
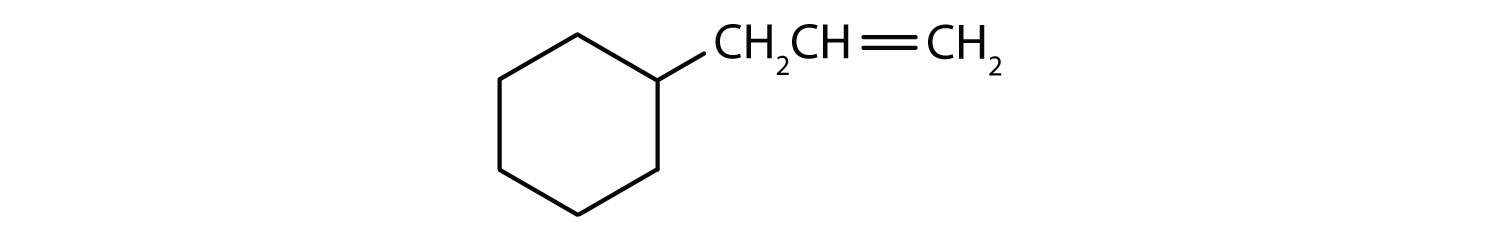
¿Qué compuestos son aromáticos?
Solución
- El compuesto tiene un anillo de benceno (con un átomo de cloro sustituido por uno de los átomos de hidrógeno); es aromático.
- El compuesto es cíclico, pero no tiene un anillo de benceno; no es aromático.
- El compuesto tiene un anillo de benceno (con un grupo propilo sustituido por uno de los átomos de hidrógeno); es aromático.
- El compuesto es cíclico, pero no tiene un anillo de benceno; no es aromático.
Ejercicio de habilidad
¿Qué compuestos son aromáticos?
-
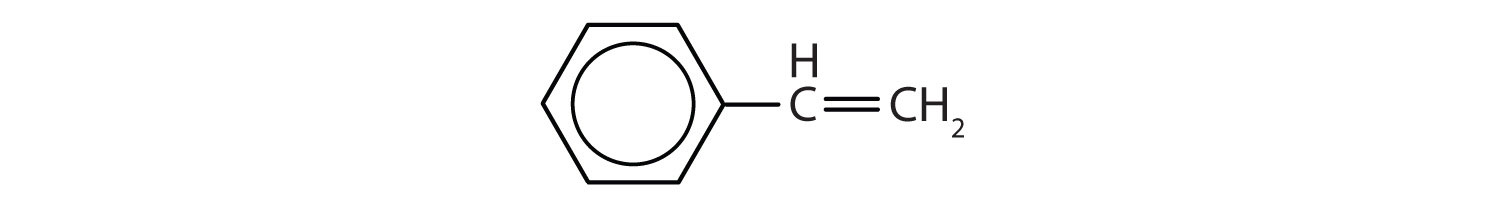
-
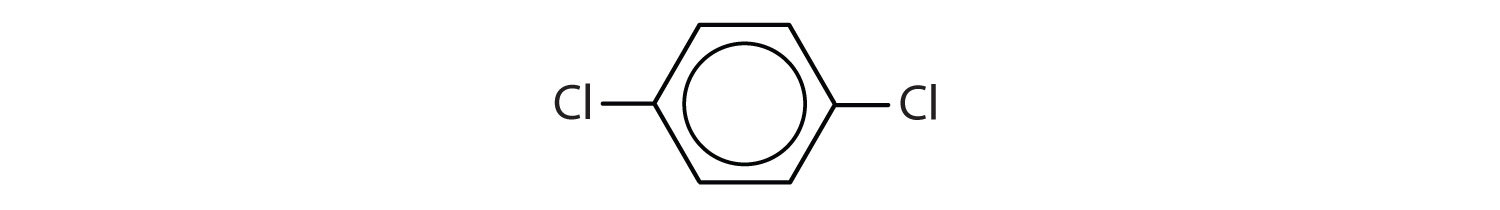
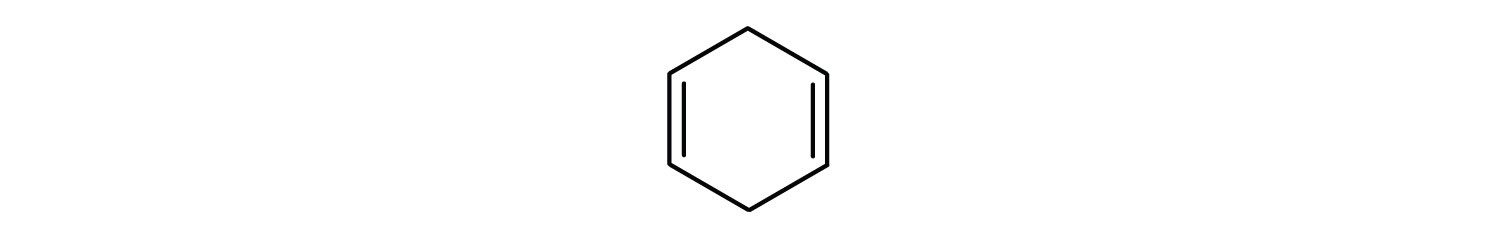
En el sistema de la Unión Internacional de Química Pura y Aplicada (IUPAC), los hidrocarburos aromáticos se nombran como derivados del benceno. A continuación se muestran cinco ejemplos. En estas estructuras, es indiferente que el sustituyente único se escriba en la parte superior, lateral o inferior del anillo: un hexágono es simétrico y, por lo tanto, todas las posiciones son equivalentes.
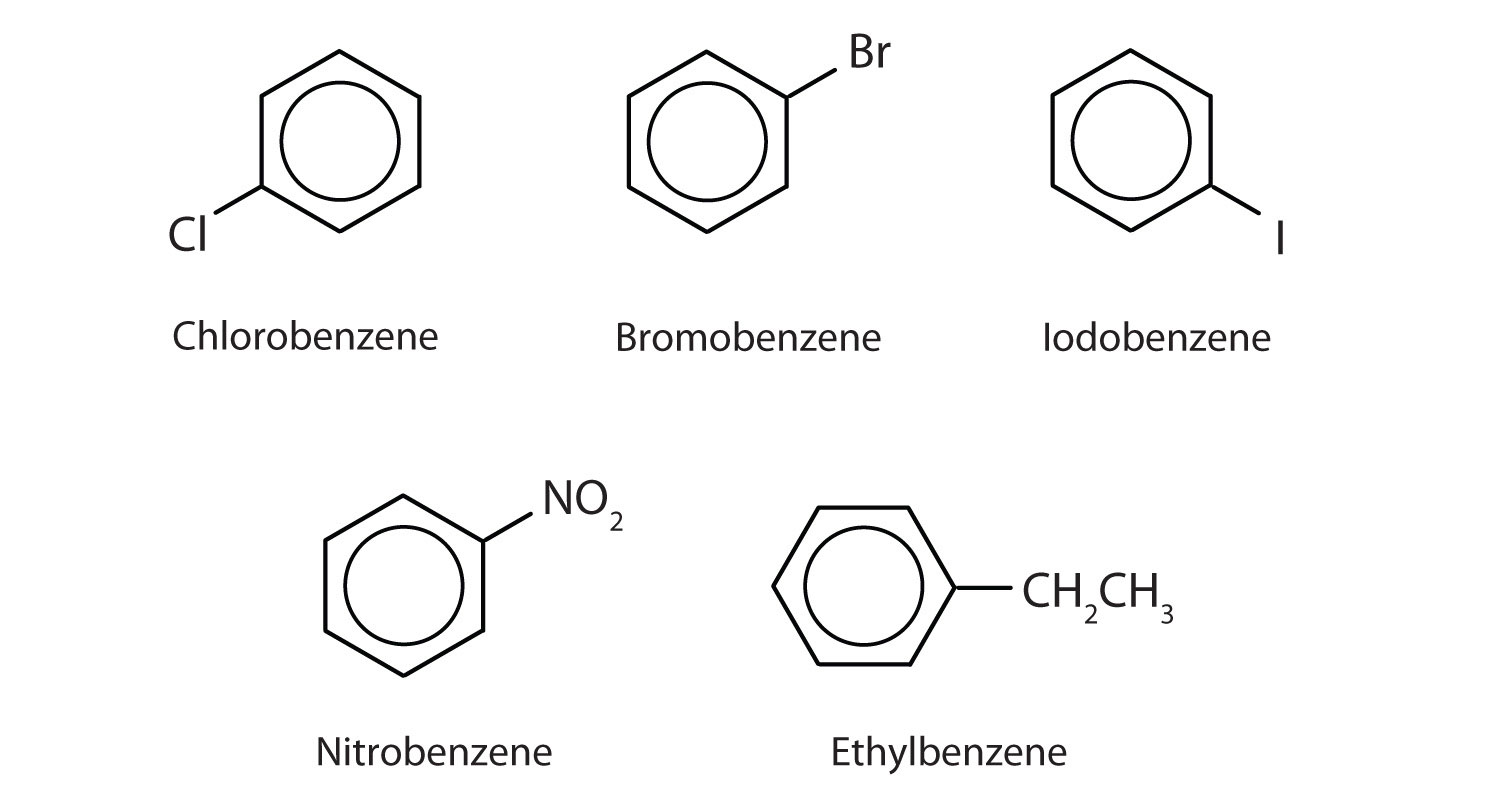
Estos compuestos se nombran de la forma habitual con el grupo que sustituye a un átomo de hidrógeno nombrado como grupo sustituyente: Cl como cloro, Br como bromo, I como yodo, NO2 como nitro, y CH3CH2 como etilo.
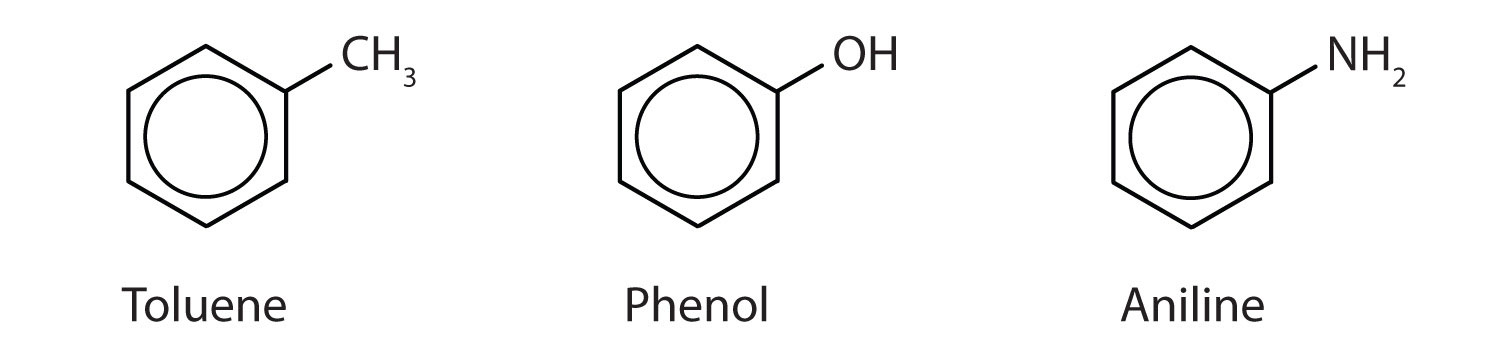
Aunque algunos compuestos se denominan exclusivamente con nombres de la IUPAC, algunos se denotan más frecuentemente con nombres comunes, como se indica a continuación.
Lo más importante
- Los hidrocarburos aromáticos parecen ser insaturados, pero tienen un tipo especial de enlace y no sufren reacciones de adición.
(Volver al principio)
Hidrocarburos aromáticos policíclicos
Algunos hidrocarburos aromáticos comunes están formados por anillos-anillos de benceno fusionados que comparten un lado común. Estos compuestos se denominan hidrocarburos aromáticos policíclicos (PAHs)Un hidrocarburo aromático que consiste en anillos de benceno fusionados que comparten un lado común..
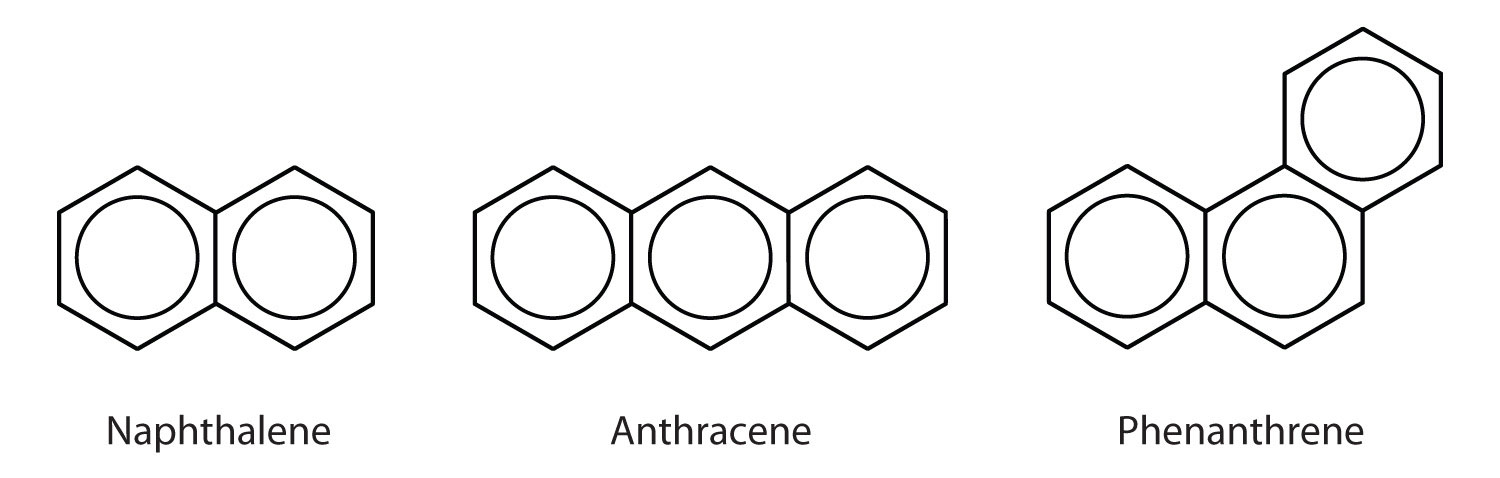
Los tres ejemplos mostrados aquí son sólidos incoloros y cristalinos que se obtienen generalmente del alquitrán de hulla. El naftaleno tiene un olor penetrante y se utiliza en las bolas de naftalina. El antraceno se utiliza en la fabricación de ciertos tintes. Los esteroides, incluyendo el colesterol y las hormonas, estrógeno y testosterona, contienen la estructura del fenantreno.
Para su salud: Hidrocarburos Aromáticos Policíclicos y Cáncer
El intenso calentamiento necesario para destilar el alquitrán de hulla da lugar a la formación de HAP. Desde hace muchos años, se sabe que los trabajadores de las refinerías de alquitrán de hulla son susceptibles de padecer un tipo de cáncer de piel conocido como cáncer de alquitrán. Las investigaciones han demostrado que varios HAP son cancerígenos. Uno de los compuestos cancerígenos más activos, el benzopireno, se encuentra en el alquitrán de hulla y también se ha aislado del humo de los cigarrillos, el humo de la marihuana, los gases de escape de los automóviles y los filetes asados al carbón. Se calcula que cada año se emiten más de 1.000 toneladas de benzopireno en el aire de Estados Unidos. Sólo se necesitan unos pocos miligramos de benzopireno por kilogramo de peso corporal para inducir cáncer en animales de experimentación.
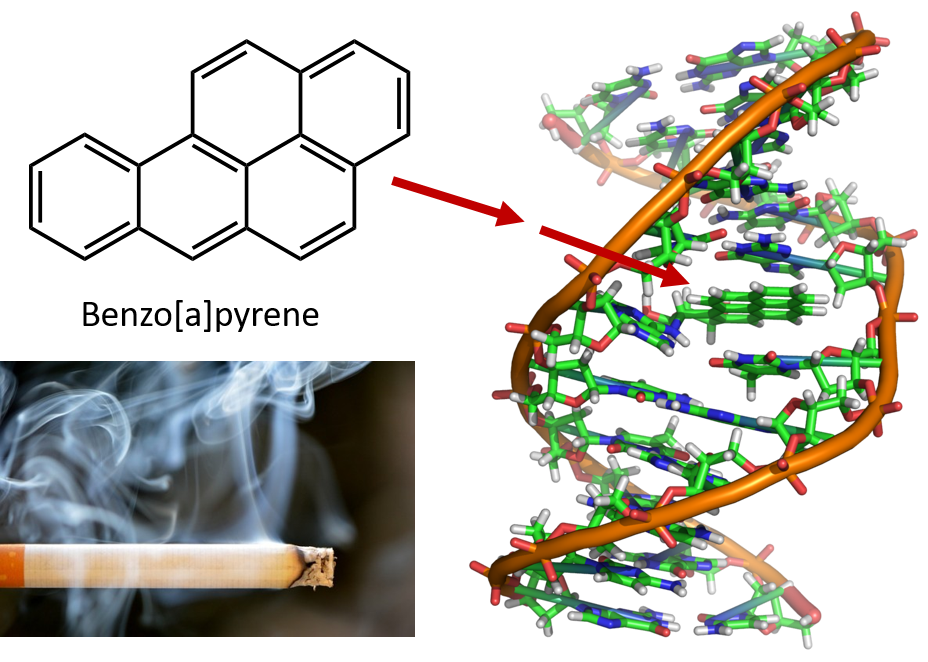
Figura 8.6 El benzopireno es un hidrocarburo aromático policíclico que se produce como subproducto en el alquitrán de hulla, el humo de los cigarrillos y la marihuana, y en los filetes asados al carbón. El benzopireno se metaboliza para producir compuestos biológicamente activos que pueden formar aductos físicos en las moléculas de ADN. Estos aductos pueden provocar mutaciones genéticas que causan cáncer.
Foto de humo de cigarrillo
Compuestos biológicamente importantes con anillos de benceno
Las sustancias que contienen el anillo de benceno son comunes tanto en animales como en plantas, aunque son más abundantes en estas últimas. Las plantas pueden sintetizar el anillo de benceno a partir de dióxido de carbono, agua y materiales inorgánicos. Los animales no pueden sintetizarlo, pero dependen de ciertos compuestos aromáticos para sobrevivir y, por tanto, deben obtenerlos de los alimentos. La fenilalanina, la tirosina y el triptófano (aminoácidos esenciales) y las vitaminas K, B2 (riboflavina) y B9 (ácido fólico) contienen el anillo bencénico. Muchos fármacos importantes, algunos de los cuales se muestran en la Tabla 8.2, también presentan un anillo bencénico.
Nota
Hasta ahora hemos estudiado sólo los compuestos aromáticos con anillos que contienen carbono. Sin embargo, muchos compuestos cíclicos tienen un elemento distinto de los átomos de carbono en el anillo. Las estructuras anulares orgánicas que contienen un átomo distinto del carbono se denominan compuestos heterocíclicos., Los compuestos aromáticos heterocíclicos también tienen propiedades únicas y médicamente relevantes.
Tabla 8.2 Algunos fármacos que contienen un anillo de benceno
Nombre Estructura aspirina 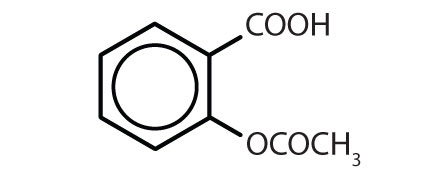
acetaminofén 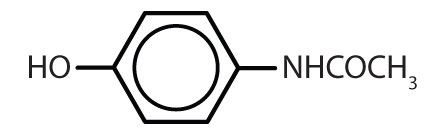
ibuprofeno 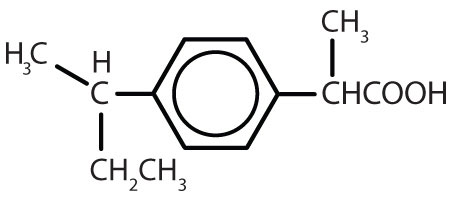
anfetamina 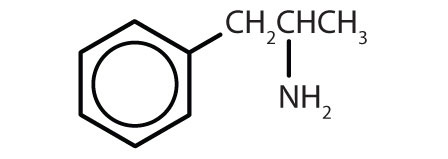
sulfanilamida 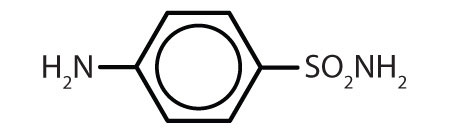
8.5 Isómeros geométricos
En la estructura de los alcanos hay rotación libre sobre los enlaces simples carbono-carbono (C-C). Por el contrario, la estructura de los alquenos requiere que los átomos de carbono formen un doble enlace. Los dobles enlaces entre los elementos se crean utilizando caparazones orbitales p (también llamados orbitales pi). Estos orbitales tienen forma de campana en lugar de los orbitales circulares utilizados en los enlaces simples. Esto impide la rotación libre de los átomos de carbono alrededor del doble enlace, ya que provocaría la ruptura del doble enlace durante la rotación (Figura 8.7). Así, un enlace simple es análogo a dos tablas clavadas con un solo clavo. Las tablas son libres de girar alrededor del clavo único. Una unión doble, en cambio, es análoga a dos tablas clavadas con dos clavos. En el primer caso se pueden torcer las tablas, mientras que en el segundo no se pueden torcer.

Figura 8.7 La formación de dobles enlaces requiere el uso de enlaces pi. Para que las moléculas creen dobles enlaces, los electrones deben compartir orbitales pi superpuestos entre los dos átomos. Esto requiere que los orbitales pi en forma de campana (mostrados a la izquierda) permanezcan en una conformación fija durante la formación del doble enlace. Esto permite la formación de orbitales de electrones que pueden ser compartidos por ambos átomos (mostrados a la derecha). La rotación alrededor del doble enlace haría que los orbitales pi se desalinearan, rompiendo el doble enlace.
Diagrama proporcionado por: JoJanderivative work – Vladsinger (talk)
La naturaleza fija y rígida del doble enlace crea la posibilidad de un centro quiral adicional, y por lo tanto, el potencial de estereoisómeros. Se forman nuevos estereoisómeros si cada uno de los carbonos involucrados en el doble enlace tiene dos átomos o grupos diferentes unidos a él. Por ejemplo, observe los dos hidrocarburos clorados de la figura 8.8. En la figura superior se muestra el alcano halogenado. La rotación alrededor de este enlace carbono-carbono es posible y no da lugar a diferentes conformaciones isoméricas. En el diagrama inferior, el alqueno halogenado tiene restringida la rotación alrededor del doble enlace. Obsérvese también que cada carbono implicado en el doble enlace está unido a dos átomos diferentes (un hidrógeno y un cloro). Así, esta molécula puede formar dos estereoisómeros: uno que tiene los dos átomos de cloro en el mismo lado del doble enlace, y otro en el que los cloros residen en lados opuestos del doble enlace.
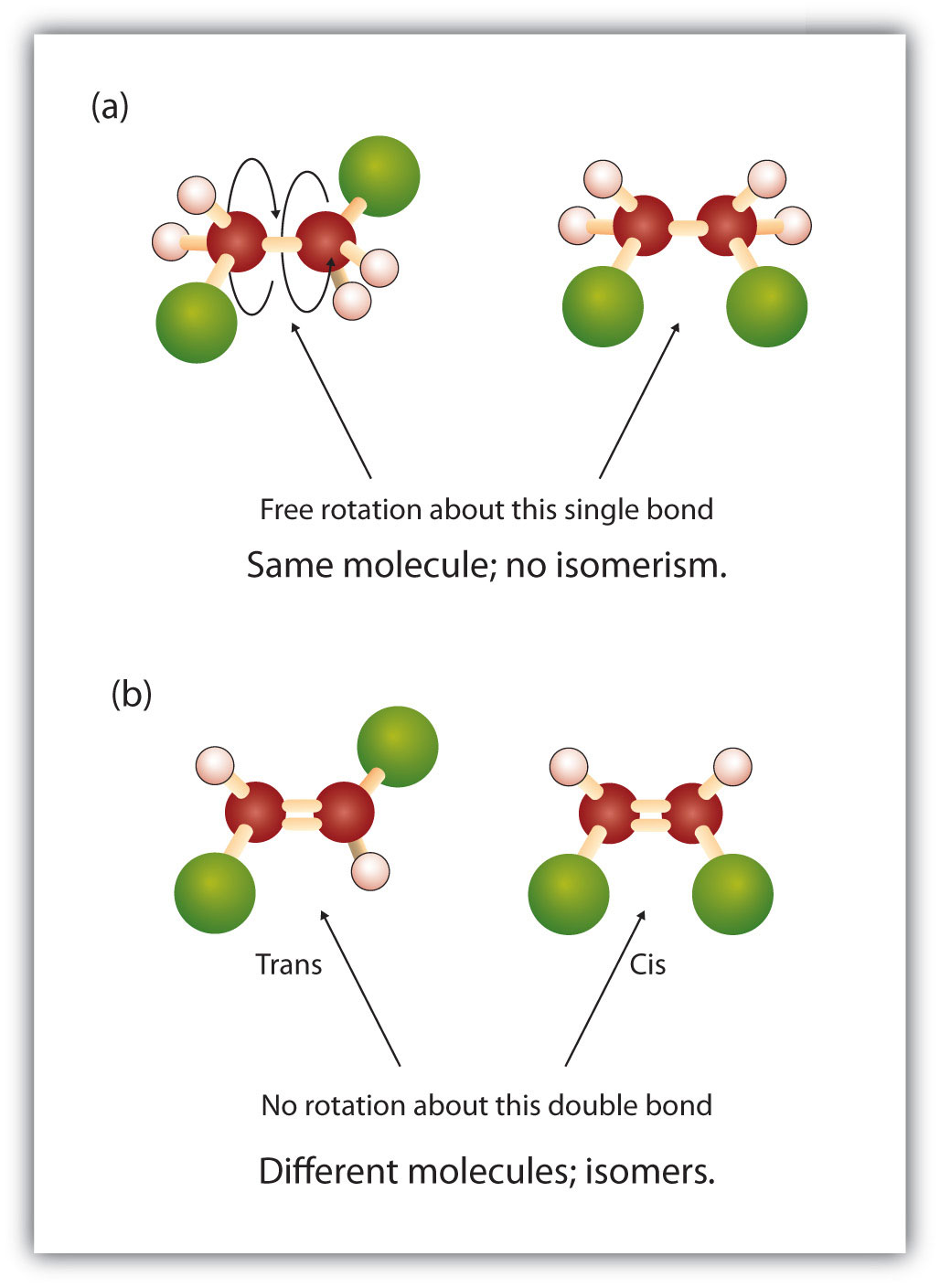
Figura 8.8 Los dobles enlaces del alqueno pueden formar isómeros geométricos. (a) Muestra la rotación libre alrededor de un enlace simple carbono-carbono en la estructura del alcano. (b) Muestra la posición fija del doble enlace carbono-carbono que da lugar a isómeros geométricos (espaciales).
Haga clic aquí para ver un video tutorial de Kahn Academy sobre la estructura del alqueno.
Para esta sección, no nos interesa la denominación que también se incluye en este video tutorial.(Nota: Todo el contenido de Khan Academy está disponible de forma gratuita utilizando la licencia CC-BY-NC-SA en www.khanacademy.org )
Nomenclatura cis-trans
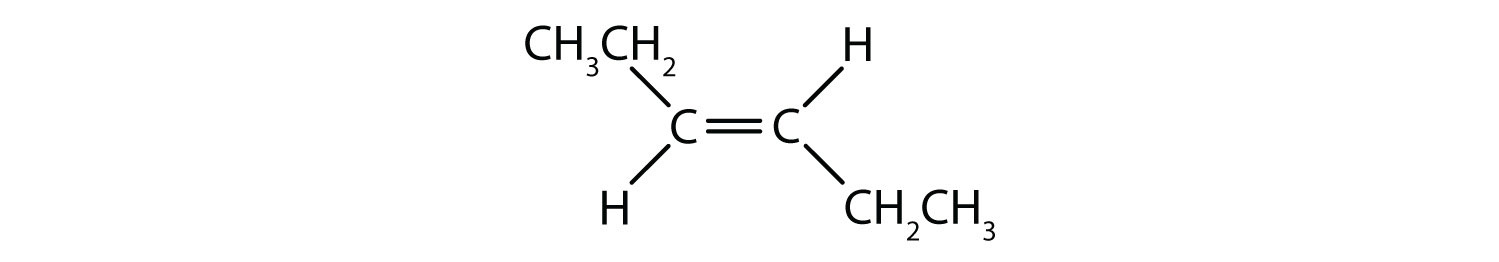
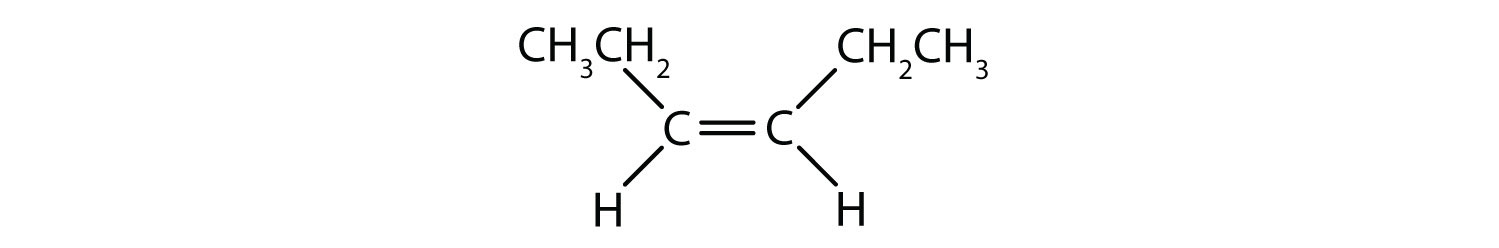
El sistema de denominación cis-trans puede utilizarse para distinguir isómeros simples, en los que cada carbono del doble enlace tiene un conjunto de grupos idénticos unidos a él. Por ejemplo, en la Figura 8.8b, cada carbono involucrado en el doble enlace, tiene un cloro unido a él, y también tiene hidrógeno unido a él. El sistema cis y trans, identifica si los grupos idénticos están en el mismo lado (cis) del doble enlace o si están en el lado opuesto (trans) del doble enlace. Por ejemplo, si los átomos de hidrógeno están en el lado opuesto del doble enlace, se dice que el enlace está en la conformación trans. Cuando los grupos de hidrógeno están en el mismo lado del doble enlace, se dice que el enlace está en la conformación cis. Obsérvese que también se puede decir que si los dos grupos cloro están en el lado opuesto del doble enlace, la molécula está en la conformación trans o si están en el mismo lado del doble enlace, la molécula está en la conformación cis.
Para determinar si una molécula es cis o trans, es útil dibujar una línea discontinua por el centro del doble enlace y luego rodear los grupos idénticos, como se muestra en la figura 8.9. Ambas moléculas mostradas en la figura 8.9, se denominan 1,2-dicloroeteno. Así, la designación cis y trans, sólo define la estereoquímica alrededor del doble enlace, no cambia la identidad global de la molécula. Sin embargo, los isómeros cis y trans suelen tener propiedades físicas y químicas diferentes, debido a la naturaleza fija de los enlaces en el espacio.
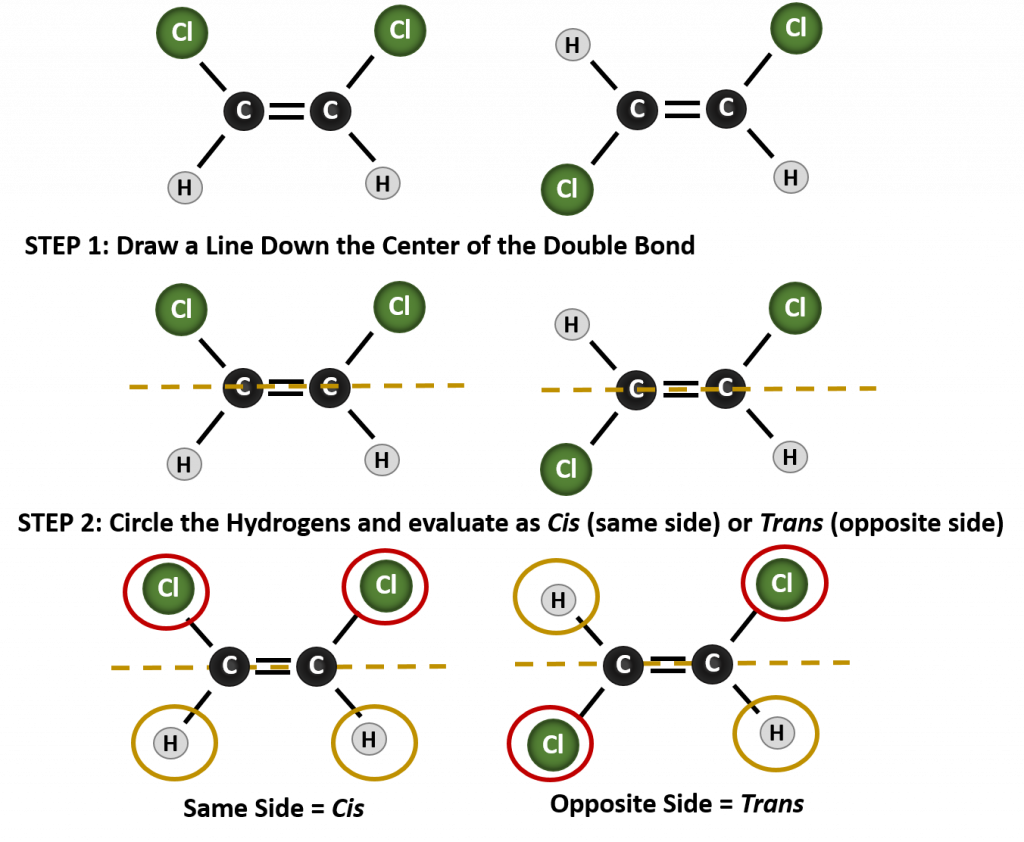
Figura 8.9 Una guía para determinar las conformaciones cis o trans.
Haga clic aquí para ver un video tutorial de Kahn Academy sobre la isomerización Cis/Trans
(Nota: Todo el contenido de Khan Academy está disponible de forma gratuita utilizando la licencia CC-BY-NC-SA en www.khanacademy.org )
La isomerización Cis-trans también ocurre en los compuestos cíclicos. En las estructuras de anillo, los grupos no pueden girar sobre ninguno de los enlaces carbono-carbono del anillo. Por lo tanto, los grupos pueden estar en el mismo lado del anillo (cis) o en lados opuestos del anillo (trans). Para nuestros propósitos aquí, representamos todos los cicloalcanos como estructuras planas, e indicamos las posiciones de los grupos, ya sea por encima o por debajo del plano del anillo.

A su salud
Posiblemente el lugar más común en el que escuchará referencia a las conformaciones cis-trans en la vida cotidiana es en el supermercado o en la consulta de su médico. Está relacionado con nuestro consumo de grasas alimentarias. El consumo inadecuado o excesivo de grasas alimentarias se ha relacionado con muchos trastornos de la salud, como la diabetes y la aterosclerosis, y las enfermedades coronarias. Entonces, ¿cuáles son las diferencias entre las grasas saturadas y las insaturadas y qué son las grasas trans y por qué son tan preocupantes para la salud?

Figura 8.10 Fuentes comunes de grasas alimentarias.
Foto de: TyMaHe
La forma más común de grasas alimentarias y el principal constituyente de la grasa corporal en los seres humanos y otros animales son los triglicéridos (TAGs). Los TAGs, como se muestra en la figura 8.10, están construidos a partir de una molécula de glicerol y tres moléculas de ácidos grasos que están unidos por un enlace éster. En esta sección, nos centraremos en la estructura de las largas colas de los ácidos grasos, que pueden estar compuestas por estructuras de alcanos o alquenos. El capítulo 10 se centrará más en la formación de los enlaces éster.

Figura 8.11. Ejemplo de la estructura de un triglicérido (TAG). Observe que cada triglicérido tiene tres ácidos grasos de cadena larga que se extienden desde el esqueleto de glicerol. Cada ácido graso puede tener diferentes grados de saturación e insaturación.
Estructura adaptada de: Wolfgang Schaefer
Las grasas que están totalmente saturadas sólo tendrán ácidos grasos con colas de alcanos de cadena larga. Se dice que están «saturadas» de átomos de hidrógeno. Las grasas saturadas son comunes en la dieta estadounidense y se encuentran en la carne roja, los productos lácteos como la leche, el queso y la mantequilla, el aceite de coco, y se encuentran en muchos productos de panadería. Las grasas saturadas suelen ser sólidas a temperatura ambiente. Esto se debe a que los alcanos de cadena larga pueden apilarse teniendo más fuerzas intermoleculares de dispersión de Londres. Esto hace que las grasas saturadas tengan puntos de fusión y ebullición más altos que las grasas insaturadas que se encuentran en muchos aceites vegetales.
La mayoría de las grasas insaturadas que se encuentran en la naturaleza están en la conformación cis, como se muestra en la figura 8.11. Obsérvese que los ácidos grasos mostrados en la figura 8.11 están dibujados por comodidad, para que sean fáciles de ver y no ocupen demasiado espacio en el papel, pero los ángulos de enlace escritos no retratan adecuadamente la verdadera orientación espacial de las moléculas. Cuando los ácidos grasos del GAT mostrados en la Figura 8.11 se dibujan con los ángulos de enlace correctos, es fácil ver que los dobles enlaces cis causan dobleces en la cadena de alquenos (Fig. 8.12).
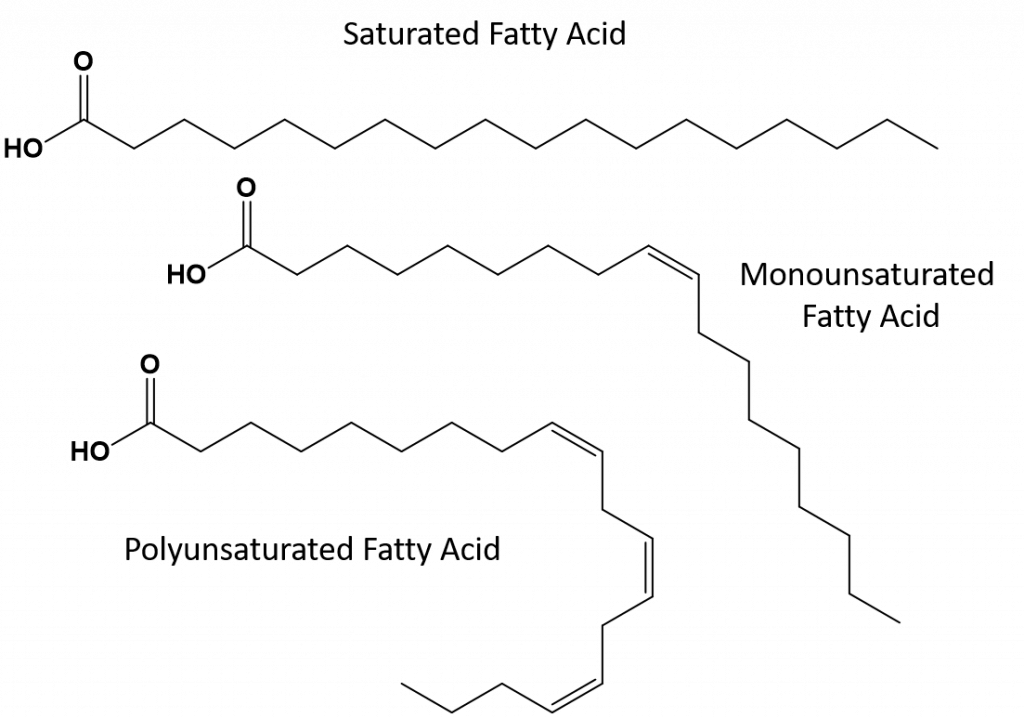
Figura 8.12 Los dobles enlaces Cis causan dobleces en la estructura de los ácidos grasos
Así, las grasas monoinsaturadas y poliinsaturadas no pueden apilarse tan fácilmente y no tienen tantas fuerzas de atracción intermoleculares en comparación con las grasas saturadas. Como resultado, tienen puntos de fusión y de ebullición más bajos y tienden a ser líquidos a temperatura ambiente. Se ha demostrado que la reducción o la sustitución de las grasas saturadas por grasas mono y poliinsaturadas en la dieta, ayuda a reducir los niveles de la forma de lipoproteína de baja densidad (LDL) del colesterol, que es un factor de riesgo para las enfermedades coronarias.
Las grasas trans, por otra parte, contienen dobles enlaces que están en la conformación trans. Así, la forma de los ácidos grasos es lineal, similar a la de las grasas saturadas. Las grasas trans también tienen puntos de fusión y ebullición similares a los de las grasas saturadas. Sin embargo, a diferencia de las grasas saturadas, las grasas trans no se encuentran habitualmente en la naturaleza y tienen efectos negativos para la salud. Las grasas trans se producen principalmente como subproducto en el procesamiento de alimentos (sobre todo en el proceso de hidrogenación para crear margarinas y mantecas) o durante la cocción, especialmente al freír. De hecho, muchos establecimientos de comida rápida utilizan grasas trans en su proceso de fritura con grasa profunda, ya que las grasas trans pueden utilizarse muchas veces antes de necesitar ser reemplazadas. El consumo de grasas trans aumenta los niveles de colesterol LDL en el organismo (el colesterol malo que se asocia a las enfermedades coronarias) y tiende a reducir el colesterol de lipoproteínas de alta densidad (HDL) (el colesterol bueno del organismo). El consumo de grasas trans aumenta el riesgo de padecer enfermedades cardíacas y accidentes cerebrovasculares, así como de desarrollar diabetes de tipo II. El riesgo está tan correlacionado que muchos países han prohibido el uso de grasas trans, como Noruega, Suecia, Austria y Suiza. En Estados Unidos, la Administración de Alimentos y Medicamentos (FDA) ha aprobado recientemente una medida para eliminar el uso de grasas trans en los alimentos para 2018. Se calcula que esta medida evitará 20.000 infartos y 7.000 muertes al año.
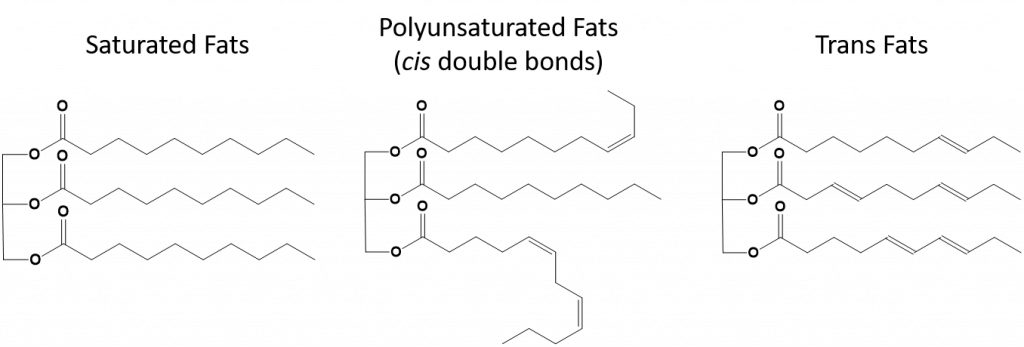
Figura 8.13 Diferencias estructurales de las grasas saturadas, poliinsaturadas y trans.
Haga clic aquí para ver un video tutorial de Kahn Academy sobre las grasas saturadas, insaturadas y trans
(Nota: Todo el contenido de Khan Academy está disponible de forma gratuita con licencia CC-BY-NC-SA en www.khanacademy.org )
Factores clave para determinar la isomerización Cis/Trans
- El compuesto necesita contener un enlace doble o triple, o tener una estructura de anillo que no permita la rotación libre alrededor del enlace carbono-carbono.
- El compuesto necesita tener dos grupos no idénticos unidos a cada carbono implicado en el doble o triple enlace carbono-carbono.
Ejemplo trabajado
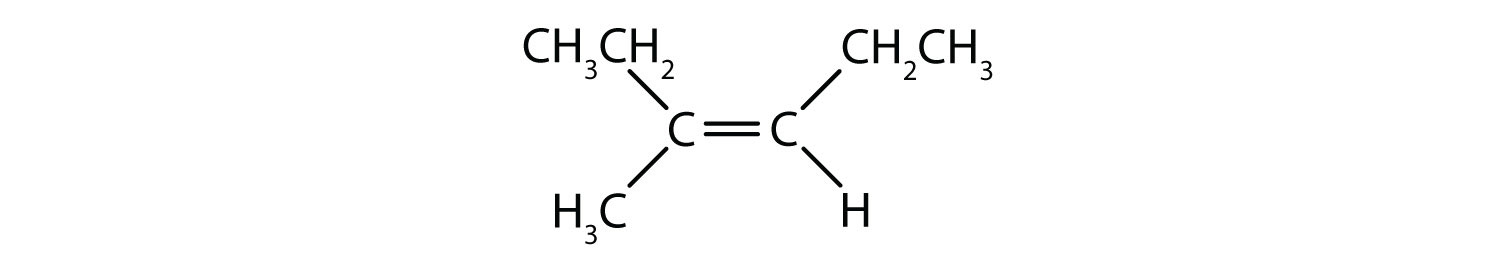
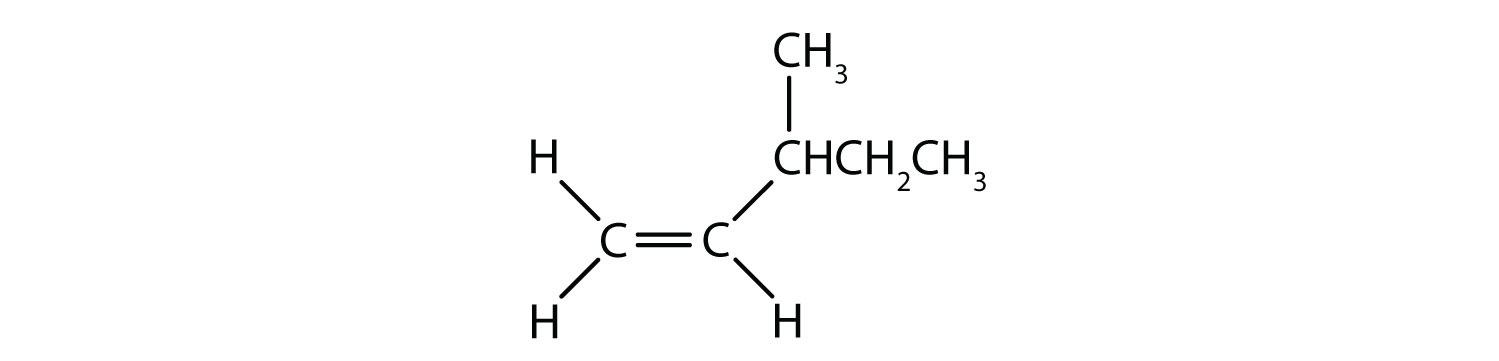
¿Qué compuestos pueden existir como isómeros cis-trans (geométricos)? Dibújalos.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CH2CH3
- CH3CH=CHCH2CH3
Solución
Las cuatro estructuras tienen un doble enlace y, por tanto, cumplen la regla 1 de isomería cis-trans.
-
Este compuesto cumple la regla 2; tiene dos grupos no idénticos en cada átomo de carbono (H y Cl en uno y H y Br en el otro). Existe como isómeros cis y trans:

- Este compuesto tiene dos átomos de hidrógeno en uno de sus átomos de carbono de doble enlace; no cumple la regla 2 y no existe como isómeros cis y trans.

- Este compuesto tiene dos grupos metilo (CH3) en uno de sus átomos de carbono de doble enlace. No cumple la regla 2 y no existe como isómeros cis y trans.

-
Este compuesto cumple la regla 2; tiene dos grupos no idénticos en cada átomo de carbono y existe como isómeros cis y trans:

Ejercicio de habilidad
-
¿Qué compuestos pueden existir como isómeros cis-trans? Dibújalos.
- CH2=CH2CH3
- CH3CH=CH2CH3
- CH3CH2CH=CH2CH3
-
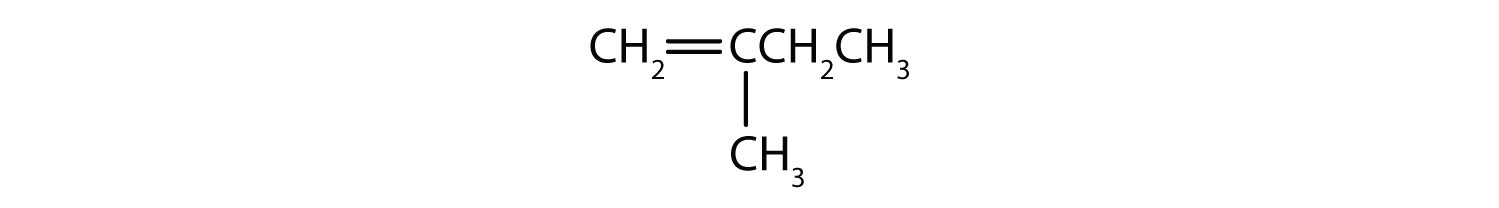
-
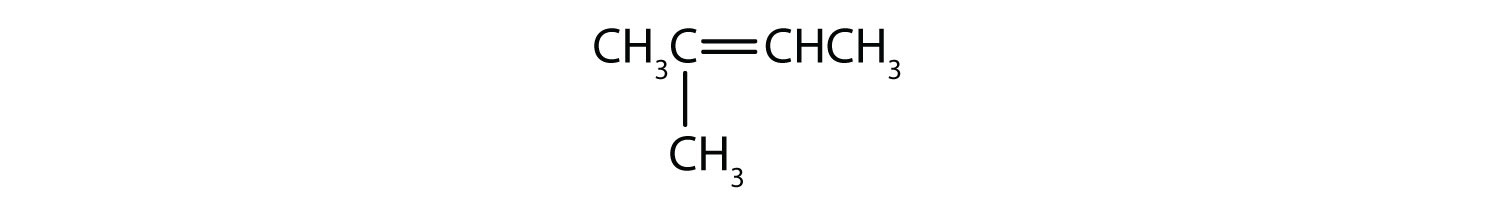
Ejercicios de repaso de conceptos
-
¿Qué son los isómeros cis-trans (geométricos)? ¿Qué dos tipos de compuestos pueden presentar isomerismo cis-trans?
-
Clasifique cada compuesto como un isómero cis, un isómero trans, o ninguno de los dos.
-
Respuestas
-
Los isómeros cis-Los isómeros trans son compuestos que tienen diferentes configuraciones (grupos permanentemente en diferentes lugares del espacio) debido a la presencia de una estructura rígida en su molécula. Los alquenos y los compuestos cíclicos pueden presentar isomería cis-trans.
-
- trans
- cis
- ninguno de los dos
Las claves
- El isomerismo cis-trans (geométrico) existe cuando hay una rotación restringida en una molécula y hay dos grupos diferentes en cada átomo de carbono involucrado en el enlace químico.
(Volver al principio)
Nomenclatura E-Z
La situación se vuelve más compleja cuando hay 4 grupos diferentes unidos a los átomos de carbono implicados en la formación del doble enlace. En este caso no se puede utilizar el sistema de nomenclatura cis-trans, ya que no se hace referencia a los grupos que describe la nomenclatura. Por ejemplo, en la molécula que se muestra a continuación, se puede decir que el cloro es trans con el grupo bromo, o se puede decir que el cloro es cis con el grupo metilo (CH3). Por lo tanto, escribir simplemente cis o trans en este caso no delinea claramente la orientación espacial de los grupos en relación con el doble enlace.
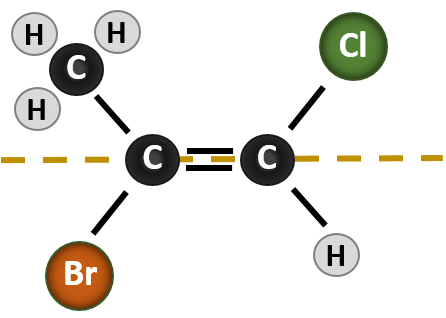
Nombrar los diferentes estereoisómeros formados en esta situación, requiere el conocimiento de las reglas de prioridad. Recordemos del capítulo 5 que en el sistema de prioridad Cahn-Ingold-Prelog (CIP), los grupos que se unen al carbono quiral tienen prioridad según su número atómico (Z). Los átomos con mayor número atómico (más protones) tienen mayor prioridad (es decir, S > P > O > N > C > H). Para este sistema de nomenclatura se utilizan las denominaciones (Z) y (E) en lugar del sistema cis/trans. (E) proviene de la palabra alemana entgegen, u opuesta. Así, cuando los grupos de mayor prioridad están en el lado opuesto del doble enlace, se dice que el enlace está en la conformación (E). (Z), por otro lado, proviene de la palabra alemana zusammen, o juntos. Así, cuando los grupos de mayor prioridad están en el mismo lado del doble enlace, se dice que el enlace está en la conformación (Z). La figura 8.14 muestra los pasos utilizados para asignar las conformaciones (E) o (Z) de una molécula.
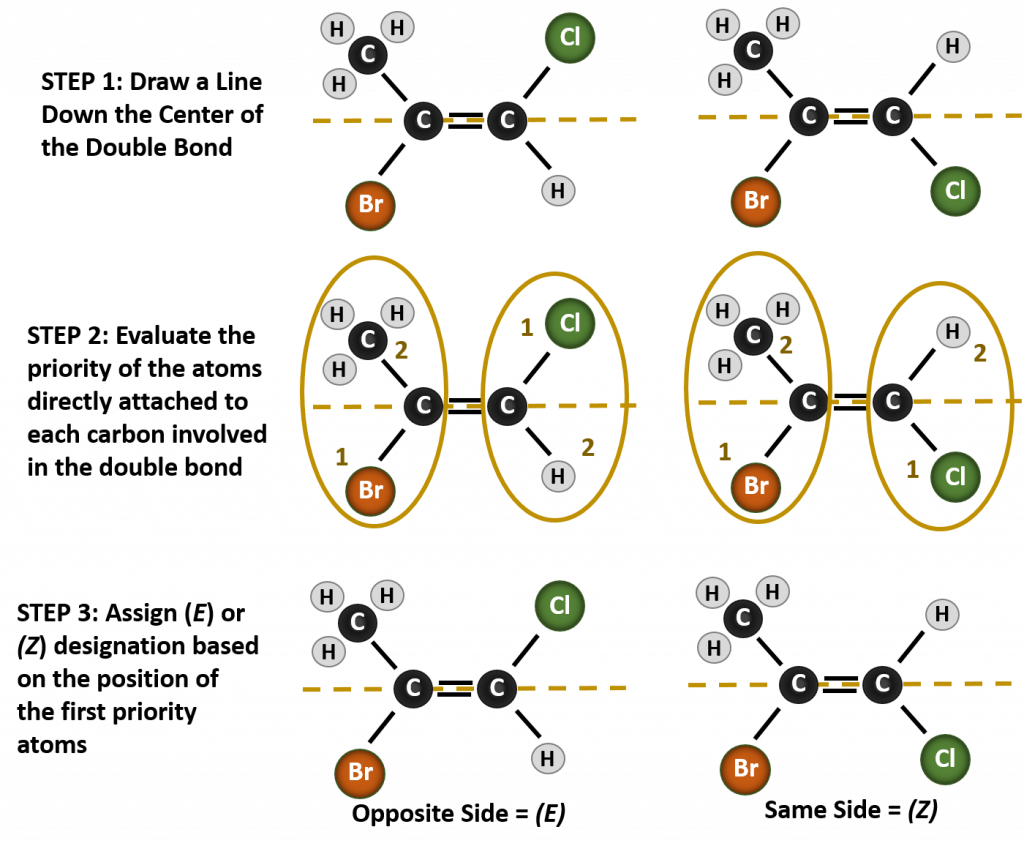
Figura 8.14 Pasos utilizados para asignar las conformaciones (E) y (Z).
Haga clic aquí para ver un video tutorial de Kahn Academy sobre la isomerización E/Z.
(Nota: Todo el contenido de Khan Academy está disponible de forma gratuita utilizando la licencia CC-BY-NC-SA en www.khanacademy.org )
(Volver al principio)
-