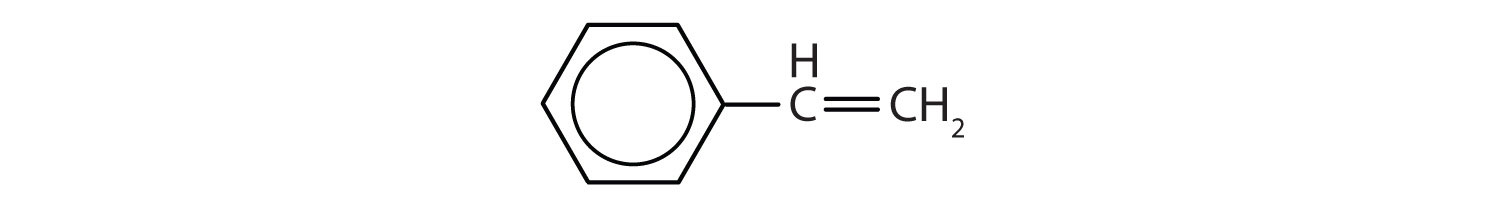
Aromatische Kohlenwasserstoffe sind dadurch definiert, dass sie 6-gliedrige Ringstrukturen mit alternierenden Doppelbindungen haben (Abb. 8.2).
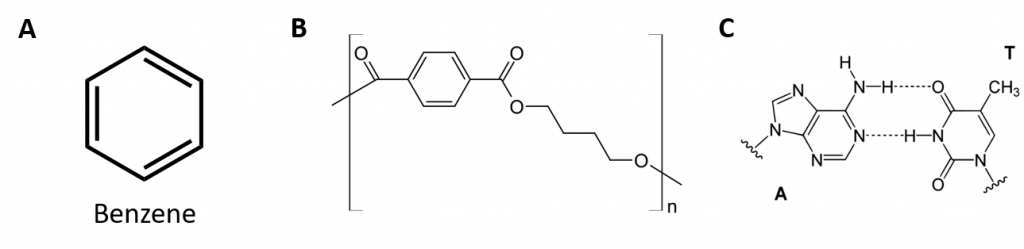
Abbildung 8.2: Aromatische Kohlenwasserstoffe. Aromatische Kohlenwasserstoffe enthalten die 6-gliedrige Benzolringstruktur (A), die durch alternierende Doppelbindungen gekennzeichnet ist. Ultradur, PBT ist ein Kunststoffpolymer, das eine aromatische funktionelle Gruppe enthält. Das sich wiederholende Monomer von Ultradur ist in (B) dargestellt. Ultradur findet sich in Duschköpfen, Zahnbürstenborsten, Kunststoffgehäusen für Glasfaserkabel und in Außen- und Innenkomponenten von Autos. Biologisch wichtige Moleküle wie die Desoxyribonukleinsäure (DNS) (C) enthalten ebenfalls eine aromatische Ringstruktur.
Sie haben daher Formeln, die als zyklische Alkene gezeichnet werden können, was sie ungesättigt macht. Aufgrund der zyklischen Struktur sind die Eigenschaften aromatischer Ringe jedoch in der Regel ganz anders, und sie verhalten sich nicht wie typische Alkene. Aromatische Verbindungen dienen als Grundlage für viele Arzneimittel, Antiseptika, Sprengstoffe, Lösungsmittel und Kunststoffe (z. B. Polyester und Polystyrol).
Die beiden einfachsten ungesättigten Verbindungen – Ethylen (Ethen) und Acetylen (Ethin) – wurden früher als Anästhetika verwendet und 1924 in der Medizin eingeführt. Es stellte sich jedoch heraus, dass Acetylen mit Luft explosive Gemische bildet, so dass seine medizinische Verwendung 1925 aufgegeben wurde. Ethylen galt als sicherer, doch auch es war in zahlreiche tödliche Brände und Explosionen während der Anästhesie verwickelt. Dennoch blieb es bis in die 1960er Jahre ein wichtiges Anästhetikum, bis es durch nicht brennbare Anästhetika wie Halothan (CHBrClCF3) ersetzt wurde.
- (Zurück zum Anfang)
- 8.1 Überblick über Alkene und Alkine
- (Zurück zum Anfang)
- 8.2 Eigenschaften von Alkenen
- Looking Closer: Hinweis zur Umwelt
- Konzeptüberprüfungsübungen
- Antworten
- Key Takeaway
- Übungen
- Antwort
- Konzeptüberprüfungsübungen
- Antworten
- Key Takeaway
- 8.3 Alkine
- Anmerkung
- Übungen zur Überprüfung des Konzepts
- Key Takeaway
- Übungen
- (Zurück zum Anfang)
- 8.4 Aromatische Verbindungen: Benzol
- Anmerkung
- Für Ihre Gesundheit: Benzol und wir
- Concept Review Exercises
- Erkennen von aromatischen Verbindungen
- Skill-Building Exercise
- Key Takeaway
- (Zurück zum Anfang)
- Polyzyklische aromatische Kohlenwasserstoffe
- Für Ihre Gesundheit: Polyzyklische aromatische Kohlenwasserstoffe und Krebs
- Biologisch wichtige Verbindungen mit Benzolringen
- Anmerkung
- 8.5 Geometrische Isomere
- Klicken Sie hier für ein Video-Tutorial der Kahn Academy über die Struktur von Alken.
- Cis-Trans-Nomenklatur
- Klicken Sie hier für ein Video-Tutorial der Kahn Academy über Cis/Trans-Isomerisierung
- Zu Ihrer Gesundheit
- Klicken Sie hier für ein Video-Tutorial der Kahn Academy über gesättigte, ungesättigte und Transfette
- Schlüsselfaktoren für die Bestimmung der Cis/Trans-Isomerisierung
- Arbeitsbeispiel
- Skill-Building Exercise
- Konzeptübersichtsübungen
- Antworten
- Key Takeaway
- (Zurück zum Anfang)
- E-Z Nomenklatur
- Klicken Sie hier für ein Video-Tutorial der Kahn Academy zur E/Z-Isomerisierung.
- (Zurück zum Anfang)
(Zurück zum Anfang)
8.1 Überblick über Alkene und Alkine
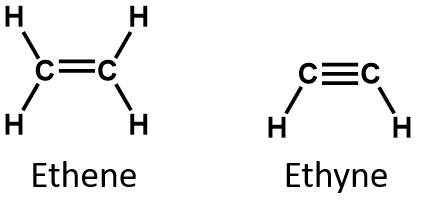
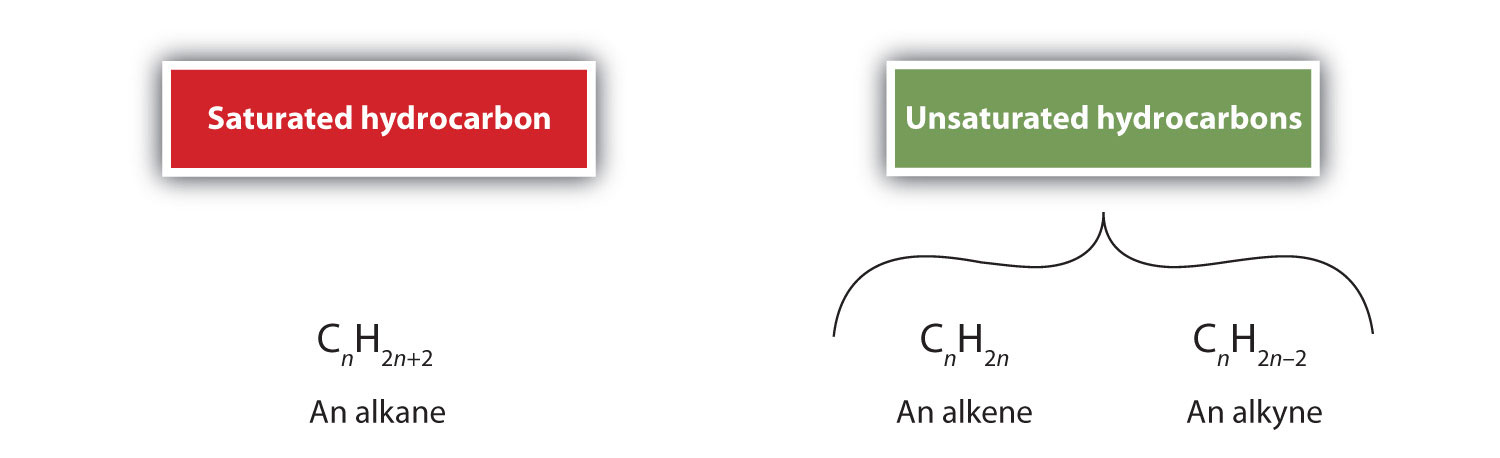
Alkene sind per Definition Kohlenwasserstoffe mit einer oder mehreren Kohlenstoff-Kohlenstoff-Doppelbindungen (R2C=CR2), während Alkine Kohlenwasserstoffe mit einer oder mehreren Kohlenstoff-Kohlenstoff-Dreifachbindungen (R-C≡C-R) sind. Zusammen werden sie als ungesättigte Kohlenwasserstoffe bezeichnet, die eine oder mehrere Mehrfachbindungen (Doppel- oder Dreifachbindungen) zwischen Kohlenstoffatomen aufweisen. Aufgrund der Doppel- oder Dreifachbindung haben Alkene und Alkine weniger Wasserstoffatome als vergleichbare Alkane mit der gleichen Anzahl von Kohlenstoffatomen. Mathematisch kann dies durch die folgenden allgemeinen Formeln dargestellt werden:
In einem Alken wird die Doppelbindung von den beiden Kohlenstoffatomen geteilt und betrifft nicht die Wasserstoffatome, obwohl die kondensierte Formel diesen Punkt nicht offensichtlich macht, d.h. die kondensierte Formel für Ethen ist CH2CH2. Die Art der Doppel- oder Dreifachbindung eines Moleküls ist anhand der Molekülformeln noch schwieriger zu erkennen. Beachten Sie, dass die Summenformel für Ethen C2H4 lautet, während die für Ethin C2H2 ist. Bis Sie mit der Sprache der organischen Chemie vertrauter sind, ist es daher oft am nützlichsten, lineare oder teilweise kondensierte Strukturen zu zeichnen, wie unten gezeigt:
(Zurück zum Anfang)
8.2 Eigenschaften von Alkenen
Die physikalischen Eigenschaften von Alkenen ähneln denen von Alkanen. Tabelle 8.1 zeigt, dass die Siedepunkte der geradkettigen Alkene wie bei den Alkanen mit zunehmender Molmasse ansteigen. Bei Molekülen mit der gleichen Anzahl von Kohlenstoffatomen und der gleichen allgemeinen Form unterscheiden sich die Siedepunkte in der Regel nur geringfügig, so wie man es bei Stoffen erwarten würde, deren molare Masse sich nur um 2 u (entspricht zwei Wasserstoffatomen) unterscheidet. Wie andere Kohlenwasserstoffe sind die Alkene unlöslich in Wasser, aber löslich in organischen Lösungsmitteln.
Einige repräsentative Alkene – ihre Namen, Strukturen und physikalischen Eigenschaften – sind in Tabelle 8.1 aufgeführt.
Tabelle 8.1 Physikalische Eigenschaften einiger ausgewählter Alkene
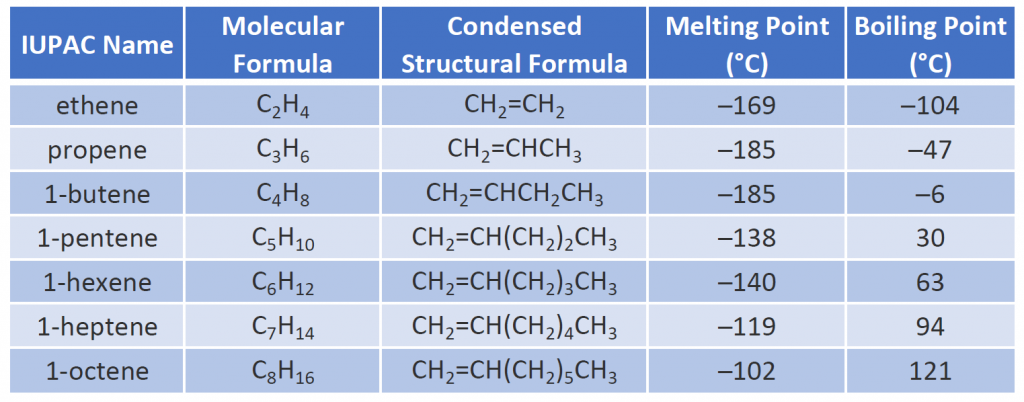
Die ersten beiden Alkene in Tabelle 8.1 – Ethen und Propen – werden am häufigsten mit ihren gebräuchlichen Namen – Ethylen bzw. Propylen – bezeichnet. Ethylen ist eine wichtige Handelschemikalie. Die chemische Industrie in den USA stellt jährlich etwa 25 Milliarden Kilogramm Ethylen her, mehr als jede andere synthetische organische Chemikalie. Mehr als die Hälfte dieses Ethylens wird für die Herstellung von Polyethylen verwendet, einem der bekanntesten Kunststoffe. Propylen ist ebenfalls eine wichtige Industriechemikalie. Es wird zu Kunststoffen, Isopropylalkohol und einer Vielzahl anderer Produkte verarbeitet.
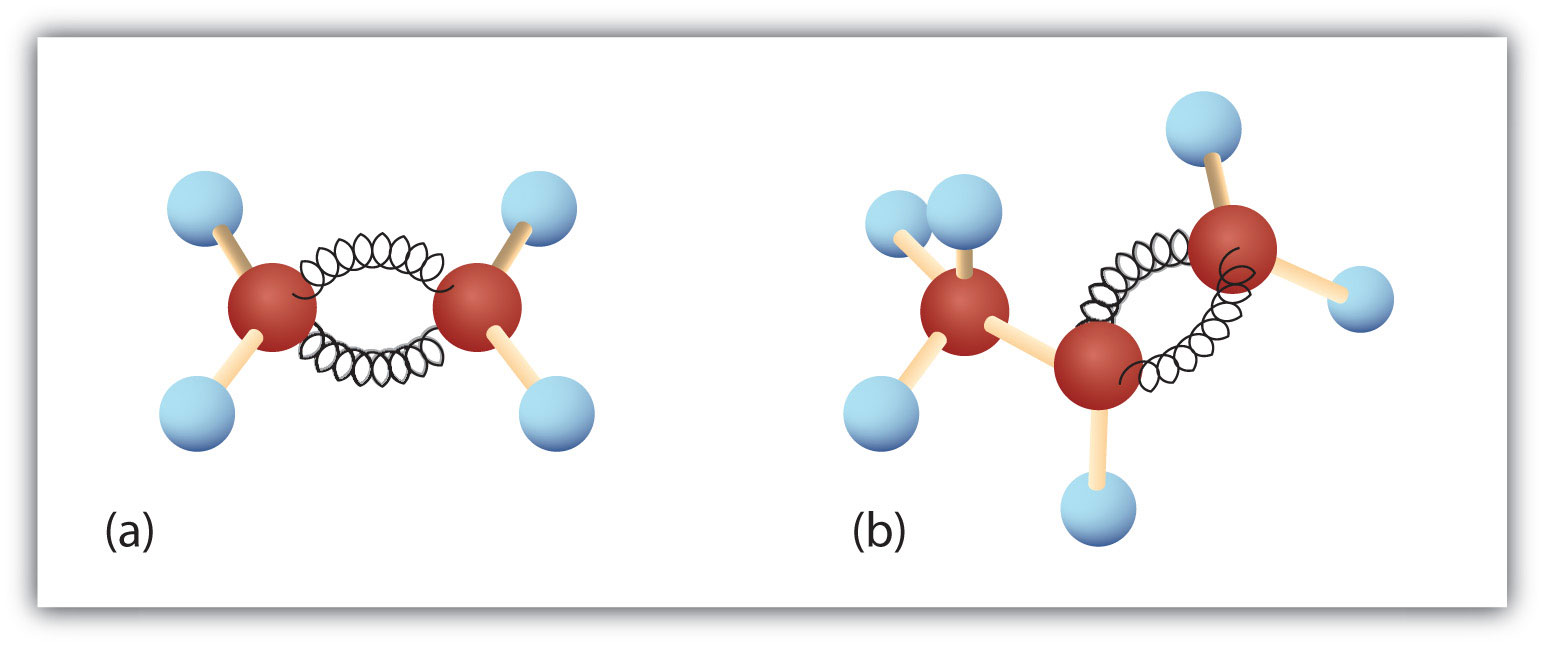
Abbildung 8.3. Ethen und Propen. Die Kugel-Feder-Modelle von Ethen/Ethylen (a) und Propen/Propylen (b) zeigen ihre jeweiligen Formen, insbesondere die Bindungswinkel.
Looking Closer: Hinweis zur Umwelt
Alkene kommen in der Natur häufig vor. Reifendes Obst und Gemüse gibt Ethylen ab, das die weitere Reifung auslöst. Obstverarbeiter setzen Ethylen künstlich ein, um den Reifungsprozess zu beschleunigen; schon 0,1 mg Ethylen für 24 Stunden können 1 kg Tomaten reifen lassen. Leider entspricht dieses Verfahren nicht genau dem Reifungsprozess, und Tomaten, die grün gepflückt und auf diese Weise behandelt werden, schmecken nicht so sehr wie weinreife Tomaten frisch aus dem Garten.
Andere Alkene, die in der Natur vorkommen, sind 1-Octen, ein Bestandteil von Zitronenöl, und Octadecen (C18H36), das in Fischleber vorkommt. Diene (zwei Doppelbindungen) und Polyene (drei oder mehr Doppelbindungen) sind ebenfalls häufig. Butadien (CH2=CHCH=CH2) ist im Kaffee enthalten. Lycopin und die Carotine sind isomere Polyene (C40H56), die Wassermelonen, Tomaten, Karotten und anderen Früchten und Gemüsen ihre attraktive rote, orange und gelbe Farbe verleihen. Vitamin A, das für eine gute Sehkraft unerlässlich ist, wird aus einem Karotin gewonnen. Ohne Alkene wäre die Welt viel weniger farbenfroh.

Abbildung 8.4 Die leuchtend rote Farbe der Tomate ist auf Lycopin zurückzuführen.
Foto von: © Thinkstock; Lycopinstruktur von: Jeff Dahl
Konzeptüberprüfungsübungen
-
Beschreiben Sie kurz die physikalischen Eigenschaften von Alkenen. Wie lassen sich diese Eigenschaften mit denen der Alkane vergleichen?
-
Reihen Sie die folgenden Alkene in der Reihenfolge ihres aufsteigenden Siedepunkts an, ohne Tabellen zu Rate zu ziehen:

Antworten
-
Alkene haben ganz ähnliche physikalische Eigenschaften (niedrige Siedepunkte, unlöslich in Wasser) wie die entsprechenden Alkane.
-
Ethen < Propen < 1-Buten < 1-Hexen
Key Takeaway
- Die physikalischen Eigenschaften von Alkenen sind denen der Alkane sehr ähnlich: Ihre Siedepunkte steigen mit zunehmender Molmasse, und sie sind unlöslich in Wasser.
Übungen
-
Bestimmen Sie ohne Bezugnahme auf eine Tabelle oder eine andere Referenz, welches Mitglied jedes Paares den höheren Siedepunkt hat.
- 1-Penten oder 1-Buten
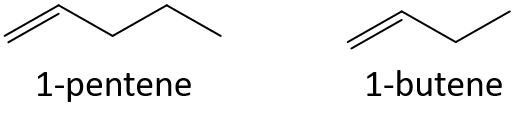
- 3-Hepten oder 3-Nonen
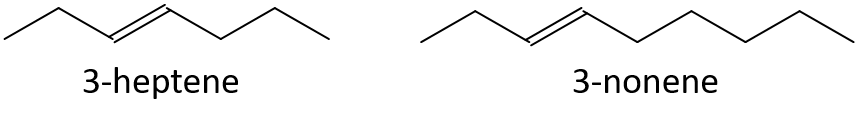
- 1-Penten oder 1-Buten
-
Welches ist ein gutes Lösungsmittel für Cyclohexen: Pentan oder Wasser?
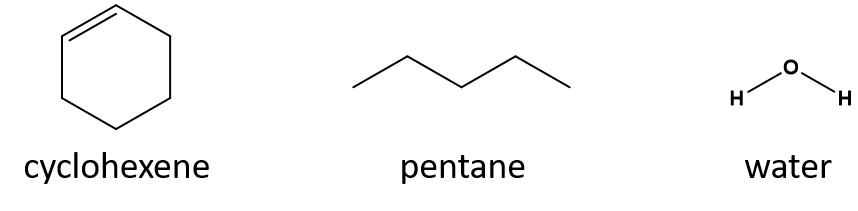
Antwort
-
- 1-Penten
- 3-Nonen
Konzeptüberprüfungsübungen
-
Nennen Sie kurz die wichtigen Unterschiede zwischen einem gesättigten Kohlenwasserstoff und einem ungesättigten Kohlenwasserstoff.
-
Nenne kurz die wichtigen Unterschiede zwischen einem Alken und einem Alkan.
-
Klassifiziere jede Verbindung als gesättigt oder ungesättigt. Identifiziere jede Verbindung als ein Alkan, ein Alken oder ein Alkin.
-
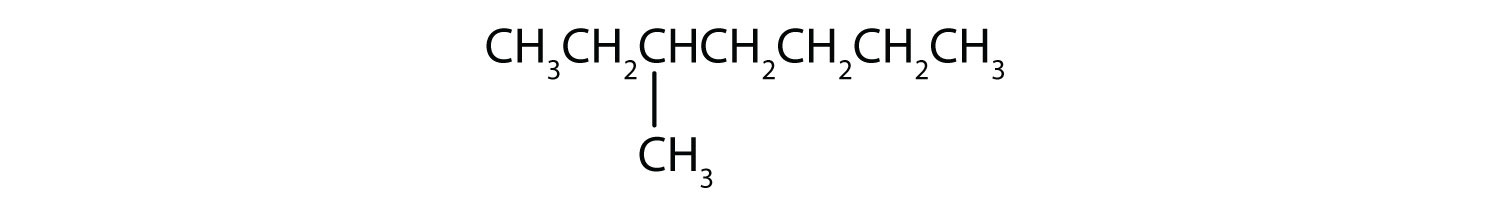
- CH3CH2C≡CCH3
-

-
Antworten
-
Ungesättigte Kohlenwasserstoffe haben Doppel- oder Dreifachbindungen und sind sehr reaktiv; Gesättigte Kohlenwasserstoffe haben nur Einfachbindungen und sind eher nicht reaktiv.
-
Ein Alken hat eine Doppelbindung; ein Alkan hat nur Einfachbindungen.
-
- gesättigt; Alkan
- ungesättigt; Alkin
- ungesättigt; Alken
Key Takeaway
- Alkene sind Kohlenwasserstoffe mit einer Kohlenstoff-zu-Kohlenstoff Doppelbindung.
8.3 Alkine
Das einfachste Alkin – ein Kohlenwasserstoff mit einer Kohlenstoff-Kohlenstoff-Dreifachbindung – hat die Summenformel C2H2 und ist unter seinem gebräuchlichen Namen Acetylen bekannt (Abb. 8.5). Seine Struktur ist H-C≡C-H.
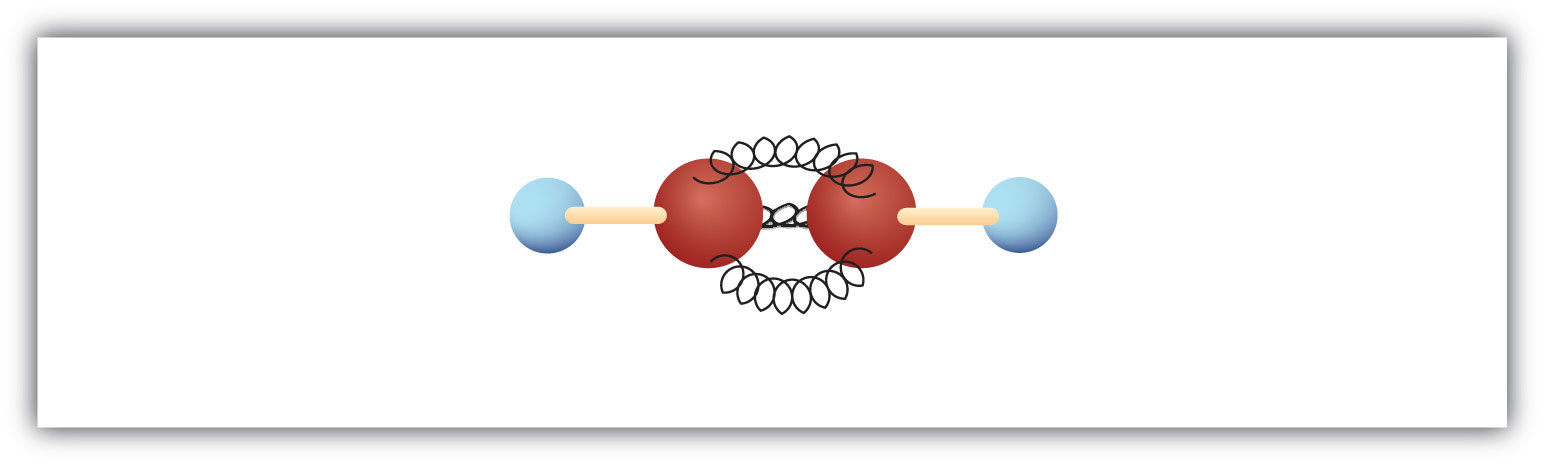
Abbildung 8.5 Kugel-Feder-Modell von Acetylen. Acetylen (Ethin) ist das einfachste Mitglied der Alkinfamilie.
Anmerkung
Acetylen wird in Autogenbrennern zum Schneiden und Schweißen von Metallen verwendet. Die Flamme eines solchen Brenners kann sehr heiß sein. Der größte Teil des Acetylens wird jedoch in chemische Zwischenprodukte umgewandelt, die zur Herstellung von Vinyl- und Acrylkunststoffen, Fasern, Harzen und einer Vielzahl anderer Produkte verwendet werden.
Alkine ähneln den Alkenen sowohl in ihren physikalischen als auch chemischen Eigenschaften. Zum Beispiel durchlaufen Alkine viele der typischen Additionsreaktionen von Alkenen. Die Namen der Internationalen Union für reine und angewandte Chemie (IUPAC) für Alkine entsprechen denen der Alkene, mit der Ausnahme, dass die Familienendung -yne statt -en lautet. Der IUPAC-Name für Acetylen ist Ethin. Die Namen anderer Alkine werden in den folgenden Übungen veranschaulicht.
Übungen zur Überprüfung des Konzepts
-
Nennen Sie kurz die wichtigsten Unterschiede zwischen einem Alken und einem Alkin. Inwiefern sind sie ähnlich?
-
Das Alken (CH3)2CHCH2CH=CH2 wird 4-Methyl-1-penten genannt. Wie heißt (CH3)2CHCH2C≡CH?
-
Zeigen Alkine cis-trans-Isomerie? Erklären Sie.
Antworten
-
Alkene haben Doppelbindungen, Alkine haben Dreifachbindungen. Beide unterliegen Additionsreaktionen.
-
4-Methyl-1-pentin
-
Nein; ein dreifach gebundenes Kohlenstoffatom kann nur eine weitere Bindung bilden. Es müsste zwei Gruppen haben, um cis-trans-Isomerie zu zeigen.
Key Takeaway
- Alkine sind Kohlenwasserstoffe mit Kohlenstoff-Kohlenstoff-Dreifachbindungen und ähnlichen Eigenschaften wie Alkene.
Übungen
-
Zeichne die Struktur für jede Verbindung.
- Acetylen
- 3-Methyl-1-hexyne
-
Zeichne die Struktur für jede Verbindung.
- 4-Methyl-2-hexyne
- 3-Octyne
-
Benenne jedes Alkin.
- CH3CH2CH2C≡CH
- CH3CH2CH2C≡CCH3
Antworten
-
- H-C≡C-H
-
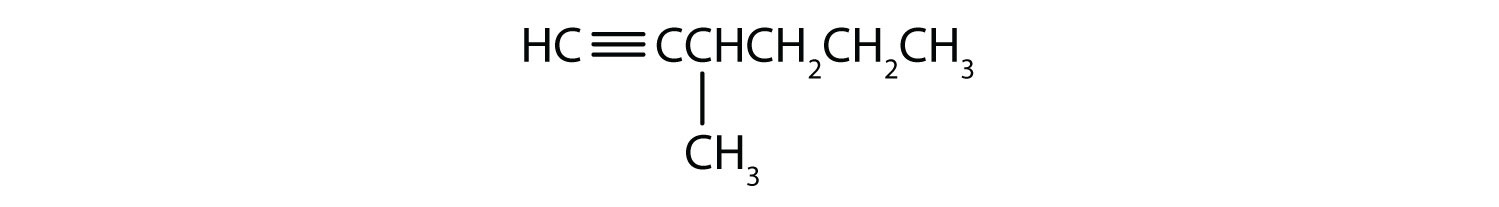
-
- 1-Pentyne
- 2-Hexyn
(Zurück zum Anfang)
8.4 Aromatische Verbindungen: Benzol
Als Nächstes betrachten wir eine Klasse von Kohlenwasserstoffen, deren Molekülformeln denen der ungesättigten Kohlenwasserstoffe ähneln, die aber im Gegensatz zu den Alkenen nicht ohne weiteres Additionsreaktionen eingehen. Diese Verbindungen bilden eine eigene Klasse, die aromatischen Kohlenwasserstoffe. Die einfachste aromatische Verbindung ist Benzol (C6H6), das von großer wirtschaftlicher Bedeutung ist, aber auch bemerkenswerte gesundheitsschädliche Auswirkungen hat (siehe „Für Ihre Gesundheit: Benzol und wir“).
Die Formel C6H6 scheint darauf hinzuweisen, dass Benzol einen hohen Grad an Ungesättigtheit aufweist. (Hexan, der gesättigte Kohlenwasserstoff mit sechs Kohlenstoffatomen, hat die Formel C6H14 – acht Wasserstoffatome mehr als Benzol.) Trotz des scheinbar geringen Sättigungsgrades ist Benzol jedoch ziemlich unreaktiv. Das liegt an der Resonanzstruktur, die sich aus der alternierenden Doppelbindungsstruktur des aromatischen Rings ergibt.

Anmerkung
Benzol ist eine Flüssigkeit, die nach Benzin riecht, bei 80°C siedet und bei 5,5°C gefriert. Es ist der aromatische Kohlenwasserstoff, der am meisten produziert wird. Früher wurde es zur Entkoffeinierung von Kaffee verwendet und war ein wichtiger Bestandteil vieler Konsumgüter, wie z. B. Abbeizmittel, Gummiklebstoffe und Fleckenentferner für die chemische Reinigung. In den 1950er Jahren wurde Benzol aus vielen Produktformulierungen gestrichen, aber in anderen Produkten wurde Benzol bis in die 1970er Jahre weiter verwendet, als es mit Todesfällen durch Leukämie in Verbindung gebracht wurde. Benzol ist in der Industrie nach wie vor ein wichtiges Ausgangsmaterial für die Herstellung von Kunststoffen (wie Styropor und Nylon), Arzneimitteln, Reinigungsmitteln, synthetischem Kautschuk, Pestiziden und Farbstoffen. Es wird als Lösungsmittel verwendet, z. B. zur Reinigung und Wartung von Druckmaschinen und für Klebstoffe, die z. B. für die Befestigung von Schuhsohlen verwendet werden. Benzol ist ein natürlicher Bestandteil von Erdölprodukten, aber da es ein bekanntes Karzinogen ist, wird seine Verwendung als Zusatzstoff in Benzin jetzt eingeschränkt.
Für Ihre Gesundheit: Benzol und wir
Der größte Teil des kommerziell verwendeten Benzols stammt aus Erdöl. Es wird als Ausgangsstoff für die Herstellung von Waschmitteln, Medikamenten, Farbstoffen, Insektiziden und Kunststoffen verwendet. Einst als organisches Lösungsmittel weit verbreitet, ist heute bekannt, dass Benzol sowohl kurz- als auch langfristig toxische Wirkungen hat. Das Einatmen hoher Konzentrationen kann zu Übelkeit und sogar zum Tod durch Atem- oder Herzversagen führen, während wiederholte Exposition zu einer fortschreitenden Krankheit führt, bei der die Fähigkeit des Knochenmarks, neue Blutzellen zu bilden, schließlich zerstört wird. Dies führt zu einer aplastischen Anämie, bei der die Zahl der roten und weißen Blutkörperchen abnimmt.
Concept Review Exercises
-
Wie unterscheiden sich die typischen Reaktionen von Benzol von denen der Alkene?
-
Beschreiben Sie kurz die Bindungen in Benzol.
-
Was bedeutet der Kreis in der chemischen Darstellung von Benzol?
Antworten
-
Benzol ist im Vergleich zu einem Alken eher unreaktiv gegenüber Additionsreaktionen.
-
Die Valenzelektronen werden von allen sechs Kohlenstoffatomen gleichmäßig geteilt (das heißt, die Elektronen sind delokalisiert).
-
Die sechs Elektronen werden von allen sechs Kohlenstoffatomen gleichmäßig geteilt.
Erkennen von aromatischen Verbindungen
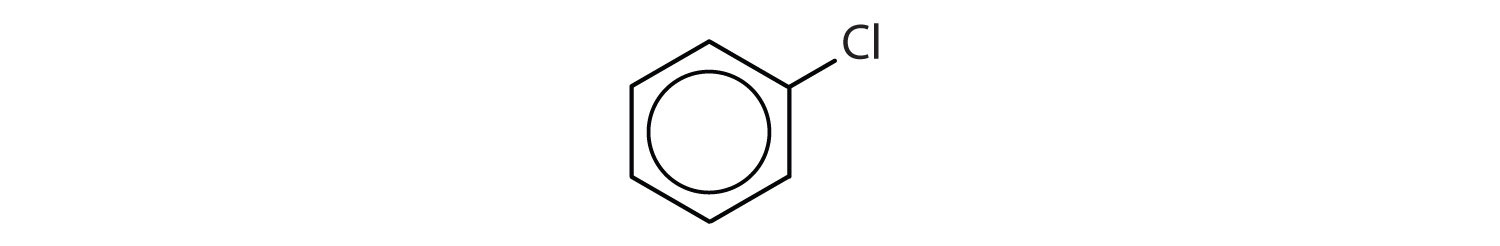
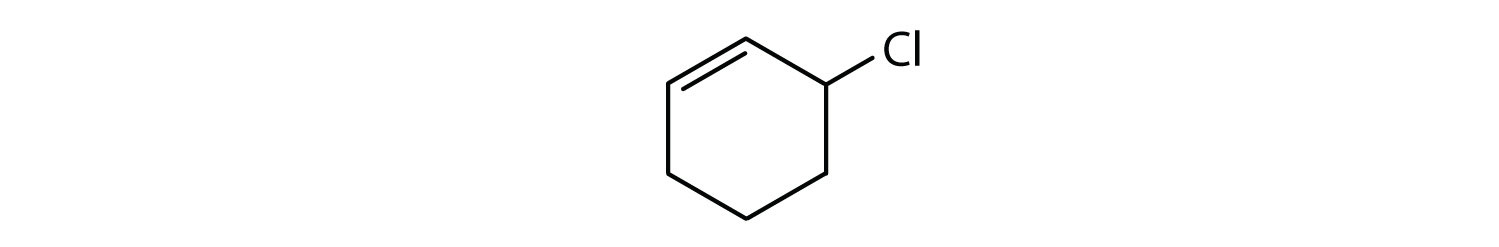
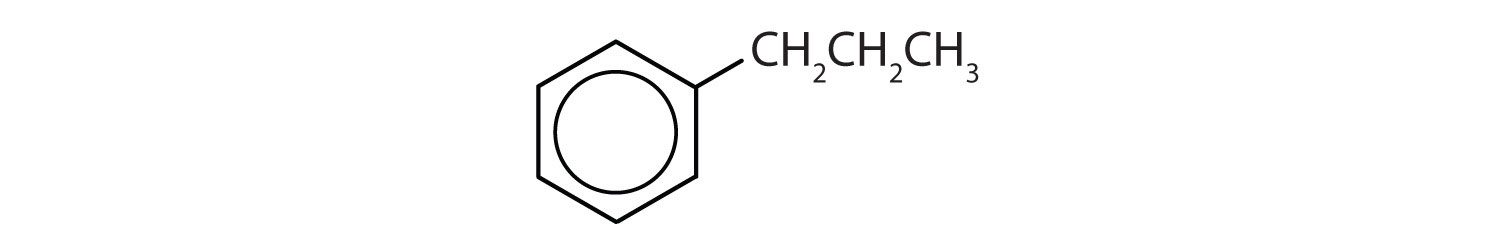
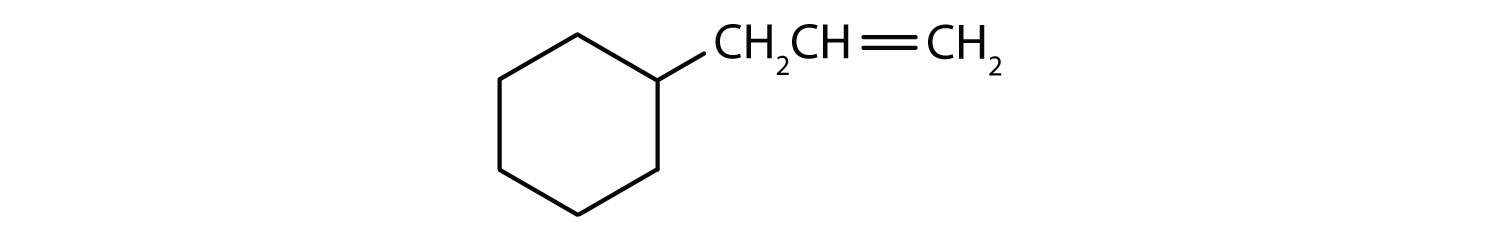
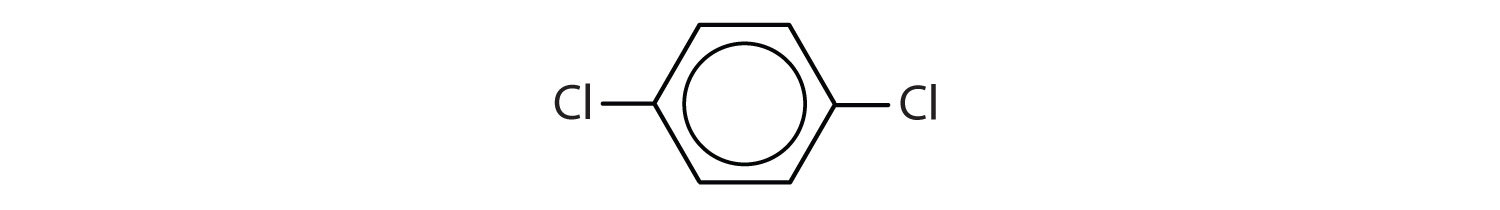
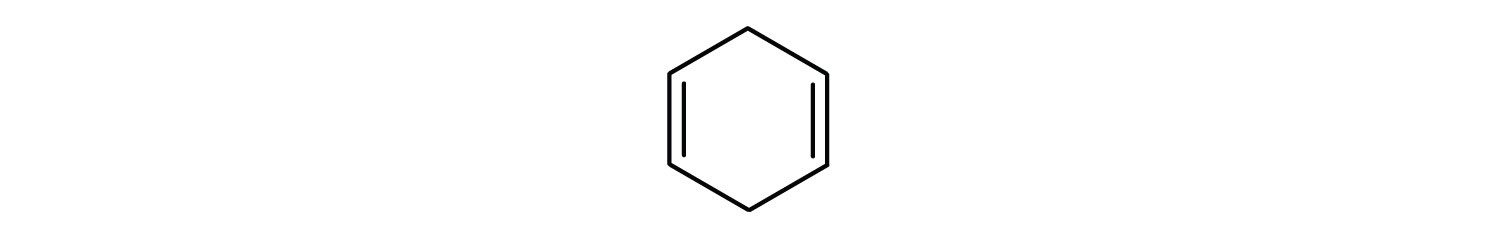
Welche Verbindungen sind aromatisch?
Lösung
- Die Verbindung hat einen Benzolring (mit einem Chloratom als Ersatz für eines der Wasserstoffatome); Sie ist aromatisch.
- Die Verbindung ist cyclisch, hat aber keinen Benzolring; sie ist nicht aromatisch.
- Die Verbindung hat einen Benzolring (mit einer Propylgruppe als Ersatz für eines der Wasserstoffatome); sie ist aromatisch.
- Die Verbindung ist cyclisch, hat aber keinen Benzolring; sie ist nicht aromatisch.
Skill-Building Exercise
Welche Verbindungen sind aromatisch?
Im System der International Union of Pure and Applied Chemistry (IUPAC) werden aromatische Kohlenwasserstoffe als Derivate des Benzols bezeichnet. Nachstehend sind fünf Beispiele aufgeführt. Bei diesen Strukturen ist es unerheblich, ob der einzelne Substituent am oberen, seitlichen oder unteren Ende des Rings steht: Ein Sechseck ist symmetrisch, und daher sind alle Positionen gleichwertig.
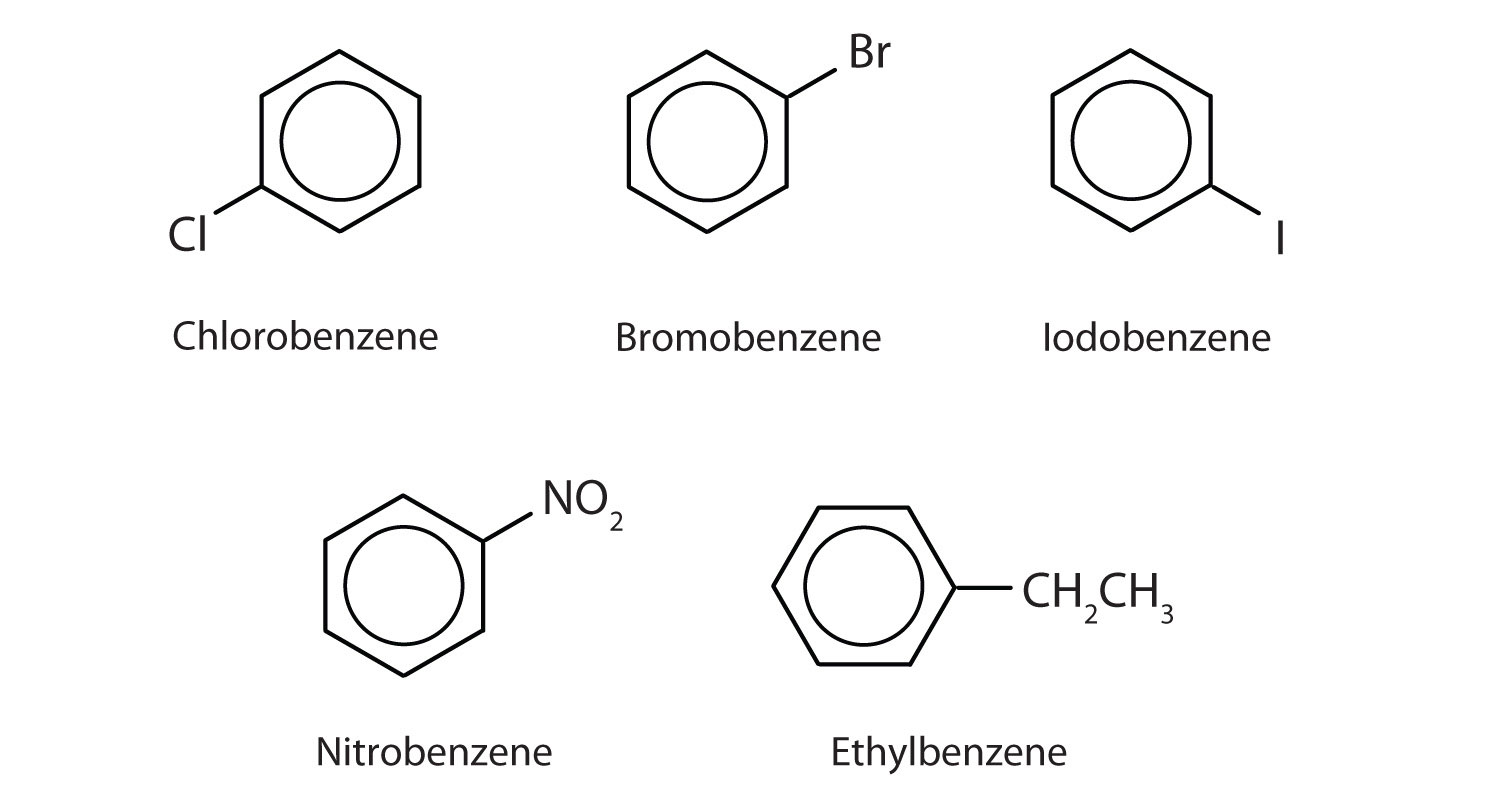
Diese Verbindungen werden in der üblichen Weise benannt, wobei die Gruppe, die ein Wasserstoffatom ersetzt, als Substituentengruppe bezeichnet wird: Cl als Chlor, Br als Brom, I als Iod, NO2 als Nitro und CH3CH2 als Ethyl.
Obwohl einige Verbindungen ausschließlich mit IUPAC-Namen bezeichnet werden, werden einige häufiger mit gebräuchlichen Namen benannt, wie im Folgenden angegeben.
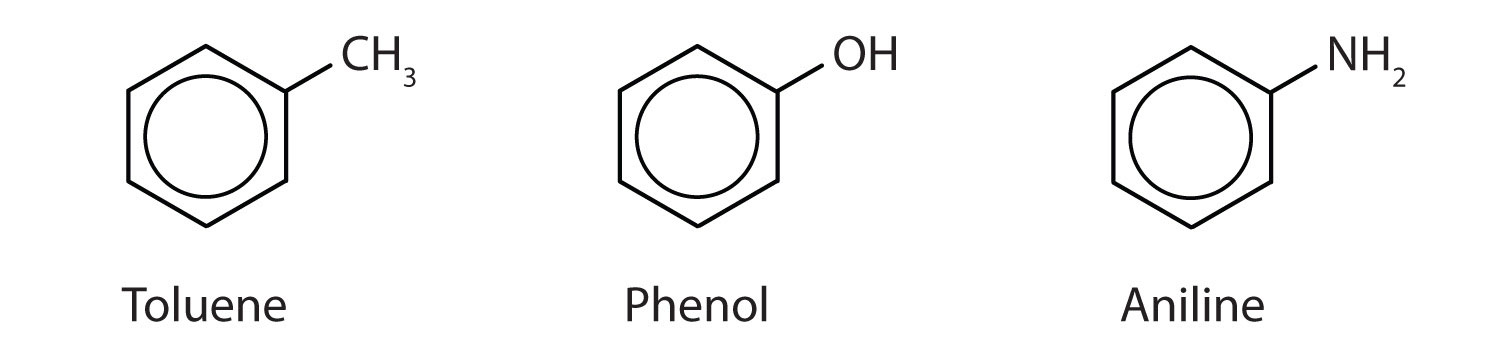
-
Key Takeaway
- Aromatische Kohlenwasserstoffe scheinen ungesättigt zu sein, aber sie haben eine besondere Art von Bindungen und gehen keine Additionsreaktionen ein.
(Zurück zum Anfang)
Polyzyklische aromatische Kohlenwasserstoffe
Einige gebräuchliche aromatische Kohlenwasserstoffe bestehen aus kondensierten Benzolringen – Ringen, die eine gemeinsame Seite haben. Diese Verbindungen werden als polyzyklische aromatische Kohlenwasserstoffe (PAK) bezeichnet. Ein aromatischer Kohlenwasserstoff, der aus verschmolzenen Benzolringen besteht, die sich eine gemeinsame Seite teilen…
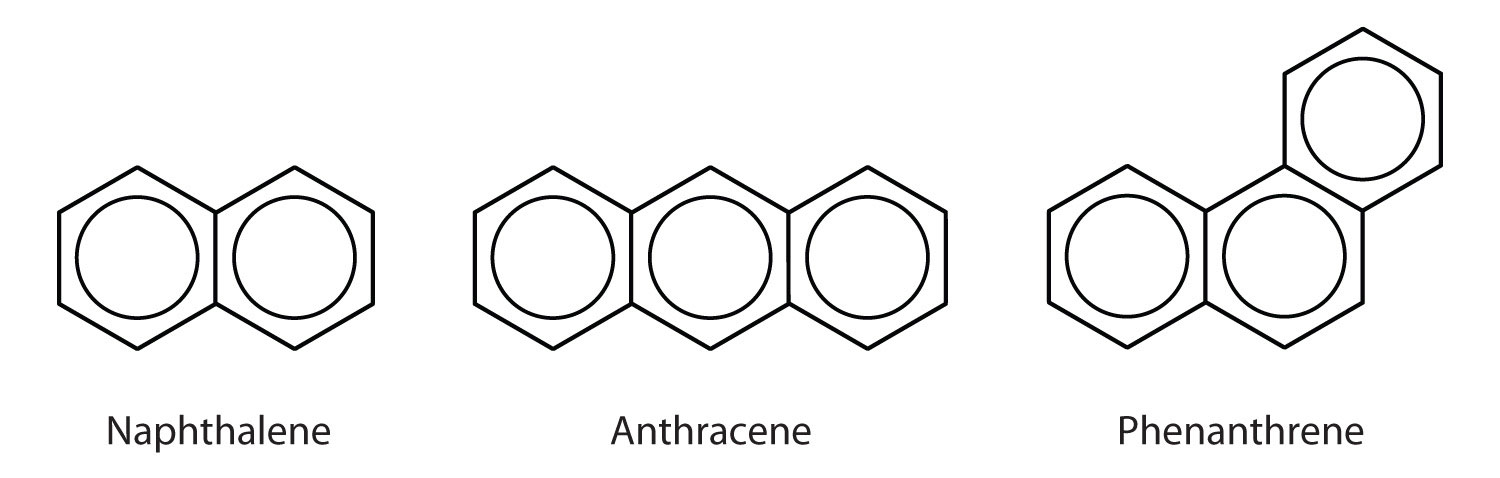
Die drei hier gezeigten Beispiele sind farblose, kristalline Feststoffe, die im Allgemeinen aus Kohlenteer gewonnen werden. Naphthalin hat einen stechenden Geruch und wird in Mottenkugeln verwendet. Anthracen wird für die Herstellung bestimmter Farbstoffe verwendet. Steroide, einschließlich Cholesterin und die Hormone Östrogen und Testosteron, enthalten die Phenanthrenstruktur.
Für Ihre Gesundheit: Polyzyklische aromatische Kohlenwasserstoffe und Krebs
Die für die Destillation von Steinkohlenteer erforderliche starke Erhitzung führt zur Bildung von PAK. Seit vielen Jahren ist bekannt, dass Arbeiter in Steinkohlenteerraffinerien anfällig für eine Art von Hautkrebs sind, der als Teerkrebs bekannt ist. Untersuchungen haben gezeigt, dass eine Reihe von PAK krebserregend sind. Eine der aktivsten krebserregenden Verbindungen, Benzopyren, kommt in Steinkohlenteer vor und wurde auch aus Zigarettenrauch, Marihuanarauch, Autoabgasen und auf Holzkohle gegrillten Steaks isoliert. Schätzungen zufolge werden in den Vereinigten Staaten jedes Jahr mehr als 1.000 Tonnen Benzpyren in die Luft emittiert. Nur wenige Milligramm Benzpyren pro Kilogramm Körpergewicht sind erforderlich, um bei Versuchstieren Krebs auszulösen.
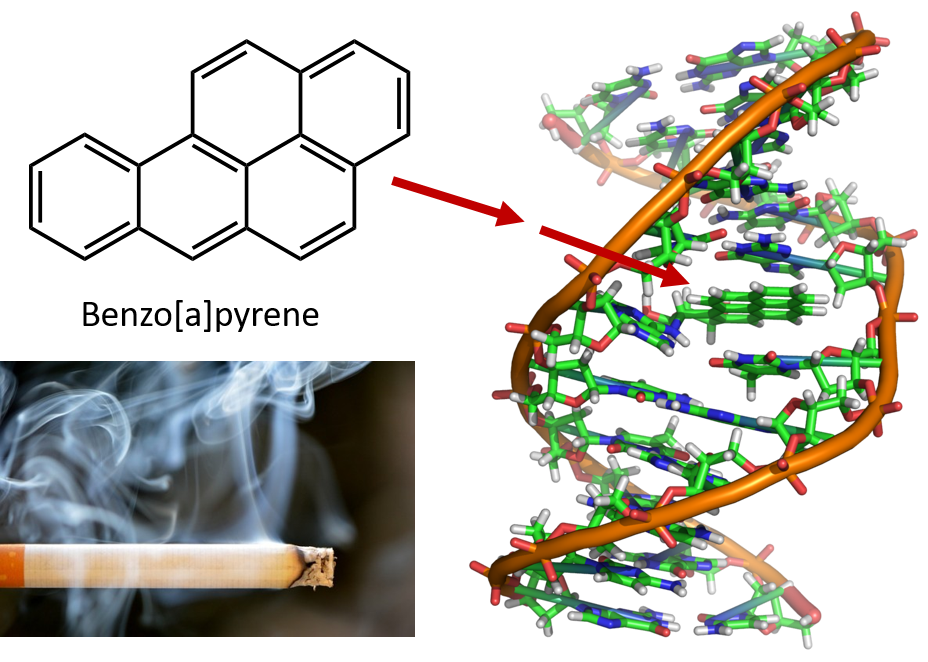
Abbildung 8.6 Benzpyren ist ein polyzyklischer aromatischer Kohlenwasserstoff, der als Nebenprodukt in Steinkohlenteer, Zigaretten- und Marihuanarauch sowie in gegrillten Steaks entsteht. Benzopyren wird zu biologisch aktiven Verbindungen abgebaut, die physikalische Addukte an DNA-Moleküle bilden können. Diese Addukte können genetische Mutationen verursachen, die zu Krebs führen.
Foto von Zigarettenrauch
Biologisch wichtige Verbindungen mit Benzolringen
Stoffe, die den Benzolring enthalten, kommen sowohl in Tieren als auch in Pflanzen vor, obwohl sie in letzteren häufiger vorkommen. Pflanzen können den Benzolring aus Kohlendioxid, Wasser und anorganischen Stoffen synthetisieren. Tiere können ihn nicht synthetisieren, aber sie sind zum Überleben auf bestimmte aromatische Verbindungen angewiesen und müssen sie daher mit der Nahrung aufnehmen. Phenylalanin, Tyrosin und Tryptophan (essentielle Aminosäuren) sowie die Vitamine K, B2 (Riboflavin) und B9 (Folsäure) enthalten alle den Benzolring. Viele wichtige Arzneimittel, von denen einige in Tabelle 8.2 aufgeführt sind, weisen ebenfalls einen Benzolring auf.
Anmerkung
Bislang haben wir nur aromatische Verbindungen mit kohlenstoffhaltigen Ringen untersucht. Viele zyklische Verbindungen haben jedoch ein anderes Element als Kohlenstoffatome im Ring. Organische Ringstrukturen, die ein anderes Atom als Kohlenstoff enthalten, nennt man heterozyklische Verbindungen.., Heterozyklische aromatische Verbindungen haben auch einzigartige und medizinisch relevante Eigenschaften.
Tabelle 8.2 Einige Wirkstoffe, die einen Benzolring enthalten
| Name | Struktur |
|---|---|
| Aspirin |
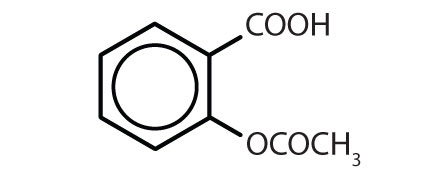 |
| Acetaminophen |
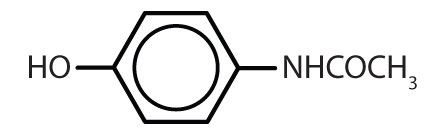 |
| Buprofen |
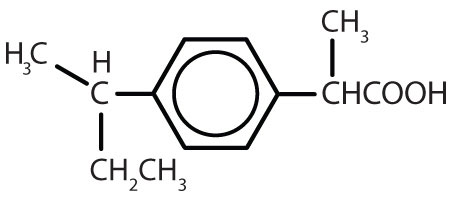 |
| Amphetamin |
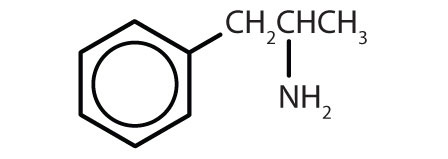 |
| Sulfanilamid |
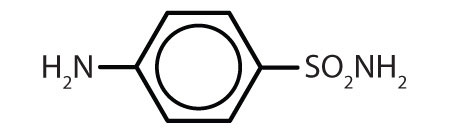 |
8.5 Geometrische Isomere
In der Struktur der Alkane gibt es eine freie Rotation um die Kohlenstoff-Kohlenstoff-Einfachbindungen (C-C). Im Gegensatz dazu erfordert die Struktur von Alkenen, dass die Kohlenstoffatome eine Doppelbindung bilden. Doppelbindungen zwischen Elementen werden durch p-Orbitalschalen (auch pi-Orbitale genannt) gebildet. Diese Orbitalschalen haben die Form von Hanteln und nicht die von kreisförmigen Orbitalen wie bei Einfachbindungen. Dadurch wird die freie Drehung der Kohlenstoffatome um die Doppelbindung verhindert, da die Doppelbindung bei der Drehung brechen würde (Abbildung 8.7). Eine Einfachbindung ist also vergleichbar mit zwei Brettern, die mit einem Nagel zusammengenagelt sind. Die Bretter können sich frei um den einzelnen Nagel drehen. Eine Doppelverleimung hingegen entspricht zwei Brettern, die mit zwei Nägeln zusammengenagelt sind. Im ersten Fall kann man die Bretter verdrehen, während man sie im zweiten Fall nicht verdrehen kann.

Abbildung 8.7 Die Bildung von Doppelbindungen erfordert die Verwendung von pi-Bindungen. Damit Moleküle Doppelbindungen ausbilden können, müssen sich Elektronen überlappende pi-Orbitale zwischen den beiden Atomen teilen. Dies erfordert, dass die hantelförmigen Pi-Orbitale (links dargestellt) während der Bildung der Doppelbindung in einer festen Konformation bleiben. Dies ermöglicht die Bildung von Elektronenorbitalen, die von beiden Atomen gemeinsam genutzt werden können (rechts dargestellt). Eine Drehung um die Doppelbindung würde dazu führen, dass die pi-Orbitale falsch ausgerichtet werden und die Doppelbindung aufbrechen.
Diagramm bereitgestellt von: JoJanderivative work – Vladsinger (talk)
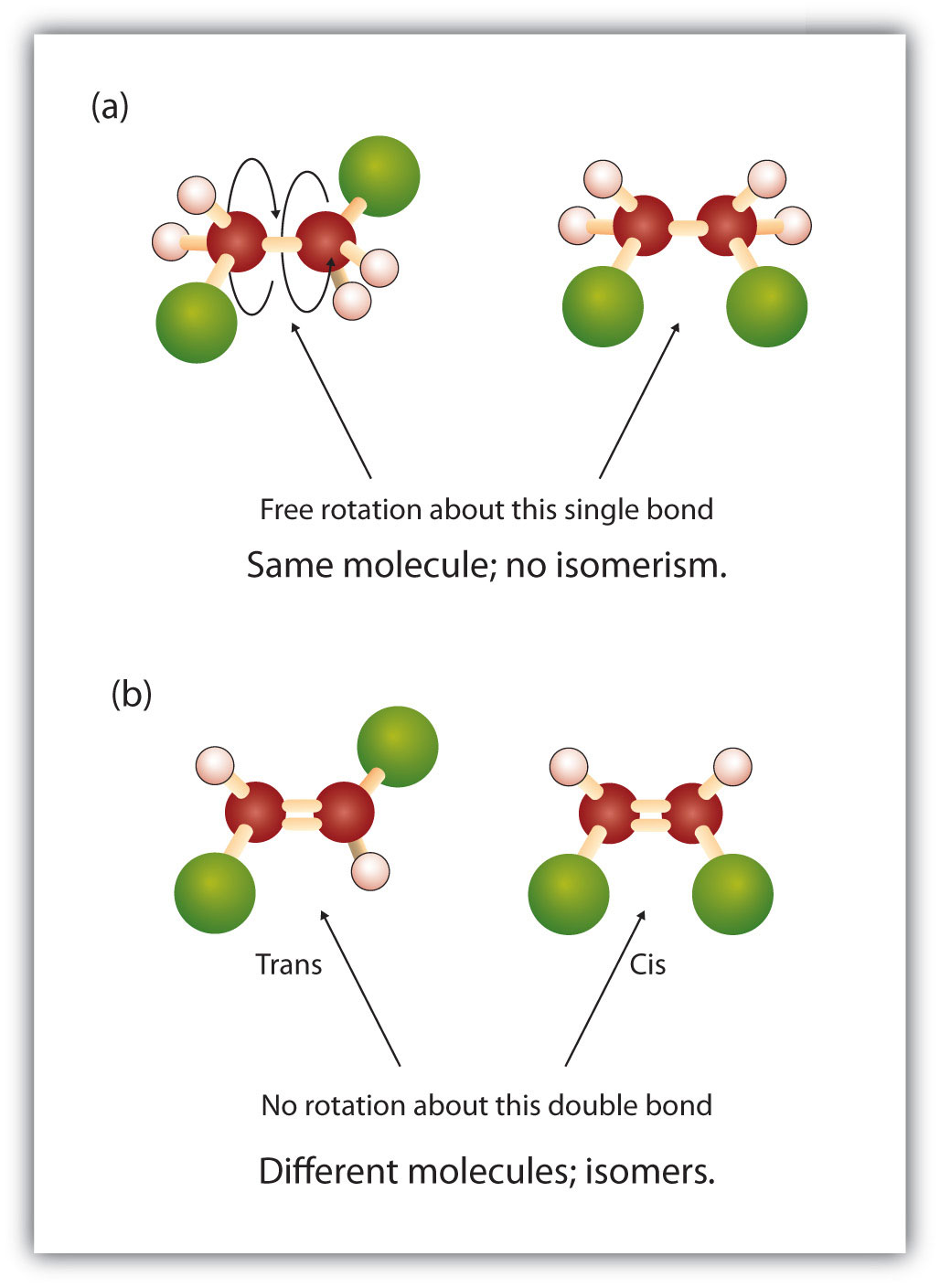
Die feste und starre Natur der Doppelbindung schafft die Möglichkeit eines zusätzlichen chiralen Zentrums und damit das Potenzial für Stereoisomere. Neue Stereoisomere bilden sich, wenn an jedem der an der Doppelbindung beteiligten Kohlenstoffe zwei verschiedene Atome oder Gruppen gebunden sind. Betrachten Sie zum Beispiel die beiden Chlorkohlenwasserstoffe in Abbildung 8.8. In der oberen Abbildung ist das halogenierte Alkan dargestellt. Eine Drehung um diese Kohlenstoff-Kohlenstoff-Bindung ist möglich und führt nicht zu unterschiedlichen Isomerkonformationen. Im unteren Diagramm ist die Drehung des halogenierten Alkens um die Doppelbindung eingeschränkt. Man beachte auch, dass jeder an der Doppelbindung beteiligte Kohlenstoff an zwei verschiedene Atome gebunden ist (ein Wasserstoff- und ein Chloratom). Daher können diese Moleküle zwei Stereoisomere bilden: eines, bei dem sich die beiden Chloratome auf derselben Seite der Doppelbindung befinden, und das andere, bei dem sich die Chloratome auf gegenüberliegenden Seiten der Doppelbindung befinden.
Abbildung 8.8 Alkendoppelbindungen können geometrische Isomere bilden. (a) Zeigt die freie Drehung um eine Kohlenstoff-Kohlenstoff-Einfachbindung in der Alkanstruktur. (b) Zeigt die feste Position der Kohlenstoff-Kohlenstoff-Doppelbindung, die zu geometrischen (räumlichen) Isomeren führt.
Klicken Sie hier für ein Video-Tutorial der Kahn Academy über die Struktur von Alken.
In diesem Abschnitt befassen wir uns nicht mit der Namensgebung, die auch in diesem Video-Tutorial enthalten ist.(Hinweis: Alle Inhalte der Khan Academy sind unter der CC-BY-NC-SA-Lizenz kostenlos verfügbar unter www.khanacademy.org )
Cis-Trans-Nomenklatur
Das cis-trans-Namenssystem kann verwendet werden, um einfache Isomere zu unterscheiden, bei denen an jedes Kohlenstoffatom der Doppelbindung eine Reihe identischer Gruppen gebunden ist. In Abbildung 8.8b zum Beispiel ist an jedes Kohlenstoffatom der Doppelbindung ein Chlor und ein Wasserstoffatom gebunden. Das cis- und trans-System gibt an, ob sich identische Gruppen auf der gleichen Seite (cis) der Doppelbindung oder auf der gegenüberliegenden Seite (trans) der Doppelbindung befinden. Befinden sich die Wasserstoffatome beispielsweise auf der gegenüberliegenden Seite der Doppelbindung, spricht man von der trans-Konformation der Bindung. Befinden sich die Wasserstoffatome auf der gleichen Seite der Doppelbindung, liegt die Bindung in der cis-Konformation vor. Man könnte auch sagen, dass sich das Molekül in der trans-Konformation befindet, wenn sich beide Chlorgruppen auf der gegenüberliegenden Seite der Doppelbindung befinden, oder dass sich das Molekül in der cis-Konformation befindet, wenn sie sich auf der gleichen Seite der Doppelbindung befinden.
Um festzustellen, ob ein Molekül cis- oder trans-konform ist, ist es hilfreich, eine gestrichelte Linie durch die Mitte der Doppelbindung zu ziehen und dann die identischen Gruppen einzukreisen, wie in Abbildung 8.9 gezeigt. Die beiden in Abbildung 8.9 gezeigten Moleküle werden als 1,2-Dichlorethen bezeichnet. Die cis- und trans-Bezeichnung definiert also nur die Stereochemie um die Doppelbindung, sie ändert nicht die Gesamtidentität des Moleküls. Allerdings haben cis- und trans-Isomere oft unterschiedliche physikalische und chemische Eigenschaften, was auf die feste Natur der Bindungen im Raum zurückzuführen ist.
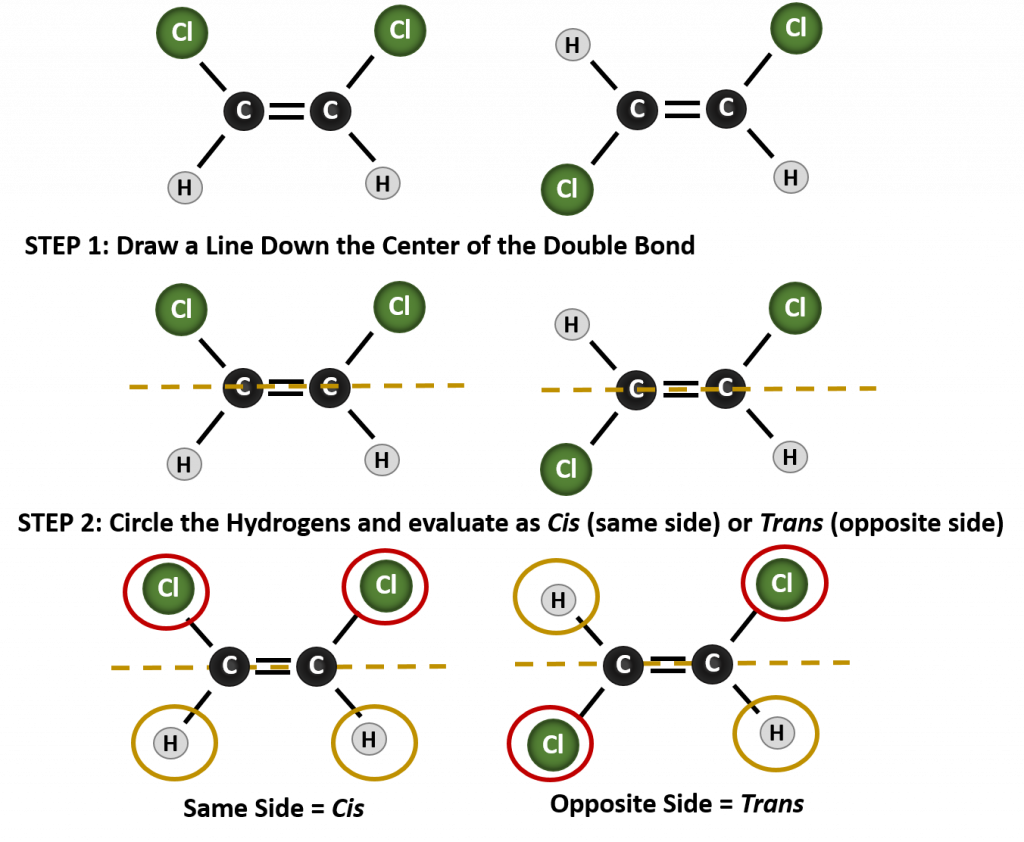
Abbildung 8.9 Ein Leitfaden zur Bestimmung von cis- oder trans-Konformationen.
Klicken Sie hier für ein Video-Tutorial der Kahn Academy über Cis/Trans-Isomerisierung
(Hinweis: Alle Inhalte der Khan Academy sind unter CC-BY-NC-SA-Lizenzierung kostenlos verfügbar unter www.khanacademy.org )
Cis-trans-Isomerie tritt auch in cyclischen Verbindungen auf. In Ringstrukturen können die Gruppen nicht um eine der Kohlenstoff-Kohlenstoff-Bindungen des Rings rotieren. Daher können sich die Gruppen entweder auf der gleichen Seite des Rings (cis) oder auf entgegengesetzten Seiten des Rings (trans) befinden. Für unsere Zwecke hier stellen wir alle Cycloalkane als planare Strukturen dar und geben die Positionen der Gruppen entweder oberhalb oder unterhalb der Ringebene an.

Zu Ihrer Gesundheit
Wahrscheinlich werden Sie im Alltag am häufigsten im Supermarkt oder in der Arztpraxis auf die cis-trans-Konformation hingewiesen. Er bezieht sich auf unseren Konsum von Nahrungsfetten. Ein unangemessener oder übermäßiger Verzehr von Nahrungsfetten wird mit zahlreichen Gesundheitsstörungen wie Diabetes, Arteriosklerose und koronaren Herzkrankheiten in Verbindung gebracht. Was sind also die Unterschiede zwischen gesättigten und ungesättigten Fetten, was sind Transfette und warum sind sie so gesundheitsschädlich?

Abbildung 8.10 Häufige Quellen von Nahrungsfetten.
Foto von: TyMaHe
Die häufigste Form von Nahrungsfetten und der Hauptbestandteil des Körperfetts bei Menschen und anderen Tieren sind die Triglyceride (TAGs). TAGs sind, wie in Abbildung 8.10 dargestellt, aus einem Molekül Glycerin und drei Molekülen Fettsäuren aufgebaut, die durch eine Esterbindung miteinander verbunden sind. In diesem Abschnitt werden wir uns auf die Struktur der langen Fettsäureschwänze konzentrieren, die aus Alkan- oder Alkenstrukturen bestehen können. Kapitel 10 wird sich mehr auf die Bildung der Esterbindungen konzentrieren.

Abbildung 8.11. Beispiel für die Struktur eines Triglycerids (TAG). Beachten Sie, dass jedes Triglycerid drei langkettige Fettsäuren hat, die sich vom Glycerin-Rückgrat aus erstrecken. Jede Fettsäure kann einen unterschiedlichen Grad an Sättigung und Ungesättigtheit aufweisen.
Struktur nach: Wolfgang Schaefer
Fette, die vollständig gesättigt sind, haben nur Fettsäuren mit langkettigen Alkanschwänzen. Man sagt, dass sie mit Wasserstoffatomen „gesättigt“ sind. Gesättigte Fette sind in der amerikanischen Ernährung weit verbreitet und finden sich in rotem Fleisch, Milchprodukten wie Milch, Käse und Butter, Kokosnussöl und in vielen Backwaren. Gesättigte Fette sind bei Zimmertemperatur in der Regel fest. Das liegt daran, dass sich die langkettigen Alkane mit mehr intermolekularen Londoner Dispersionskräften zusammenlagern können. Dadurch haben gesättigte Fette einen höheren Schmelz- und Siedepunkt als die ungesättigten Fette, die in vielen Pflanzenölen vorkommen.
Die meisten ungesättigten Fette, die in der Natur vorkommen, liegen in der cis-Konformation vor, wie in Abbildung 8.11 dargestellt. Man beachte, dass die in Abbildung 8.11 gezeigten Fettsäuren der Einfachheit halber gezeichnet sind, so dass sie leicht zu sehen sind und nicht zu viel Platz auf dem Papier einnehmen, aber die geschriebenen Bindungswinkel geben die wahre räumliche Orientierung der Moleküle nicht angemessen wieder. Wenn die Fettsäuren aus dem TAG in Abbildung 8.11 mit korrekten Bindungswinkeln gezeichnet werden, ist leicht zu erkennen, dass cis-Doppelbindungen Biegungen in der Alkenkette verursachen (Abb. 8.12).
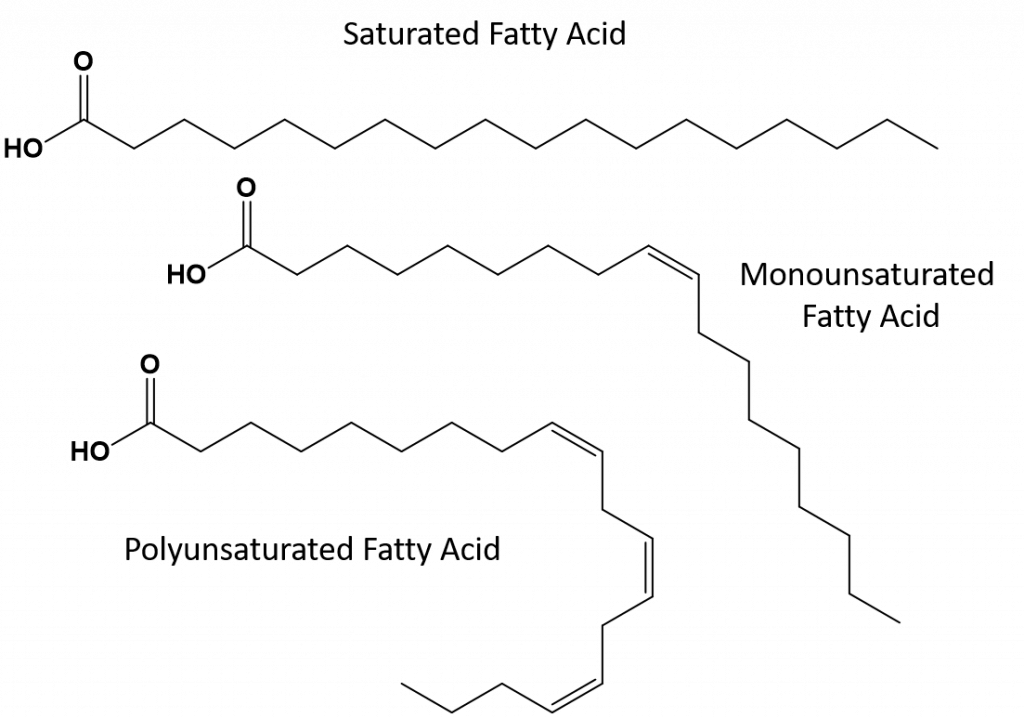
Abbildung 8.12 Cis-Doppelbindungen verursachen Biegungen in der Fettsäurestruktur
Daher können sich einfach ungesättigte und mehrfach ungesättigte Fette nicht so leicht stapeln und haben im Vergleich zu gesättigten Fetten nicht so viele intermolekulare Anziehungskräfte. Infolgedessen haben sie niedrigere Schmelz- und Siedepunkte und sind bei Raumtemperatur eher flüssig. Es hat sich gezeigt, dass die Verringerung oder der Ersatz von gesättigten Fetten durch einfach und mehrfach ungesättigte Fette in der Ernährung dazu beiträgt, den Gehalt an Cholesterin in Form von Lipoprotein niedriger Dichte (LDL) zu senken, das ein Risikofaktor für koronare Herzkrankheiten ist.
Trans-Fette hingegen enthalten Doppelbindungen, die sich in der trans-Konformation befinden. Die Form der Fettsäuren ist also linear, ähnlich wie bei gesättigten Fetten. Transfette haben auch ähnliche Schmelz- und Siedepunkte wie gesättigte Fette. Im Gegensatz zu gesättigten Fetten kommen Transfette in der Natur jedoch nicht häufig vor und haben negative Auswirkungen auf die Gesundheit. Transfette entstehen hauptsächlich als Nebenprodukt bei der Lebensmittelverarbeitung (vor allem bei der Hydrierung zur Herstellung von Margarine und Backfett) oder beim Kochen, insbesondere beim Frittieren. Tatsächlich verwenden viele Fast-Food-Betriebe Transfette bei ihrem Frittierverfahren, da Transfette viele Male verwendet werden können, bevor sie ersetzt werden müssen. Der Konsum von Transfetten erhöht den LDL-Cholesterinspiegel im Körper (das schlechte Cholesterin, das mit koronaren Herzkrankheiten in Verbindung gebracht wird) und senkt tendenziell das HDL-Cholesterin (das gute Cholesterin im Körper). Der Konsum von Transfetten erhöht das Risiko für Herzkrankheiten und Schlaganfälle sowie für die Entwicklung von Typ-II-Diabetes. Das Risiko ist so hoch, dass viele Länder die Verwendung von Transfetten verboten haben, darunter Norwegen, Schweden, Österreich und die Schweiz. In den Vereinigten Staaten hat die Food and Drug Administration (FDA) kürzlich eine Maßnahme verabschiedet, die die Verwendung von Transfetten in Lebensmitteln bis 2018 auslaufen lassen soll. Diese Maßnahme wird schätzungsweise 20.000 Herzinfarkte und 7.000 Todesfälle pro Jahr verhindern.
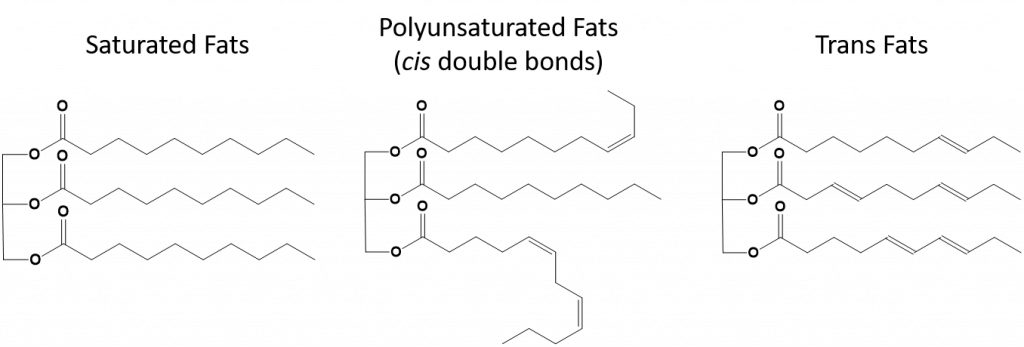
Abbildung 8.13 Strukturelle Unterschiede zwischen gesättigten, mehrfach ungesättigten und Transfetten.
Klicken Sie hier für ein Video-Tutorial der Kahn Academy über gesättigte, ungesättigte und Transfette
(Hinweis: Alle Inhalte der Khan Academy sind unter CC-BY-NC-SA-Lizenzierung kostenlos verfügbar unter www.khanacademy.org )
Schlüsselfaktoren für die Bestimmung der Cis/Trans-Isomerisierung
- Die Verbindung muss eine Doppel- oder Dreifachbindung enthalten oder eine Ringstruktur aufweisen, die keine freie Drehung um die Kohlenstoff-Kohlenstoff-Bindung zulässt.
- Die Verbindung muss zwei nicht identische Gruppen an jedem Kohlenstoff haben, der an der Kohlenstoff-Kohlenstoff-Doppel- oder Dreifachbindung beteiligt ist.
Arbeitsbeispiel
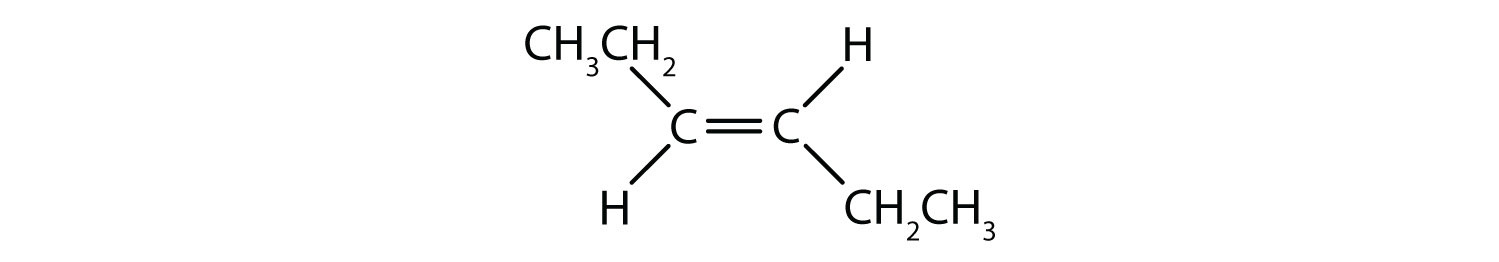
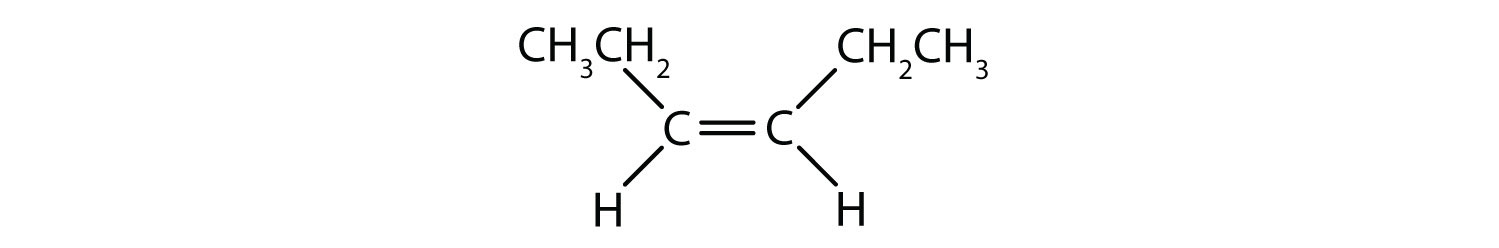
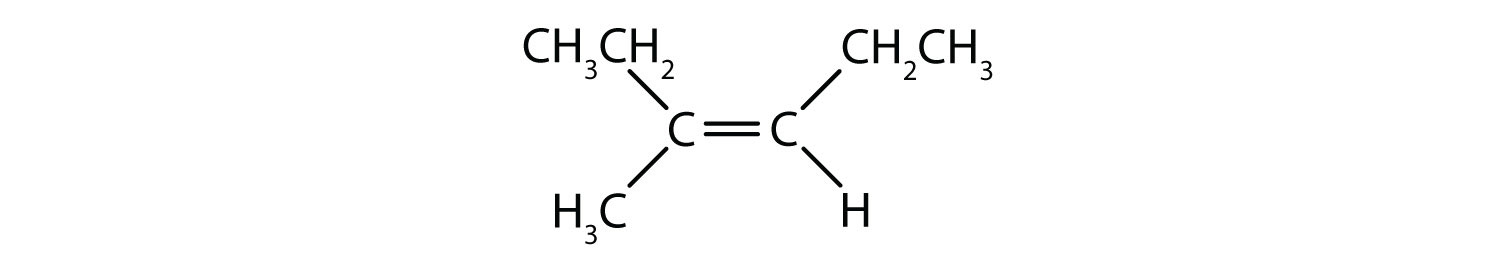
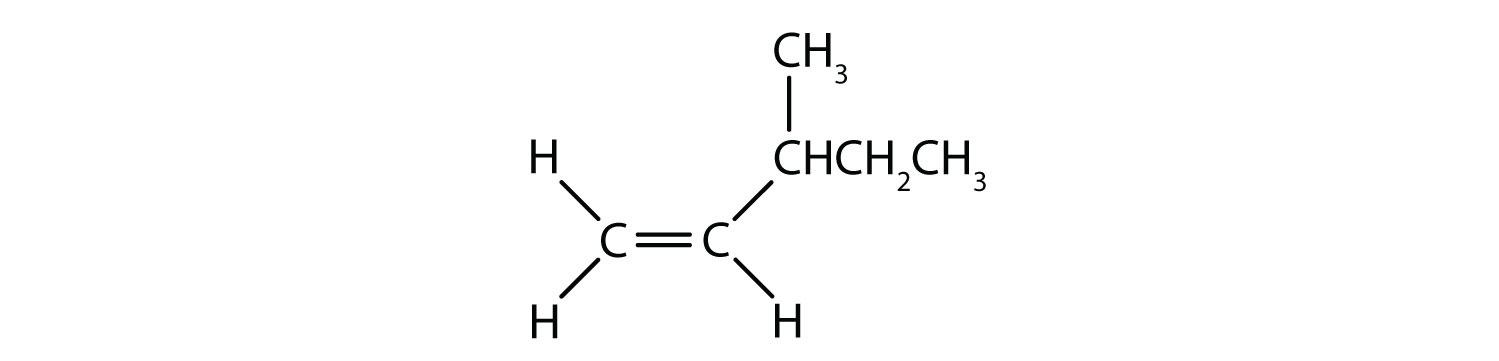
Welche Verbindungen können als cis-trans (geometrische) Isomere existieren? Zeichnen Sie sie.
- CHCl=CHBr
- CH2=CBrCH3
- (CH3)2C=CHCH2CH3
- CH3CH=CHCH2CH3
Lösung
Alle vier Strukturen haben eine Doppelbindung und erfüllen somit die Regel 1 für cis-trans-Isomerie.
-
Diese Verbindung erfüllt Regel 2; sie hat zwei nicht identische Gruppen an jedem Kohlenstoffatom (H und Cl an einem und H und Br an dem anderen). Sie existiert sowohl als cis- als auch als trans-Isomer:

- Diese Verbindung hat zwei Wasserstoffatome an einem ihrer doppelt gebundenen Kohlenstoffatome; sie erfüllt Regel 2 nicht und existiert nicht als cis- und trans-Isomer.

- Diese Verbindung hat zwei Methylgruppen (CH3) an einem ihrer doppelt gebundenen Kohlenstoffatome. Sie versagt bei Regel 2 und existiert nicht als cis- und trans-Isomer.

-
Diese Verbindung erfüllt Regel 2; sie hat zwei nicht identische Gruppen an jedem Kohlenstoffatom und existiert sowohl als cis- als auch als trans-Isomer:

Skill-Building Exercise
-
Welche Verbindungen können als cis-trans-Isomere existieren? Zeichne sie ein.
- CH2=CHCH2CH2CH3
- CH3CH=CHCH2CH3
- CH3CH2CH=CHCH2CH3
-
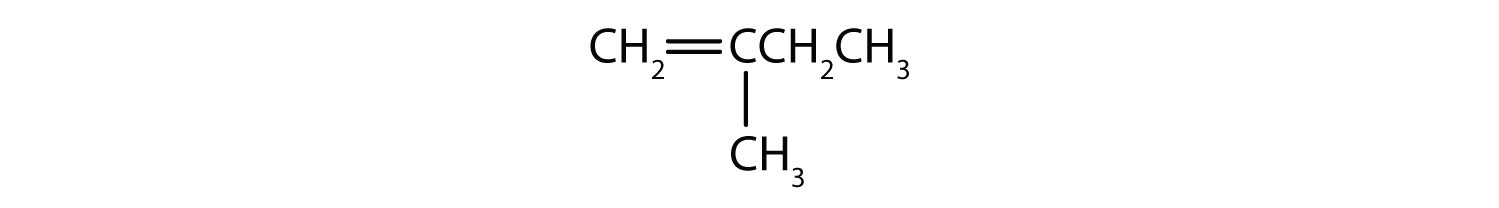
-
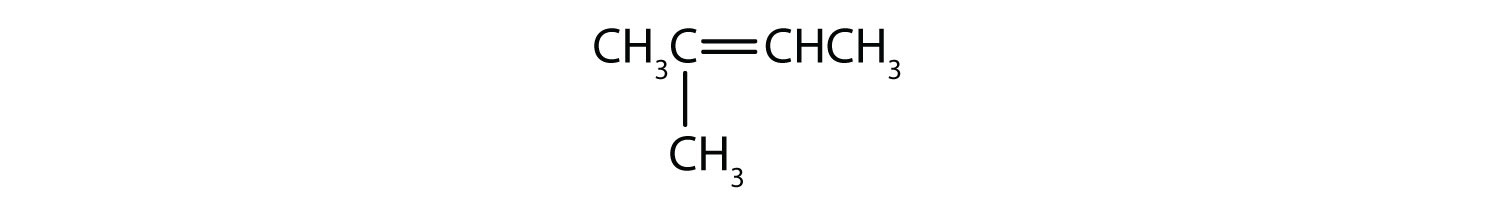
Konzeptübersichtsübungen
-
Was sind cis-trans (geometrische) Isomere? Welche zwei Arten von Verbindungen können eine cis-trans-Isomerie aufweisen?
-
Klassifizieren Sie jede Verbindung als cis-Isomer, trans-Isomer oder keines von beiden.
-
Antworten
-
Cis-trans-Isomere sind Verbindungen, die aufgrund des Vorhandenseins einer starren Struktur in ihrem Molekül unterschiedliche Konfigurationen haben (Gruppen, die sich dauerhaft an verschiedenen Stellen im Raum befinden). Alkene und zyklische Verbindungen können eine cis-trans-Isomerie aufweisen.
-
- trans
- cis
- cis
- neither
Key Takeaway
- Cis-trans (geometrische) Isomerie liegt vor, wenn in einem Molekül eine eingeschränkte Rotation vorliegt und an jedem Kohlenstoffatom zwei verschiedene Gruppen an der chemischen Bindung beteiligt sind.
(Zurück zum Anfang)
E-Z Nomenklatur
Komplexer wird die Situation, wenn an den Kohlenstoffatomen, die an der Bildung der Doppelbindung beteiligt sind, vier verschiedene Gruppen hängen. Das cis-trans-Namenssystem kann in diesem Fall nicht verwendet werden, da es keinen Hinweis darauf gibt, welche Gruppen durch die Nomenklatur beschrieben werden. Im unten stehenden Molekül könnte man zum Beispiel sagen, dass das Chlor in trans-Stellung zur Bromgruppe steht, oder man könnte sagen, dass das Chlor in cis-Stellung zur Methylgruppe (CH3) steht. Wenn man also in diesem Fall einfach cis oder trans schreibt, wird die räumliche Orientierung der Gruppen in Bezug auf die Doppelbindung nicht klar beschrieben.
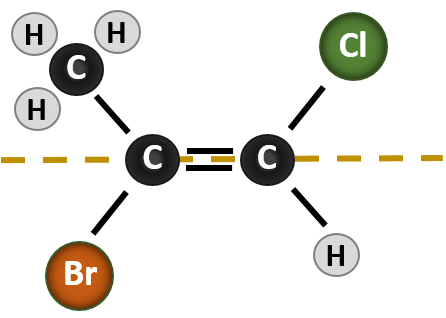
Die Benennung der verschiedenen Stereoisomere, die in dieser Situation gebildet werden, erfordert die Kenntnis der Prioritätsregeln. Erinnern Sie sich aus Kapitel 5, dass im Cahn-Ingold-Prelog (CIP)-Prioritätssystem die Gruppen, die an den chiralen Kohlenstoff gebunden sind, auf der Grundlage ihrer Ordnungszahl (Z) Priorität haben. Atome mit höherer Ordnungszahl (mehr Protonen) erhalten eine höhere Priorität (d. h. S > P > O > N > C > H). Für dieses Nomenklatursystem werden die Bezeichnungen (Z) und (E) anstelle des cis/trans-Systems verwendet. (E) kommt von dem deutschen Wort entgegen, oder entgegengesetzt. Wenn sich also die höherwertigen Gruppen auf der gegenüberliegenden Seite der Doppelbindung befinden, spricht man von der (E)-Konformation der Bindung. (Z) hingegen kommt von dem deutschen Wort zusammen, oder zusammen. Wenn sich also die Gruppen mit höherer Priorität auf derselben Seite der Doppelbindung befinden, liegt die Bindung in der (Z)-Konformation vor. Abbildung 8.14 zeigt die Schritte, die bei der Zuweisung der (E)- oder (Z)-Konformationen eines Moleküls verwendet werden.
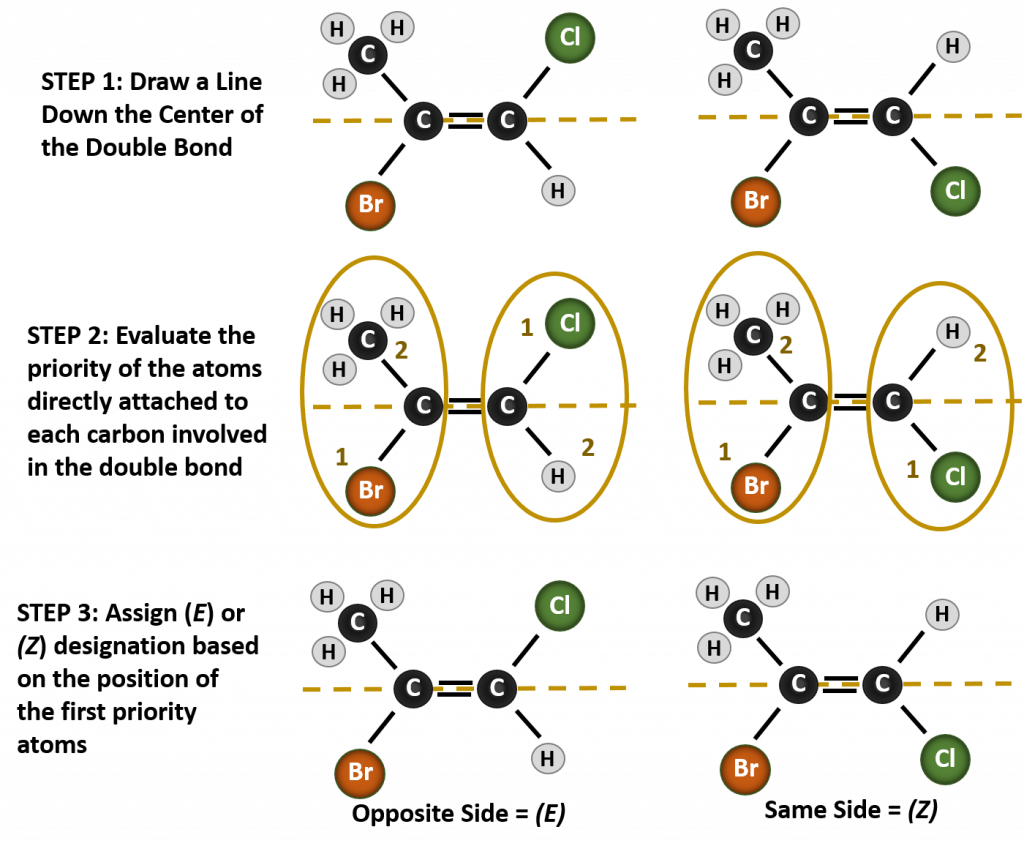
Abbildung 8.14 Schritte zur Zuweisung der (E)- und (Z)-Konformationen.
Klicken Sie hier für ein Video-Tutorial der Kahn Academy zur E/Z-Isomerisierung.
(Hinweis: Alle Inhalte der Khan Academy sind unter CC-BY-NC-SA-Lizenzierung kostenlos verfügbar unter www.khanacademy.org )