新生児のかなりの割合が、生後1週間で治療を要する高ビリルビン血症(「著しい」高ビリルビン血症、SHB)を発症します。 出生時の入院期間の短縮は、ビリルビンによる神経障害の発生率の上昇と時間的に関連している。 退院後の保健師による家庭訪問や家族による病院訪問でSHBを発見できるかもしれないが、普遍的に実行可能で費用対効果が高いとは言えない。 したがって、新生児が出生病院から退院する前に、ビリルビン値が高くなる危険性のある患者を特定する必要がある。
黄疸の程度の視覚的評価の精度が低いため、退院前にSHB発症の危険性を客観的に評価することも重要である。 SHBのリスク層別化は、ビリルビン負荷(血清総ビリルビンまたは経皮ビリルビンの絶対値または上昇率)、ビリルビン産生(呼気一酸化炭素)の測定、基礎となる臨床危険因子の特定によって行われてきた …。
末梢血中のビリルビン濃度は、ビリルビンの産生、代謝、排泄、再吸収の年齢別割合の関数である。 したがって、新生児のビリルビン値の解釈は生後年齢に基づいて行われる。 Bhutaniらによって開発された時間別ビリルビンノモグラムは、出生病院からの退院前に血清総ビリルビン(STB)を測定することで、追跡調査中にSTBのパーセンタイル値が高くなる危険性のある新生児を特定できることを実証している。 様々なリスク予測法の中で、退院前のSTB測定は、北米の新生児において最も優れた識別能力を示している。 しかし、ビリルビン代謝の遺伝的な違いや授乳方法の違いにより、高ビリルビン血症の臨床経過は民族や地理的に異なる新生児で異なる可能性がある。 また、従来のノモグラムは、高ビリルビン血症の転帰に関する情報が調査対象者の5分の1しかわからないレトロスペクティブなコホートから作成されたものであった。 したがって、退院前のビリルビン測定をリスク評価戦略として使用するためには、異なる新生児集団において時間別ビリルビンノモグラムを構築することが前提条件である。
我々は、インドの新生児を対象に時間別血清総ビリルビンノモグラムを構築し、治療が必要な高ビリルビン血症の予測における退院前ビリルビン測定の有効性を評価するために、この前向きコホート研究を企画した。 研究プロトコルは病院の倫理委員会で承認され、保護者から書面によるインフォームドコンセントを得た。 妊娠35週以上または出生時体重2000g以上の健康な新生児が研究への登録資格を得た。 物流上の理由から、日曜日に生後24時間を経過した新生児は、本研究への登録対象とはしなかった。 主要な先天性奇形、新生児集中治療室への入院、直接クームス試験陽性(母親の血液型が赤血球陰性の場合に実施)、最初のビリルビン測定前の光線療法、フォローアップに来ることができない新生児は除外された。
試験の測定とフォローアップ:血清総ビリルビンの初回測定のための血液サンプルは、生後18-30時間のメタボリックスクリーニング時に採取された。 毛細血管または末梢静脈血はあらかじめヘパリン処理したマイクロキャピラリーで採取した。 血液は直ちに12000rpmで5分間遠心分離し、分光光度計(NEO-BIL plus, das srl, Italy)を用いて総ビリルビンを測定した。
新生児は入院中および退院後、生後7日目終了までフォローアップを行った。 フォローアップのタイミングは退院時の年齢をもとに決定した。 生後48時間以前に退院した赤ちゃんは生後72時間から96時間の間に、生後48時間以降に退院した赤ちゃんは生後96時間から120時間の間に呼び戻された。 メタボリックスクリーニング時の最初のSTB測定に加えて、各新生児にさらに2回のSTB測定が行われた。 最初の測定後、2回目、3回目のSTB測定を行うかどうかは、臨床的評価に基づいて決定された。 黄疸の程度の臨床的評価は、多波長経皮ビリメーター(BiliChek、変動係数<8738>5%)による経皮ビリルビン(TcB)測定を伴って行われた。 STB推定は,掌・足底が黄疸で染まるか,TcBが>12 mg/dL,または年齢別光線療法閾値の80%以内であれば行われた。 臨床的な指示がない場合、2回目および3回目のSTB測定はそれぞれ生後72-96時間および96-144時間に行われた。 5477><6047>SHB発症リスクに影響を及ぼす可能性のある臨床的・疫学的危険因子を記録した。 出生体重,妊娠期間,性別,母親の学歴と宗教,分娩数,妊婦合併症,母親のABOおよびRh血液型,分娩方法,分娩時の麻酔の種類,分娩時のオキシトシン点滴の使用などが記録された。 さらに、哺乳開始年齢、出生後24時間以降における補助哺乳(母乳または表現母乳以外)、初便の通過年齢についても言及した
Outcome: 高ビリルビン血症の治療のために光線療法や輸血が必要と定義された重要な高ビリルビン血症(SHB)が主要な成果であった。 光線療法の開始は、米国小児科学会(AAP)ガイドラインの地域適応に従って、赤ちゃんの年齢(時間)とSTB値に基づいて決定された。 妊娠38週以上で出生した新生児には中リスクの閾値を、妊娠37週以下で出生した新生児には高リスクの閾値を用い、光線療法を開始した。 AAPガイドラインの中リスク閾値はBhutani nomogramの95
thパーセンタイル値とほぼ同じである。
統計解析 プロスペクティブスタディにおいて、妊娠35週以上で生まれた新生児の10%に有意な高ビリルビン血症が観察された。 感度95%(信頼区間5%)、α値0.05以上の診断テストを検討するためには、約1000人の被験者を登録する必要があった。
データはStata 9 (StataCorp, College Station, TX, USA)を用いて解析した。 ノモグラムの作成には、生後48時間までは6時間ごと(年齢±3時間)、48時間以降は12時間ごと(年齢±6時間)にSTB値をクラブ化し、各エポックのデータが対称であるかどうかを検討した。 各エポックについて、5
番目、10番目、25番目、40番目、75番目、90番目、95番目のパーセンタイル値が計算された。 Microsoft Excel (Microsoft Corporation, Richmond, US) を用いて時間別ビリルビン値ノモグラムをプロットした。 40、75、95パーセンタイルを描く平滑化ノモグラムは、R統計ソフトウェアのGAMLSSパッケージで立方棘モデリングを用いてプロットされた。 平滑化後の40%ライン以下は36.5%、75%ライン以下は77.8%、95%ライン以下は95.1%であった。 ノモグラムの予測能力は,感度,特異度,陽性予測値,陰性予測値,尤度比を算出し,受信者操作特性(ROC)曲線のプロットとc統計量の算出により評価した.
結果
研究期間中、合計1255人の新生児が生まれ、そのうち1090人が登録可能であった。 このうち93人は異なる理由で除外された(図1)。 合計997人の新生児が研究に登録された。 出生時体重の平均±SD値は2627±536 g、妊娠週数は37.8±1.5週(中央値およびIQR:38および37-39)であった(Web Table I)。 研究対象児のほとんどは、合併症のない出生後の経過で生まれ、子宮外生命への移行も問題なく行われた。 入院中、80%以上の新生児が母乳のみで育てられた
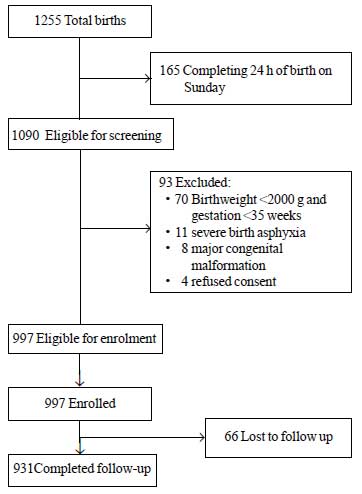
図1 研究フロー
ビリルビン・ノモグラムの作成 ビリルビンの初回測定は生後23.3±6.3時間で行われ、平均STBは7.0±2.0mg/dLであった。 29名(2.9%)の新生児は、最初のビリルビン測定に基づき光線療法を必要とした。 これらの新生児では、光線療法は生後27±5.6時間から開始され、STB値は12.3±2.0 mg/dLであった。 66名(6.6%)の新生児は試験病院退院後に追跡調査を受けられなくなった。 これらの新生児の初回ビリルビン値は,SHBを発症しなかった新生児と同等であり(6.5±1.9 vs 6.7±1.7 mg/dL,P=0.54),SHB発症者よりも有意に低かった(6.5±1.9 vs 8.5±2.2 mg/dL, P<8738> 0.001 ).
ノモグラムの作成とSTB値の分布を評価するために,生後48時間までは6時間,48時間以降は12時間に分割して評価した。 図2 血清総ビリルビン値の分布を示す箱ひげ図
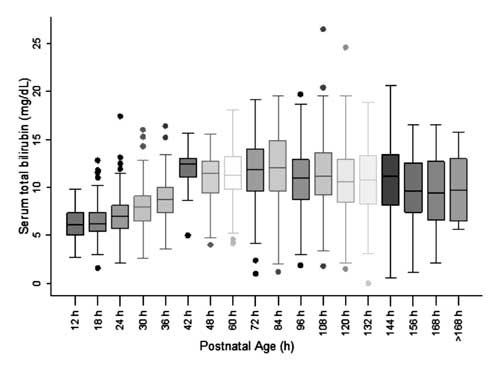
各エポックの5
番目、10番目、25番目、40番目、75番目、90番目、95番目のパーセンタイル値が計算された。 図3は、年齢別の血清ビリルビンのノモグラムであり、40%、75%、95%の値が出生後の年齢とともに増加する。 3 Bilirubin nomogram – hour-specific serum total bilirubin depicted as 40th, 75th and 95th percentiles.
Predictive ability of pre-discharge STB: Overall, 199 (20%) neonates developed SHB (received phototherapy). 最初のビリルビン値は、その後の高ビリルビン血症の治療の必要性を予測するために使用された。 出生後48時間以内に2つ以上の値が得られた場合は、より高いパーセンタイル値を予測に使用した。
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| 退院前の血清総ビリルビン | Outcome | 検査成績 | |||||||||||||
| Percentile | 人数(n=928) | SHB+ | SHB- | Percentile | Number(n=928) | PPV | NPV | 感度 | 特異度 | ||||||
| 95%以上 | 49 | 15 | 1%以上 | 2% | 1%未満 | 3% | 1% | 2%未満 | 3%以上 | 4%以上 | 5%未満 | 6%未満4 | 81.2 | 17.1 | 97.9 |
| 95%以下 | 879 | 165 | 714 | 239 | 107 | 132 | 44.5%以上 | ||||||||
| 199%> | 199%> | 86.2 | 53.8 | 81.9 | |||||||||||
| 75%以下 | 689 | 92 | 597 | ||||||||||||
| 40%以上 | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 | ||||||||
| 40%以下 | 342 | 32 | 310 | ||||||||||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
|||||||||||||||
新生児のうち、事前に退院時にSTBを測定し、フォローアップを完了した(n=928)。 で49人(5.3%)の新生児は、退院前のSTBが年齢別分布の95%以上であった(表I)。 このうち34名の新生児はその後光線療法を必要とした(陽性的中率:69.4%、感度:17.1%)。 退院前のSTBが年齢別分布の40%未満であった新生児は342例(36.8%)であった。 このうち310名は,その後の高ビリルビン血症の治療を必要としなかった(陰性的中率:90.6%,特異度:42.5%)。 75パーセンタイルカットオフの陽性的中率は44.8%,陰性的中率は86.2%であった。 図4のROC曲線は、各パーセンタイルカットオフの診断能力を示しており、曲線下面積(c-statistic)は0.73であった。
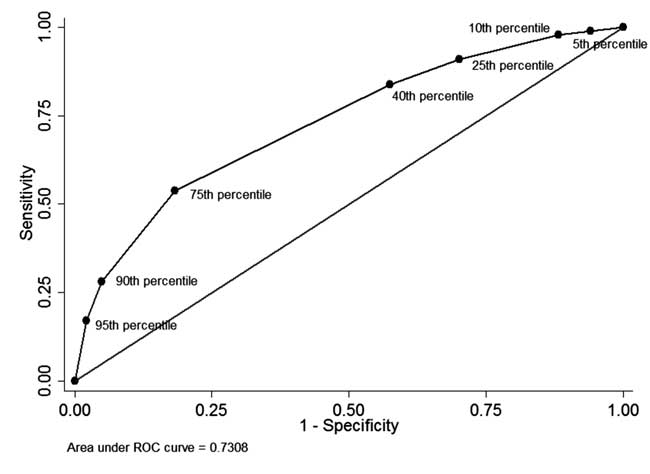
Fig.4 退院前血清総ビリルビンの異なるパーセンタイルカットオフの診断能力に関するROC曲線
尤度比(LR)は、結果のバックグラウンド有病率の変化に影響を受けないため、診断テストパフォーマンスを測定するより良いツールである。 LR+(病気で陽性になる可能性/非病気で陽性になる可能性)は、リスク区分ごとに算出された。 退院前のSTBが95%以上の場合を高リスクゾーン,75~94%の場合を上・中リスクゾーン,40~74%の場合を下・中リスクゾーン,40%未満の場合を低リスクゾーンとして割り付けた. 高リスクゾーン49名のうち34名がSHBを発症したため、高リスクゾーンのSTB陽性LRは8.26であった(表II)。 上・中級リスクゾーンに属する190人の新生児のうち73人がSHBを発症したので、このリスクゾーンのSTVの陽性LRは2.30であった。 同様に、低中級リスクゾーンにおけるSTB陽性LRは0.76、低リスクゾーンにおける陽性LRは0.37であった。
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| 退院前の血清総ビリルビン | アウトカム | |||||||||||||||||
| 卒業前 | 卒業前 | のテストパフォーマンス | 卒業前 | 卒業前 | 卒業前 | 卒業前 | Percentile | Total | SHB+ | SHB- | P.の場合。A ratio | Probability of disease | LR+ | |||||
| ハイリスク | ≧95th | 49 | 15 | 7:3 | 7/10 | |||||||||||||
| 上中級 | 75〜94 | 190 | 73 | 2:5 | 2.30 | |||||||||||||
| 中級下 | 347 | 287 | 1:5 | 1/6 | 0.76 | |||||||||||||
| ローリスク | <40th | 342 | 32 | 1:10 | 1/11 | 0.37 | ||||||||||||
| 928 | 199 | 729 | 1:4 | 1/5 | ||||||||||||||
| SHB: significant hyperbilirubinemia; P:A ratio.を示す。 5678> | ||||||||||||||||||
考察
ビリルビンによる神経障害やカーニクテルの発生を減らすための戦略として、その後のSHB発症に対する退院前のリスク評価が推奨されます。 この前向きコホート研究では、北インドの新生児のサブセットを対象に時間別血清ビリルビンノモグラムを作成し、退院前のSTB測定によるリスク区分がその後の光線療法の必要性(SHB)を予測する上で有効であることを評価した。 本研究のコホートでは、ベースラインのSHB発生率は高く、新生児10人中2人がSHBを発症していた。 退院前のSTBの位置が2つの高リスクゾーンにある場合,高リスクゾーンでは10人中7人がSHBを発症し(正のLR=8.26),高中リスクゾーンでは10人中4人がSHBを発症し(正のLR=2.3),その後のSHBのリスクを有意に上昇させることが示された。 退院前のSTBの位置が低リスクゾーンにある場合,10人中1人がSHBを発症し,その後のSHBリスクを有意に減少させた(正のLR=0.37). しかし,Low risk cut-offの陰性的中率は90%にとどまり,Low risk zoneに位置することはその後のSHBの可能性を排除することはできなかった.
Bhutaniらは大規模コホートにおいて,退院前のSTBが高リスクゾーンと高中リスクゾーンにある新生児は,追跡調査中にSHBを発症する可能性が高いことを示した。 著者らは、臨月と満月の新生児を対象に、出生後の異なる年齢における血清ビリルビン値のパーセンタイルチャートを作成した。 その結果、新生児の6.1%が退院前の血清ビリルビン値が>95パーセンタイルであり、これらの乳児の32.1%がその後、高ビリルビン血症を示したことが判明した。 Bhutaniらの時間別ノモグラムと比較すると,本研究でのSTBのパーセンタイル値は生後84-108時間まで最大2mg/dL高いことがわかった. 北インド出身の新生児はビリルビンの値が高く、高ビリルビン血症の発生率が高いことが観察されている。 本研究で認められたSTBの平均値7.0±2.0mg/dLはBhutani nomogramの75〜95パーセンタイルの間にある。 同様にAgarwalらは生後24時間の平均STBを5.9±1.8 mg/dLと報告しており、Bhutani nomogramの75パーセンタイルに近い値であった。 本研究では、早産または低出生体重新生児の割合が高く、母乳育児率が高いことが、STB値の上昇とSHB発生率の上昇の要因であると考えられる。 さらに、低リスクの新生児であってもAAP光線療法閾値の上限ラインではなく中 央ラインを使用するという我々の決定もSHB発生率を増加させた。 出生後108時間以降、本研究におけるSTBのパーセンタイル値はBhutaniノモグラムの対応する値より低い。 臨床医の判断で選択的に経過観察された新生児のSTB値をノモグラムの作成に含めたため、Bhutaniノモグラムのプロットに高いSTB値が使用され、後者の一般化可能性が減少した可能性がある。 本研究では、高ビリルビン血症の重症度に関係なくフォローアップを行ったため、ノモグラムは生後4日目と5日目にピークを迎え、1週目の終わりには自然に減少することが示された。
プロスペクティブ・コホート研究において、Agarwalらは高ビリルビン血症の予測のために、妊娠35週以上で生まれた220人の新生児の生後24±6時間におけるSTBを測定している. 生後24±6時間の時点でSTB >6 mg/dLであれば、生後5日以内にSHBを発症する可能性はほとんどない(陰性化の尤度比0.07)。 しかし、追跡調査中にビリルビン値が>10 mg/dLの「臨床的」新生児のみを選択的に測定したため、検証にバイアスがかかってしまった。 インドの別の研究では、18-24時間後のカットオフ値3.99mg/dLは、その後のビリルビン値>15mg/dLの予測に対して、感度および特異度がそれぞれ67%であることが判明した。 しかし,完全な追跡調査は,新生児疾患または帝王切開などの母体の理由で入院した乳児にのみ行われた. 健康で早期に退院した乳児の50%以上はフォローアップされていなかった。 トルコの研究では、妊娠35週から37週の新生児における時間特異的ビリルビンノモグラムが発表された。 STB値が95
thパーセンタイル以上であれば、その後のSHB発症の陽性予測値が高かった。 しかし,STB値が30パーセンタイル以下では,約90%の陰性的中率を示した。 2つの大規模なレトロスペクティブスタディでは,早期/退院前のSTB測定の予測能力は優れており,曲線下面積(AUC)は0.83であったと報告されている. 本研究では,40パーセンタイル値と75パーセンタイル値の識別能力は,これまでの報告より低いものであった. このため、本研究ではROC曲線が対角線上にシフトし、識別能力が低下した(AUC=0.73)。 トルコでは25.3%、本研究では20%と、ベースラインのSHB発症率が高いことが、低いパーセンタイル値ではその後のSHB発症を否定できず、退院前のSTB測定の有用性を限定しているものと思われる。
後続のSHBを予測するための別のリスク評価戦略は、臨床的な危険因子の評価である。 出生時の妊娠期間,前兄弟の黄疸治療歴,オキシトシン注入,器械分娩,出生時の外傷,不十分な授乳がSHBの危険因子として示唆されている<5477>が,臨床リスクモデルの識別能力は早期STB測定より低いことが報告されている。 Newmanらは、臨床的リスク指標を早期STB測定と組み合わせた場合、識別能力が向上することを報告した。 我々のコホートでは低出生体重児や早産児が多いため、これらの客観的に測定可能な臨床的リスク因子と早期STB測定を組み合わせることで、より優れた識別能力を持つリスクモデルを作成できると推測している。
本研究で得られた知見の外部への適用性は,光線療法を開始する際に低いビリルビン閾値を使用するため,研究コホートにおける高ビリルビン血症の発生率が比較的高いことに影響されるかもしれない。 先進国とは対照的に、インドではビリルビンのピーク値が低くても核黄疸が報告されている。このことは、インドの新生児は血清ビリルビンのピーク値が低くてもビリルビンによる神経学的障害を発症する可能性を示している。 また、インドでは約3分の1の新生児が低出生体重児として出生している。 5477><6047>本研究の長所は、前向き研究デザイン、大規模なサンプルサイズ、90%以上の追跡率、検証バイアスがないことである。 登録された新生児の約7%において転帰を確認することができなかった。 しかし、これらの追跡不能新生児における初期のSTBおよび人口統計学的特徴は、SHBを発症しなかった新生児と同様であるため、時間別ノモグラムおよびリスク評価手段に影響を与える可能性は低いと思われる。 我々は、ビリルビンの測定に「ゴールドスタンダード」である高速液体クロマトグラフィー(HPLC)を使用しなかった。 ビリルビンの測定には、より一般的なベッドサイドでの分光光度計を使用した。 我々の研究で使用されたビリメーターは変動係数が低く、毎回使用前に校正されていた。
退院前にSTBを呈した新生児は、高リスクゾーンまたは高中リスクゾーンでは、早期にSHBを発症する可能性が高いため、頻繁にフォローアップを行うことを推奨する。 綿密なフォローアップが不可能な環境では、ビリルビンが低リスクゾーンに下がるまで退院を遅らせることが検討されるかもしれない。 退院前のSTBが低中リスクゾーンまたは低リスクゾーンにある新生児は、地域の方針に従って退院させることができる。 しかし、その後のSHBの発症を否定できないため、十分なフォローアップを確保する必要がある。
結論として、識別能力はまずまずだが、我々の研究ではフォローアップレベルが高いため、インドの乳児における退院前のSTBによるSHB予測能力への信頼が高まった。 この時間別ビリルビンノモグラムで定義されたリスク分界帯の性能を検証するために、さらなる研究が必要である。
1. 2002-2003年の報告書。 National Neonatal Perinatal Database Network(国立新生児周産期医療データベースネットワーク). New Delhi: National Neonatology Forum of India; 2004.
2. Watchko JF. 危険な高ビリルビン血症のリスクのある新生児の識別:新たな臨床的洞察。 2009;56:671-87.
3. 妊娠35週以上の新生児における高ビリルビン血症の管理. 小児科医。 2004;114:297-316.
4. Lodha R、Deorari AK、Jatana V、ポールVK. 新生児における多波長分光反射率による総血清ビリルビンの非侵襲的推定。 インド小児科 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. 初日血清ビリルビン値を用いた早期新生児高ビリルビン血症。 Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Prediction of hyperbilirubinemia in near-term and term infants.(近親期および期産の乳児における高ビリルビン血症の予測).2002;39:724-30。 小児科 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH.など。 重症高ビリルビン血症のリスクを評価するために、多人種の退院前の新生児集団における血清総ビリルビンの非侵襲的測定。 小児科。 2000;106:E17.
8. Bhutani VK、ジョンソンL、Sivieri EM. 健康な正期・臨月新生児における退院前の時間別血清ビリルビンのその後の有意な高ビリルビン血症に対する予測能力。 小児科。 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. 新生児高ビリルビン血症に関する重要事項のエビデンスに基づく検討。 小児科。 2004;114:e130-53.
10. 新生児のビリルビン脳症のスクリーニングの系統的レビュー。 小児科。 2009;124:1162-71.
11. 診断研究においてサンプルサイズを計算するためのシンプルなノモグラム. エマージェンシー・メッド・J.2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. 正常新生児のビリルビン・スクリーニング:時間別ビリルビン・ノモグラムの批判。 小児科。 2009;124:1203-5.
13. Awasthi S, Rehman H. Early prediction of neonatal hyperbilirubinemia(新生児高ビリルビン血症の早期予測). インディアンJ小児科 1998;65:131-9.
14. 瀕死の新生児と瀕死の新生児における高ビリルビン血症の発生率、経過、予測。 Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. 新生児の高ビリルビン血症リスクを特定する:推奨される2つのアプローチの比較。 Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. 新生児の高ビリルビン血症を予測するための臨床的危険因子と血清ビリルビン値との組み合わせ。 アーチ小児科思春期医学。 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. 成熟した健康維持組織における極端な新生児高ビリルビン血症の予知と予防。 Arch Pediatr Adolesc Med. 2000;154: 1140-7.
18. ケレンR、ルアンX、フリードマンS、サドルミアS、Cnaan A、Bhutani VK。 このような場合、「新生児期における高ビリルビン血症のリスク評価方法」を検討する必要がある。 Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Risk factors for kernicterus in terms babies with non-hemolytic jaundice. インド小児科 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. 高ビリルビン血症の新生児における脳幹聴覚誘発反応。 インド小児科 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Evidence Based Clinical Practice Guidelines(エビデンスに基づく臨床実践ガイドライン)。 また、「震災復興に向けた取り組みについて」、「震災復興に向けた取り組みについて」、「震災復興に向けた取り組みについて」、「震災復興に向けた取り組みについて」、「震災復興に向けた取り組みについて」を掲載しています。 Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Preliminary report on neonatal screening for congenital hypothyroidism, congenital adrenal hyperplasia and glucose-6-phosphate dehydrogenase deficiency: A Chandigarh experience. インドJ小児科2010;77:969-73.
。
