Une proportion significative de nouveau-nés développe une hyperbilirubinémie nécessitant un traitement (hyperbilirubinémie « significative », SHB) au cours de la première semaine de vie . La diminution de la durée de l’hospitalisation à la naissance a été associée dans le temps à une augmentation de l’incidence des lésions neurologiques dues à la bilirubine. Les visites à domicile du personnel de santé après la sortie de l’hôpital ou les visites de la famille à l’hôpital peuvent permettre de détecter la SHB, mais elles ne sont pas universellement réalisables ou rentables. Par conséquent, avant que les nouveau-nés ne quittent l’hôpital de naissance, il convient d’identifier ceux qui risquent de développer des taux élevés de bilirubine
L’évaluation objective du risque de développer la SHB avant la sortie de l’hôpital est également importante en raison de la précision limitée de l’évaluation visuelle de l’étendue de la jaunisse. La stratification du risque de SHB a été faite en mesurant la charge en bilirubine (niveaux absolus ou taux d’augmentation de la bilirubine totale sérique ou de la bilirubine transcutanée), la production de bilirubine (monoxyde de carbone expiré) et en identifiant les facteurs de risque cliniques sous-jacents .
La concentration de bilirubine dans le sang périphérique est fonction des taux de production, de métabolisme, d’excrétion et de réabsorption de la bilirubine en fonction de l’âge. Par conséquent, l’interprétation du taux de bilirubine chez un nouveau-né est basée sur l’âge postnatal. Le nomogramme de bilirubine spécifique à l’heure développé par Bhutani et al. a démontré que la mesure de la bilirubine totale sérique (STB) avant la sortie de l’hôpital de naissance peut aider à identifier les nouveau-nés qui risquent d’avoir des valeurs de STB supérieures au cours du suivi. Parmi les différentes méthodes de prédiction du risque, la mesure de la STB avant la sortie de l’hôpital a montré la meilleure capacité de discrimination chez les nouveau-nés nord-américains. Toutefois, en raison des différences génétiques dans le métabolisme de la bilirubine et des différences dans les pratiques alimentaires, l’évolution clinique de l’hyperbilirubinémie peut varier chez les nouveau-nés appartenant à des ethnies ou à des régions géographiques différentes. En outre, le nomogramme précédent a été élaboré à partir d’une cohorte rétrospective dans laquelle les informations sur l’issue d’une hyperbilirubinémie significative n’étaient connues que pour un cinquième de la population étudiée. Par conséquent, la construction d’un nomogramme de bilirubine spécifique à l’heure dans différentes populations néonatales est une condition préalable à l’utilisation de la mesure de la bilirubine avant la sortie de l’hôpital comme stratégie d’évaluation des risques.
Nous avons planifié cette étude de cohorte prospective pour construire un nomogramme de bilirubine totale sérique spécifique à l’heure chez les nouveau-nés indiens et pour évaluer l’efficacité de la mesure de la bilirubine avant la sortie de l’hôpital pour prédire l’hyperbilirubinémie nécessitant un traitement chez les nouveau-nés à terme et les prématurés tardifs.
Méthodes
Cette étude de cohorte prospective avec évaluation de la performance des tests de diagnostic a été menée de février à juin 2010 dans un hôpital universitaire du nord de l’Inde. Le protocole d’étude a été approuvé par le comité d’éthique de l’hôpital et le consentement éclairé écrit a été obtenu des parents. Les nouveau-nés en bonne santé avec une gestation ≥35 semaines ou un poids de naissance ≥2000 g étaient éligibles pour l’inscription à l’étude. Pour des raisons logistiques, les nouveau-nés ayant terminé leurs 24 heures de vie le dimanche n’ont pas été admis dans l’étude. Les nouveau-nés présentant une malformation congénitale majeure, une admission en unité de soins intensifs néonatals, un test de Coombs direct positif (était effectué si le groupe sanguin de la mère était Rhésus négatif), une photothérapie avant la première mesure de la bilirubine ou une incapacité à venir pour le suivi ont été exclus.
Mesures de l’étude et suivi : Un échantillon de sang pour la première mesure de la bilirubine totale sérique a été prélevé au moment du dépistage métabolique à 18-30 h d’âge postnatal. Le sang capillaire ou veineux périphérique a été collecté dans des micro-capillaires pré-héparinés. Le sang a été centrifugé immédiatement à 12000 rpm pendant 5 minutes et la bilirubine totale a été mesurée avec un spectrophotomètre (NEO-BIL plus, das srl, Italie).
Les nouveau-nés ont été suivis pendant leur séjour à l’hôpital et après leur sortie jusqu’à la fin du 7ème jour postnatal. Le moment de la visite de suivi a été décidé en fonction de l’âge au moment de la sortie. Les bébés sortis avant 48 heures étaient rappelés entre 72 et 96 heures et les bébés sortis après 48 heures entre 96 et 120 heures. En plus de la première mesure de la STB au moment du dépistage métabolique, deux autres mesures de la STB ont été effectuées chez chaque nouveau-né. Après la première mesure, la décision d’effectuer les deuxième et troisième mesures de STB était basée sur l’évaluation clinique. L’évaluation clinique du degré de jaunisse s’accompagnait d’une mesure de la bilirubine transcutanée (BTc) à l’aide d’un bilimètre transcutané multi-longueurs d’onde (BiliChek, coefficient de variation <5%). Une estimation de la STB a été effectuée si les paumes/soles étaient tachées d’ictère ou si la TcB était >12 mg/dL ou inférieure à 80% du seuil de photothérapie spécifique à l’âge. En l’absence d’indication clinique, une deuxième et une troisième mesure de la STB ont été effectuées respectivement à 72-96 h et 96-144 h d’âge postnatal. Les valeurs de STB après le début de la photothérapie n’ont pas été incluses pour la construction du nomogramme.
Les facteurs de risque cliniques et épidémiologiques pouvant influencer le risque de développer une SHB ont été enregistrés. Les données suivantes ont été enregistrées : poids de naissance, gestation, sexe, éducation et religion de la mère, parité, complications prénatales, groupe sanguin maternel ABO et Rh, mode d’accouchement, type d’anesthésie utilisé pendant l’accouchement et utilisation d’une perfusion d’ocytocine pendant le travail. En outre, l’âge au début de l’alimentation, l’alimentation complémentaire (autre que l’allaitement maternel ou le lait maternel exprimé) pendant et après les 24 premières heures après la naissance et l’âge au passage des premières selles ont également été notés.
Résultat : Le résultat clé était l’hyperbilirubinémie significative (SHB) qui a été définie comme la nécessité d’une photothérapie ou d’une transfusion d’échange pour le traitement de l’hyperbilirubinémie. La décision de commencer la photothérapie a été prise sur la base de l’âge du bébé en heures et des niveaux de STB, conformément à l’adaptation locale des directives de l’American Academy of Pediatrics (AAP). Le seuil de risque moyen a été utilisé pour initier la photothérapie chez les nouveau-nés nés à 38 semaines de gestation ou plus, et le seuil de risque plus élevé chez les nouveau-nés nés à 37 semaines de gestation ou moins. Les valeurs du seuil de risque moyen dans les directives de l’AAP sont presque identiques aux valeurs du 95
e percentile du nomogramme de Bhutani .
Analyse statistique : Dans une étude prospective, une hyperbilirubinémie significative a été observée chez 10 % des nouveau-nés nés à ≥35 semaines de gestation . Pour étudier un test de diagnostic avec une sensibilité d’au moins 95 % (intervalle de confiance de 5 %) et une valeur alpha de 0,05, nous devions inscrire environ 1000 sujets .
Les données ont été analysées à l’aide de Stata 9 (StataCorp, College Station, TX, USA). Pour la construction du nomogramme, les valeurs de STB ont été regroupées en époques de six heures (âge±3 heures) pour l’âge postnatal jusqu’à 48 h et en époques de douze heures (âge±6 heures) pour l’âge au-delà de 48 h. Les données de chaque époque ont été examinées pour vérifier la symétrie. Les valeurs des 5
e, 10e, 25e, 40e, 75e, 90e et 95e percentiles ont été calculées pour chaque époque. Microsoft Excel (Microsoft Corporation, Richmond, US) a été utilisé pour tracer le nomogramme de la bilirubine spécifique à l’heure. Le nomogramme lissé représentant les 40e, 75e et 95e percentiles a été tracé à l’aide d’une modélisation cubique de la colonne vertébrale avec le logiciel statistique GAMLSS. Après lissage, 36,5 % des cas étaient en dessous de la ligne du 40e percentile, 77,8 % des cas étaient en dessous de la ligne du 75e percentile et 95,1 % des cas étaient en dessous de la ligne du 95e percentile. La capacité prédictive du nomogramme a été évaluée en calculant la sensibilité, la spécificité, la valeur prédictive positive, la valeur prédictive négative et le rapport de vraisemblance, en traçant la courbe des caractéristiques récepteur-opérateur (ROC) et en calculant la statistique c.
Résultats
Pendant la période d’étude, un total de 1255 nouveau-nés sont nés dont 1090 étaient éligibles pour l’enrôlement. Parmi ceux-ci, 93 ont été exclus pour différentes raisons (Fig. 1). Au total, 997 nouveau-nés ont été inscrits dans l’étude. La valeur moyenne ± SD du poids de naissance était de 2627±536 g et l’âge de gestation de 37,8±1,5 semaines (médiane et IQR : 38 et 37-39) (Tableau Web I). La plupart des enfants étudiés sont nés après un parcours prénatal sans complication et ont connu une transition sans incident vers la vie extra-utérine. Plus de 80 % des nouveau-nés ont été nourris exclusivement au sein pendant leur séjour à l’hôpital.
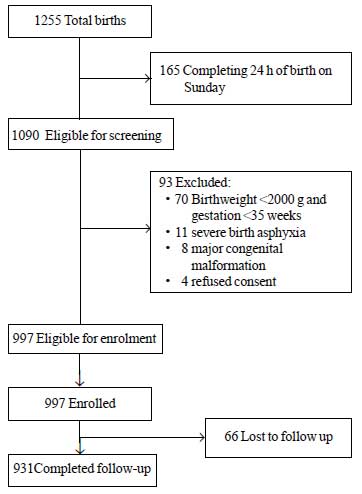
Fig.1 Déroulement de l’étude.
Construction du nomogramme de la bilirubine : La première mesure de la bilirubine a été effectuée à 23,3±6,3 h d’âge et la STB moyenne était de 7,0±2,0 mg/dL. Vingt-neuf (2,9 %) nouveau-nés avaient besoin d’une photothérapie sur la base de la première mesure de la bilirubine. Chez ces nouveau-nés, la photothérapie a été commencée à l’âge de 27±5,6 h avec des taux de STB de 12,3±2,0 mg/dL. Soixante-six (6,6 %) nouveau-nés ont été perdus de vue après leur sortie de l’hôpital étudié. La première valeur de bilirubine chez ces nouveau-nés était comparable à celle des nouveau-nés n’ayant jamais développé de SHB (6,5±1,9 vs 6,7±1,7 mg/dL, P=0,54) et était significativement inférieure à celle des nouveau-nés ayant développé une SHB (6,5±1,9 vs 8,5±2,2 mg/dL, P< 0,001).
Pour construire le nomogramme et évaluer la distribution des valeurs de STB, l’âge postnatal a été divisé en époques de six heures pour l’âge postnatal jusqu’à 48 h et en époques de douze heures pour l’âge au-delà de 48 h. On a observé que la STB à chacune des époques, sauf à 42 h, était distribuée symétriquement (Fig. 2). La distribution des valeurs de STB à 42 h a été observée comme étant positivement asymétrique et ces valeurs n’ont pas été utilisées pour la construction du nomogramme.
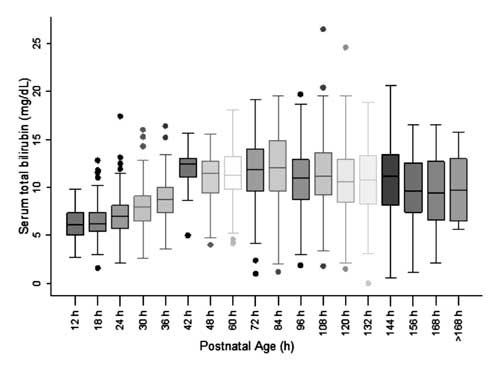
Fig. 2 Diagramme boîte-moustache montrant la distribution de la bilirubine sérique totale.
Les 5
e, 10e, 25e, 40e, 75e, 90e et 95e percentiles pour chaque époque ont été calculés. Un nomogramme de bilirubine sérique spécifique à l’âge a été dessiné avec les valeurs des 40ème, 75ème et 95ème percentiles à l’âge postnatal avancé (Fig. 3).
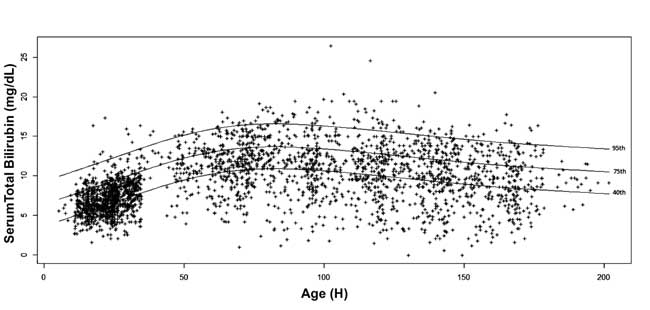
Fig. 3 Nomogramme de la bilirubine – bilirubine totale sérique spécifique à l’heure représentée sous forme de 40e, 75e et 95e percentiles.
Capacité prédictive de la STB avant la sortie : Dans l’ensemble, 199 (20 %) nouveau-nés ont développé une SHB (ont reçu une photothérapie). La première valeur de bilirubine a été utilisée pour prédire le besoin ultérieur de traitement pour l’hyper-bilirubinémie. Si plus de deux valeurs ont été obtenues dans les 48 premières heures après la naissance, la valeur du percentile le plus élevé a été utilisée à des fins de prédiction.
TABLE I Predictive Characteristics of Percentile Values as Risk Demarcators for Subsequent Need of Treatment for Hyperbilirubinemia
| Bilirubine totale sérique avant la sortie de l’hôpital | Résultat | Performance du test | |||||
| Percentile | Nombre(n=928) | SHB+ | SHB-. | PPV | NPV | Sensibilité | Spécificité |
| Au-dessus du 95ème percentile | 49 | 34 | 15 | 69.4 | 81.2 | 17.1 | 97.9 |
| En dessous du 95ème percentile | 879 | 165 | 714 | ||||
| Au-dessus du 75ème percentile | 239 | 107 | 132 | 44.8 | 86.2 | 53.8 | 81.9 |
| Inférieur au 75ème percentile | 689 | 92 | 597 | ||||
| Au-dessus du 40ème percentile | 586 | 167 | 419 | 28.5 | 90.6 | 83.9 | 42.5 |
| En dessous du 40ème percentile | 342 | 32 | 310 | ||||
SHB: significant hyperbilirubinemia, PPV: positive predictive value, NPV: negative predictive value. |
|||||||
Parmi les nouveau-nés qui ont eu une mesure de la STB avant lamesure de la STB à la sortie de l’hôpital et qui ont terminé le suivi (n=928), chez 49 (5.3 %), la STB avant la sortie était supérieure au 95e percentile de la distribution par âge (tableau I). Parmi eux, 34 nouveau-nés ont ensuite eu besoin d’une photothérapie (valeur prédictive positive : 69,4 %, sensibilité : 17,1 %). Chez 342 (36,8 %) nouveau-nés, la STB avant la sortie était inférieure au 40e percentile de la distribution par âge. Parmi ceux-ci, 310 nouveau-nés n’ont pas eu besoin de traitement ultérieur pour l’hyperbilirubinémie (valeur prédictive négative : 90,6 % et spécificité : 42,5 %). La valeur prédictive positive du seuil du 75e percentile était de 44,8 % et la valeur prédictive négative de 86,2 %. La courbe ROC présentée dans la figure 4 illustre la performance diagnostique de chaque seuil percentile avec une aire sous la courbe (statistique c) de 0,73.
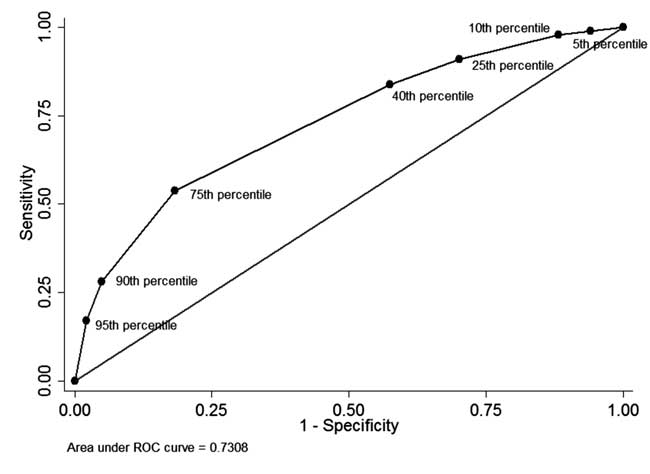
Fig. 4 La courbe ROC pour la capacité de diagnostic de différents seuils de percentile de la bilirubine totale sérique avant la décharge.
Le rapport de vraisemblance (LR) est un meilleur outil de mesure de la performance du test de diagnostic car le rapport n’est pas affecté par le changement de la prévalence de fond du résultat. Le LR d’un test positif (LR+, probabilité d’un test positif chez un malade/probabilité d’un test positif chez un non-malade) a été calculé pour chaque zone de délimitation du risque. Un STB avant la sortie de l’hôpital de ≥95e percentile a été attribué à la zone à haut risque, entre le 75e et le 94e centile à la zone à risque intermédiaire supérieur, entre le 40e et le 74e centile à la zone à risque intermédiaire inférieur et en dessous du 40e percentile à la zone à faible risque. Parmi les 49 nouveau-nés de la zone à haut risque, 34 ont développé une STB ; par conséquent, le RL positif pour la STB dans la zone à haut risque était de 8,26 (tableau II). Parmi les 190 nouveau-nés de la zone de risque intermédiaire supérieur, 73 ont développé une SHB ; par conséquent, le LR positif pour la STB dans cette zone de risque était de 2,30. De même, le LR positif pour la STB dans la zone de risque intermédiaire inférieur était de 0,76 et dans la zone de risque faible de 0,37.
TABLE IIPredictive Ability of Pre-discharge Serum Total Bilirubin for Subsequent Significant Hyperbilirubinemia (Need of Phototherapy)
| Bilirubine totale sérique avant la sortie | Résultat | Performance du test | |||||
| Zone de risque cumulé avant la sortie | Percentile | Total | SHB+ | SHB- | P :Un ratio | Probabilité de la maladie | LR+ |
| Haut risque | ≥95ème | 49 | 34 | 15 | 7:3 | 7/10 | 8.26 |
| Intermédiaire supérieur | 75ème à 94ème | 190 | 73 | 117 | 2:3 | 2/5 | 2.30 |
| Intermédiaire inférieur | 40ème à 74ème | 347 | 60 | 287 | 1:5 | 1/6 | 0.76 |
| Faible risque | <40ème | 342 | 32 | 310 | 1:10 | 1/11 | 0.37 |
| 928 | 199 | 729 | 1:4 | 1/5 | |||
| SHB : hyperbilirubinémie significative ; rapport P:A : Présence de résultat : Absence de résultat. | |||||||
Discussion
L’évaluation du risque de développement ultérieur de SHB avant la sortie de l’hôpital est recommandée comme une stratégie potentielle pour réduire l’incidence des dommages neurologiques ou de l’ictère nucléaire induits par la bilirubine. Dans cette étude de cohorte prospective, nous avons construit un nomogramme de bilirubine sérique spécifique à l’heure chez un sous-ensemble de nouveau-nés du nord de l’Inde et nous avons évalué l’efficacité de la démarcation du risque par la mesure de la BST avant la sortie de l’hôpital pour prédire le besoin ultérieur de photothérapie (SHB). L’incidence de base du SHB était élevée dans notre cohorte d’étude avec 2 nouveau-nés sur 10 développant un SHB. La localisation de la STB avant la sortie de l’hôpital dans deux zones à haut risque a augmenté de manière significative le risque de SHB ultérieur : 7 nouveau-nés sur 10 dans la zone à haut risque ont développé une SHB (LR positif = 8,26) et 4 nouveau-nés sur 10 dans la zone à risque intermédiaire supérieur ont développé une SHB (LR positif = 2,3). La localisation de la STB avant la sortie de l’hôpital dans la zone à faible risque a diminué de manière significative le risque de SHB ultérieure, 1 nouveau-né sur 10 développant une SHB (LR positif=0,37). Cependant, comme la valeur prédictive négative du seuil de faible risque n’était que de 90%, la localisation dans la zone à faible risque n’était pas en mesure d’exclure la possibilité d’un SHB ultérieur.
Bhutani, et al. ont montré dans une grande cohorte que les nouveau-nés avec une STB avant la décharge dans les zones de risque élevé et élevé-intermédiaire sont plus susceptibles d’avoir une SHB pendant le suivi. Les auteurs ont établi des graphiques percentiles du taux de bilirubine sérique à différents âges postnatals chez les nouveau-nés à court et à long terme. Ils ont constaté que 6,1 % des nouveau-nés avaient une bilirubine sérique >95e percentile avant leur sortie de l’hôpital ; 32,1 % de ces nourrissons ont ensuite présenté une hyperbilirubinémie. En comparaison avec le nomogramme horaire de Bhutani et al, les valeurs percentiles de la STB dans cette étude sont plus élevées de 2 mg/dL jusqu’à 84-108 heures d’âge postnatal. On a observé que les nouveau-nés d’origine nord-indienne atteignent des valeurs de bilirubine plus élevées et présentent une incidence plus importante d’hyperbilirubinémie. La STB moyenne de 7,0±2,0 mg/dL observée dans cette étude se situe entre le 75ème et le 95ème percentile du nomogramme de Bhutani. De même, Agarwal et al. ont rapporté une STB moyenne de 5,9±1,8 mg/dL à 24 heures d’âge postnatal, ce qui est proche du 75e percentile du nomogramme de Bhutani. La proportion plus élevée de nouveau-nés prématurés ou de faible poids de naissance et le taux plus élevé d’allaitement exclusif dans notre étude peuvent être les facteurs contribuant à l’augmentation des valeurs de STB et à l’incidence accrue de la SHB. En outre, notre décision d’utiliser la ligne médiane plutôt que la ligne supérieure des seuils de photothérapie de l’AAP, même chez les nouveau-nés à faible risque, a également augmenté l’incidence du SHB. Au-delà de 108 heures d’âge postnatal, les valeurs percentiles de la STB dans cette étude sont inférieures aux valeurs correspondantes du nomogramme de Bhutani. L’inclusion des valeurs de STB des nouveau-nés qui ont été suivis de manière sélective sur la base du jugement du clinicien pour la construction du nomogramme peut avoir entraîné l’utilisation de niveaux de STB plus élevés pour tracer le nomogramme de Bhutani, diminuant ainsi la généralisation de ce dernier. Dans la présente étude, étant donné que le suivi a été effectué quelle que soit la gravité de l’hyperbilirubinémie, le nomogramme atteint son maximum au 4e et 5e jour de l’âge postnatal avec un déclin naturel à la fin de la première semaine.
Dans une étude de cohorte prospective, Agarwal, et al. ont mesuré la STB à 24±6 h d’âge chez 220 nouveau-nés nés à ≥35 semaines de gestation pour prédire l’hyperbilirubinémie . L’absence de STB >6 mg/dL à 24±6 h d’âge a pratiquement exclu la possibilité d’une SHB ultérieure (rapport de vraisemblance du test négatif 0,07) dans les 5 jours suivant la naissance. Cependant, la mesure sélective des résultats chez les seuls nouveau-nés qui, au cours du suivi, présentaient un taux de bilirubine « clinique » de >10 mg/dL a introduit un biais de vérification dans l’étude. Dans une autre étude indienne, un seuil de 3,99 mg/dL à 18-24 h s’est avéré avoir une sensibilité et une spécificité de 67 % chacune pour la prédiction d’un taux de bilirubine ultérieur >15 mg/dL . Cependant, le suivi complet n’était présent que chez les nourrissons qui sont restés à l’hôpital soit pour une maladie néonatale, soit pour une raison maternelle, comme une césarienne. Plus de 50 % des nourrissons, qui étaient en bonne santé et ont donc pu sortir de l’hôpital plus tôt, n’ont pas été suivis. Une étude turque a présenté un nomogramme de bilirubine spécifique à l’heure chez les nouveau-nés dont l’âge gestationnel était compris entre 35 et 37 semaines. Une valeur de STB supérieure au 95
e percentile avait une valeur prédictive positive élevée pour le développement ultérieur de la SHB . Cependant, une valeur de STB inférieure au 30e percentile avait une valeur prédictive négative d’environ 90 %. Deux grandes études rétrospectives ont rapporté une excellente capacité prédictive de la mesure précoce/avant la sortie de l’hôpital de la STB avec une aire sous la courbe (AUC) de 0,83 . Dans notre étude, la capacité de discrimination des valeurs des 40e et 75e percentiles était plus faible que celles rapportées précédemment. Cela a déplacé la courbe ROC de notre étude vers la diagonale, ce qui a entraîné une diminution de la capacité de discrimination (AUC= 0,73). L’incidence de base élevée de la SHB en Turquie (25,3 %) et dans notre étude (20 %) peut expliquer l’incapacité des valeurs percentiles basses à exclure le développement de la SHB ultérieure, limitant ainsi l’utilité de la mesure de la STB avant la sortie.
Une autre stratégie d’évaluation du risque pour la prédiction d’un SHB ultérieur est l’évaluation des facteurs de risque cliniques. La gestation à la naissance, les antécédents de jaunisse nécessitant un traitement chez le frère ou la sœur précédent(e), la perfusion d’ocytocine, l’accouchement instrumental, le traumatisme de la naissance et l’alimentation inadéquate ont été impliqués comme facteurs de risque de SHB.
Cependant, la capacité de discrimination du modèle de risque clinique a été rapportée comme étant inférieure à celle de la mesure précoce de la STB. Newman et al. ont signalé une meilleure capacité de discrimination lorsqu’un instrument de risque clinique était combiné à une mesure précoce de la STB. En raison de la proportion importante de nouveau-nés de faible poids de naissance et prématurés dans notre cohorte, nous supposons que la combinaison de ces facteurs de risque cliniques objectivement mesurables avec la mesure précoce de la STB générerait un modèle de risque avec une meilleure capacité de discrimination.
L’applicabilité externe des observations faites dans cette étude peut être influencée par l’incidence relativement élevée de l’hyperbilirubinémie dans la cohorte étudiée en raison de l’utilisation de seuils de bilirubine plus bas pour commencer la photothérapie. Contrairement aux pays développés, l’ictère nucléaire a été signalé à des niveaux plus faibles de bilirubine maximale en Inde, ce qui indique que les nouveau-nés indiens peuvent développer des dommages neurologiques induits par la bilirubine à des niveaux de bilirubine sérique maximale plus faibles. En outre, environ un tiers des nouveau-nés indiens ont un poids insuffisant à la naissance. Pour ces raisons, le Forum national de néonatologie de l’Inde suggère, dans ses directives, d’utiliser des seuils plus bas pour commencer la photothérapie, en particulier dans les régions où l’incidence du déficit en glucose-6-phosphate déshydrogénase est plus élevée.
Les points forts de notre étude comprennent un plan d’étude prospectif, un grand échantillon, un taux de suivi de plus de 90 % et l’absence de biais de vérification. Nous n’avons pas pu vérifier l’occurrence des résultats chez environ 7% des nouveau-nés inscrits. Cependant, comme la STB précoce et les caractéristiques démographiques de ces nouveau-nés perdus de vue étaient similaires à celles des nouveau-nés qui n’ont jamais développé de SHB, il est peu probable que le nomogramme spécifique à l’heure et l’instrument d’évaluation des risques soient affectés. Nous n’avons pas utilisé la chromatographie liquide à haute performance (HPLC), qui est la méthode de référence pour mesurer la bilirubine. Nous avons mesuré la bilirubine par spectrophotométrie, une méthode plus couramment utilisée au chevet du patient. Le bilimètre utilisé dans notre étude avait un faible coefficient de variation et il était calibré avant chaque utilisation.
Nous recommandons qu’étant donné que les nouveau-nés présentant une STB avant la sortie de l’hôpital dans une zone à risque élevé ou intermédiaire élevé ont une forte probabilité de développer une SHB précoce, un suivi fréquent doit être assuré. Dans les contextes où un suivi étroit n’est pas possible, on peut envisager de retarder la sortie de l’hôpital jusqu’à ce que la bilirubine tombe dans les zones de risque inférieures. Les nouveau-nés dont la STB avant la sortie de l’hôpital se situe dans les zones de risque inférieur-intermédiaire ou faible peuvent sortir de l’hôpital conformément à la politique locale. Cependant, un suivi adéquat doit être assuré car le développement ultérieur de la SHB ne peut être exclu.
En conclusion, malgré une capacité de discrimination passable, le niveau plus élevé de suivi dans notre étude augmente la confiance dans la capacité de la STB avant la sortie pour prédire la SHB chez les nourrissons indiens. D’autres études sont nécessaires pour valider la performance des zones de démarcation du risque définies dans ce nomogramme de bilirubine spécifique à l’heure.
Contributeurs : DC : a conceptualisé et conçu l’étude ; UP et SK : ont collecté les données ; DC : a analysé les données ; UP : a rédigé l’article avec des contributions critiques de DC, SK et SJ. Tous les auteurs approuvent la version finale du manuscrit pour soumission.
Financement : Aucun ; Intérêts concurrents : Aucun déclaré.
1. Rapport 2002-2003 : Réseau national de bases de données périnatales néonatales. New Delhi : National Neonatology Forum of India ; 2004.
2. Watchko JF. Identification des nouveau-nés à risque d’hyperbilirubinémie dangereuse : perspectives cliniques émergentes. Pediatr Clin North Am. 2009;56:671-87.
3. Gestion de l’hyperbilirubinémie chez le nouveau-né de 35 semaines de gestation ou plus. Pédiatrie. 2004;114:297-316.
4. Lodha R, Deorari AK, Jatana V, Paul VK. Estimation non invasive de la bilirubine sérique totale par réflectance spectrale multi-longueur d’onde chez les nouveau-nés. Indian Pediatr. 2000;37:771-5.
5. Agarwal R, Kaushal M, Aggarwal R, Paul VK, Deorari AK. Hyperbilirubinémie néonatale précoce en utilisant le taux de bilirubine sérique du premier jour. Indian Pediatr. 2002;39:724-30.
6. Stevenson DK, Fanaroff AA, Maisels MJ, Young BW, Wong RJ, Vreman HJ, et al. Prediction of hyperbilirubinemia in near-term and term infants. Pediatrics 2001;108:31-39.
7. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Mesure non invasive de la bilirubine sérique totale dans une population multiraciale de nouveau-nés avant le congé pour évaluer le risque d’hyperbilirubinémie grave. Pediatrics. 2000;106:E17.
8. Bhutani VK, Johnson L, Sivieri EM. Capacité prédictive d’une bilirubine sérique spécifique à l’heure avant la sortie de l’hôpital pour une hyperbilirubinémie significative ultérieure chez les nouveau-nés à terme et proches du terme en bonne santé. Pediatrics. 1999;103:6-14.
9. Ip S, Chung M, Kulig J, O’Brien R, Sege R, Glicken S, et al. Un examen fondé sur des preuves des questions importantes concernant l’hyperbilirubinémie néonatale. Pediatrics. 2004;114:e130-53.
10. Trikalinos TA, Chung M, Lau J, Ip S. Examen systématique du dépistage de l’encéphalopathie à la bilirubine chez les nouveau-nés. Pediatrics. 2009;124:1162-71.
11. Carley S, Dosman S, Jones SR, Harrison M. Nomogrammes simples pour calculer la taille de l’échantillon dans les études de diagnostic. Emerg Med J. 2005;22:180-1.
12. Fay DL, Schellhase KG, Suresh GK. Dépistage de la bilirubine chez les nouveau-nés normaux : une critique du nomogramme de la bilirubine spécifique à l’heure. Pediatrics. 2009;124:1203-5.
13. Awasthi S, Rehman H. Prédiction précoce de l’hyperbilirubinémie néonatale. Indian J Pediatr. 1998;65:131-9.
14. Sarici SU, Serdar MA, Korkmaz A, Erdem G, Oran O, Tekinalp G, et al. Incidence, évolution et prédiction de l’hyperbilirubinémie chez les nouveau-nés à court et à terme. Pediatrics. 2004;113:775-80.
15. Keren R, Bhutani VK, Luan X, Nihtianova S, Cnaan A, Schwartz JS. Identifier les nouveau-nés à risque d’hyperbilirubinémie significative : une comparaison de deux approches recommandées. Arch Dis Child. 2005;90:415-21.
16. Newman TB, Liljestrand P, Escobar GJ. Combiner les facteurs de risque cliniques avec les niveaux de bilirubine sérique pour prédire l’hyperbilirubinémie chez les nouveau-nés. Arch Pediatr Adolesc Med. 2005;159:113-9.
17. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Prévision et prévention de l’hyperbilirubinémie néonatale extrême dans une organisation de maintenance de la santé mature. Arch Pediatr Adolesc Med. 2000;154 : 1140-7.
18. Keren R, Luan X, Friedman S, Saddlemire S, Cnaan A, Bhutani VK. A comparison of alternative risk-assessment strategies for predicting significant neonatal hyperbilirubinemia in term and near-term infants. Pediatrics. 2008;121:e170-9.
19. Murki S, Kumar P, Majumdar S, Marwaha N, Narang A. Risk factors for kernicterus in term babies with non-hemolytic jaundice. Indian Pediatr. 2001;38:757-62.
20. Agrawal VK, Shukla R, Misra PK, Kapoor RK, Malik GK. Réponse évoquée auditive du tronc cérébral chez les nouveau-nés atteints d’hyperbilirubinémie. Indian Pediatr. 1998;35:513-8.
21. Kumar P, Jain N, Thakre R, Murki S, Venkataseshan S (eds). Directives de pratique clinique fondées sur des données probantes. National Neonatology Forum of India, New Delhi, Inde, 2010.
22. Kaur G, Srivastav J, Jain S, Chawla D, Chavan BS, Atwal R, et al. Preliminary report on neonatal screening for congenital hypothyroidism, congenital adrenal hyperplasia and glucose-6-phosphate dehydrogenase deficiency : a Chandigarh experience. Indian J Pediatr. 2010;77:969-73.
