Lernziele
- Erläutern Sie den Aufbau und die Verwendung eines typischen Phasendiagramms
- Wenden Sie Phasendiagramme an, um stabile Phasen bei bestimmten Temperaturen und Drücken zu identifizieren, und Phasenübergänge zu beschreiben, die sich aus Änderungen dieser Eigenschaften ergeben
- Beschreiben Sie die überkritische flüssige Phase der Materie
Im vorhergehenden Modul wurde die Veränderung des Gleichgewichtsdampfdrucks einer Flüssigkeit mit der Temperatur beschrieben. Unter Berücksichtigung der Definition des Siedepunkts wird anhand der Darstellung des Dampfdrucks in Abhängigkeit von der Temperatur gezeigt, wie sich der Siedepunkt der Flüssigkeit mit dem Druck verändert. Außerdem wurde die Verwendung von Heiz- und Kühlkurven zur Bestimmung des Schmelz- (oder Gefrier-) Punktes einer Substanz beschrieben. Die Durchführung solcher Messungen über einen breiten Druckbereich liefert Daten, die in Form eines Phasendiagramms grafisch dargestellt werden können. Ein Phasendiagramm ist eine Kombination von Druck und Temperatur für die Phasenübergangsgleichgewichte einer Substanz zwischen flüssig und gasförmig, fest und flüssig sowie fest und gasförmig. Diese Diagramme zeigen die physikalischen Zustände an, die unter bestimmten Druck- und Temperaturbedingungen existieren, und geben auch die Druckabhängigkeit der Phasenübergangstemperaturen (Schmelzpunkte, Sublimationspunkte, Siedepunkte) an. Ein typisches Phasendiagramm für eine reine Substanz ist in Abbildung 1 dargestellt.
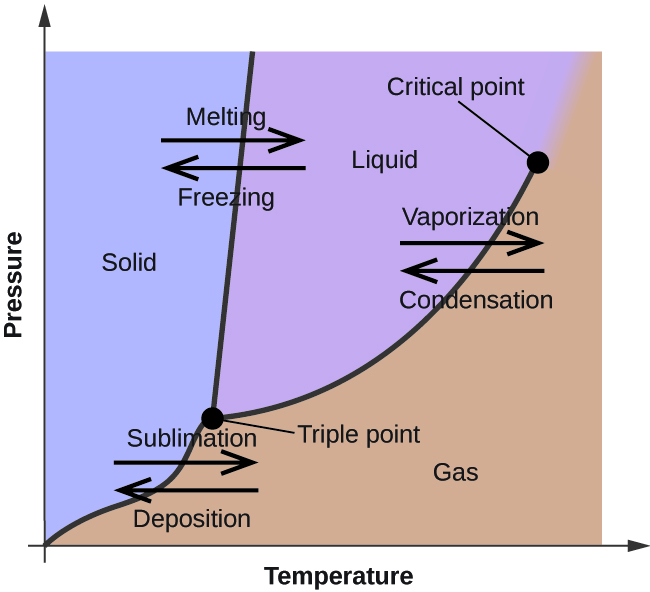
Um die Nützlichkeit dieser Darstellungen zu veranschaulichen, betrachten wir das Phasendiagramm für Wasser in Abbildung 2.
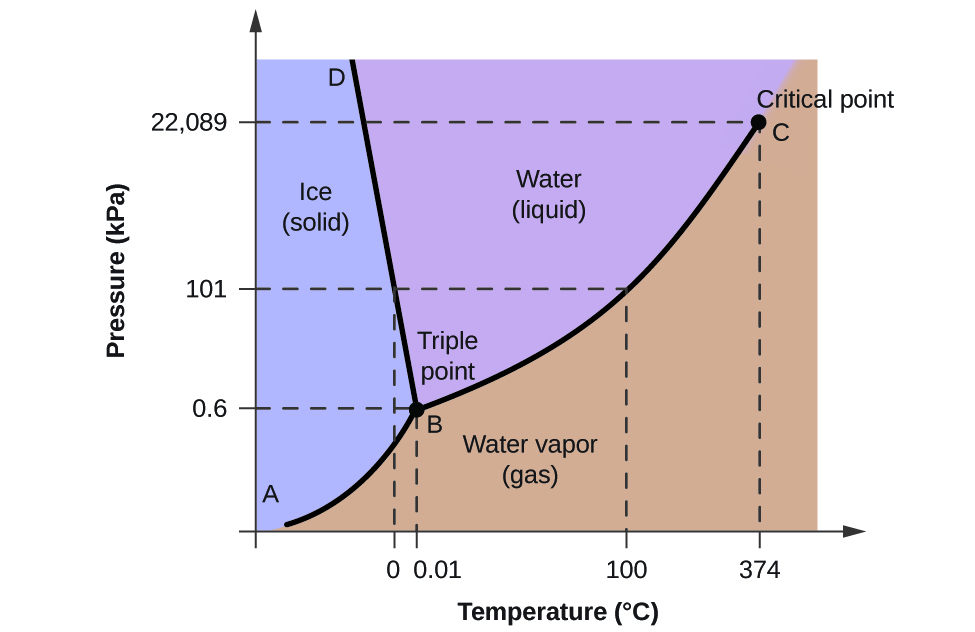
Wir können das Phasendiagramm verwenden, um den physikalischen Zustand einer Wasserprobe unter bestimmten Druck- und Temperaturbedingungen zu bestimmen. Zum Beispiel entsprechen ein Druck von 50 kPa und eine Temperatur von -10 °C dem Bereich des Diagramms, der mit „Eis“ bezeichnet ist. Unter diesen Bedingungen existiert Wasser nur als Feststoff (Eis). Ein Druck von 50 kPa und eine Temperatur von 50 °C entsprechen dem Bereich „Wasser“ – hier existiert Wasser nur als Flüssigkeit. Bei 25 kPa und 200 °C liegt Wasser nur im gasförmigen Zustand vor. Man beachte, dass im H2O-Phasendiagramm die Druck- und Temperaturachsen nicht auf einer konstanten Skala gezeichnet sind, um einige wichtige Merkmale, wie sie hier beschrieben werden, zu veranschaulichen.
Die Kurve BC in Abbildung 2 ist die Darstellung des Dampfdrucks in Abhängigkeit von der Temperatur, wie sie im vorherigen Modul dieses Kapitels beschrieben wurde. Diese „Flüssig-Dampf“-Kurve trennt die flüssigen und gasförmigen Bereiche des Phasendiagramms und gibt den Siedepunkt von Wasser bei jedem Druck an. Bei 1 atm beträgt der Siedepunkt zum Beispiel 100 °C. Beachten Sie, dass die Flüssigkeits-Dampf-Kurve bei einer Temperatur von 374 °C und einem Druck von 218 atm endet, was bedeutet, dass Wasser oberhalb dieser Temperatur unabhängig vom Druck nicht als Flüssigkeit existieren kann. Die physikalischen Eigenschaften von Wasser unter diesen Bedingungen liegen zwischen denen der flüssigen und der gasförmigen Phase. Dieser einzigartige Zustand der Materie wird als überkritisches Fluid bezeichnet, ein Thema, das im nächsten Abschnitt dieses Moduls beschrieben wird.
Die Feststoff-Dampf-Kurve, die in Abbildung 2 mit AB bezeichnet ist, gibt die Temperaturen und Drücke an, bei denen sich Eis und Wasserdampf im Gleichgewicht befinden. Diese Temperatur-Druck-Datenpaare entsprechen den Sublimations- oder Ablagerungspunkten für Wasser. Wenn wir die Feststoff-Gas-Linie in Abbildung 2 heranzoomen könnten, würden wir sehen, dass Eis bei -10 °C einen Dampfdruck von etwa 0,20 kPa hat. Legt man also eine gefrorene Probe in ein Vakuum mit einem Druck von weniger als 0,20 kPa, so sublimiert das Eis. Dies ist die Grundlage für das „Gefriertrocknungsverfahren“, das häufig zur Konservierung von Lebensmitteln verwendet wird, wie z. B. bei dem in Abbildung 3 dargestellten Speiseeis.

Die mit BD bezeichnete Fest-Flüssig-Kurve zeigt die Temperaturen und Drücke, bei denen sich Eis und flüssiges Wasser im Gleichgewicht befinden, was die Schmelz-/Gefrierpunkte für Wasser darstellt. Man beachte, dass diese Kurve eine leicht negative Steigung aufweist (zur Verdeutlichung stark übertrieben), was darauf hinweist, dass der Schmelzpunkt von Wasser mit steigendem Druck leicht sinkt. Wasser ist in dieser Hinsicht eine ungewöhnliche Substanz, denn bei den meisten Substanzen steigt der Schmelzpunkt mit zunehmendem Druck. Dieses Verhalten ist teilweise für die Bewegung von Gletschern, wie in Abbildung 4 dargestellt, verantwortlich. Der Boden eines Gletschers erfährt durch sein Gewicht einen immensen Druck, der einen Teil des Eises zum Schmelzen bringen kann, so dass sich eine Schicht aus flüssigem Wasser bildet, auf der der Gletscher leichter gleiten kann.

Der Schnittpunkt aller drei Kurven ist in Abbildung 2 mit B gekennzeichnet. Bei dem Druck und der Temperatur, die durch diesen Punkt dargestellt werden, befinden sich alle drei Phasen des Wassers im Gleichgewicht. Dieses Temperatur/Druck-Datenpaar wird als Tripelpunkt bezeichnet. Bei einem Druck unterhalb des Tripelpunkts kann Wasser unabhängig von der Temperatur nicht als Flüssigkeit existieren.
Beispiel 1
Bestimmen Sie den Zustand von Wasser
Bestimmen Sie anhand des Phasendiagramms für Wasser in Abbildung 2 den Zustand von Wasser bei den folgenden Temperaturen und Drücken:
(a) -10 °C und 50 kPa
(b) 25 °C und 90 kPa
(c) 50 °C und 40 kPa
(d) 80 °C und 5 kPa
(e) -10 °C und 0.3 kPa
(f) 50 °C und 0,3 kPa
Lösung
Anhand des Phasendiagramms für Wasser kann man feststellen, dass der Zustand von Wasser bei jeder angegebenen Temperatur und jedem angegebenen Druck wie folgt ist: (a) fest; (b) flüssig; (c) flüssig; (d) gasförmig; (e) fest; (f) gasförmig.
Kontrolliere dein Wissen
Welchen Phasenänderungen kann Wasser bei Temperaturänderungen unterliegen, wenn der Druck bei 0,3 kPa gehalten wird? Wenn der Druck bei 50 kPa gehalten wird?
Antwort:
Bei 0,3 kPa: \bei -58 °C. Bei 50 kPa: \text{s}\;{\longrightarrow}\;\text{l} bei 0 °C, \text{l}\;{\longrightarrow}\;\text{g} bei 78 °C
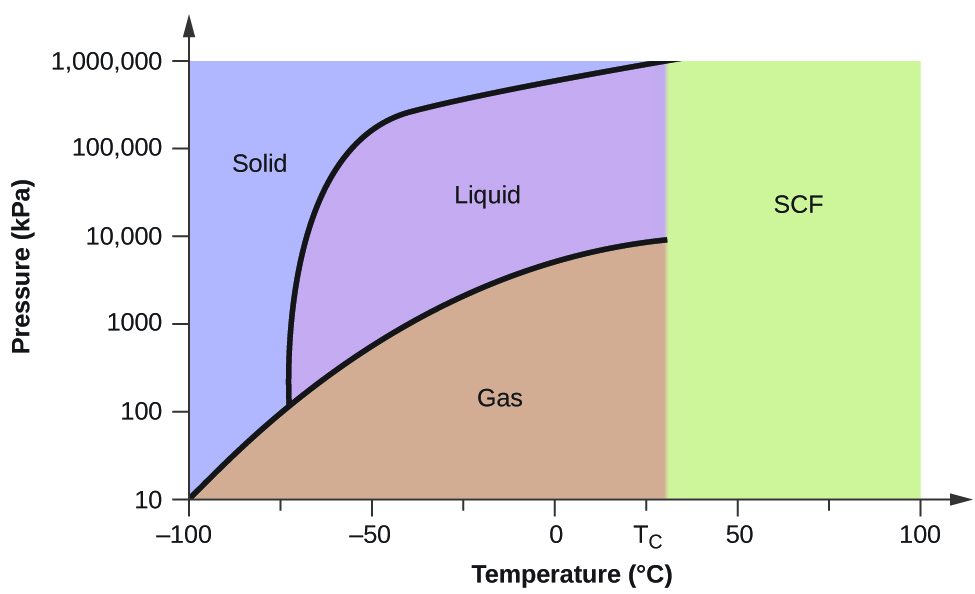
Betrachten Sie als weiteres Beispiel das in Abbildung 5 dargestellte Phasendiagramm für Kohlendioxid. Die Fest-Flüssig-Kurve weist eine positive Steigung auf, was darauf hindeutet, dass der Schmelzpunkt von CO2 mit dem Druck ansteigt, wie es bei den meisten Substanzen der Fall ist (Wasser ist eine bemerkenswerte Ausnahme, wie zuvor beschrieben). Beachten Sie, dass der Tripelpunkt deutlich über 1 atm liegt, was bedeutet, dass Kohlendioxid unter Umgebungsdruck nicht als Flüssigkeit existieren kann. Stattdessen führt die Abkühlung von gasförmigem Kohlendioxid bei 1 atm dazu, dass es sich in einen festen Zustand umwandelt. Ebenso schmilzt festes Kohlendioxid bei einem Druck von 1 atm nicht, sondern sublimiert zu gasförmigem CO2. Schließlich ist zu beachten, dass der kritische Punkt für Kohlendioxid bei einer relativ niedrigen Temperatur und einem relativ niedrigen Druck im Vergleich zu Wasser liegt.
Beispiel 2
Bestimmen des Zustands von Kohlendioxid
Bestimmen Sie unter Verwendung des in Abbildung 5 dargestellten Phasendiagramms für Kohlendioxid den Zustand von CO2 bei den folgenden Temperaturen und Drücken:
(a) -30 °C und 2000 kPa
(b) -60 °C und 1000 kPa
(c) -60 °C und 100 kPa
(d) 20 °C und 1500 kPa
(e) 0 °C und 100 kPa
(f) 20 °C und 100 kPa
Lösung
Unter Verwendung des Phasendiagramms für Kohlendioxid können wir feststellen, dass der Zustand von CO2 bei jeder angegebenen Temperatur und jedem angegebenen Druck wie folgt ist: (a) flüssig; (b) fest; (c) gasförmig; (d) flüssig; (e) gasförmig; (f) gasförmig.
Kontrollieren Sie Ihr Wissen
Bestimmen Sie die Phasenänderungen, die Kohlendioxid durchläuft, wenn seine Temperatur variiert wird und sein Druck bei 1500 kPa konstant bleibt? Bei 500 kPa? Bei welchen ungefähren Temperaturen treten diese Phasenänderungen auf?
Antwort:
bei 1500 kPa: \text{s}\;{\longrightarrow}\;\text{l} bei -45 °C, \text{l}\;{\longrightarrow}\;\text{g} bei -10 °C;
bei 500 kPa: \text{s}\;{\longrightarrow}\;\text{g} bei -58 °C
Wenn man eine Wasserprobe bei 25 °C in einen verschlossenen Behälter gibt, die Luft entfernt und das Verdampfungs-Kondensations-Gleichgewicht eintreten lässt, erhält man eine Mischung aus flüssigem Wasser und Wasserdampf bei einem Druck von 0,03 atm. Es ist eine deutliche Grenze zwischen der dichteren Flüssigkeit und dem weniger dichten Gas zu erkennen. Mit steigender Temperatur nimmt der Druck des Wasserdampfes zu, wie es die Flüssig-Gas-Kurve im Phasendiagramm für Wasser beschreibt (Abbildung 2), und es bleibt ein Zweiphasengleichgewicht zwischen flüssiger und gasförmiger Phase bestehen. Bei einer Temperatur von 374 °C ist der Dampfdruck auf 218 atm angestiegen, und jede weitere Temperaturerhöhung führt zum Verschwinden der Grenze zwischen flüssiger und gasförmiger Phase. Das gesamte Wasser im Behälter liegt nun in einer einzigen Phase vor, deren physikalische Eigenschaften zwischen denen des gasförmigen und des flüssigen Zustands liegen. Diese Phase der Materie wird als überkritische Flüssigkeit bezeichnet, und die Temperatur und der Druck, oberhalb derer diese Phase existiert, ist der kritische Punkt (Abbildung 6). Oberhalb der kritischen Temperatur kann ein Gas nicht mehr verflüssigt werden, egal wie viel Druck ausgeübt wird. Der Druck, der erforderlich ist, um ein Gas bei seiner kritischen Temperatur zu verflüssigen, wird als kritischer Druck bezeichnet. Die kritischen Temperaturen und kritischen Drücke einiger gängiger Stoffe sind in Tabelle 6 angegeben.
| Stoff | Kritische Temperatur (K) | Kritischer Druck (atm) |
|---|---|---|
| Wasserstoff | 33.2 | 12.8 |
| Stickstoff | 126.0 | 33.5 |
| Sauerstoff | 154.3 | 49.7 |
| Kohlendioxid | 304.2 | 73.0 |
| Ammoniak | 405.5 | 111.5 |
| Schwefeldioxid | 430.3 | 77.7 |
| Wasser | 647.1 | 217.7 |
| Tabelle 6. | ||

Beobachten Sie den Übergang von flüssigem zu überkritischem Fluid für Kohlendioxid.
Wie ein Gas dehnt sich ein überkritisches Fluid aus und füllt einen Behälter, aber seine Dichte ist viel größer als die typische Gasdichte und liegt in der Regel nahe der von Flüssigkeiten. Ähnlich wie Flüssigkeiten sind diese Fluide in der Lage, nichtflüchtige gelöste Stoffe aufzulösen. Sie weisen jedoch im Wesentlichen keine Oberflächenspannung und eine sehr niedrige Viskosität auf, so dass sie sehr kleine Öffnungen in einem festen Gemisch effektiver durchdringen und lösliche Bestandteile entfernen können. Diese Eigenschaften machen überkritische Fluide zu äußerst nützlichen Lösungsmitteln für eine Vielzahl von Anwendungen. So ist überkritisches Kohlendioxid in der Lebensmittelindustrie zu einem sehr beliebten Lösungsmittel geworden, das zur Entkoffeinierung von Kaffee, zur Entfernung von Fetten aus Kartoffelchips und zur Extraktion von Geschmacks- und Duftstoffen aus Zitrusölen verwendet wird. Es ist ungiftig, relativ preiswert und gilt nicht als Schadstoff. Nach der Verwendung kann das CO2 leicht zurückgewonnen werden, indem man den Druck verringert und das entstehende Gas auffängt.
Beispiel 3
Die kritische Temperatur von Kohlendioxid
Wenn man an einem kühlen Tag (18 °C) einen Kohlendioxid-Feuerlöscher schüttelt, hört man flüssiges CO2 in der Flasche herumschwappen. An einem heißen Sommertag (35 °C) scheint die gleiche Flasche jedoch keine Flüssigkeit zu enthalten. Erkläre diese Beobachtungen.
Lösung
Am kühlen Tag liegt die Temperatur des CO2 unter der kritischen Temperatur von CO2, 304 K oder 31 °C (Tabelle 6), so dass flüssiges CO2 in der Flasche vorhanden ist. An einem heißen Tag liegt die Temperatur des CO2 über der kritischen Temperatur von 31 °C. Oberhalb dieser Temperatur kann kein Druck CO2 verflüssigen, so dass kein flüssiges CO2 im Feuerlöscher vorhanden ist.
Kontrolliere dein Wissen
Ammoniak kann durch Kompression bei Raumtemperatur verflüssigt werden; Sauerstoff kann unter diesen Bedingungen nicht verflüssigt werden. Warum verhalten sich die beiden Gase unterschiedlich?
Antwort:
Die kritische Temperatur von Ammoniak liegt bei 405,5 K, also über der Raumtemperatur. Die kritische Temperatur von Sauerstoff liegt unter der Raumtemperatur; daher kann Sauerstoff nicht bei Raumtemperatur verflüssigt werden.
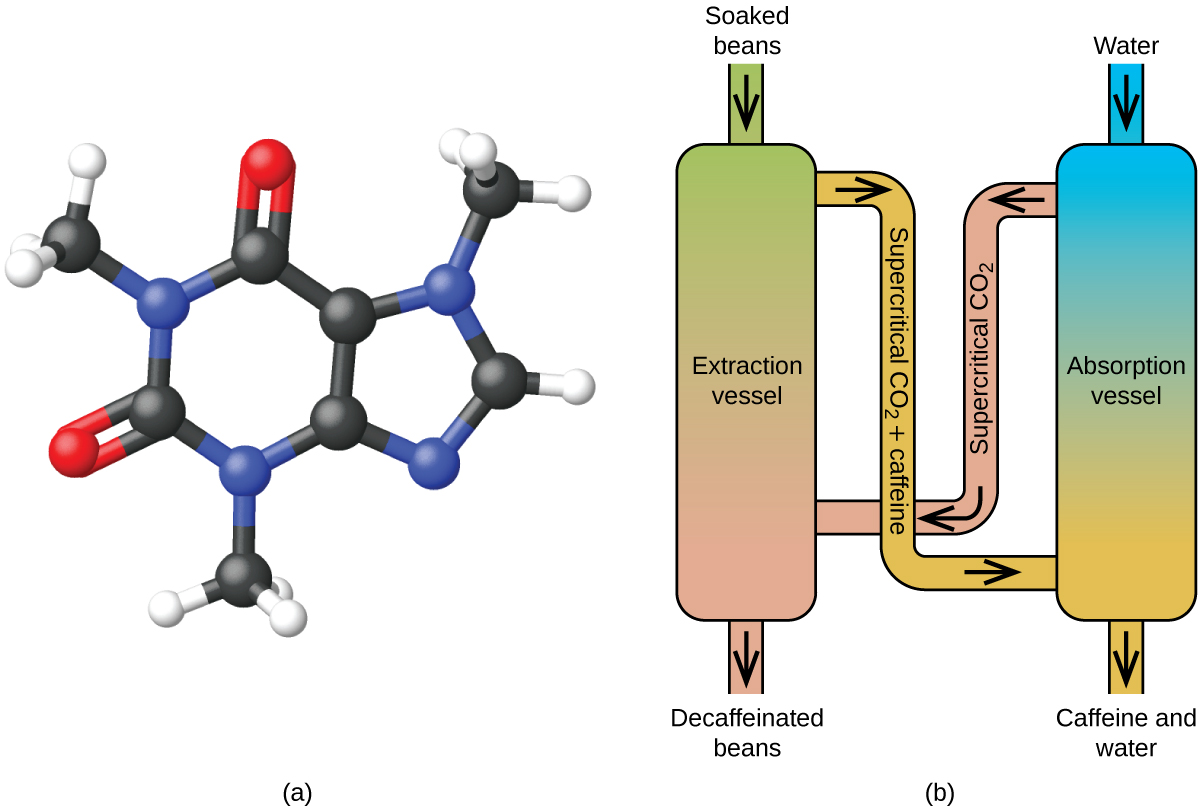
Entkoffeinierung von Kaffee mit überkritischem CO2
Kaffee ist nach Erdöl der weltweit am zweithäufigsten gehandelte Rohstoff. Überall auf der Welt lieben die Menschen das Aroma und den Geschmack von Kaffee. Viele von uns verlassen sich auch auf einen Bestandteil des Kaffees – das Koffein – um morgens in Schwung zu kommen oder nachmittags wach zu bleiben. Am späten Abend kann die anregende Wirkung des Kaffees jedoch vom Schlafen abhalten, so dass Sie sich dafür entscheiden, abends entkoffeinierten Kaffee zu trinken.
Seit den frühen 1900er Jahren wurden viele Methoden zur Entkoffeinierung von Kaffee verwendet. Alle haben Vor- und Nachteile, und alle hängen von den physikalischen und chemischen Eigenschaften des Koffeins ab. Da Koffein ein eher polares Molekül ist, löst es sich gut in Wasser, einer polaren Flüssigkeit. Da sich jedoch viele der über 400 anderen Verbindungen, die für den Geschmack und das Aroma des Kaffees verantwortlich sind, ebenfalls in H2O lösen, können bei der Entkoffeinierung mit heißem Wasser auch einige dieser Verbindungen entfernt werden, was sich nachteilig auf den Geruch und den Geschmack des entkoffeinierten Kaffees auswirkt. Dichlormethan (CH2Cl2) und Ethylacetat (CH3CO2C2H5) haben eine ähnliche Polarität wie Koffein und sind daher sehr effektive Lösungsmittel für die Koffeinextraktion, aber beide entfernen auch einige Geschmacks- und Aromakomponenten, und ihre Verwendung erfordert lange Extraktions- und Reinigungszeiten. Da beide Lösungsmittel giftig sind, wurden gesundheitliche Bedenken hinsichtlich der Auswirkungen der im entkoffeinierten Kaffee verbleibenden Lösungsmittelreste geäußert.
Die überkritische Fluidextraktion mit Kohlendioxid wird jetzt weithin als wirksamere und umweltfreundlichere Entkoffeinierungsmethode eingesetzt (Abbildung 7). Bei Temperaturen über 304,2 K und Drücken über 7376 kPa ist CO2 ein überkritisches Fluid, das sowohl gasförmige als auch flüssige Eigenschaften besitzt. Wie ein Gas dringt es tief in die Kaffeebohnen ein; wie eine Flüssigkeit löst es bestimmte Stoffe auf. Bei der überkritischen Kohlendioxid-Extraktion von gedämpften Kaffeebohnen werden 97-99 % des Koffeins entfernt, während die Geschmacks- und Aromastoffe des Kaffees erhalten bleiben. Da CO2 unter Standardbedingungen ein Gas ist, lässt es sich leicht aus den extrahierten Kaffeebohnen entfernen, ebenso wie das Koffein aus dem Extrakt gewonnen werden kann. Das mit diesem Verfahren aus den Kaffeebohnen gewonnene Koffein ist ein wertvolles Produkt, das anschließend als Zusatz zu anderen Lebensmitteln oder Medikamenten verwendet werden kann.
Schlüsselbegriffe und Zusammenfassung
Die Temperatur- und Druckbedingungen, bei denen ein Stoff in festem, flüssigem und gasförmigem Zustand vorliegt, werden in einem Phasendiagramm für diesen Stoff zusammengefasst. Phasendiagramme sind kombinierte Darstellungen von drei Druck-Temperatur-Gleichgewichtskurven: fest-flüssig, flüssig-gas und fest-gas. Diese Kurven stellen die Beziehungen zwischen Phasenübergangstemperaturen und -drücken dar. Der Schnittpunkt aller drei Kurven stellt den Tripelpunkt der Substanz dar – die Temperatur und der Druck, bei denen alle drei Phasen im Gleichgewicht sind. Bei Drücken unterhalb des Tripelpunkts kann eine Substanz unabhängig von ihrer Temperatur nicht im flüssigen Zustand existieren. Der Endpunkt der Flüssigkeits-Gas-Kurve stellt den kritischen Punkt der Substanz dar, also den Druck und die Temperatur, oberhalb derer eine flüssige Phase nicht existieren kann.
Chemie Ende des Kapitels Übungen
- Bestimmen Sie aus dem Phasendiagramm für Wasser (Abbildung 2) den Zustand von Wasser bei:
(a) 35 °C und 85 kPa
(b) -15 °C und 40 kPa
(c) -15 °C und 0.1 kPa
(d) 75 °C und 3 kPa
(e) 40 °C und 0,1 kPa
(f) 60 °C und 50 kPa
- Welche Phasenumwandlungen finden statt, wenn Wasser bei einer konstanten Temperatur von 0,005 °C einem unterschiedlichen Druck ausgesetzt wird? Bei 40 °C? Bei -40 °C?
- Durch Schnellkochtöpfe werden Lebensmittel schneller gar, weil der höhere Druck im Schnellkochtopf die Siedetemperatur des Wassers erhöht. Ein bestimmter Schnellkochtopf hat ein Sicherheitsventil, das so eingestellt ist, dass Dampf abgelassen wird, wenn der Druck 3,4 atm übersteigt. Was ist die ungefähre Höchsttemperatur, die in diesem Schnellkochtopf erreicht werden kann? Erläutern Sie Ihre Überlegungen.
- Bestimmen Sie anhand des Phasendiagramms für Kohlendioxid in Abbildung 5 den Zustand von CO2 bei:
(a) 20 °C und 1000 kPa
(b) 10 °C und 2000 kPa
(c) 10 °C und 100 kPa
(d) -40 °C und 500 kPa
(e) -80 °C und 1500 kPa
(f) -80 °C und 10 kPa
- Bestimmen Sie die Phasenänderungen, die Kohlendioxid bei Druckänderungen erfährt, wenn die Temperatur bei -50 °C gehalten wird? Wenn die Temperatur bei -40 °C gehalten wird? Bei 20 °C? (Siehe das Phasendiagramm in Abbildung 5.)
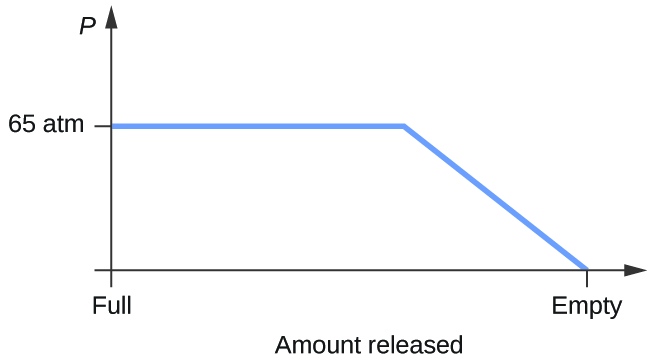
- Betrachten Sie einen Zylinder mit einem Gemisch aus flüssigem Kohlendioxid im Gleichgewicht mit gasförmigem Kohlendioxid bei einem Anfangsdruck von 65 atm und einer Temperatur von 20 °C. Skizzieren Sie ein Diagramm, das die Änderung des Zylinderdrucks mit der Zeit darstellt, wenn gasförmiges Kohlendioxid bei konstanter Temperatur freigesetzt wird.
- Trockeneis, CO2(s), schmilzt nicht bei atmosphärischem Druck. Es sublimiert bei einer Temperatur von -78 °C. Welches ist der niedrigste Druck, bei dem CO2(s) zu CO2(l) schmilzt? Bei welcher Temperatur wird dies ungefähr geschehen? (Siehe Abbildung 5 für das Phasendiagramm.)
- Wenn ein schwerer Sturm zu einem Stromausfall führt, kann es notwendig sein, eine Wäscheleine zum Trocknen der Wäsche zu benutzen. In vielen Teilen des Landes friert die Wäsche im tiefen Winter schnell ein, wenn sie auf der Leine hängt. Wenn es nicht schneit, wird die Wäsche trotzdem trocknen? Erkläre deine Antwort.
- Ist es möglich, Stickstoff bei Raumtemperatur (etwa 25 °C) zu verflüssigen? Ist es möglich, Schwefeldioxid bei Raumtemperatur zu verflüssigen? Erläutern Sie Ihre Antworten.
- Elementarer Kohlenstoff hat eine Gasphase, eine flüssige Phase und zwei verschiedene feste Phasen, wie im Phasendiagramm dargestellt:
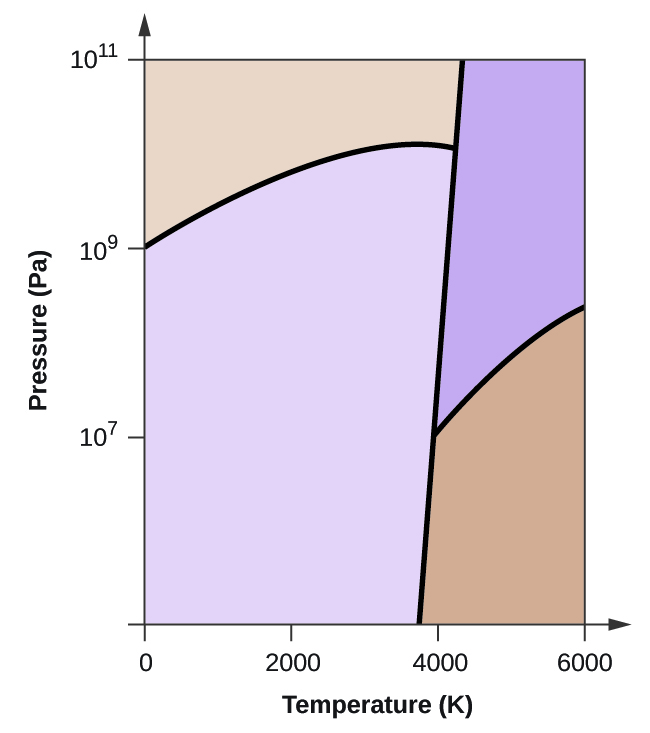
(a) Beschriften Sie im Phasendiagramm die gasförmigen und flüssigen Bereiche.
(b) Graphit ist die stabilste Phase des Kohlenstoffs unter normalen Bedingungen. Beschriften Sie im Phasendiagramm die Graphitphase.
(c) Wenn Graphit unter normalen Bedingungen auf 2500 K erhitzt wird und der Druck auf 1010 Pa erhöht wird, wandelt er sich in Diamant um. Beschriften Sie die Diamantphase.
(d) Kreisen Sie jeden Tripelpunkt im Phasendiagramm ein.
(e) In welcher Phase liegt Kohlenstoff bei 5000 K und 108 Pa vor?
(f) Wenn die Temperatur einer Kohlenstoffprobe bei einem konstanten Druck von 106 Pa von 3000 K auf 5000 K ansteigt, welcher Phasenübergang tritt gegebenenfalls ein?
Glossar
Kritischer Punkt Temperatur und Druck, oberhalb derer ein Gas nicht zu einer Flüssigkeit kondensiert werden kann Phasendiagramm Druck-Temperatur-Diagramm, das die Bedingungen zusammenfasst, unter denen die Phasen eines Stoffes existieren können Überkritische flüssige Substanz bei einer Temperatur und einem Druck, die höher sind als ihr kritischer Punkt; weist Eigenschaften auf, die zwischen denen des gasförmigen und des flüssigen Zustands liegen Dreifachpunkt Temperatur und Druck, bei denen die Dampf-, Flüssig- und Festphasen einer Substanz im Gleichgewicht sind
Lösungen
Antworten auf Chemieübungen am Ende des Kapitels
2. Bei niedrigem Druck und 0,005 °C ist das Wasser ein Gas. Wenn der Druck auf 4,6 Torr ansteigt, wird das Wasser zu einem Feststoff; wenn der Druck noch weiter ansteigt, wird es zu einer Flüssigkeit. Bei 40 °C ist Wasser bei niedrigem Druck ein Dampf; bei einem Druck von mehr als 75 Torr wird es zu einer Flüssigkeit. Bei -40 °C wird Wasser von einem Gas zu einem Feststoff, wenn der Druck über sehr niedrige Werte ansteigt.
4. (a) Flüssigkeit; (b) Feststoff; (c) Gas; (d) Gas; (e) Gas; (f) Gas
8. Ja, Eis wird sublimieren, obwohl es mehrere Tage dauern kann. Eis hat einen geringen Dampfdruck, und einige Eismoleküle bilden Gas und entweichen aus den Eiskristallen. Mit der Zeit verwandelt sich immer mehr Feststoff in Gas, bis die Kleidung schließlich trocken ist.
10. (a)
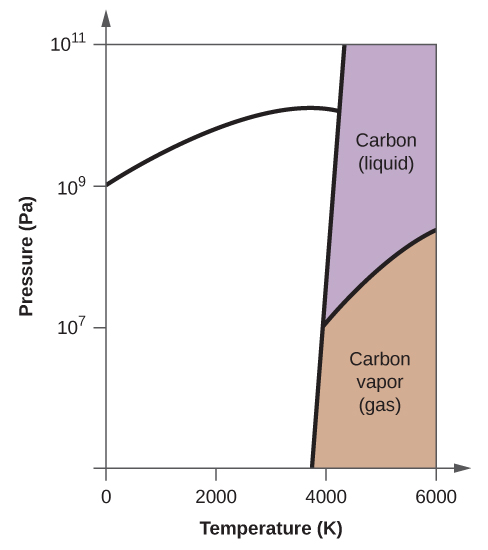
(b)
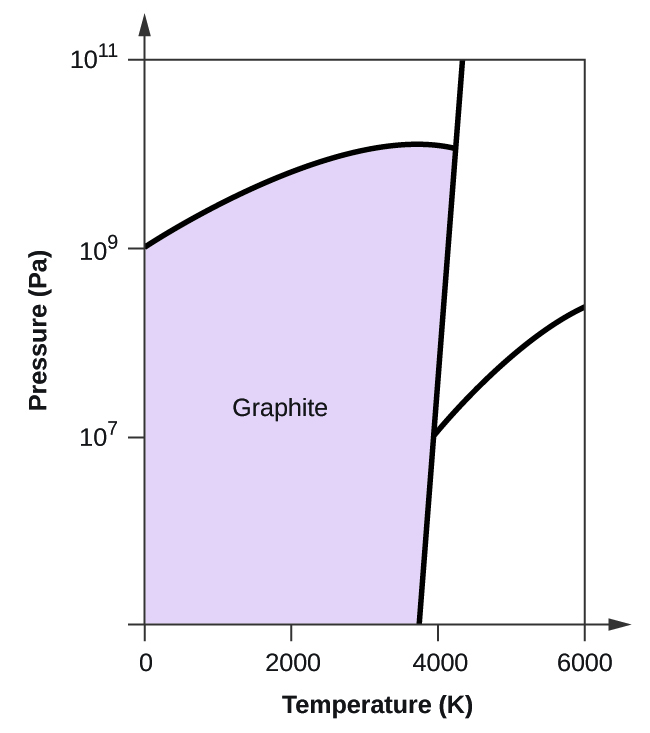
(c)
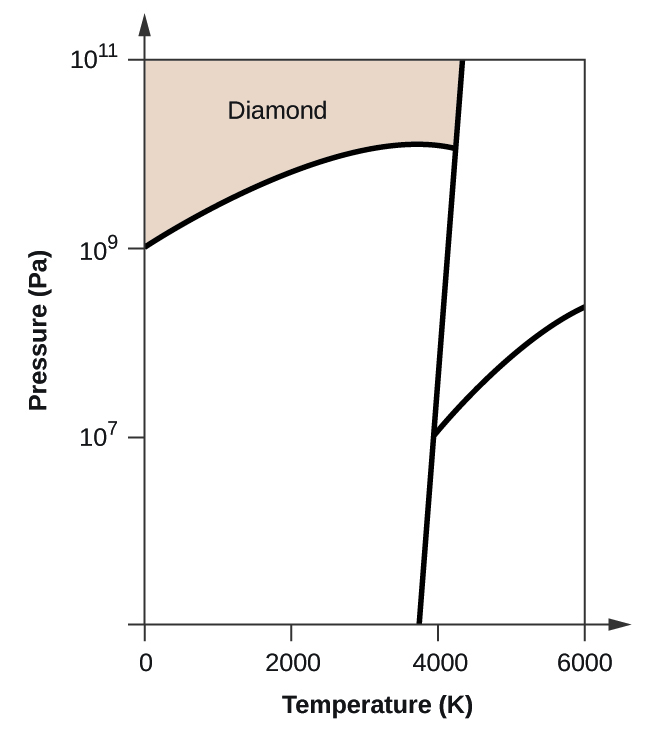
(d)
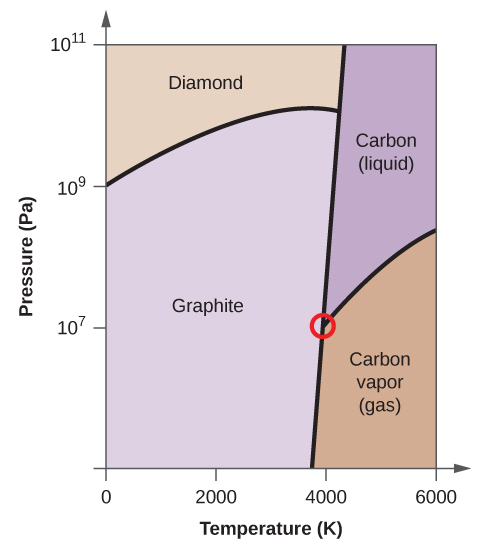
(e) flüssige Phase (f) Sublimation
