Karboxylsyror och salter med alkylkedjor som är längre än åtta kolväten uppvisar ett ovanligt beteende i vatten på grund av att det finns både hydrofila (CO2) och hydrofoba (alkyl) områden i samma molekyl. Sådana molekyler kallas amfifila (Gk. amphi = båda) eller amfipatiska. Fettsyror som består av tio eller fler kolatomer är nästan olösliga i vatten, och på grund av sin lägre densitet flyter de på ytan när de blandas med vatten. Till skillnad från paraffin och andra alkaner, som tenderar att pudra på vattenytan, sprids dessa fettsyror jämnt över en utsträckt vattenyta och bildar så småningom ett monomolekylärt skikt där de polära karboxylgrupperna är vätebundna vid vattengränssnittet och kolvätekedjorna är sammanfogade bort från vattnet. Detta beteende illustreras i diagrammet till höger. Ämnen som ansamlas vid vattenytor och förändrar ytegenskaperna kallas tensider.
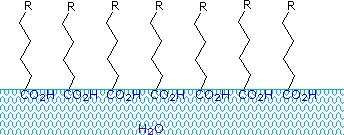
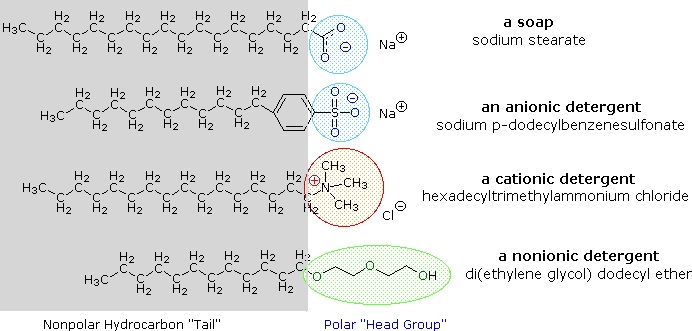
Alkalimetallsalter av fettsyror är mer lösliga i vatten än själva syrorna, och den amfifila karaktären hos dessa ämnen gör dem också till starka tensider. De vanligaste exemplen på sådana föreningar är tvålar och tvättmedel, varav fyra visas nedan. Observera att var och en av dessa molekyler har en opolär kolvätekedja, ”svansen”, och en polär (ofta jonisk) ”huvudgrupp”. Användningen av sådana föreningar som rengöringsmedel underlättas av deras ytaktiva karaktär, som sänker vattnets ytspänning, vilket gör det möjligt för det att tränga in i och blöta en mängd olika material.
Mycket små mängder av dessa ytaktiva ämnen löses upp i vatten för att ge en slumpmässig dispersion av lösta molekyler. När koncentrationen ökar sker dock en intressant förändring. De ytaktiva molekylerna samlas reversibelt till polymolekylära aggregat som kallas miceller. Genom att samla de hydrofoba kedjorna i micellens centrum minimeras störningen av det flytande vattnets vätebundna struktur, och de polära huvudgrupperna sträcker sig ut i det omgivande vattnet där de deltar i vätebindningen. Dessa miceller är ofta sfäriska till formen, men kan också anta cylindriska och förgrenade former, vilket illustreras till höger. Här är den polära huvudgruppen markerad med en blå cirkel och den opolära svansen med en sicksackformad svart linje.
Det äldsta amfifila rengöringsmedel som människan känner till är tvål. Tvål tillverkas genom baskatalyserad hydrolys (förtvålning) av animaliskt fett. Innan natriumhydroxid fanns kommersiellt tillgänglig användes en kokande lösning av kaliumkarbonat som utlakats från träaska. Mjuka kaliumtvålar omvandlades sedan till hårdare natriumtvålar genom att tvättas med saltlösning. Tvålens betydelse för den mänskliga civilisationen är dokumenterad av historien, men vissa problem i samband med dess användning har uppmärksammats. Ett av dessa orsakas av fettsyrornas svaga surhet (pKa ca 4,9). Lösningar av alkalimetalltvålar är svagt alkaliska (pH 8-9) på grund av hydrolys. Om pH-värdet i en tvållösning sänks av sura föroreningar fälls olösliga fettsyror ut och bildar ett skum. Ett annat problem orsakas av förekomsten av kalcium- och magnesiumsalter i vattentillförseln (hårt vatten). Dessa tvåvärda katjoner orsakar aggregering av micellerna, som sedan lägger sig som ett smutsigt skum.
Dessa problem har lindrats genom utvecklingen av syntetiska amfifiler som kallas tvättmedel (eller syndets). Genom att använda en mycket starkare syra för den polära huvudgruppen är vattenlösningar av amfifilen mindre känsliga för pH-ändringar. De sulfonatfunktioner som används i praktiskt taget alla anjoniska tvättmedel ger också större löslighet åt miceller som innehåller de alkaliska jordkatjoner som finns i hårt vatten. Variationer på temat amfifile har lett till utvecklingen av andra klasser, t.ex. de katjoniska och nonjoniska tvättmedel som anges ovan. Kationiska tvättmedel har ofta bakteriedödande egenskaper, och deras förmåga att ändra pH-värdet på ytan har gjort dem användbara som mjukgörare och hårbalsam. Dessa mångsidiga kemiska ”verktyg” har dramatiskt förändrat marknaden för rengöringsmedel för hushåll och personlig vård under de senaste femtio åren.
Medverkande
-
William Reusch, professor emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
