Karboxylsyrer og salte med alkylkæder længere end otte kulstofatomer udviser en usædvanlig adfærd i vand på grund af tilstedeværelsen af både hydrofile (CO2) og hydrofobiske (alkyl) områder i det samme molekyle. Sådanne molekyler betegnes som amfifile (Gk. amphi = begge) eller amfipatiske. Fedtsyrer, der består af ti eller flere kulstofatomer, er næsten uopløselige i vand, og på grund af deres lavere massefylde flyder de på overfladen, når de blandes med vand. I modsætning til paraffin eller andre alkaner, som har tendens til at samle sig på vandoverfladen, spreder disse fedtsyrer sig jævnt over en udstrakt vandoverflade og danner til sidst et monomolekylært lag, hvor de polære carboxylgrupper er hydrogenbundet ved vandoverfladen, og hvor kulbrintekæderne er rettet sammen på afstand af vandet. Denne adfærd er illustreret i diagrammet til højre. Stoffer, der ophobes ved vandoverflader og ændrer overfladeegenskaberne, kaldes overfladeaktive stoffer.
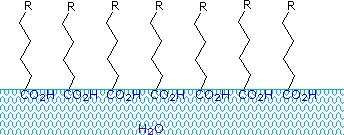
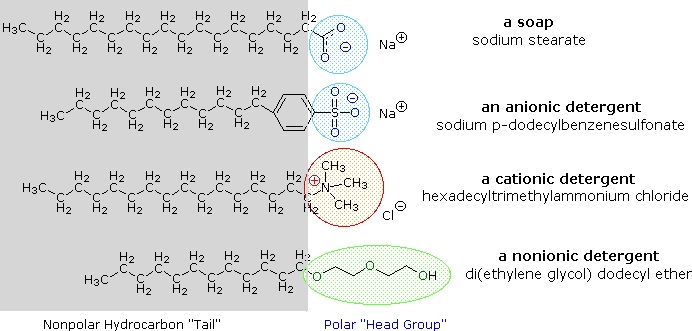
Alkali metalsalte af fedtsyrer er mere opløselige i vand end selve syrerne, og disse stoffers amfifile karakter gør dem også til stærke overfladeaktive stoffer. De mest almindelige eksempler på sådanne forbindelser er sæbe og vaske- og rengøringsmidler, hvoraf fire af dem er vist nedenfor. Bemærk, at hvert af disse molekyler har en upolær kulbrintekæde, “halen”, og en polær (ofte ionisk) “hovedgruppe”. Brugen af sådanne forbindelser som rengøringsmidler lettes af deres overfladeaktive karakter, som sænker vandets overfladespænding, så det kan trænge ind i og fugte en række forskellige materialer.
Meget små mængder af disse overfladeaktive stoffer opløses i vand og giver en tilfældig dispersion af opløste molekyler. Når koncentrationen øges, sker der imidlertid en interessant ændring. De overfladeaktive molekyler samler sig reversibelt til polymolekylære aggregater kaldet miceller. Ved at samle de hydrofobiske kæder i midten af micellen minimeres forstyrrelsen af det flydende vands hydrogenbundne struktur, og de polære hovedgrupper strækker sig ind i det omgivende vand, hvor de deltager i hydrogenbindingen. Disse miceller er ofte kugleformede, men kan også antage cylindriske og forgrenede former, som illustreret til højre. Her er den polære hovedgruppe angivet med en blå cirkel, og den upolære hale er en zig-zagformet sort linje.
Det ældste amfifile rengøringsmiddel, som mennesket kender, er sæbe. Sæbe fremstilles ved base-katalyseret hydrolyse (forsæbning) af animalsk fedt. Før natriumhydroxid var kommercielt tilgængeligt, brugte man en kogende opløsning af kaliumcarbonat, der blev udvasket fra træaske. Blød kaliumsæbe blev derefter omdannet til den hårdere natriumsæbe ved at blive vasket med saltopløsning. Sæbens betydning for den menneskelige civilisation er dokumenteret af historien, men nogle problemer i forbindelse med brugen af sæbe er blevet erkendt. Et af disse skyldes fedtsyrernes svage surhedsgrad (pKa ca. 4,9). Opløsninger af alkalimetalsæber er svagt basiske (pH 8-9) som følge af hydrolyse. Hvis pH-værdien af en sæbeopløsning sænkes af sure forurenende stoffer, udfældes uopløselige fedtsyrer og danner et skum. Et andet problem skyldes tilstedeværelsen af calcium- og magnesiumsalte i vandforsyningen (hårdt vand). Disse tosidige kationer forårsager aggregering af micellerne, som derefter aflejrer sig som et snavset skum.
Disse problemer er blevet afhjulpet ved udviklingen af syntetiske amfifile stoffer kaldet detergenter (eller syndets). Ved at anvende en meget stærkere syre til den polære hovedgruppe er vandopløsninger af amfiphilen mindre følsomme over for pH-ændringer. Desuden giver de sulfonatfunktioner, der anvendes i stort set alle anioniske vaske- og rengøringsmidler, større opløselighed til miceller, der indeholder de alkalisk-jordiske kationer, der findes i hårdt vand. Variationer over amfifiltemaet har ført til udvikling af andre klasser, f.eks. de ovenfor nævnte kationiske og nonioniske vaske- og rengøringsmidler. Kationiske vaske- og rengøringsmidler har ofte bakteriedræbende egenskaber, og deres evne til at ændre overfladens pH-værdi har gjort dem nyttige som blødgøringsmidler til tekstiler og hårbalsam. Disse alsidige kemiske “værktøjer” har dramatisk ændret markedet for rengøringsmidler til husholdningsbrug og personlig pleje i løbet af de sidste 50 år.
Medvirkende
-
William Reusch, professor emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
