Los ácidos carboxílicos y las sales que tienen cadenas alquílicas de más de ocho carbonos presentan un comportamiento inusual en el agua debido a la presencia de regiones hidrofílicas (CO2) e hidrofóbicas (alquilo) en la misma molécula. Estas moléculas se denominan anfifílicas (Gk. amphi = ambos) o anfipáticas. Los ácidos grasos formados por diez o más átomos de carbono son casi insolubles en agua y, debido a su menor densidad, flotan en la superficie cuando se mezclan con el agua. A diferencia de la parafina u otros alcanos, que tienden a encharcarse en la superficie del agua, estos ácidos grasos se extienden uniformemente sobre una superficie de agua extendida, formando finalmente una capa monomolecular en la que los grupos carboxilos polares están unidos por enlaces de hidrógeno en la interfaz del agua, y las cadenas de hidrocarburos están alineadas juntas lejos del agua. Este comportamiento se ilustra en el diagrama de la derecha. Las sustancias que se acumulan en la superficie del agua y cambian sus propiedades superficiales se denominan tensioactivos.
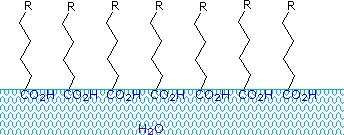
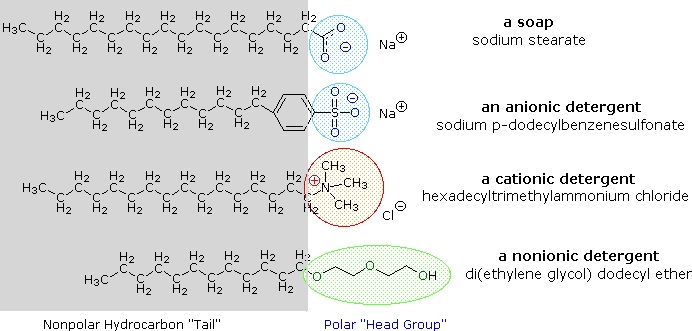
Las sales de metales alcalinos de los ácidos grasos son más solubles en agua que los propios ácidos, y el carácter anfifílico de estas sustancias también las convierte en fuertes tensioactivos. Los ejemplos más comunes de estos compuestos son los jabones y los detergentes, cuatro de los cuales se muestran a continuación. Obsérvese que cada una de estas moléculas tiene una cadena de hidrocarburos no polares, la «cola», y un «grupo de cabeza» polar (a menudo iónico). El uso de estos compuestos como agentes de limpieza se ve facilitado por su carácter tensioactivo, que reduce la tensión superficial del agua, lo que le permite penetrar y humedecer diversos materiales.
Cantidades muy pequeñas de estos tensioactivos se disuelven en el agua para dar lugar a una dispersión aleatoria de moléculas de soluto. Sin embargo, cuando se aumenta la concentración se produce un cambio interesante. Las moléculas de tensioactivos se reúnen de forma reversible en agregados polimoleculares denominados micelas. Al reunir las cadenas hidrofóbicas en el centro de la micela, se minimiza la alteración de la estructura de enlace de hidrógeno del agua líquida, y los grupos de cabeza polares se extienden hacia el agua circundante, donde participan en el enlace de hidrógeno. Estas micelas suelen tener forma esférica, pero también pueden adoptar formas cilíndricas y ramificadas, como se ilustra a la derecha. Aquí el grupo de cabeza polar se designa con un círculo azul, y la cola no polar es una línea negra en zigzag.
El agente limpiador anfifílico más antiguo conocido por los humanos es el jabón. El jabón se fabrica mediante la hidrólisis catalizada por bases (saponificación) de la grasa animal. Antes de que el hidróxido de sodio estuviera disponible comercialmente, se utilizaba una solución hirviendo de carbonato de potasio lixiviado de las cenizas de madera. Los jabones blandos de potasio se convertían en jabones más duros de sodio mediante el lavado con una solución salina. La importancia del jabón para la civilización humana está documentada por la historia, pero se han reconocido algunos problemas asociados a su uso. Uno de ellos se debe a la débil acidez (pKa aprox. 4,9) de los ácidos grasos. Las soluciones de jabones de metales alcalinos son ligeramente alcalinas (pH 8 a 9) debido a la hidrólisis. Si el pH de una solución de jabón se reduce por contaminantes ácidos, los ácidos grasos insolubles precipitan y forman una espuma. Un segundo problema es el causado por la presencia de sales de calcio y magnesio en el suministro de agua (agua dura). Estos cationes divalentes provocan la agregación de las micelas, que se depositan como una espuma sucia.
Estos problemas se han aliviado con el desarrollo de anfífilos sintéticos llamados detergentes (o syndets). Al utilizar un ácido mucho más fuerte para el grupo de cabeza polar, las soluciones acuosas del anfifilo son menos sensibles a los cambios de pH. Además, las funciones de sulfonato utilizadas para prácticamente todos los detergentes aniónicos confieren una mayor solubilidad a las micelas que incorporan los cationes alcalinotérreos que se encuentran en el agua dura. Las variaciones en el tema de los anfifilos han llevado al desarrollo de otras clases, como los detergentes catiónicos y no iónicos mostrados anteriormente. Los detergentes catiónicos suelen tener propiedades germicidas y su capacidad para cambiar el pH de la superficie los ha hecho útiles como suavizantes y acondicionadores del cabello. Estas versátiles «herramientas» químicas han transformado drásticamente los mercados de productos de limpieza para el hogar y el cuidado personal durante los últimos cincuenta años.
Contribuidores
-
William Reusch, profesor emérito (Michigan State U.), Virtual Textbook of Organic Chemistry
