Ácidos e sais carboxílicos com cadeias alquílicas superiores a oito carbonos apresentam um comportamento incomum na água devido à presença de regiões hidrofílicas (CO2) e hidrofóbicas (alquílicas) na mesma molécula. Tais moléculas são denominadas anfifílicas (Gk. amphi = ambas) ou amphipáticas. Os ácidos gordos compostos por dez ou mais átomos de carbono são quase insolúveis na água e, devido à sua menor densidade, flutuam na superfície quando misturados com água. Ao contrário da parafina ou de outros alcanos, que tendem a ficar submersos na superfície da água, estes ácidos gordos espalham-se uniformemente sobre uma superfície estendida da água, eventualmente formando uma camada monomolecular na qual os grupos carboxilo polares estão ligados a hidrogénio na interface da água, e as cadeias de hidrocarbonetos estão alinhadas juntas longe da água. Este comportamento está ilustrado no diagrama à direita. As substâncias que se acumulam na superfície da água e alteram as propriedades da superfície são chamadas surfactantes.
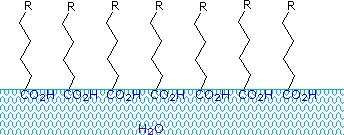
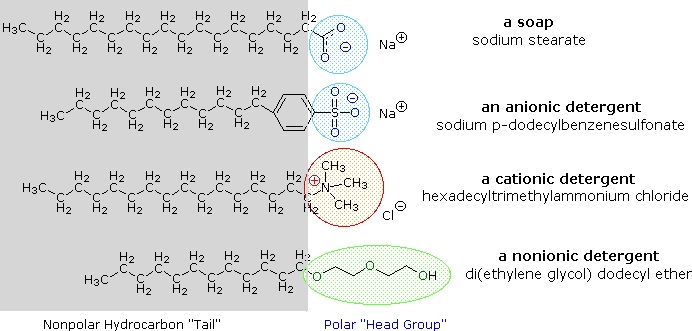
Sais metálicos alcalinos de ácidos gordos são mais solúveis na água do que os próprios ácidos, e o carácter anfifílico destas substâncias também os torna surfactantes fortes. Os exemplos mais comuns de tais compostos são os sabões e detergentes, quatro dos quais são mostrados abaixo. Note que cada uma destas moléculas tem uma cadeia não polar de hidrocarbonetos, a “cauda” e um “grupo de cabeça” polar (muitas vezes iônico). O uso de tais compostos como agentes de limpeza é facilitado pelo seu caráter surfactante, que diminui a tensão superficial da água, permitindo que ela penetre e molhe uma variedade de materiais.
Quantidades muito pequenas destes surfactantes dissolvem-se na água para dar uma dispersão aleatória de moléculas de soluto. No entanto, quando a concentração é aumentada ocorre uma mudança interessante. As moléculas tensioactivas reúnem-se reversivelmente em agregados polimoléculares chamados micelas. Ao reunir as cadeias hidrofóbicas no centro da micela, a ruptura da estrutura ligada ao hidrogênio da água líquida é minimizada, e os grupos de cabeças polares se estendem para a água ao redor, onde participam da ligação de hidrogênio. Estas micelas são frequentemente de forma esférica, mas também podem assumir formas cilíndricas e ramificadas, como ilustrado à direita. Aqui o grupo da cabeça polar é designado por um círculo azul, e a cauda não polar é uma linha preta em zigue-zague.
O mais antigo agente de limpeza anfifílico conhecido pelos humanos é o sabão. O sabão é fabricado pela hidrólise base-catalítica (saponificação) da gordura animal. Antes do hidróxido de sódio estar comercialmente disponível, era utilizada uma solução de carbonato de potássio lixiviado das cinzas da madeira. Os sabões macios de potássio foram então convertidos em sabões de sódio mais duros por lavagem com solução salina. A importância do sabão para a civilização humana está documentada pela história, mas alguns problemas associados ao seu uso têm sido reconhecidos. Um deles é causado pela fraca acidez (pKa ca. 4,9) dos ácidos gordos. As soluções de sabões alcalinos metálicos são ligeiramente alcalinas (pH 8 a 9), devido à hidrólise. Se o pH de uma solução de sabão for reduzido por contaminantes ácidos, os ácidos gordos insolúveis precipitam-se e formam uma escória. Um segundo problema é causado pela presença de sais de cálcio e magnésio no abastecimento de água (água dura). Estes catiões divalentes causam agregação das micelas, que depois se depositam como escória suja.
Estes problemas foram atenuados pelo desenvolvimento de anfípitos sintéticos chamados detergentes (ou syndets). Ao utilizar um ácido muito mais forte para o grupo da cabeça polar, as soluções de água do anfíbio são menos sensíveis às mudanças de pH. Também as funções sulfonadas utilizadas para praticamente todos os detergentes aniônicos conferem maior solubilidade às micelas incorporando os cátions alcalinos de terra encontrados em água dura. Variações sobre o tema do anfilo levaram ao desenvolvimento de outras classes, como os detergentes catiónicos e não iónicos mostrados acima. Os detergentes catiónicos apresentam frequentemente propriedades germicidas, e a sua capacidade de alterar o pH superficial tornou-os úteis como amaciadores de tecidos e amaciadores de cabelo. Estas versáteis “ferramentas” químicas transformaram drasticamente os mercados de produtos de limpeza doméstica e de cuidados pessoais nos últimos cinquenta anos.
Contribuidores
-
William Reusch, Professor Emérito (Michigan State U.), Virtual Textbook of Organic Chemistry
