Carbonsäuren und Salze mit Alkylketten, die länger als acht Kohlenstoffatome sind, zeigen ein ungewöhnliches Verhalten in Wasser, da sie sowohl hydrophile (CO2) als auch hydrophobe (Alkyl) Bereiche im selben Molekül aufweisen. Solche Moleküle werden als amphiphil (gk. amphi = beides) oder amphipathisch bezeichnet. Fettsäuren mit zehn oder mehr Kohlenstoffatomen sind in Wasser nahezu unlöslich und schwimmen aufgrund ihrer geringeren Dichte an der Oberfläche, wenn sie mit Wasser vermischt werden. Im Gegensatz zu Paraffin oder anderen Alkanen, die dazu neigen, sich auf der Wasseroberfläche abzulagern, verteilen sich diese Fettsäuren gleichmäßig über eine ausgedehnte Wasseroberfläche und bilden schließlich eine monomolekulare Schicht, in der die polaren Carboxylgruppen an der Wasseroberfläche wasserstoffgebunden sind und die Kohlenwasserstoffketten sich vom Wasser weg aneinanderreihen. Dieses Verhalten ist im Diagramm rechts dargestellt. Stoffe, die sich an Wasseroberflächen anlagern und die Oberflächeneigenschaften verändern, werden als Tenside bezeichnet.
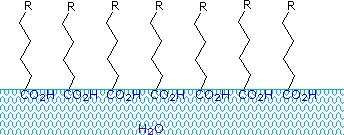
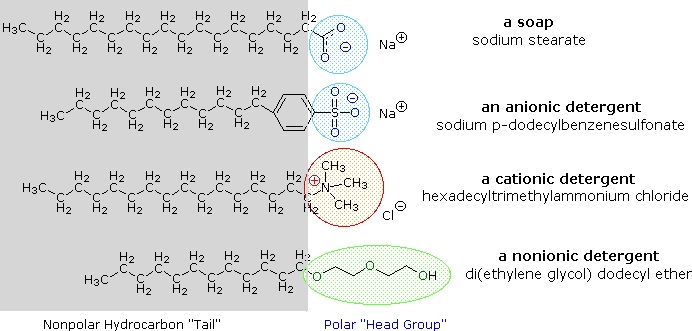
Alkalimetallsalze von Fettsäuren sind in Wasser besser löslich als die Säuren selbst, und der amphiphile Charakter dieser Stoffe macht sie auch zu starken Tensiden. Die gebräuchlichsten Beispiele für solche Verbindungen sind Seifen und Detergenzien, von denen vier unten abgebildet sind. Man beachte, dass jedes dieser Moleküle eine unpolare Kohlenwasserstoffkette, den „Schwanz“, und eine polare (oft ionische) „Kopfgruppe“ hat. Die Verwendung solcher Verbindungen als Reinigungsmittel wird durch ihren Tensidcharakter erleichtert, der die Oberflächenspannung des Wassers herabsetzt, so dass es in eine Vielzahl von Materialien eindringen und diese benetzen kann.
Sehr kleine Mengen dieser Tenside lösen sich in Wasser auf und ergeben eine zufällige Dispersion gelöster Moleküle. Wenn jedoch die Konzentration erhöht wird, tritt eine interessante Veränderung ein. Die Tensidmoleküle lagern sich reversibel zu polymolekularen Aggregaten zusammen, die Mizellen genannt werden. Durch die Zusammenfassung der hydrophoben Ketten im Zentrum der Mizelle wird die Unterbrechung der wasserstoffgebundenen Struktur des flüssigen Wassers minimiert, und die polaren Kopfgruppen ragen in das umgebende Wasser hinein, wo sie an der Wasserstoffbrückenbindung teilnehmen. Diese Mizellen sind oft kugelförmig, können aber auch zylindrische und verzweigte Formen annehmen, wie in der Abbildung rechts dargestellt. Hier ist die polare Kopfgruppe durch einen blauen Kreis und der unpolare Schwanz durch eine schwarze Zick-Zack-Linie gekennzeichnet.
Das älteste dem Menschen bekannte amphiphile Reinigungsmittel ist die Seife. Seife wird durch die basenkatalysierte Hydrolyse (Verseifung) von tierischem Fett hergestellt. Bevor Natriumhydroxid im Handel erhältlich war, wurde eine kochende Lösung aus Kaliumcarbonat verwendet, das aus Holzasche ausgelaugt wurde. Die weichen Kaliumseifen wurden dann durch Waschen mit Salzlösung in die härteren Natriumseifen umgewandelt. Die Bedeutung der Seife für die menschliche Zivilisation ist historisch belegt, aber es wurden auch einige Probleme im Zusammenhang mit ihrer Verwendung erkannt. Eines davon ist auf die schwache Säure (pKa ca. 4,9) der Fettsäuren zurückzuführen. Lösungen von Alkaliseifen sind aufgrund der Hydrolyse leicht alkalisch (pH 8 bis 9). Wenn der pH-Wert einer Seifenlösung durch saure Verunreinigungen gesenkt wird, fallen unlösliche Fettsäuren aus und bilden einen Schaum. Ein zweites Problem wird durch das Vorhandensein von Kalzium- und Magnesiumsalzen in der Wasserversorgung (hartes Wasser) verursacht. Diese zweiwertigen Kationen verursachen eine Aggregation der Mizellen, die sich dann als schmutziger Schaum absetzen.
Diese Probleme wurden durch die Entwicklung synthetischer amphiphiler Stoffe, die als Detergenzien (oder Syndets) bezeichnet werden, gelöst. Durch die Verwendung einer viel stärkeren Säure für die polare Kopfgruppe sind die wässrigen Lösungen des Amphiphils weniger empfindlich gegenüber pH-Veränderungen. Außerdem verleihen die Sulfonatfunktionen, die für praktisch alle anionischen Detergenzien verwendet werden, den Mizellen, die die in hartem Wasser vorkommenden Erdalkalikationen enthalten, eine bessere Löslichkeit. Variationen des amphiphilen Themas haben zur Entwicklung anderer Klassen geführt, wie die oben dargestellten kationischen und nichtionischen Detergenzien. Kationische Detergenzien weisen häufig keimtötende Eigenschaften auf, und ihre Fähigkeit, den pH-Wert der Oberfläche zu verändern, hat sie zu nützlichen Weichspülern und Haarspülern gemacht. Diese vielseitigen chemischen „Werkzeuge“ haben den Markt für Haushalts- und Körperpflegeprodukte in den letzten fünfzig Jahren dramatisch verändert.
Beitragende
-
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
