Carboxylzuren en zouten met alkylketens langer dan acht carbons vertonen ongewoon gedrag in water door de aanwezigheid van zowel hydrofiele (CO2) als hydrofobe (alkyl) gebieden in hetzelfde molecuul. Dergelijke moleculen worden amfifiel (Gk. amphi = beide) of amfipathisch genoemd. Vetzuren die bestaan uit tien of meer koolstofatomen zijn bijna onoplosbaar in water, en door hun lagere dichtheid drijven ze aan de oppervlakte wanneer ze met water worden gemengd. In tegenstelling tot paraffine of andere alkanen, die de neiging hebben op het wateroppervlak te plassen, verspreiden deze vetzuren zich gelijkmatig over een uitgestrekt wateroppervlak, en vormen uiteindelijk een monomoleculaire laag waarin de polaire carboxylgroepen waterstofgebonden zijn aan het waterraakvlak, en de koolwaterstofketens van het water af zijn gegroepeerd. Dit gedrag wordt geïllustreerd in het diagram rechts. Stoffen die zich aan wateroppervlakken ophopen en de oppervlakte-eigenschappen veranderen, worden oppervlakte-actieve stoffen genoemd.
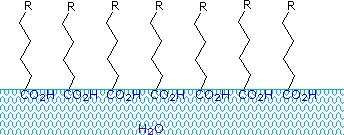
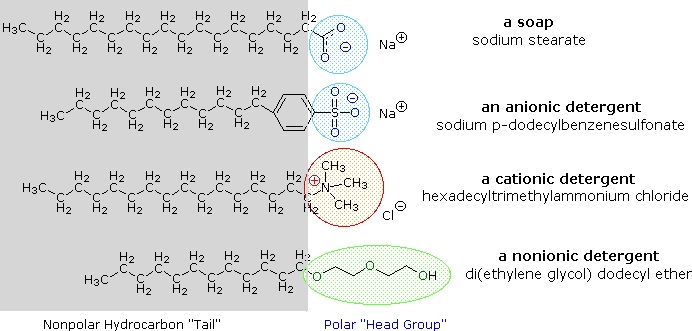
Alkalimetaalzouten van vetzuren zijn beter oplosbaar in water dan de zuren zelf, en het amfifiele karakter van deze stoffen maakt ze ook tot sterke oppervlakte-actieve stoffen. De meest voorkomende voorbeelden van dergelijke verbindingen zijn zepen en detergenten, waarvan er hieronder vier worden getoond. Merk op dat elk van deze moleculen een apolaire koolwaterstofketen heeft, de “staart”, en een polaire (vaak ionische) “kopgroep”. Het gebruik van deze verbindingen als schoonmaakmiddelen wordt vergemakkelijkt door hun oppervlakteactieve karakter, dat de oppervlaktespanning van water verlaagt, waardoor het in allerlei materialen kan doordringen en bevochtigen.
Zeer kleine hoeveelheden van deze oppervlakteactieve stoffen lossen in water op en geven een willekeurige dispersie van opgeloste moleculen. Wanneer de concentratie echter wordt verhoogd, treedt een interessante verandering op. De moleculen van de oppervlakte-actieve stoffen kunnen zich omkeerbaar samenvoegen tot polymoleculaire aggregaten, micellen genaamd. Door de hydrofobe ketens in het centrum van de micellen samen te brengen, wordt verstoring van de waterstofbrugstructuur van vloeibaar water geminimaliseerd, en de polaire hoofdgroepen breiden zich uit naar het omringende water waar ze deelnemen aan de waterstofbruggen. Deze micellen zijn vaak bolvormig, maar kunnen ook cilindrisch of vertakt zijn, zoals hiernaast is geïllustreerd. Hier wordt de polaire kopgroep aangeduid door een blauwe cirkel, en de apolaire staart door een zigzag-lijn.
Het oudste amfifiele reinigingsmiddel dat de mens kent is zeep. Zeep wordt vervaardigd door hydrolyse (verzeping) van dierlijk vet met behulp van een base. Voordat natriumhydroxide in de handel verkrijgbaar was, werd een kokende oplossing van uit houtas geloogd kaliumcarbonaat gebruikt. Zachte kaliumzepen werden vervolgens omgezet in hardere natriumzepen door ze te wassen met een zoutoplossing. Het belang van zeep voor de menselijke beschaving is door de geschiedenis gedocumenteerd, maar men heeft een aantal problemen in verband met het gebruik ervan onderkend. Eén daarvan wordt veroorzaakt door de zwakke zuurgraad (pKa ca. 4,9) van de vetzuren. Oplossingen van alkalimetaalzepen zijn licht alkalisch (pH 8 tot 9) als gevolg van hydrolyse. Als de pH van een zeepoplossing wordt verlaagd door zure verontreinigingen, slaan onoplosbare vetzuren neer en vormen een schuim. Een tweede probleem wordt veroorzaakt door de aanwezigheid van calcium- en magnesiumzouten in de watertoevoer (hard water). Deze tweewaardige kationen veroorzaken aggregatie van de micellen, die vervolgens neerslaan als een vuil schuim.
Deze problemen zijn verholpen door de ontwikkeling van synthetische amfifielen, detergenten (of syndets) genoemd. Door een veel sterker zuur te gebruiken voor de polaire kopgroep, zijn wateroplossingen van het amfifiel minder gevoelig voor pH-veranderingen. Ook de sulfonaatfuncties die voor vrijwel alle anionische detergentia worden gebruikt, zorgen voor een grotere oplosbaarheid van micellen waarin de aardalkalimetaalkationen zijn opgenomen die in hard water voorkomen. Variaties op het amfifiele thema hebben geleid tot de ontwikkeling van andere klassen, zoals de hierboven genoemde kationogene en niet-ionogene detergentia. Kationische detergentia hebben vaak kiemdodende eigenschappen, en hun vermogen om de pH-waarde van het oppervlak te veranderen heeft hen nuttig gemaakt als wasverzachters en haarconditioners. Deze veelzijdige chemische “gereedschappen” hebben de markten voor huishoudelijke en persoonlijke reinigingsproducten in de afgelopen vijftig jaar ingrijpend veranderd.
Inzenders
-
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
