- Aufgeschrieben von Dr. Gabriel Scripcaru und Dr. Predrag Nikolic
- Hautanamnese des Patienten
- Schuppenzellkarzinom (SCC)
- Klinische Merkmale
- Hochrisiko-Merkmale
- Basalzellkarzinom (BCC)
- Klinische Merkmale
- Hochrisikomerkmale
- Schritte vor der Entfernung von SCC/BCC
- Bestätigung der Diagnose und Vermerke im histologischen Bericht
- Die chirurgische Exzision ist die Behandlung der Wahl sowohl für SCC als auch für BCC
- Zusätzliche Aspekte der Behandlung
- Nicht-chirurgische Optionen für BCC
- Über die Autoren
- Lokale Pathologen in Ihrer Nähe
Aufgeschrieben von Dr. Gabriel Scripcaru und Dr. Predrag Nikolic
Das Erkennen der definierenden klinischen Merkmale verschiedener Arten von Hautkrebs und ein angemessenes Vorgehen bei der Biopsie sind für ihre Diagnose und Behandlung von wesentlicher Bedeutung. Die Bedeutung einer rechtzeitigen Diagnose kann nicht hoch genug eingeschätzt werden, um das bestmögliche Ergebnis zu erzielen und die Komplikationen zu minimieren.
In diesem Artikel werden das Plattenepithelkarzinom (SCC) und das Basalzellkarzinom (BCC), zwei der häufigsten Krebsarten, die in Australien vorkommen, behandelt.
Hautanamnese des Patienten
Es ist wichtig, die relevante Hautanamnese des Patienten zu erheben, bevor man einen Ganzkörper-Hautcheck durchführt oder eine besonders besorgniserregende neue oder veränderte Läsion untersucht, einschließlich:
- Hautkrebs in der Familie
- Vorherige Hautkrebserkrankungen
- Vorherige Exzisionen
- Beruf
- Vorherige UV-Exposition/Sonnenbrand einschließlich Nutzung von Solarien
- Häufigkeit des Sonnenschutzes
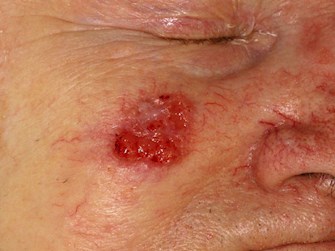
Schuppenzellkarzinom (SCC)
 |
 |
| Klinische Merkmale | Histologie |
SCC ist ein bösartiger epithelialer Tumor der Keratinozyten, der am häufigsten in sonnengeschädigtergeschädigter Haut. Die überwiegende Mehrheit der Fälle geht mit einer bereits bestehenden aktinischen (solaren) Keratose, einem Plattenepithelkarzinom in situ oder beidem einher. SCCs machen fast 30 % der nicht-melanomalen Hautkrebsarten aus.
Einige SCCs können mit humanen Papillomviren, chronischen Entzündungen oder Strahlentherapie in Verbindung gebracht werden.
Histologisch gesehen können diese Läsionen gut differenziert, mäßig differenziert oder schlecht differenziert sein. Der Grad der Differenzierung ist ein wesentlicher Marker für die Progression, das Metastasierungsrisiko und die Prognose. Viele Läsionen weisen Bereiche mit unterschiedlichem Differenzierungsgrad auf, wobei der am schlechtesten differenzierte Bereich bei der endgültigen Einstufung der Läsion zu berücksichtigen ist. Es ist der am wenigsten differenzierte Bereich, der letztlich über die Behandlung und die Prognose entscheidet.
SCC mit fokaler basaloider Differenzierung oder basosquamösem Karzinom wird als mäßig differenzierte Läsion betrachtet. Schlecht differenzierte SCCs sind durch das Fehlen einer Keratinisierung gekennzeichnet. SCC können langsam oder schnell wachsend sein. In einigen Fällen können signifikante klinische Veränderungen innerhalb von Monaten oder sogar Wochen sichtbar werden.
Klinische Merkmale
- Verdickte rote, schuppende Stelle
- Slowly or rapidly growing papule or nodule
- Nonhealing ulcers or recurrently bleeding
- May be tender to touch
- May be pigmented, was den klinischen Verdacht auf eine pigmentierte Läsion weckt
Hochrisiko-Merkmale
- SCCs an Kopf und Hals gelten als Hochrisiko
- Auftreten bei immunsupprimierten Patienten oder an Stellen mit früherer Pathologie oder Trauma (z. B. Verbrennungsnarben, Strahlennarben)z. B. Verbrennungsnarben, Bestrahlungsnarben, chronische Geschwüre/Sinus)
- Der Tumor wächst schnell, hat einen Durchmesser von >20 mm, schlecht definierte Ränder, Feldveränderungen, ist an darunter liegenden Strukturen fixiert, befindet sich über wichtigen Strukturen oder es gibt zahlreiche Tumore
- Der Patient zeigt Symptome, die auf eine perineurale Invasion hinweisen (z.z. B. Kribbeln, Schmerzen, Parästhesie, Ameisenlaufen, Dysästhesie oder eingeschränkte motorische Funktion)
- Wenn eine Biopsie durchgeführt wurde, gehören zu den histopathologischen Hochrisikomerkmalen: Tumordicke >6 mm, Invasion über die Subkutis hinaus, lymphovaskuläre Invasion oder Hochrisikomuster der perineuralen Invasion, schlecht differenzierte Tumoren und/oder aggressive Subtypen (z. B. infiltrativ/desmoplastisch, sarkomatoid)
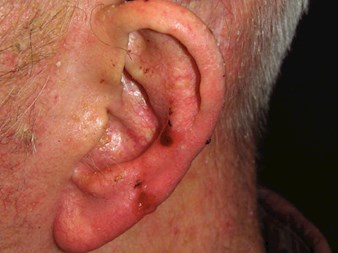
Basalzellkarzinom (BCC)
 |
 |
| Klinische Merkmale | Histologie |
Basalzellkarzinom (BCC) ist ein langsamlangsam wachsender, lokal invasiver Tumor, Er entsteht meist in sonnengeschädigter Haut aus der Basalschicht der Epidermis. Das Fortschreiten der Erkrankung erfolgt in der Regel in Form einer lokalen Gewebedestruktion, selten kommt es zu Metastasen.
Histologisch gesehen weisen die Tumoren verschiedene Architekturmuster auf: nodulär, oberflächlich (was eine frühe Phase eines nodulären Musters darstellen kann), oberflächlich multifokal, infiltrativ, mikronodulär, morphoeisch und metatypisch (d. h. mit Plattenepithel- oder Talgdrüsendifferenzierung). Häufig wird bei ein und derselben Läsion ein gemischtes Muster beobachtet.
Patientenbezogene Faktoren und das Vorhandensein von Hochrisikomerkmalen bestimmen den Verlauf der Behandlung. BCC ist der häufigste Krebs beim Menschen und macht fast 70 % der nicht-melanomalen Hautkrebse aus.
Klinische Merkmale
- Perlige, durchscheinende Papel, Plaque oder Knötchen
- Schuppiger, trockener Bereich, glänzend und von blasser oder hellrosa Farbe
- Rezidivierende Blutungen oder Ulzerationen
- Kann pigmentiert sein, klinischer Verdacht auf eine pigmentierte Läsion
Hochrisikomerkmale
- Kopf- und Hals-BCCs >10 mm gelten als Hochrisikotumore
- Kopf- und Extremitäten-BCCs >20 mm gelten als Hochrisikotumore
- Aggressive histologische Subtypen (z.z. B. mikronodulär, infiltrativ, morphoeisch oder basosquamös/metatypisch)
- Symptome, die auf eine perineurale Invasion hindeuten (z. B. Kribbeln, Schmerzen, Parästhesien, Ameisenlaufen, motorische Störungen)
- Fixierung an darunter liegenden Strukturen
- Genetische Disposition des Patienten (z.z. B. Gorlin-Syndrom oder Xeroderma pigmentosum) und Verwendung von Immunsuppressiva
Schritte vor der Entfernung von SCC/BCC
Vor der Exzision des Tumors sollte der Durchmesser gemessen und aufgezeichnet werden. Die Tumormessung nach der Exzision ist aufgrund der Gewebeschrumpfung, die nach der Exzision und während der Fixierung und Verarbeitung des Präparats auftritt, nicht genau. Die histologisch untersuchte Schnittebene bezieht sich auf den Abstand vom Tumor zum nächstgelegenen Rand und stellt daher nicht unbedingt die größte Tumorausdehnung dar.
Bestätigung der Diagnose und Vermerke im histologischen Bericht
Die chirurgischen Möglichkeiten umfassen zunächst eine Rasur oder Stanzbiopsie zu diagnostischen Zwecken oder eine vollständige kurative Exzision ohne vorherige Gewebediagnose. Die primär kurative Exzision wird in der Regel bei hohem klinischen Verdacht oder auf Wunsch des Patienten durchgeführt.
Eine Stanzbiopsie hat den Vorteil, dass sie den tieferen Aspekt der Läsion einschließt und leicht zu verarbeiten ist, wobei das Risiko von Gewebeartefakten geringer ist.
Abhängig von ihrer Größe kann eine Rasierbiopsie das architektonische Muster besser erkennen lassen und einen größeren Teil der Läsion einschließen, jedoch möglicherweise nicht den tieferen Aspekt des Tumors und sie kann anfällig für Artefakte sein, wenn sie zu dünn ist. Ein dickerer Shave ist vorzuziehen, um eine Faltung oder Fragmentierung zu vermeiden, die die histologische Beurteilung erheblich beeinträchtigen könnte. Eine dickere Shave-Biopsie gibt auch einen besseren Einblick in die Tiefe und Architektur des Tumors. Es ist wichtig zu beachten, dass die Ränder bei einer Stanz- oder Schabbiopsie nicht genau beurteilt werden können, obwohl kleine Läsionen mit einer dieser Biopsiearten oft vollständig entfernt werden können. Das Vorhandensein klarer Ränder kann in solchen Fällen im histologischen Bericht erwähnt werden, jedoch ist die klinische Korrelation entscheidend, wenn es darum geht, die Notwendigkeit einer weiteren Exzision zu bestimmen.
Die chirurgische Exzision ist die Behandlung der Wahl sowohl für SCC als auch für BCC
Es gibt keine eindeutige evidenzbasierte Empfehlung für den Mindestexzisionsrand. Faktoren wie der Risikostatus des Tumors, die chirurgische Zugänglichkeit, das Alter des Patienten, Komorbiditäten und die Wundheilungsfähigkeit sollten bei der Entscheidung über den Exzisionsrand berücksichtigt werden.
Klinische Leitlinien werden regelmäßig in Publikationen und auf Konferenzen mitgeteilt und aktualisiert. Unabhängig von den Richtlinien, die der Kliniker befolgt, ist es wichtig zu beachten, dass aufgrund der Gewebeschrumpfung die berichteten histologischen Ränder nur die Hälfte des klinischen Randes betragen können, der zum Zeitpunkt der Operation gemessen wurde.
Der histologische Bericht gibt die Freigabe der Ränder in den untersuchten Schnittebenen an und stellt keine absolute Garantie für eine vollständige Exzision des Tumors dar. Eine erneute Exzision mit denselben empfohlenen klinischen Rändern wie bei der ersten Exzision sollte versucht werden, wenn betroffene Ränder gemeldet werden.
In etwa 50 % der Fälle, in denen ein Tumor an den Rändern der Biopsie oder an den Rändern der Exzision im ursprünglichen Präparat vorhanden war, wird im erneut exzidierten Präparat kein weiterer Resttumor gefunden. Dies erklärt sich dadurch, dass ein minimaler Resttumor am Rand der ursprünglichen Biopsie durch die Immunreaktion und den Regenerationsprozess, der zur Reparatur und Vernarbung nach dem ersten chirurgischen Eingriff führt, beseitigt wurde.
Zusätzliche Aspekte der Behandlung
In Fällen von SCC mit perineuraler Invasion (PNI) oder lymphovaskulärer Invasion (LVI) sollte der Patient an einen Spezialisten (Strahlenonkologe oder Hautkrebsabteilung des Krankenhauses) überwiesen werden. Bei LVI können weitere Untersuchungen im Hinblick auf das Staging angezeigt sein, während bei PNI eine adjuvante Therapie, z. B. eine Strahlentherapie, eingesetzt werden kann.
Nicht-chirurgische Optionen für BCC
Im Gegensatz zu SCC gibt es für eine Untergruppe von BCC nicht-chirurgische Optionen. Kryotherapie, Kürettage und Kauterisation können in Kombination bei Patienten eingesetzt werden, die eine Operation nicht vertragen. BCC weisen nur selten eine LVI auf. Diese Fälle sollten wie ein mäßig differenzierter SCC mit LVI behandelt werden. PNI tritt häufiger bei Hochrisiko-BCC auf. In diesen Fällen kann eine Strahlentherapie angezeigt sein, und der Patient sollte daher zur weiteren Stadieneinteilung und Behandlung an einen Spezialisten (Strahlenonkologen oder eine Hautkrebsabteilung des Krankenhauses) überwiesen werden. Oberflächliches BCC kann mit einem nicht-chirurgischen Ansatz behandelt werden.
Andere Behandlungsmöglichkeiten, die oberflächlichem BCC vorbehalten sind, umfassen eine topische Therapie wie Imiquimod (Aldara) Creme und eine topische photodynamische Therapie. Diese Methoden sind in der Regel nicht für Fälle von BCC mit Hochrisikomerkmalen geeignet.
Über die Autoren

Dr. Gabriel Scripcaru
Qualifikationen: FRCPA, MD
Lab: Clayton, Vic
Interessengebiete: Hautpathologie, Kopf, Hals & Pathologie der Weichteile
Spezialgebiet: Anatomische Pathologie
Telefon: 1300 134 111
Email: [email protected]
Dr. Gabriel Scripcaru studierte Medizin an der Universität für Medizin und Pharmazie „Gr.T.Popa“, Iasi Rumänien. Nach seinem Abschluss begann er eine Ausbildung in Neurochirurgie und arbeitete in Cluj, Rumänien, und Newcastle, England. Nach Abschluss der erforderlichen Prüfungen wurde er Mitglied des Royal College of Surgeons of Edinburgh. Vor seiner Tätigkeit in der anatomischen Pathologie sammelte Gabriel klinische Erfahrungen in der Notfallmedizin, der Intensivpflege und der Chirurgie in Australien und Schottland. Seine Ausbildung in anatomischer Pathologie umfasste Stationen im Royal Melbourne Hospital, im Royal Women’s Hospital und im Royal Children’s Hospital in Melbourne. Bevor er zu Australian Clinical Labs kam, arbeitete Dr. Scripcaru bei Southern Sun Pathology in Sydney, wo er Erfahrungen in der Dermatopathologie sammelte.

Dr. Predrag Nikolic
Qualifikationen: MBChB, MMedSci, PhD, FRCPA
Lab: Clayton, Vic
Interessengebiete: Lungenpathologie, Brustpathologie, Hautpathologie, Molekulare Diagnostik
Spezialgebiet: Anatomische Pathologie
Telefon: 1300 134 111
E-Mail: [email protected]
Dr. Nikolic ist beratender Histopathologe mit Interesse an Lungenpathologie, Brustpathologie, Dermatopathologie und molekularer Diagnostik. Dr. Nikolic schloss sein Medizinstudium und seinen Master-Abschluss (Immunpathologie) in Belgrad, Serbien, ab und zog anschließend nach Neuseeland, wo er an der Universität von Auckland über purinerge Signalübertragung und programmierten Zelltod promovierte. Er arbeitete als Dozent und als medizinischer Offizier in Auckland und zog nach Australien, um sich in anatomischer Pathologie auszubilden. Er absolvierte seine Pathologieausbildung am Monash Medical Centre und bei Healthscope (jetzt Australian Clinical Labs) und erhielt 2011 seinen FRCPA. Nach Abschluss seiner Ausbildung blieb er bei Australian Clinical Labs als Berater.
Lokale Pathologen in Ihrer Nähe
 Dr Carl Bulliard
Dr Carl Bulliard
Qualifikationen: BSc (Med), MBBS, Grad Dip Med (Clin Epid), FRCPA
Labor: Bella Vista, NSW
Interessengebiete: Pathologie der Haut, des Kopfes & des Halses und der Augen, Ausbildung zum Assistenzarzt
Spezialgebiet: Anatomische Pathologie
Telefon: (02) 8887 9951
E-Mail: [email protected]
 Dr Irani Dissanayake
Dr Irani Dissanayake
Qualifikationen: MBBS, MD, FRCPA
Labor: Adelaide Airport, SA
Interessengebiete: Gynäkologische Pathologie, Gastrointestinale Pathologie
Spezialgebiet: Anatomische Pathologie
Telefon: (08) 8205 5641
E-Mail: [email protected]
 Dr Jenny Grew
Dr Jenny Grew
Qualifikationen: MBChB, FRCPA, AFRACMA
Labor: Subiaco, WA
Interessengebiete: Brust, Magen-Darm, Gynäkologie & Hautpathologie, Zytologie und Molekularpathologie
Spezialgebiet: Anatomische Pathologie
Telefon: 1300 367 674
E-Mail: [email protected]
