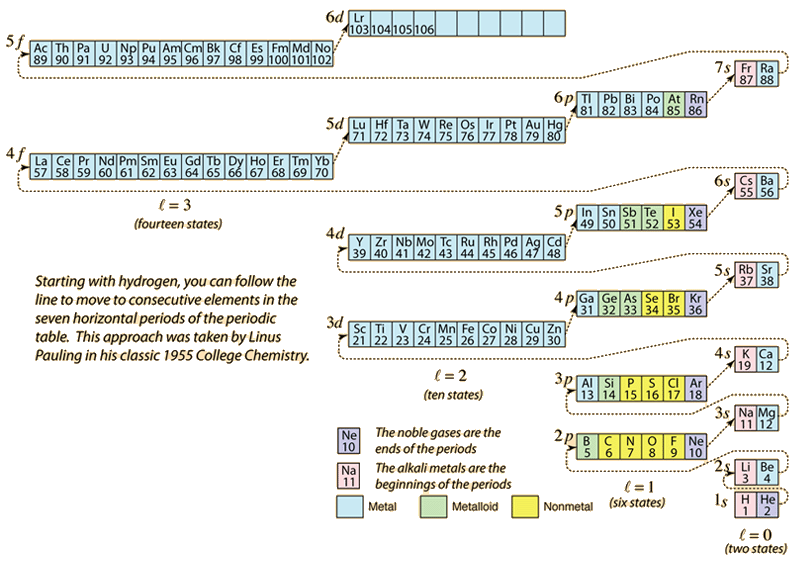
Como a tabela periódica dos elementos é construída pela adição dos elétrons necessários para corresponder ao número atômico, os elétrons tomarão a menor energia consistente com o princípio de exclusão Pauli. A população máxima de cada concha é determinada pelos números quânticos e o diagrama acima é uma forma de ilustrar a ordem de preenchimento dos estados energéticos dos elétrons.
Para um único elétron, a energia é determinada pelo número quântico n principal e esse número quântico é usado para indicar a “concha” na qual os elétrons residem. Para uma determinada concha em átomos de múltiplos elétrons, aqueles elétrons com menor número quântico orbital l serão menores em energia devido à maior penetração da nuvem de proteção dos elétrons nas conchas internas. Estes níveis de energia são especificados pelos números quânticos principal e orbital usando a notação espectroscópica. Quando se atinge o nível 4s, a dependência do número quântico orbital é tão grande que o 4s é menor que o 3d. A natureza da passagem de nível segue a linha tracejada no diagrama, que mostra os pontos em que um se move para a próxima shell em vez de proceder para um número quântico orbital mais alto na mesma shell.
A configuração eletrônica da maioria dos elementos pode ser implícita no diagrama acima, mas não em todos. A configuração eletrônica de qualquer elemento pode ser encontrada clicando nesse elemento na tabela periódica. A primeira exceção ao esquema acima que é encontrada é o cromo, onde o quinto estado de elétron 3d é ocupado ao invés do segundo estado de 4s. O cobre também é uma exceção, preenchendo todos os 10 estados 3d em vez do segundo estado 4s. O nióbio preenche o 4º estado 4d antes de preencher o segundo estado 5s.
