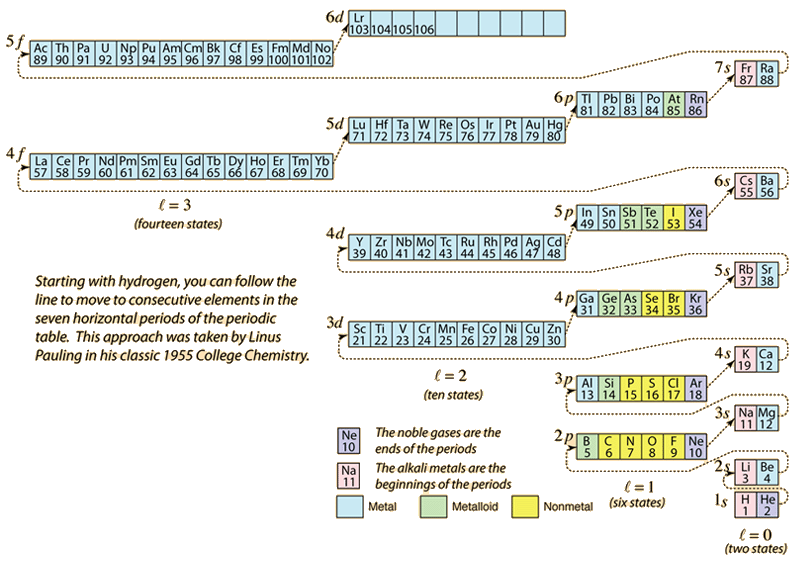
Da det periodiske system af grundstoffer opbygges ved at tilføje de nødvendige elektroner for at matche atomnummeret, vil elektronerne tage den laveste energi, der er i overensstemmelse med Pauli-eksklusionsprincippet. Den maksimale population af hver skal bestemmes af kvantetallene, og diagrammet ovenfor er en måde at illustrere rækkefølgen af fyldningen af elektronernes energitilstande på.
For en enkelt elektron bestemmes energien af det vigtigste kvantetal n-tallet, og dette kvantetal bruges til at angive den “skal”, som elektronerne befinder sig i. For en given skal i atomer med flere elektroner vil de elektroner med et lavere orbitalkvantetal l have en lavere energi på grund af større indtrængning af den afskærmende sky af elektroner i de indre skaller. Disse energiniveauer specificeres ved hjælp af hoved- og orbitalkvantetal ved hjælp af den spektroskopiske notation. Når man når til 4s niveauet, er afhængigheden af orbital kvantetal så stor, at 4s er lavere end 3d. Karakteren af niveauovergangen følger den stiplede linje i diagrammet, som viser de punkter, hvor man går over til den næste skal i stedet for at fortsætte til et højere orbitalkvantetal i den samme skal.
Elektronkonfigurationen for de fleste grundstoffer kan antydes ud fra ovenstående diagram, men ikke alle. Elektronkonfigurationen for et hvilket som helst grundstof kan findes ved at klikke på det pågældende grundstof i det periodiske system. Den første undtagelse fra ovenstående skema, som man støder på, er krom, hvor den femte 3d-elektrontilstand er besat i stedet for den anden 4stilstand. Kobber er også en undtagelse, idet det besætter alle 10 3d-tilstande i stedet for den anden 4s-tilstand. Niobium udfylder den fjerde 4d-tilstand før den anden 5s-tilstand.
