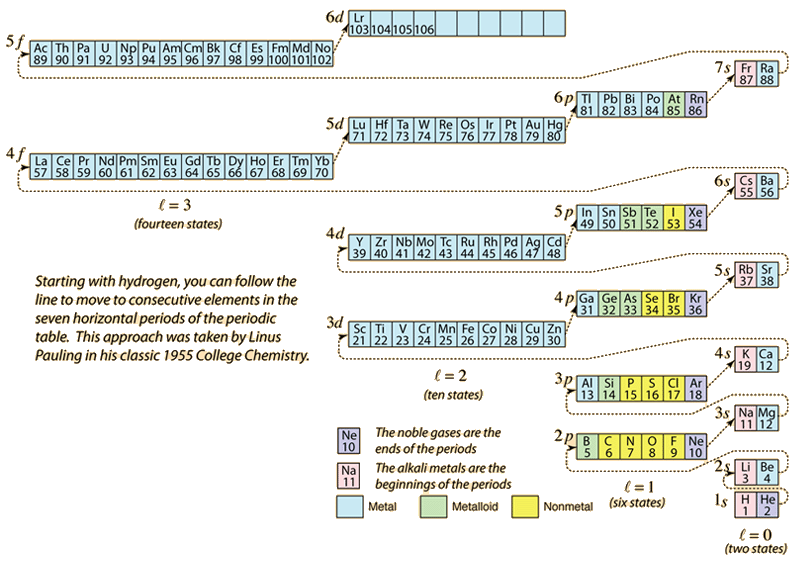
原子番号に合わせて必要な電子を加えて元素の周期表を作るとき、電子はパウリの排他律に合致する最も低いエネルギーをとる。 各殻の最大人口は量子数によって決まり、上の図は電子のエネルギー状態の充填順序を説明する一つの方法である。
単一の電子の場合、エネルギーは主量子n数によって決まり、その量子数は電子が存在する「殻」を示すために使われる。 多電子原子のある殻では、軌道量子数lの小さい電子は、内殻の電子の遮蔽雲をより多く透過するため、エネルギーは低くなる。 これらのエネルギー準位は、分光学的表記法を用いて、主量子数と軌道量子数で指定される。 4s準位になると、軌道量子数への依存性が大きくなり、4sは3dより低くなる。 レベルクロスの性質は図の破線に従っており、同じ殻の中でより高い軌道量子数に進むのではなく、次の殻に移動する点を示している。
ほとんどの元素の電子配置は上の図から示唆されるが、すべてではない。 どの元素の電子配置も、周期表でその元素をクリックすればわかる。 上の図式に対する最初の例外はクロムで、2番目の4s状態の代わりに5番目の3d電子状態が占有されます。 銅も例外で、2番目の4s状態ではなく、10個の3d状態をすべて埋める。 ニオブは4番目の4d電子状態を満たした後、2番目の5s電子状態を満たします。
