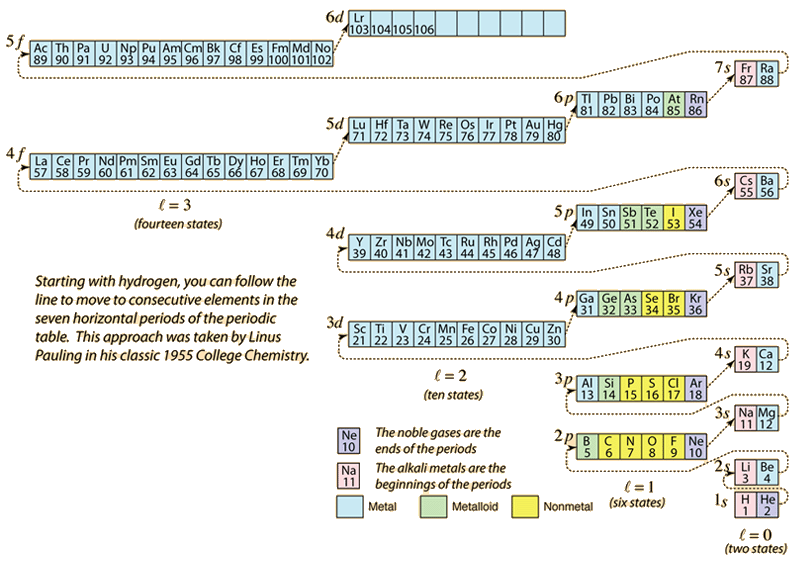
Kun alkuaineiden jaksollista järjestelmää rakennetaan lisäämällä tarvittavia elektroneja vastaamaan atomilukua, elektronit ottavat pienimmän energian, joka on sopusoinnussa Paulin poissulkemisperiaatteen kanssa. Kunkin kuoren maksimipopulaatio määräytyy kvanttilukujen perusteella, ja yllä oleva kaavio on yksi tapa havainnollistaa elektronien energiatilojen täyttymisjärjestystä.
Yksittäisen elektronin energia määräytyy pääkvanttiluvun n mukaan, ja tätä kvanttilukua käytetään osoittamaan ”kuori”, jossa elektronit asuvat. Monielektronisten atomien tietyssä kuoressa niiden elektronien energia, joilla on pienempi orbitaalikvanttiluku l, on alhaisempi, koska ne tunkeutuvat paremmin sisempien kuorien elektronien suojapilveen. Nämä energiatasot määritetään pää- ja orbitaalikvanttiluvuilla käyttäen spektroskooppista merkintätapaa. Kun päästään 4s-tasolle, riippuvuus orbitaalikvanttiluvusta on niin suuri, että 4s on alempi kuin 3d. Tason ylityksen luonne noudattaa kaaviossa katkoviivaa, joka osoittaa ne kohdat, joissa siirrytään seuraavaan kuoreen sen sijaan, että siirryttäisiin samassa kuoressa korkeampaan orbitaalikvanttilukuun.
Yllä olevasta diagrammista voidaan päätellä useimpien alkuaineiden elektronikonfiguraatio, mutta ei kaikkien. Minkä tahansa alkuaineen elektronikonfiguraatio löytyy klikkaamalla kyseistä alkuainetta jaksollisessa järjestelmässä. Ensimmäinen poikkeus yllä olevaan kaavioon, johon törmää, on kromi, jossa on miehitetty viides 3d-elektronitila toisen 4s-tilan sijasta. Kupari on myös poikkeus, sillä se täyttää kaikki 10 3d-tilaa toisen 4s-tilan sijasta. Niobium täyttää neljännen 4d-tilan ennen toisen 5s-tilan täyttymistä.
