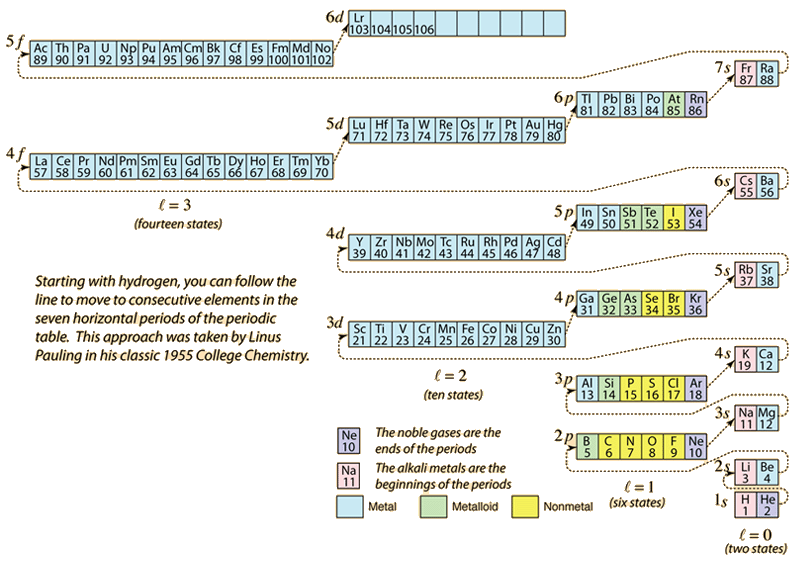
Come la tavola periodica degli elementi è costruita aggiungendo gli elettroni necessari per corrispondere al numero atomico, gli elettroni prenderanno l’energia più bassa coerente con il principio di esclusione di Pauli. La popolazione massima di ogni guscio è determinata dai numeri quantici e il diagramma qui sopra è un modo per illustrare l’ordine di riempimento degli stati energetici degli elettroni.
Per un singolo elettrone, l’energia è determinata dal numero quantico n principale e quel numero quantico è usato per indicare il “guscio” in cui risiedono gli elettroni. Per un dato guscio negli atomi multielettronici, gli elettroni con numero quantico orbitale l più basso avranno un’energia inferiore a causa della maggiore penetrazione della nuvola schermante di elettroni nei gusci interni. Questi livelli energetici sono specificati dai numeri quantici principali e orbitali usando la notazione spettroscopica. Quando si raggiunge il livello 4s, la dipendenza dal numero quantico orbitale è così grande che il 4s è inferiore al 3d. La natura del passaggio di livello segue la linea tratteggiata nel diagramma, che mostra i punti in cui si passa al guscio successivo piuttosto che procedere a un numero quantico orbitale superiore nello stesso guscio.
La configurazione elettronica della maggior parte degli elementi può essere implicata dal diagramma di cui sopra, ma non tutti. La configurazione elettronica di qualsiasi elemento può essere trovata cliccando su quell’elemento nella tavola periodica. La prima eccezione allo schema di cui sopra che si incontra è il cromo, dove il quinto stato elettronico 3d è occupato invece del secondo stato 4s. Anche il rame è un’eccezione, riempiendo tutti i 10 stati 3d piuttosto che il secondo stato 4s. Il niobio riempie il quarto stato 4d prima di riempire il secondo stato 5s.
