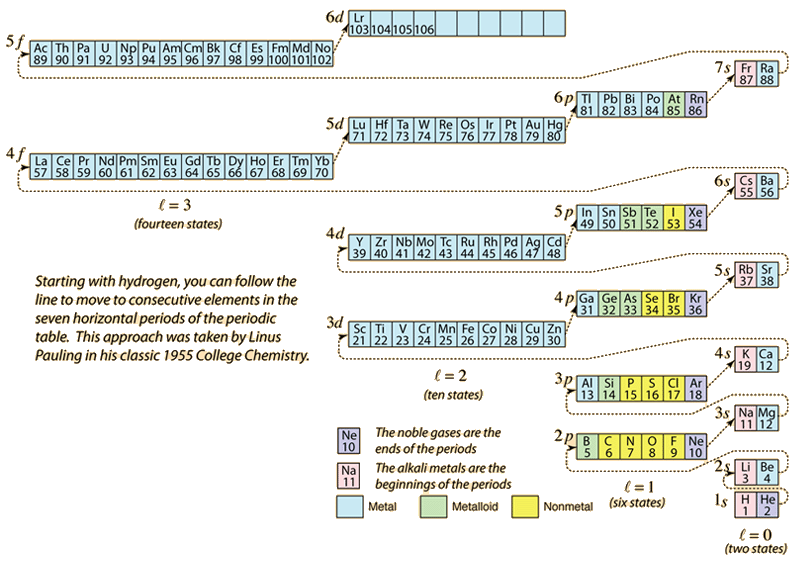
Amint az elemek periódusos rendszerét az atomszámhoz szükséges elektronok hozzáadásával építjük fel, az elektronok a Pauli-féle kizárási elvnek megfelelő legkisebb energiát veszik fel. Az egyes héjak maximális populációját a kvantumszámok határozzák meg, és a fenti diagram az elektronok energiaállapotainak kitöltési sorrendjét szemlélteti.
Egyetlen elektron esetében az energiát az n fő kvantumszám határozza meg, és ez a kvantumszám jelzi azt a “héjat”, amelyben az elektronok tartózkodnak. Egy adott héj esetében a többelektronos atomokban az alacsonyabb l pályakvantumszámú elektronok energiája alacsonyabb lesz, mivel a belső héjakban lévő elektronok árnyékoló felhője jobban áthatja őket. Ezeket az energiaszinteket a spektroszkópiai jelöléssel a fő- és a pályakvantumszámok határozzák meg. A 4s szint elérésekor a pályakvantumszámtól való függés olyan nagy, hogy a 4s alacsonyabb, mint a 3d. A szintátmenet jellege az ábrán a szaggatott vonalat követi, amely azokat a pontokat mutatja, amelyeknél a következő héjba lépünk, nem pedig ugyanazon héjon belül magasabb orbitális kvantumszámra haladunk.
A fenti diagramból a legtöbb elem elektronkonfigurációjára lehet következtetni, de nem mindegyikre. Bármely elem elektronkonfigurációja megtalálható, ha az adott elemre kattintunk a periódusos rendszerben. Az első kivétel a fenti séma alól, amellyel találkozunk, a króm, ahol a második 4s állapot helyett az ötödik 3d elektronállapot foglalt. A réz szintén kivétel, amely a második 4s állapot helyett mind a 10 3d állapotot betölti. A nióbium a 4. 4d állapotot tölti ki a második 5s állapot betöltése előtt.
