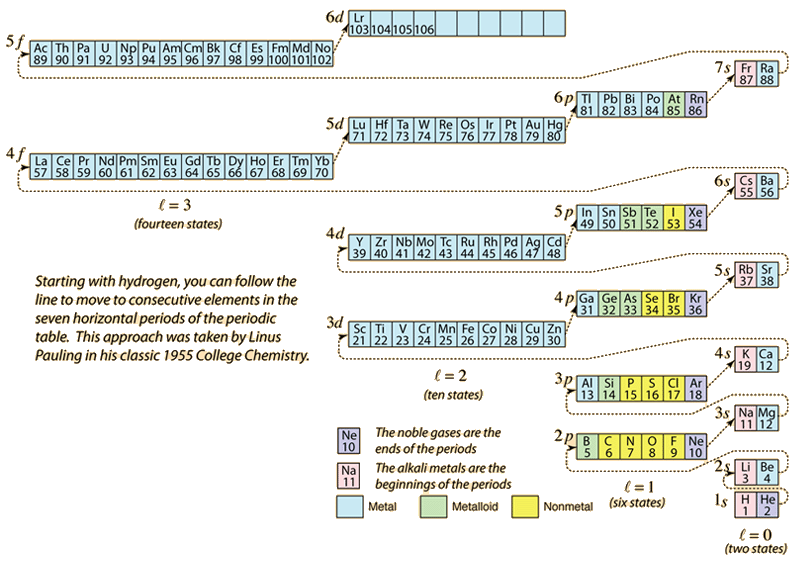
Jak układ okresowy pierwiastków jest budowany poprzez dodawanie niezbędnych elektronów, aby dopasować liczbę atomową, elektrony przyjmują najniższą energię zgodną z zasadą wykluczenia Pauliego. Maksymalna populacja każdej powłoki jest określona przez liczby kwantowe, a powyższy diagram jest jednym ze sposobów zilustrowania kolejności wypełniania stanów energetycznych elektronów.
Dla pojedynczego elektronu, energia jest określona przez główną liczbę kwantową n i ta liczba kwantowa jest używana do wskazania „powłoki”, w której elektrony rezydują. Dla danej powłoki w atomach wieloelektronowych, elektrony o niższej orbitalnej liczbie kwantowej l będą miały niższą energię z powodu większej penetracji chmury osłaniającej elektrony w powłokach wewnętrznych. Te poziomy energetyczne są określone przez główną i orbitalną liczbę kwantową przy użyciu notacji spektroskopowej. Po osiągnięciu poziomu 4s zależność od orbitalnej liczby kwantowej jest tak duża, że poziom 4s jest niższy od poziomu 3d. Charakter przejścia przez poziom wynika z przerywanej linii na diagramie, która pokazuje punkty, w których przechodzi się do następnej powłoki, a nie przechodzi do wyższej orbitalnej liczby kwantowej w tej samej powłoce.
Konfiguracja elektronowa większości pierwiastków może być implikowana z powyższego diagramu, ale nie wszystkich. Konfiguracja elektronowa dla dowolnego elementu może być znaleziona przez kliknięcie na ten element w układzie okresowym. Pierwszym wyjątkiem od powyższego schematu, który jest spotykany jest chrom, gdzie piąty stan elektronowy 3d jest zajęty zamiast drugiego stanu 4s. Wyjątkiem jest również miedź, która wypełnia wszystkie 10 stanów 3d, a nie drugi stan 4s. Niob wypełnia 4. stan 4d przed wypełnieniem drugiego stanu 5s.
