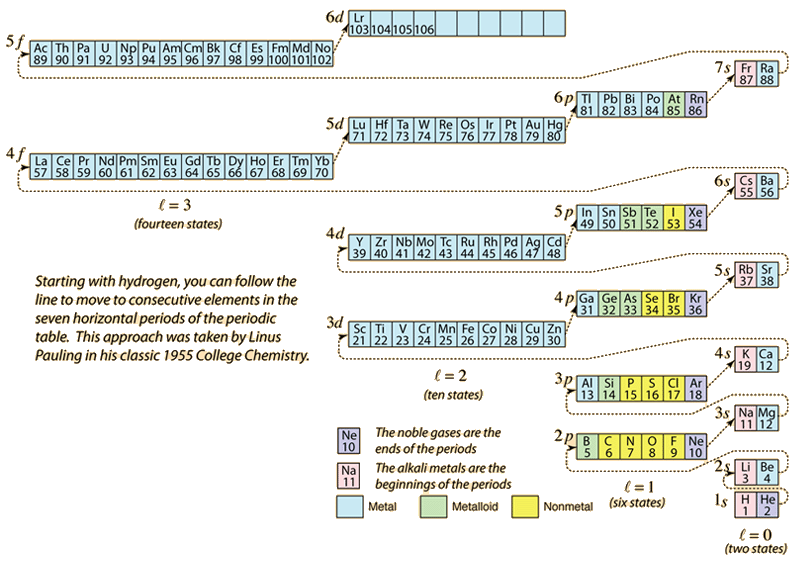
Als het periodiek systeem van de elementen wordt opgebouwd door de nodige elektronen toe te voegen om overeen te stemmen met het atoomnummer, zullen de elektronen de laagste energie nemen die in overeenstemming is met het Pauli-uitsluitingsprincipe. De maximale populatie van elke schil wordt bepaald door de kwantumgetallen en het diagram hierboven is een manier om de volgorde van vulling van de elektron-energietoestanden te illustreren.
Voor een enkel elektron wordt de energie bepaald door het hoofdkwantumgetal n en dat kwantumgetal wordt gebruikt om de “schil” aan te geven waarin de elektronen zich bevinden. Voor een bepaalde schil in atomen met meerdere elektronen zullen de elektronen met een lager baankwantumgetal l een lagere energie hebben, omdat zij meer doordringen in de afschermende wolk van elektronen in de binnenste schillen. Deze energieniveaus worden gespecificeerd door de hoofd- en orbitaalkwantumgetallen met behulp van de spectroscopische notatie. Wanneer men het 4s niveau bereikt, is de afhankelijkheid van het orbitaal kwantumnummer zo groot dat het 4s lager is dan het 3d. De aard van de niveauovergang volgt de stippellijn in het diagram, die de punten aangeeft waarop men naar de volgende schil overgaat in plaats van naar een hoger baankwantumgetal in dezelfde schil.
De elektronenconfiguratie van de meeste elementen kan worden afgeleid uit bovenstaand diagram, maar niet van alle. De elektronenconfiguratie van elk element kan worden gevonden door op dat element in het periodiek systeem te klikken. De eerste uitzondering op bovenstaand schema is chroom, waar de vijfde elektronenstaat 3d is bezet in plaats van de tweede elektronenstaat 4s. Koper is ook een uitzondering, en vult alle 10 3d toestanden in plaats van de tweede 4s toestand. Niobium vult de vierde 4d toestand alvorens de tweede 5s toestand te vullen.
